第三章酶化学终结版概论
- 格式:ppt
- 大小:9.45 MB
- 文档页数:8


酶化学总结1. 介绍酶(enzyme)是一类高度特异的生物催化剂,能够在细胞内加速化学反应速率。
酶对于生命体的正常生理功能至关重要,它们在许多生物学过程中发挥关键作用。
本文将对酶化学进行总结,包括酶的基本特点、催化机制、酶动力学以及应用领域等内容。
2. 酶的基本特点2.1 蛋白质性质酶通常是由蛋白质组成的,具有复杂的三维结构。
蛋白质的结构决定了酶的催化活性和特异性。
常见的酶蛋白质结构包括原核酶、真核酶和金属酶等。
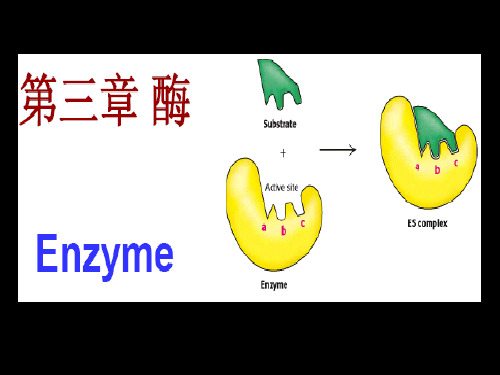
2.2 特异性催化酶对底物的结构具有高度特异性,只能催化特定的反应。
酶与底物之间通过键合或非共价相互作用,形成酶底物复合物。
酶通过催化底物分子重新组合、断裂化学键、转移化学基团等反应来加速化学反应速率。
2.3 温度和pH值的影响酶活性受到温度和pH值的影响。
每个酶对温度和pH值都有最适宜的范围。
过高或过低的温度或pH值会使酶的结构发生变化,从而影响催化活性。
3. 酶的催化机制3.1 锁键假说锁键假说是酶催化机制的最早提出的假说之一。
该假说认为酶与底物形成亲合力,通过变换空间构象或者改变环境条件来促进底物分子反应。
3.2 酸碱催化酶可以通过提供酸碱催化剂来促进化学反应。
酶催化的反应中,酶可以释放或接收质子,从而改变底物的电子密度或中间体的稳定性。
3.3 亲和力触媒亲和力触媒是酶催化机制中的一种重要方式,它通过调节酶和底物之间的亲和力来促进化学反应。
酶可以调整其活性位点的构象和特异性,以增强与底物的结合能力。
4. 酶动力学酶动力学研究酶催化反应速率的变化规律。
常见的酶动力学参数包括最大催化速率(Vmax)、米氏常数(Km)和酶的催化效率(kcat/Km)。
4.1 米氏动力学米氏动力学研究酶活性与底物浓度之间的关系。
酶的米氏常数(Km)表示酶对底物的亲和力,最大催化速率(Vmax)表示酶在饱和底物浓度下达到的最大催化速率。
4.2 动力学模型常见的酶动力学模型包括酶的饱和型动力学模型、双酶底物型动力学模型和酶抑制动力学模型等。