兽医临床生化检测
- 格式:doc
- 大小:80.00 KB
- 文档页数:7

一、实验目的本次实验旨在通过模拟临床病例,运用兽医临床诊断学的方法和技巧,对动物疾病进行诊断。
通过实验,使学生掌握兽医临床诊断的基本流程、诊断方法及注意事项,提高临床诊断能力。
二、实验材料1. 实验动物:病猪1头,健康猪1头。
2. 实验仪器:体温计、听诊器、血压计、X光机、实验室显微镜、离心机等。
3. 实验试剂:生理盐水、抗生素、消毒液等。
三、实验方法1. 病史采集:询问猪主关于病猪的饲养管理、发病经过、治疗情况等,了解病猪的基本情况。
2. 临床检查:对病猪进行全面的临床检查,包括体温、呼吸、脉搏、可视黏膜、皮肤、四肢、神经系统等。
3. 实验室检查:(1)血液学检查:采集病猪血液,进行血常规、生化指标等检查。
(2)病原学检查:采集病猪的组织、分泌物等,进行病原学检测。
(3)影像学检查:利用X光机对病猪进行影像学检查,观察器官形态及病变情况。
4. 综合分析:结合病史、临床检查和实验室检查结果,进行综合分析,提出诊断。
四、实验结果1. 病史采集:病猪饲养管理良好,发病前无明显异常。
发病后出现食欲减退、精神沉郁、体温升高、呼吸急促等症状。
2. 临床检查:病猪体温39.5℃,呼吸频率加快,可视黏膜发绀,四肢无力,站立不稳,神经系统症状明显。
3. 实验室检查:(1)血液学检查:白细胞计数升高,淋巴细胞比例升高,提示可能存在感染。
(2)病原学检查:病猪肠道分泌物中检测到溶血性大肠杆菌。
(3)影像学检查:X光片显示病猪肺部有炎症灶,心包积液。
五、诊断根据病史、临床检查和实验室检查结果,初步诊断为猪水肿病。
六、讨论猪水肿病是由某些溶血性大肠杆菌引起的断奶后仔猪的一种毒血症。
主要症状为头部和胃壁等处出现明显水肿,神经症状明显,肌肉颤抖、阵发性抽搐、盲目运动,发展为共济失调、麻痹和倒卧,四肢呈划水样。
病变主要为水肿,胃壁及肠系膜水肿明显。
本次实验中,通过对病猪进行病史采集、临床检查和实验室检查,最终诊断为猪水肿病。

犬生化检查的步骤犬生化检查是一种常见的临床检验方法,通过分析犬体内的血液成分,可以了解犬的健康状况及内脏功能是否正常。
下面将介绍犬生化检查的步骤,以及其对犬的重要意义。
第一步:血液采集需要采集犬的静脉血样本。
通常,犬的前肢内侧的静脉是较为适合的采血部位。
在确保采血部位清洁的前提下,用一根注射针或者采血针缓慢地插入静脉,以获取足够的血液样本。
第二步:血液标本处理采集到的血液样本需要进行处理,以获取血浆或血清。
处理方法根据检测项目的不同而有所差异,常见的处理方式包括离心、凝固或添加抗凝剂等。
处理后的血液样本中,可以分离出各种生物化学指标,如蛋白质、糖类、脂质、肝功能指标等。
第三步:生化指标检测在血液标本处理完成后,可以使用生化分析仪器对采集到的血液样本进行检测。
根据需要检测的指标,可以选择相应的分析方法。
常见的生化指标包括血糖、肝酶、尿酸、胆固醇、肾功能指标等。
通过分析这些指标,可以评估犬的糖代谢、肝功能、肾功能以及其他器官的正常运转情况。
第四步:结果分析与诊断根据检测结果,可以对犬的健康状况进行初步判断。
例如,血糖水平的异常可能提示犬是否患有糖尿病;肝酶水平的升高可能意味着犬有肝功能异常等。
但是,这些结果仅供参考,还需要结合临床症状和其他检查结果进行综合分析和诊断。
犬生化检查的意义在于帮助兽医了解犬的整体健康状况,并及时发现潜在的疾病。
通过检测生化指标,可以早期发现犬的器官功能异常,及时采取治疗措施,有效降低疾病的发展风险。
因此,犬生化检查在犬的健康管理中起着重要的作用。
总结起来,犬生化检查的步骤包括血液采集、血液标本处理、生化指标检测以及结果分析与诊断。
这一系列步骤可以帮助兽医评估犬的健康状况,及时发现潜在的疾病,并采取相应的治疗措施。
犬生化检查对于犬的健康管理具有重要的意义,可以维护犬的身体健康,延长其寿命。
因此,对于犬主人来说,定期进行犬生化检查是非常重要的。

全血是血细胞和液体的混合物。
全血计数(CBC)检查血液细胞部分,并给出各种不同类型红细胞和白细胞、血小板以及血红蛋白的数量。
生化检测对象是血液移除细胞后的液体部分。
为了获取血液中的液体,血样需要先在管内凝集,然后经离心机离心,使血凝块下沉至管的底部,而析出的液体留在管的上部。
血液凝集后析出的液体被称为“血清”,通常用于生化检测。
动物生化检测包括在一份样品内检查查多种化学成分,这些化学成分的浓度可揭示体内各种器官许多方面的信息。
检测项目兽医临床生化指标通常包括以下项目:T-Pro总蛋白T-Bil总胆红素Alb白蛋白BUN血尿素氮GPT 谷丙转氨酶丙氨酸氨基转移酶(ALT)CRE肌酸酐GOT 谷草转氨酶天门冬氨酸氨基转移酶(AST)TG甘油三酯ALP碱性磷酸酶T-Cho总胆固醇CPK肌酸磷酸激酶FRA果糖胺LDH乳酸脱氢酶Ca钙Amy淀粉酶IP无机磷GGTγ-谷酰氨基转移酶Mg镁Glu葡萄糖UA尿酸主要项目的判读总蛋白(T-Pro):一般说来,总蛋白浓度检测的是两种血液蛋白分子,白蛋白和球蛋白。
总蛋白浓度升高通常见于机体脱水。
球蛋白=总蛋白-白蛋白。
“球蛋白”包括免疫球蛋白,免疫球蛋白由机体免疫系统产生,保护机体免遭细菌和病毒的侵害。
某些疾病,如猫传染性腹膜炎,可见免疫球蛋白浓度升高。
白蛋白(Alb):白蛋白在肝脏合成,是构成血浆蛋白的主要成分。
在外周组织中分解,其半衰期为7-10天。
犬的白蛋白半衰期约是8.2天。
白蛋白的主要功能有维持血浆渗透压和作为载体转运各种激素、离子和药物。
脱水时可见白蛋白升高,降低多因生成减少、小肠吸收不良、蛋白质丢失过多或蛋白质分解过多所致。
谷丙转氨酶(GPT):血清谷丙转氨酶(GPT)也称为“丙氨酸氨基转移酶”(ALT),它是检测肝功能的一种重要的酶,其活性升高通常意味着肝细胞由于某种原因遭到破坏,肝脏可能出现癌变、感染、充血(见于心力衰竭)、硬化、堵塞(因此血液中的代谢废物和毒素不能经胆管清除)等。

兽医临床诊断学的三大内容
兽医临床诊断学是研究动物疾病的一门学科,主要通过对临床症状、实验室检查和影像学等手段进行分析,以制定合适的治疗方案。
兽医临床诊断学的三大内容包括:
1.临床症状观察与分析:
•病史采集:兽医在诊断过程中首先要详细了解患者的病史,包括生活环境、饮食、行为、接触史等,这有助于初
步判断可能的病因。
•临床症状观察:对患者的生理状况、行为表现、食欲、体温、呼吸、心率等进行仔细观察,以获取病理变化的线
索。
•体格检查:通过对动物的身体结构、器官状况、皮毛、眼睛、口腔、腹部等方面的检查,发现可能的异常体征。
2.实验室检查:
•血液学检查:包括血细胞计数、血红蛋白测定、白细胞分类计数等,用于评估机体的免疫状态和贫血程度。
•生化学检查:包括血液中各种生化指标的测定,如肝功能、肾功能、电解质平衡等,有助于判断器官功能的异常。
•尿液检查:通过对尿液的化学性质和沉淀物进行分析,了解肾功能和泌尿系统的状况。
•细菌学检查、病毒学检查:对患者的分泌物、血液、组织等进行微生物学检查,帮助确定感染性疾病。
3.影像学诊断:
•X射线检查:对骨骼、内脏器官等进行X射线成像,用于检测骨折、肿瘤、腹部腔内异常等。
•超声波检查:通过超声波成像技术观察内脏器官的形态和功能,适用于腹部、心脏等部位的检查。
•核磁共振(MRI):对软组织、神经系统等进行高分辨率的成像,适用于复杂的内部结构检查。
这三大内容相互交叉,综合运用有助于确定动物的疾病诊断和治疗方案。
兽医临床诊断学的发展为更准确地诊断和治疗动物疾病提供了重要的支持。


兽医生化检查的要求
兽医生化检查是指对动物进行身体健康状况的全面检查,以评估其健康状况和提供适当的保健建议。
以下是兽医生化检查的一般要求:
1. 预约:提前预约时间,避免等待时间过长。
2. 历史记录:带上动物的健康历史记录,包括疫苗接种情况、曾经患过的疾病、手术历史等。
3. 完整的体格检查:包括对动物的皮肤、毛发、眼睛、鼻子、耳朵、口腔、牙齿、心肺、腹部、肢体等进行检查。
这有助于发现任何异常或疾病迹象。
4. 血液和尿液检查:可通过提取一部分血液和尿液进行检查,以评估肝功能、肾功能、血糖水平以及其他生化指标。
5. 心电图:有时可能需要做心电图检查,以评估心脏功能和检测潜在的心脏问题。
6. 影像学检查:如需要,可能进行X射线或超声波检查,以
获得更详细的内部器官结构图像。
7. 其他特殊检查:根据具体情况,可能需要进行其他特殊检查,如皮肤刮片检查、血液凝血功能检查等。
8. 咨询和建议:兽医会根据检查结果给出相应的建议,包括疾
病治疗、预防措施、饮食和营养、训练建议等。
需要注意的是,兽医生化检查的要求可能会因动物的种类和个体差异而有所变化,同时也可以根据动物的特殊情况进行调整。
建议定期进行兽医生化检查,以确保动物的健康和幸福。

兽医临床诊断学是一门研究动物健康和疾病的学科,其中包括对不同动物种类的临床诊断和治疗。
而对于家畜中的猪来说,肌酸激酶(CK)是一种非常重要的生化指标,可以帮助兽医诊断猪的健康状况。
1. 肌酸激酶概述肌酸激酶是一种酶类蛋白质,存在于肌肉和其他组织中,其主要功能是促进肌肉收缩。
当肌肉受到损伤或疾病影响时,肌酸激酶会释放到血液中,因此可以用作疾病诊断的重要生化指标。
在猪的健康管理中,肌酸激酶也常被用来评估猪的肌肉健康状况。
2. 猪的肌酸激酶范围根据研究和临床实验,正常健康的猪的肌酸激酶水平通常在30-200U/L之间。
这个范围是根据对大量猪裙的观察和测试得出的,可以作为猪的肌酸激酶水平的一个参考标准。
3. 影响肌酸激酶水平的因素(1)芳龄:猪的芳龄对肌酸激酶水平有一定影响。
幼猪和成年猪的肌酸激酶水平可能会有所不同,因此在进行肌酸激酶水平检测时需要考虑猪的芳龄因素。
(2)健康状况:疾病、损伤或其他健康问题都会对肌酸激酶水平产生影响。
一般来说,疾病或肌肉损伤会导致肌酸激酶水平升高。
(3)饮食和环境:猪的饮食和生活环境也可能影响其肌酸激酶水平。
比如饲料成分、饮水情况以及圈舍条件等都可能对肌酸激酶水平产生影响。
4. 使用肌酸激酶检测的意义了解猪裙的肌酸激酶水平有助于兽医判断其健康状况,特别是肌肉健康状况。
如果发现猪的肌酸激酶水平异常偏高,可能意味着猪裙中存在健康问题,及时采取相应的措施可以帮助猪裙恢复健康。
5. 结语猪的肌酸激酶范围是一个重要的生化指标,可以帮助兽医评估猪的健康状况。
通过了解肌酸激酶的参考范围以及影响因素,兽医能够更好地进行疾病诊断和健康管理,保障猪裙的健康和生产性能。
希望通过这篇文章的介绍,读者们能够对猪的肌酸激酶有更深入的了解,并在养猪生产中加以应用。
肌酸激酶(CK)作为一种生化指标,在猪的健康管理中具有重要作用。
除了了解其参考范围和影响因素外,我们还需要深入了解肌酸激酶异常升高的可能原因及其相关的疾病。

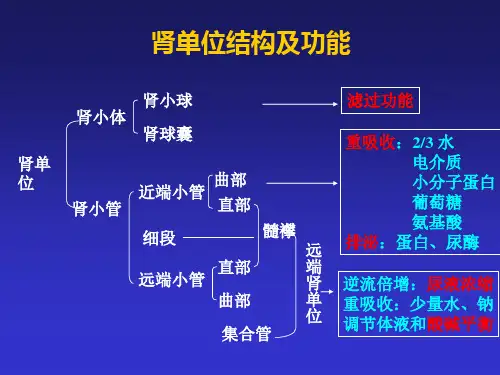
解读动物医院血液生化检验单兽医临床上常用的血液生物化学检验项目,包括电解质紊乱和酸碱平衡失调的检查、肝功能检验、肾脏功能检验、心脏及肌肉疾病的检验、其他血清酶检验以及微量元素、维生素检测等。
这些项目对动物疾病的诊断和鉴别诊断、判断病情及预后等具有重要的意义。
一、血清电解质(K、Na、Cl、P、Ca)1、低钾血症的病理原因:(1)K+由细胞外液向细胞内液转移:①pH升高(H+减少),碱中毒;②血浆HCO3-升高;③快速大量输注碱性溶液;④血浆胰岛素浓度升高;⑤血浆葡萄糖浓度增加(非糖尿病性);⑥使用利尿剂。
(2)K+摄入减少:①食物中K+缺乏(少见);②食欲缺乏;③输注缺K+的溶液。
(3)经胃肠道丢失:①呕吐;②腹泻;③过度使用灌肠剂、缓泻剂或交换树脂。
(4)经尿液丢失:①肾实质疾病,如肾小管酸中毒、范康尼氏综合征(先天性骨髓发育不全及其他缺陷)、慢性肾脏疾病(偶尔引起)、长期使用两性霉素-B或庆大霉素等。
②利尿治疗;③低镁血症;④盐皮质激素作用增强(醛固酮功能亢进);⑤非渗透性离子作用(青霉素、羧苄青霉素)。
低钾血症的临床体征:(1)代谢方面--碳水化合物耐量受损,空腹血糖浓度升高,这是因为胰腺胰岛素分泌依赖钾的作用,缺钾时胰岛素分泌减少。
(2)神经肌肉症状--为常见体征,特别当K+低于2.5 m moL/L时,可见肌无力、痉挛、感觉异常、反射机能降低、精神沉郁、昏睡、精神混乱,少数发生昏迷和发狂;胃肠道平滑肌无力引起肠蠕动减弱和肠梗阻,有时还出现膀胱麻痹,引起尿潴留;可出现厌食、呕吐、便秘、胃排空缓慢及腹部痛性痉挛;严重低钾血症可因呼吸肌麻痹而死亡。
(3)心血管症状--血清K+低于3.0 mmoL/L时可出现心电图变化,包括ST段降低、平坦或T波倒置,出现U波,P峰升高,PR间期延长以及QRS时期延长(在严重低血钾时)。
可出现窦性心动徐缓,Ⅰ度或Ⅱ度传导阻滞,心房扑动,阵发性心房过速,房室分离以及心室纤维颤动。

犬猫生化指标的临床解读近年来,随着小动物临床诊断技术的发展,血液生化仪血液生化仪的逐渐普及,这给犬猫疾病的临床诊断带来了很大的帮助,但同时也出现了一些问题。
第一:医生认为或向主人夸大生化检查的意义,认为做了这些检查,所有疾病基本都能确诊。
第二:认为单项收费贵,只选做几项化验,而不能全面了解患病动物的情况况。
第三:不做前期基础检查,在没有明确诊断思路的情况下,盲目进行全项生化检查,给宠主带来不必要的花费,从而降低医生及医院的声望及地位。
第四:不了解干、湿生化分析仪的特点,不能定时或按要求做质控而造成检测指标有较大误差。
第五:生化指标判读时,只考虑单项指标的意义,缺乏横向联系的能力。
本文的目的是帮助临床兽医师解决以上所述问题。
一、干、湿式生化分析仪的特点及质控的重要性较大型的动物医院使用干式生化仪的较多,但很多人不知其特点及如何选择机型。
干式生化仪的特点是操作简单、速度快,试剂为干片式独立包装,不会出现试剂的浪费,如果是反射光原理的机型抗干扰能力强。
但存在单份试剂贵,结果大多数只能精确到小数点后一位,每次更换试剂批号后要重新进行质控等缺点。
随着国产湿式生化仪的出现,国产及进口品牌仪器的价格已逐渐被被兽医院所接受,有些半自动湿式生化仪的价格还低于干式生化仪化。
湿式生化的特点是单份试剂价格低,结果能精确小数点后三位。
但因试剂大多为500-1000份包装,以兽医临床用量来看,试剂浪费严重,不能很好的节省成本,且仪器为折射光原理,抗干扰能力差,只适合进行体检时用,当样本为脂血、黄疸、溶血时测得的肝功能指标临床参考价值不大。
为确保各中生化酶、胆固醇及甘油三酯的准确性,采样前要确保动物在8-10小时内空腹(视食物脂肪含量而定),使用湿式生化时要尤其注意。
各品牌的仪器其标准值是不尽相同的,因此要按厂家给出的正常范围判读指标,不该按照工具书中的正常值参考。
生化检查的基本原理都是在各种化学反应的基础上利用分光光度计的原理进行读数,测定的数值是在事先设定好的靶值范围内的,根据试剂质量、使用环境卫生情况,电流电压的稳定性、开关机频率等因素的影响,每次化验的结果都会有不同程度的偏差,这种偏差大于可接受范围时称为误差,会影响临床诊断的准确性。
兽医血液常规检验技术任务分析:血液在机体的新陈代谢过程中具有非常重要的作用,它保证机体生命机能的正常活动,任何对机体有害的刺激,都会影响血液成分的变化。
因此,血液的检查在疾病的诊断中是十分重要的。
血液检查按其方法和内容,可分为3个方面:第一、用物理方法测定其物理特性。
如出血时间、红细胞沉降速率测定等。
第二、以化学方法分析其化学成分的含量。
如血红蛋白测定。
第三、用显微镜或电阻抗法检查其形态及数量的测定。
如红细胞计数、白细胞计数、白细胞分类计数等。
任务目标:1、会进行血液标本的采集与抗凝;2、会进行红细胞沉降速率、红细胞压积容量及血红蛋白含量测定,并对结果进行判定与分析;3、会进行红细胞和白细胞计数,并对结果进行判定与分析;4、会进行白细胞分类计数,并对结果进行判定与分析。
操作训练:利用课余时间参与门诊化验室工作,进行血常规检验训练。
技能一血液标本的采集与处理一、技能描述血液标本采集是进行兽医临床检验的前提,检验人员必须根据检验目的,确定血液标本的数量,从而选择合适的采血途径,依据要求进行采集,并对标本进行编号标记、登记、填写采样单,必要时还需进行保存或送检。
二、技能情境1.动物及器材动物饲养场或实训室;动物(牛、羊、猪、鸡、犬或猫等);采血器或灭菌针头;碘酊棉球,酒精棉球,干棉球,试管,剪毛剪,止血带;离心机;保定用具等。
2.试剂双草酸盐(草酸铵、草酸钾)溶液;3.8%枸橼酸钠溶液等。
三、技能实施(一)、血样的采集1、静脉采血(1)牛、羊、马的颈静脉采血:常在颈静脉上1/3与中1/3交界处剪毛、消毒,紧压颈静脉近心端,待血管怒张(助手尽量将动物头部向穿刺的对侧牵拉,使颈静脉充分显露),用采血器或注射针头对准血管刺入,即可获得血液标本。
(2)奶牛的尾中静脉采血:助手(或术者)尽量将牛尾上举,术者将牛尾根腹侧消毒,用采血器在第2~3尾椎间垂直刺入,轻轻抽动采血器内芯,直到抽出一定量的血液为止。
此外,奶牛可在腹壁皮下静脉(乳前静脉)采血,注意针头不能太粗,以免造成血肿。
中国兽医杂志CHINESE JOURNAL VETERINARY MEDICINE1998年第24卷第3期★宠物保健健康犬猫生理生化值安丽英戴庶李安熙 李伊立(中国农业大学动物医院,北京海淀 100094)为了兽医工作者的需要,我们专门对来我院给动物注射疫苗和做绝育手术的一些健康犬、猫,进行了血液部分生理生化指标的测定。
其中血液生理指标,包括白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、白细胞分类计数(DC);血清部分生化指标包括,总蛋白(TP)、白蛋白(ALb)、血清尿素氮(BUN)、肌酐(Cre)、血糖(Glu)、血钙(Ca)、血磷(P)、胆固醇(Chol)、甘油酸三酯(Trig)、天门冬氨酸氨基转移酶(AST/GOT)、碱性磷酸酶(ALP)、谷氨酸氨基转移酶(ALT/GPT)、淀粉酶(α-Amylase)、甲状腺素(T)等。
测定结果可作为北京地区和其它地4区犬猫生理生化的正常参考值。
现报告如下。
1 材料与方法1.1动物来源临床检查确诊为健康的犬、猫,以及注射疫苗和做绝育手术前的健康犬、猫。
1.2样品采静脉血液。
血清是采血后及时分离;全血是用EDTA-Na2抗凝。
1.3 仪器1.3.1血液正常生理指标,包括RBC、WBC、HGB和HCT,使用CELL-DyN400血球仪(美国Seguoia-turper-coparation)测定。
1.3.2血清生化正常指标:包括AST、ALT、ALP、淀粉酶、总胆固醇、总蛋白、白蛋白、BUN、肌酐、血糖、血钙、血磷、胆固醇、甘油酸三酯,采用优利Ⅱ型生化仪(意大利,Sclavo,Unifast2 Aualyzer)测定。
所用试剂是由北京中生生物工程高技术公司提供。
,是采用北京核仪器厂的FT-630G型,微机全自动γ-计1.3.3血清T4数仪进行测定。
所用试剂是中国北京生物制品研究所提供。
2 结果见表1、表2。
表1 血液生理指标的x±s测定值表2 血清生化指标的x±s测定值* 美国兽医、联合国志愿人员。
Summarize and reviews | 综述与专论180 ·2021.030 引言在进行牛疾病生化检验中,要严格地遵循我国的规章制度及行业的规范要求,提升实际工作的规范性和科学性,并且加强和技术人员之间的沟通以及交流,及时发现在牛疾病生化检验中存在的难题,融入我国目前新的技术和新的设备保证实际工作效率的科学性实施,从牛疾病生化检验的各个环节入手开展日常工作,进而提高牛疾病生化检验的精准性和有效性。
1 牛疾病生化检验背景随着我国目前养殖行业的不断发展,牛疾病的类型和感染范围逐渐朝着多样化的方向而发展,为保证牛疾病的问题能得到有效的解决,维护养殖人员的经济效益,在实际工作中要对牛疾病进行生化检验,更加符合实际工作需求工作要求。
在养殖中,养殖的品质会受周边环境及营养因素的影响,为使养殖的效果和品质能得到有效提高,相关工作人员需要结合临床的一些疾病对牛疾病进行良好的预防,一些牛在生长中会出现一些临床性的亚疾病,如卧地不起和产后瘫痪等,为及时了解牛场养殖的主要问题及主要的发展动向,相关工作人员需要及时了解在养殖中存在的问题,且提出针对性解决措施,保证饲养管理工作有序进行。
另外,对于一些亚临床的疾病,包含子宫内膜炎和腹泻等常见疾病,相关工作人员要通过全自动的血液仪对牛疾病进行多方位的分析,检测细胞变化的范围及主要的特征,在进行深化检验时,可及时发现牛疾病的病毒及存在于牛身上的一些寄生虫,为实际饲养的质量工作提供重要的理论依据。
相关工作人员需要加强设备和资金的投入力度构建完善的实验室,科学而有序的进行牛疾病生化的检验,牛疾病生化检验工作不仅有助于提高疾病诊断的效果,还可对病情进行精准性的判断,对于病情的愈合有较大的帮助。
因此相关工作人员在实际工作中,需要结合牛疾病检测的主要工作流程及主要的工作思路,快速得出最终的检验结果,且相关工作人员还需要对检验中和检验后的流程进行质量上的控制,获得最为准确的临床结果,保证实际养殖工作有序进行[1]。
第二部分临床生化4/特异性检验的解释血浆生化的基本原理血浆基本上就是流动的细胞外液,内含用来保持水分的蛋白(通过提高渗透压)。
它把大量的物质从吸收部位或生成部位运输到利用部位或分泌部位,并含有许多其它的物质,这些物质对维持细胞外液正常功能所需的精确浓度是十分重要的。
因此,对血浆样品的分析可以提供各种类型的信息。
血浆生化结果的解释真正对于每一种成分是特异的,但其内含有一些必须遵循的基本原理。
在第一次接触到生化时,对它们的理解是很有帮助的,而且当要尽力搞清楚有疑问的或异常的结果时特别有用。
首先要搞清楚的是某一特定物质存在于血浆中的原因。
它的主要作用就要存于血浆中的(白蛋白,电解质)?还是正被运往需要它的地方的(葡萄糖,激素)?或是正在排泄过程中的代谢产物(尿素,肌酐,胆红素)?还是偶尔存在于血浆中的物质(大多数的酶)?其次是考虑该物质是从哪里来的,要到哪里去------换句话说,就是它进入血浆和从血浆中消除的机制,包括正常和异常的,并且它们是怎样调控的?从这里不难找出异常浓度可能的原因。
异常浓度降低可能是由于进入血浆中的量减少(合成的损伤,营养缺乏,吸收不良,缺乏前体等)或血浆中的清除加快(需要量的增加,排泄量的增加,病理性丢失等)。
异常浓度升高可能是由于进入血浆的量增加(生成和摄入的增加,从细胞内compartment中病理性漏出)或血浆中清除减慢(利用减少,排泄损伤等)。
同时,在一些病例中还要记得正常的体液平衡机制干扰的影响。
这似乎是很复杂的,但经过训练后,其思路就变得机械了。
用其基本原理来解释尽可能多的病例是熟练掌握它的最好的方法,特别是关于记住上述的特异物质哪些是理论上可能发生的,哪些是不可能发生的。
这里讨论的血浆的成分是那些常规使用中最常用的。
还有许多其它的可用于特异性诊断的检验(如激素化验),但这些方法的详细讲述更适于那些与特异性临床疾病相关的课本。
血清和血浆?当含有抗凝剂的血样被离心后,血浆就是上清液,而血清是血样凝固后的上清液。
兽医临床病理学检验技术名词解释嘿,朋友们!今天咱们来聊聊兽医临床病理学检验技术里那些让人有点晕乎的名词。
先说“血常规”,这就好比是给动物身体内部来一次大普查。
通过检测血液里的红细胞、白细胞、血小板啥的,就能知道动物身体是不是哪里出了岔子。
你想想,要是红细胞少了,那动物会不会像没吃饱饭的人一样没力气?白细胞多了,是不是就像身体里来了一群捣乱的“小怪兽”,在暗示着有炎症或者感染?再讲讲“生化检查”。
这就像是给动物身体里的各种物质做个“账本”。
看看血糖高不高,就知道它是不是吃多了甜食;肝功能指标正不正常,就知道肝脏这个“大工厂”有没有好好干活;肾功能的指标呢,能告诉咱们肾脏这个“过滤器”有没有出问题。
这不就跟咱们检查家里的电器是不是正常运转一个道理嘛!“尿液分析”也很重要哦!尿液就像是身体排出来的“小报告”。
通过检查尿液的酸碱度、有没有蛋白、有没有潜血,就能知道泌尿系统是不是在正常工作。
要是尿液里蛋白多了,那肾脏是不是就像漏了底的水桶,没能把好关?还有“细胞学检查”,这就像是拿着放大镜观察细胞这个“小士兵”有没有调皮捣蛋。
比如从肿瘤组织里提取细胞来检查,看看是不是有癌变的细胞在捣乱。
这就好比在一群人中找出那个心怀不轨的家伙一样!“病理切片”呢,就像是把身体组织切成薄薄的一片一片,然后仔细观察。
这就像把一块大蛋糕切成小块,看看每一块里面有没有坏掉的地方。
要是发现了异常的细胞结构,那可就得小心啦!“免疫组化”呢,这就像是给细胞做个特别的标记。
通过特定的抗体,找到那些有问题的细胞,就像在一群人中通过特殊的标志找出特定的人一样。
“微生物培养”,这就像是给细菌、真菌这些小微生物们找个“家”,看看它们在特定的环境里能不能生长。
如果长出来了,那就知道是哪种坏家伙在捣乱啦!总之,这些兽医临床病理学检验技术的名词,可都是帮助兽医们了解动物身体状况的重要工具。
就像我们通过各种工具来了解自己的生活一样,兽医们也靠着这些来守护动物们的健康。