过程设计和开发输入评审记录
- 格式:docx
- 大小:15.07 KB
- 文档页数:1

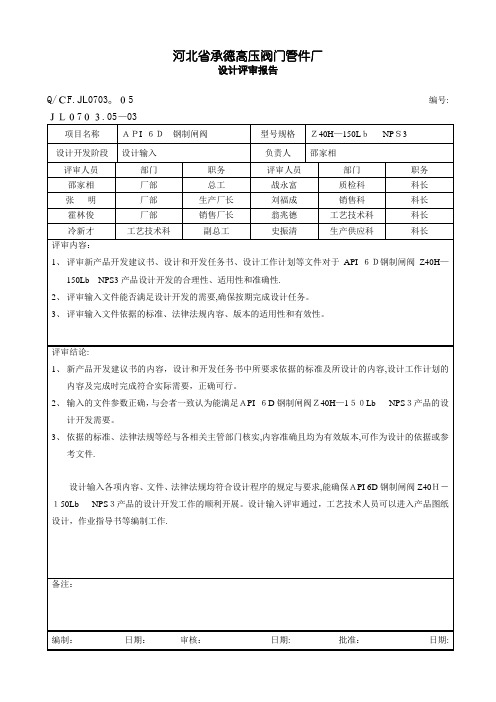

说明:
1. 设计评审的目的是发现潜在的不确定因素,或者已经知道的不足,然后采取措施,跟踪和解决这些问题,使评审对象
最后具有能力满足要求。
设计输入的评审资料应包括但不限于市场调研报告、新产品可行性报告、产品评估报告、涉及的法律法规。
设计输出的评审资料应包括但不限于设计图纸、组装图纸、BOM、产品规格书、材料规格书、测试要求、使用说明书。
设计验证的评审资料应包括但不限于产品综合性能测试报告、材料验证报告(比如生物兼容性检测、有效期验证等)。
设计确认的评审资料应包括但不限于产品应用报告或临床评估报告。
2. 研发负责人:负责提供评审资料,产品设计的技术性能指标,评审条目,组织评审会议。
3. 质量负责人:负责提出有关产品的法律法规资料及参与设计评审。
4. 生产负责人:负责提出有关产品的生产工艺和生产能力的资料,及参与设计评审。
5. 市场负责人:负责提出有关产品的市场信息,及参与设计评审。
6. 评审组长:负责评审总结,监督改进措施的实施。
7. 审批人:设计评审报告的批准。



审核记录要求4.11.可简单描述体系建立的过程。
2.可简单描述企业领导对自身体系运行水平、体系运行所需资源状况的客观评价。
3.可简单描述企业领导对体系主要过程的识别和认识。
4.应记录企业对外包过程的识别和控制方法。
5.可记录企业近期接受政府监管的结果。
总要求4.2.11.应描述企业的体系文件结构和详略情况,判断是否合理。
总则4.2.21.应记录手册的发布日期、审批人和版本号。
2.应记录对手册的删减及合理性。
3.可记录文审时提出的纠正要求是否落实。
质量手册4.2.31.应记录程序文件名称和编号以及受控文件清单。
2.可对企业是否收集了必要的外来文件作出判断。
3.应记录所抽查的三份以上文件的审批、更改、分发、回收、作废、保存等状况。
4.可判断文件的控制水平。
文件控制4.2.41.应记录程序文件名称和编号以及质量记录清单。
2.应记录所抽查的三份以上记录的检索和保存。
3.可对记录的管理方法和保存环境作出判断。
记录控制5.11.应简单描述企业领导为实现管理承诺做了哪些工作。
管理承诺5.21.应简单描述企业领导对顾客、顾客意见、顾客要求的认识。
2.可简单描述企业顾客群的概况和特点。
3.可简单描述企业与顾客的各个接口以及记录要求。
以顾客为关注焦点5.31.应描述企业领导对质量方针的内涵的理解。
2.应记录质量方针的审批和发布,并描述质量方针的传达情况。
3.可简单描述在管评时是否对持续适宜性进行评审。
4.可对质量方针的适宜性作出判断。
质量方针5.4.11.应记录总目标和目标分解,应对合理性和分解层次作出判断。
2.可描述质量目标的实现/考核情况。
质量目标5.4.21.应简单描述企业在体系建立和运行过程中的总体策划活动。
2.应记录质量管理体系的变更过程及变更过程是否受控。
质量管理体系策划5.5.11.应简单描述企业各部门和各岗位的职责和权限分工,2.应判断职责和权限分工是否明确和清晰。
职责权限5.5.21.应简单描述管代的任命、管代的职责权限。
医疗设备设计开发记录模板-07设计开发
评审报告-输入阶段
1. 项目信息
- 项目名称:
- 项目编号:
- 设计开发人员:
- 评审日期:
2. 评审目的
本评审旨在对医疗设备的设计开发过程进行评估和确认,确保输入阶段的设计符合相关要求和标准。
3. 设计开发内容
详细描述输入阶段所涉及的设计开发内容,包括但不限于:
- 设计需求分析
- 技术方案制定
- 文档编制
- 原型设计
4. 评审结果
针对输入阶段的设计开发,经过评审确认,结果如下:- 设计需求分析:符合项目要求,明确的需求描述。
- 技术方案制定:合理的技术路径,满足设计需求。
- 文档编制:规范的文档格式,清晰的内容描述。
- 原型设计:符合设计需求,具备基本功能。
5. 评审结论
根据对输入阶段的设计开发的评审结果,结论如下:- 设计开发符合要求,可以进入下一阶段的开发。
- 针对评审结果提出改进建议:
- 进一步优化技术方案,提升性能。
- 完善文档编制,确保内容准确性和完整性。
6. 评审人员
列出参与本次评审的人员和其所属部门或岗位。
7. 评审记录
记录评审过程中的关键问题、结果和讨论内容。
8. 附件
列出评审报告中所需的附件,如设计文档、技术规范等。
9. 评审意见
各评审人员可以在此表达对设计开发的补充意见或建议。
10. 评审日期
评审报告的起草日期和最后修改日期。
参考文献:
- 相关的标准和设计开发要求。
- 相关的行业规范和法律法规。