物质转化的规律1[1]
- 格式:ppt
- 大小:495.50 KB
- 文档页数:18
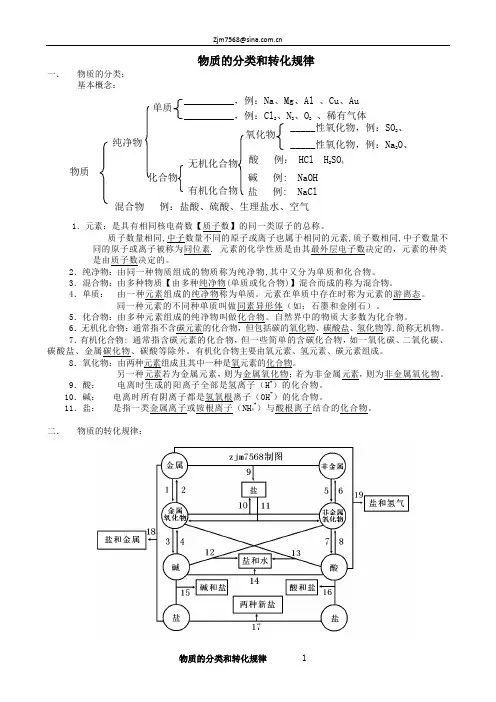
物质的分类和转化规律 一. 物质的分类:基本概念:3.混合物:由多种物质【由多种纯净物(单质或化合物)】混合而成的称为混合物。
4.单质: 由一种元素组成的纯净物称为单质。
元素在单质中存在时称为元素的游离态。
同一种元素的不同种单质叫做同素异形体(如:石墨和金刚石)。
5.化合物:由多种元素组成的纯净物叫做化合物。
自然界中的物质大多数为化合物。
6.无机化合物:通常指不含碳元素的化合物,但包括碳的氧化物、碳酸盐、氢化物等,简称无机物。
7.有机化合物: 通常指含碳元素的化合物,但一些简单的含碳化合物,如一氧化碳、二氧化碳、碳酸盐、金属碳化物、碳酸等除外。
有机化合物主要由氧元素、氢元素、碳元素组成。
8.氧化物:由两种元素组成且其中一种是氧元素的化合物。
另一种元素若为金属元素,则为金属氧化物;若为非金属元素,则为非金属氧化物。
9.酸: 电离时生成的阳离子全部是氢离子(H +)的化合物。
10.碱: 电离时所有阴离子都是氢氧根离子(OH -)的化合物。
11.盐: 是指一类金属离子或铵根离子(NH4+)与酸根离子结合的化合物。
二. 物质的转化规律:物质纯净物 单质化合物 __________,例:Cl2、N 2、O 2 、稀有气体_____性氧化物,例:SO 2、CO _____性氧化物,例:Na 2O 、氧化物酸 例: HCl H 2SO 4碱 例: NaOH盐 例: NaCl__________,例:Na 、Mg 、Al 、Cu 、Au无机化合物 有机化合物 混合物 例:盐酸、硫酸、生理盐水、空气1.金属+氧==金属氧化物①钠放置在空气中。
现象:银白色逐渐褪去,反应:4Na + O2 === 2Na2O②镁条燃烧。
现象:发出耀眼的白光,生成白色粉末. 反应:2Mg+O22MgO③加热金属铝片。
现象:铝箔熔化,失去光泽,熔化的铝并不滴落,产生这一现象的原因是:铝表面生成了氧化铝薄膜,构成薄膜的氧化铝的熔点高于金属铝的熔点,包在铝的外面,所以熔化的液态铝不会落下来。


生物的物质转化与能量转化规律生物体内的各种生物化学反应以及物质转化与能量转化是维持生物生命的基础。
在生物体内,物质与能量相互转化的过程影响着各种生命活动,如新陈代谢、生长、发育、繁殖等。
生物的物质转化与能量转化规律对我们理解生命的本质以及应用于医药、农业和环境保护等领域都具有重要意义。
一、物质转化物质转化是生物体内的一种重要过程。
由于生物体种类的复杂性,物质转化的方式也各有不同。
下面我们将从典型的物质转化过程来探讨一下物质转化的规律。
1. 糖类的转化糖类是生物体内最常见的能量来源,它们可以被分解产生能量。
在有氧条件下,糖类通过三个主要的代谢途径进行转化,即糖酵解、细胞呼吸和肝糖原生成。
糖酵解是一种无需氧气参与的糖类分解方式,通过一系列的反应将葡萄糖分解为乳酸或乙醛酸,生成能量。
细胞呼吸是糖类在有氧条件下的主要代谢途径,通过一系列的反应将葡萄糖分解为二氧化碳和水,同时产生大量的能量。
肝糖原生成是指当机体的能量需求旺盛时,糖类通过某些酶的催化作用生成肝糖原,以满足机体对能量的需要。
糖类的转化规律表明了生物体内糖类利用的复杂性,为我们理解生命物质转化提供了重要的参考。
2. 脂类的转化脂类是生物体内的能量储存体,它主要以三酸甘油脂的形式存在。
脂类的转化过程主要涉及到脂肪分解和β-氧化反应。
脂肪分解是脂肪酸从脂肪中解离出来的过程,产生脂肪酸和甘油。
在细胞内,脂肪酸再经过酯化过程,生成三酸甘油脂。
β-氧化反应是脂肪酸在线粒体中的一种重要代谢过程,通过一系列的反应将脂肪酸分解为乙酰辅酶A,产生大量能量。
脂类的转化规律揭示了生物体内脂类的分解与合成过程,这对于我们研究肥胖、心血管疾病和糖尿病等疾病具有重要意义。
3. 蛋白质的转化蛋白质是生物体内的重要组成部分,它们参与到各种细胞机能的实现中。
蛋白质的转化主要包括合成、降解和转化。
蛋白质的合成是指生物体内蛋白质通过肽链的形式进行合成的过程,合成过程因复杂性而多步骤进行。

高中化学必修一专题一:物质的分类及转化(经典实用)
物质的分类及转化是高中化学必修一的重要内容,该专题主要介绍了物质的分类方法和物质的转化规律。
以下是该专题的经典实用内容:
一、物质的分类方法:
1.按性质分类:可以根据物质的物理性质、化学性质、生物性
质等进行分类,如固体、液体、气体;酸、碱、盐等。
2.按组成分类:可以根据物质的基本组成单位进行分类,如元素、化合物、混合物等。
3.按来源分类:可以根据物质的来源进行分类,如天然物质和
人工合成物质等。
二、物质的转化规律:
1.物理变化:指物质在不改变其化学成分的情况下,发生形状、颜色、状态等方面的改变。
如溶解、汽化、凝固等。
2.化学变化:指物质在发生化学反应过程中,形成新的物质,
即产生化学变化。
如燃烧、酸碱中和、金属与酸反应等。
三、化学方程式:
1.化学方程式用化学符号和化学式表示化学反应的物质的种类
和数量关系。
反应物在化学方程式的左边,生成物在右边,用箭头分隔。
2.化学方程式还可以表示反应的摩尔比例关系和反应的能量变化。
四、化学反应的计算:
1.摩尔与质量的转化:可以利用化学方程式中物质的摩尔比例关系,通过已知物质的摩尔数或质量,计算其他物质的摩尔数或质量。
2.气体体积与摩尔数的关系:在一定的温度和压强下,气体的体积与物质的摩尔数成正比关系。
可以利用这一关系,计算反应物或生成物的摩尔数或体积。

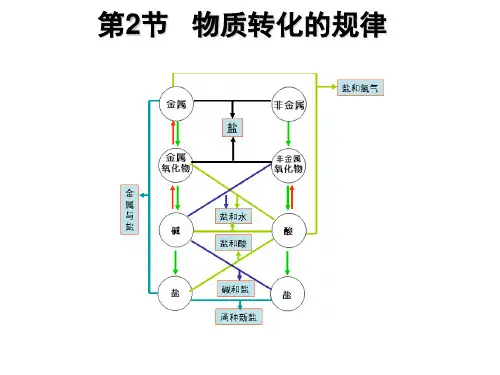

物质间的相互转化规律温馨提醒复分解反应发生的条件:①有沉淀↓(溶解性表)、气体↑或H2O生成;②盐+盐、盐+碱的反应要求反应物都能溶。
3、复分解反应是化合物之间的反应,反应前后化合价没有变化。
关于酸一、金属+酸=盐+氢气1、(实验室制氢气)2、3、二、金属氧化物+酸=盐+水1、2、三、非金属氧化物+碱=盐+水1、2、氢氧化钠在空气中变质3、4、四、酸+碱=盐+水(中和反应)1、2、3、4、五、酸+盐=新酸+新盐1、盐酸和硝酸银(检验Cl—)2、硫酸和硝酸钡(检验SO42—)3、盐酸和碳酸钙(制取CO2)4、盐酸和碳酸钠(检验CO32—)5、6、六、碱+盐=新碱+新盐(要求反应物都能溶于水)1、2、3(制取氢氧化钠)2、氯化铵和氢氧化钠(检验NH4+)七、盐+盐=新盐+新盐(要求反应物都能溶于水)1、2、3、4、八、金属+盐(溶液)=新金属+新盐(根据金属活动性顺序判断)1、2、、金属+氧气=金属氧化物1、2、3、九、金属氧化物+水=碱(只有下列四种可溶性碱)1、2、3、4、十、非金属+氧气=非金属氧化物1、2、3、4、氢气在空气中燃烧十一、非金属氧化物+水=酸1、二氧化碳和水2、二氧化硫和水3、三氧化硫和水十二、金属+非金属=无氧酸盐1、铁和硫2、铁和氯气3、铜和氯气4、钠和氯气十三、金属氧化物+非金属氧化物=含氧酸盐(很少用,别乱写。
)1、氧化钙和二氧化硅十四、金属氧化物+还原剂(H2、C、CO)===金属+非金属氧化物(H2O或CO2)1、氢气还原氧化铜2、氢气还原氧化铁3、炭还原氧化铜4、炭还原氧化铁5、一氧化碳还原氧化铜6、一氧化碳还原氧化铁十五、其它1、碳酸分解2、电解水3、高锰酸钾制氧气4、实验室制取氧气5、甲烷燃烧6、一氧化碳燃烧7、炭还原二氧化碳8、煅烧石灰石9、加热氢氧化铜(不溶性碱)10、加热氢氧化铁(不溶性碱)。


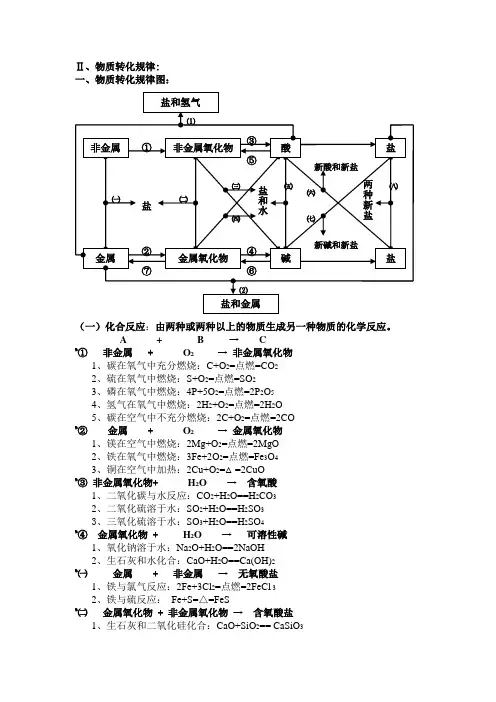
Ⅱ、物质转化规律:一、物质转化规律图:(一)化合反应:由两种或两种以上的物质生成另一种物质的化学反应。
A +B → C%①非金属 + O2 →非金属氧化物1、碳在氧气中充分燃烧:C+O2=点燃=CO22、硫在氧气中燃烧:S+O2=点燃=SO23、磷在氧气中燃烧:4P+5O2=点燃=2P2O54、氢气在氧气中燃烧:2H2+O2=点燃=2H2O5、碳在空气中不充分燃烧:2C+O2=点燃=2CO%②金属 + O2 →金属氧化物1、镁在空气中燃烧:2Mg+O2=点燃=2MgO2、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O43、铜在空气中加热:2Cu+O2=△=2CuO%③非金属氧化物+H2O →含氧酸1、二氧化碳与水反应:CO2+H2O==H2CO32、二氧化硫溶于水:SO2+H2O==H2SO33、三氧化硫溶于水:SO3+H2O==H2SO4%④金属氧化物+ H2O →可溶性碱1、氧化钠溶于水:Na2O+H2O==2NaOH2、生石灰和水化合:CaO+H2O==Ca(OH)2%㈠金属 + 非金属→无氧酸盐1、铁与氯气反应:2Fe+3Cl2=点燃=2FeCl 32、铁与硫反应:Fe+S=△=FeS%㈡金属氧化物+ 非金属氧化物→含氧酸盐1、生石灰和二氧化硅化合:CaO+SiO2== CaSiO3其它化合反应:1、一氧化碳在空气中燃烧:2CO+O2=点燃=2CO22、二氧化碳通过灼热的碳层:CO2+C=高温=2CO3、氢气在氯气中燃烧:H2+Cl2=点燃=2HCl(二)分解反应:由一种物质生成两种或两种以上其它物质的化学反应。
C → A + B%⑤酸分解酸→酸性氧化物+ H2O1、碳酸不稳定分解:H2CO3==H2O+CO2↑%⑥碱分解不溶性碱→碱性氧化物+ H2O1、氢氧化铜受热分解:Cu(OH)2=△=CuO+H2O氧化物分解:1、电解水:2H2O=通电=2H2↑+O2↑盐分解:1、加热高锰酸钾:2KMnO4=△=K2MnO4+MnO2+O2↑2、氯酸钾受热分解(实验室制O2):2KClO3=(MnO2△)=2KCl+3O2↑3、加热碱式碳酸铜:Cu2(OH)2CO3=△=2CuO+H2O+CO2↑4、高温煅烧石灰石:CaCO3=高温=CaO+CO2↑5、硫酸铜晶体受热失去结晶水:CuSO4·5H2O=△=CuSO4+5H2O(三)置换反应:由一种单质跟一种化合物发生反应生成另一种单质和另一种化合物的反应。
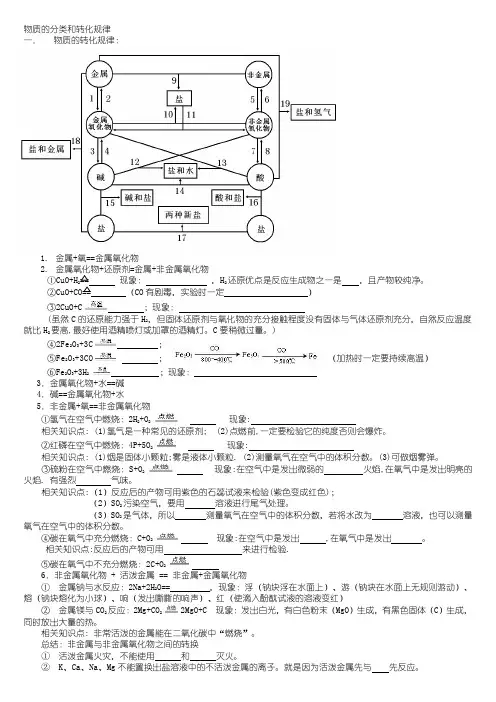
物质的分类和转化规律一.物质的转化规律:1.金属+氧==金属氧化物2.金属氧化物+还原剂=金属+非金属氧化物①CuO+H2== 现象:,H2还原优点是反应生成物之一是,且产物较纯净。
②CuO+CO== (CO有剧毒,实验时一定)③2CuO+C;现象:(虽然C的还原能力强于H2,但固体还原剂与氧化物的充分接触程度没有固体与气体还原剂充分,自然反应温度就比H2要高,最好使用酒精喷灯或加罩的酒精灯。
C要稍微过量。
)④2Fe2O3+3C;⑤Fe2O3+3CO;(加热时一定要持续高温)⑥Fe2O3+3H2 ;现象:3.金属氧化物+水==碱4.碱==金属氧化物+水5.非金属+氧==非金属氧化物①氢气在空气中燃烧:2H2+O2现象:相关知识点: (1)氢气是一种常见的还原剂; (2)点燃前,一定要检验它的纯度否则会爆炸。
②红磷在空气中燃烧:4P+5O2现象:相关知识点: (1)烟是固体小颗粒;雾是液体小颗粒. (2)测量氧气在空气中的体积分数。
(3)可做烟雾弹。
③硫粉在空气中燃烧: S+O2现象:在空气中是发出微弱的火焰,在氧气中是发出明亮的火焰. 有强烈气味。
相关知识点:(1)反应后的产物可用紫色的石蕊试液来检验(紫色变成红色);(2)SO2污染空气,要用溶液进行尾气处理。
(3)SO2是气体,所以测量氧气在空气中的体积分数,若将水改为溶液,也可以测量氧气在空气中的体积分数。
④碳在氧气中充分燃烧:C+O2现象:在空气中是发出 ,在氧气中是发出。
相关知识点:反应后的产物可用来进行检验.⑤碳在氧气中不充分燃烧:2C+O26.非金属氧化物 + 活泼金属 == 非金属+金属氧化物①金属钠与水反应:2Na+2H2O== ,现象:浮(钠块浮在水面上)、游(钠块在水面上无规则游动)、熔(钠块熔化为小球)、响(发出嘶嘶的响声)、红(使滴入酚酞试液的溶液变红)②金属镁与CO2反应:2Mg+CO22MgO+C 现象:发出白光,有白色粉末(MgO)生成,有黑色固体(C)生成,同时放出大量的热。
物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律)(1)~(7)四条横线相联系(四条规律)(8)~(11)六条交叉成网络(六条规律)(12)~(17)17条规律须牢记反应规律示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ C u O O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+O H C u S O SO H OH Cu 244222)(+=+ (5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+ (6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232S i O O H S i O H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐 32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H(15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用:(1)可知某物质的性质。
第2节物质转化的规律[知识梳理]1.各类物质之间存在相互关系并在一定的条件下可相互转化,其中非金属单质与氧气反应可生成非金属氧化物,某些非金属氧化物与水反应可生成酸,金属单质与氧气反应可生成金属氧化物,某些金属氧化物与水反应可生成碱。
2.金属的冶炼就是利用碳作还原剂夺取金属氧化物中的氧,使之由化合态变为游离态。
常见的还原剂还有一氧化碳和氢气。
[解题指引]例1将CO2通入CaCl2溶液中未见沉淀出现,则再在溶液加入下列哪种物质后就会出现沉淀A.盐酸B.氯化钠溶液C.氢氧化钠溶液D.稀硝酸()指引:往CaCl2溶液中通入CO2不会沉淀生成是因为H2CO3是弱酸,溶液中CO32-离子浓度很小不足于和Ca2+结合生成CaCO3沉淀。
往溶液中加强酸更不会出现沉淀。
往溶液中加碱能出现沉淀,这是因为加碱后与H2CO3中和生成可溶性的碳酸盐,溶液中CO32-离子浓度增大,从而与Ca2+结合生成CaCO3沉淀。
答案:C例2 某学生对过量炭粉与氧化铁反应产物中气体的成分进行研究。
(1)假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:使一定量的氧化铁在隔绝氧气的条件下与过量的炭粉完全反应测得参加反应的碳元素和氧元素的质量比。
(3)查阅资料:氮气不与炭粉、氧化铁反应,可用来隔绝氧气。
((6)结论:根据对数据的处理结果得知,原假设_________(填“成立”或“不成立”),理由是____________________________________________________________。
指引:反应前玻璃管和物质的总重量为3.2克+2克+48.48克=53.68克,反应后质量减少了53.68克-52.24克=1.44克,因为减少的质量小于原碳的质量2克,说明碳有剩余,而氧化铁完全反应。
生成的碳的氧化物中氧元素的质量等于氧化铁中氧元素的质量:3.2克×30%=0.96克,所以参加反应的碳元素质量是1.44克-0.96克=0.48克,根据质量守恒定律得生成的碳的氧化物中碳元素与氧元素的质量比为:0.48:0.96克=1:2,而二氧化碳中两元素的质量比为12: (16×2)=3:8≠1:2,所以产物不只有二氧化碳。
高中怎么判断物质是否能一步转化的规律
高中阶段判断物质是否能一步转化的规律,可以参考以下步骤:
1. 确定变化前后的元素种类和数量。
例如,如果反应物和生成物中的元素种类和数量都相同,那么这个反应是可能发生的。
2. 确定变化前后的化学键类型和数量。
例如,如果反应物和生成物中的化学键类型和数量都相同,那么这个反应是可能发生的。
3. 分析反应的过程,确定是否存在可逆性。
有些反应在条件变化时,可能会逆向进行。
这需要我们分析反应的过程,确定是否存在可逆性。
4. 考虑反应物和生成物的能量关系。
反应是否能一步完成,还要考虑反应物和生成物的能量关系。
如果反应物和生成物的能量关系不匹配,那么这个反应可能需要经过多个步骤完成。
5. 进行实验验证。
如果我们对某个反应的一步转化规律有疑问,最好进行实验验证。
通过实验,我们可以观察反应的过程,确定反应是否能一步完成。
需要注意的是,这只是一些基本的判断方法,化学反应是一个非常复杂的过程,在实际情况中,物质的转化可能会受到许多因素的影响,需要具体情况具体分析。