物质转化的规律
- 格式:docx
- 大小:230.85 KB
- 文档页数:8
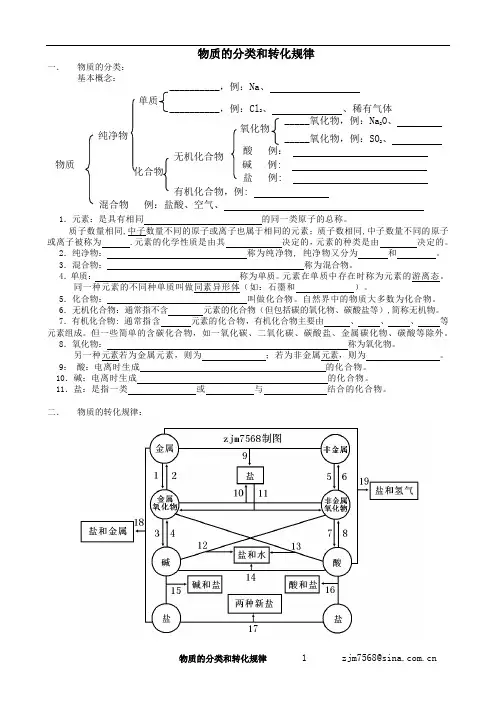
物质的分类和转化规律 一. 物质的分类: 基本概念: 1.元素:是具有相同 的同一类原子的总称。
质子数量相同,中子数量不同的原子或离子也属于相同的元素;质子数相同,中子数量不同的原子或离子被称为 .元素的化学性质是由其 决定的,元素的种类是由 决定的。
2.纯净物: 称为纯净物, 纯净物又分为 和 。
3.混合物: 称为混合物。
4.单质: 称为单质。
元素在单质中存在时称为元素的游离态。
同一种元素的不同种单质叫做同素异形体(如:石墨和 )。
5.化合物: 叫做化合物。
自然界中的物质大多数为化合物。
6.无机化合物:通常指不含 元素的化合物(但包括碳的氧化物、碳酸盐等),简称无机物。
7.有机化合物: 通常指含 元素的化合物,有机化合物主要由 、 、 、 等元素组成。
但一些简单的含碳化合物,如一氧化碳、二氧化碳、碳酸盐、金属碳化物、碳酸等除外。
8.氧化物: 称为氧化物。
另一种元素若为金属元素,则为 ;若为非金属元素,则为 。
9: 酸:电离时生成 的化合物。
10.碱:电离时生成 的化合物。
11.盐:是指一类 或 与 结合的化合物。
二. 物质的转化规律:物质 纯净物 单质 化合物 __________,例:Cl 2、 、稀有气体 _____氧化物,例:SO 2、 _____氧化物,例:Na 2O 、 氧化物 酸 例: 碱 例: 盐 例:无机化合物 有机化合物,例:__________,例:Na 、 混合物 例:盐酸、空气、1.金属+氧==金属氧化物①钠放置在空气中。
现象:银白色逐渐退去。
反应:4Na+O2 ==②镁条燃烧。
现象:,反应:2Mg+O2③加热金属铝片。
现象:铝箔熔化,失去光泽,熔化的铝并不滴落,产生这一现象的原因是:铝表面生成了氧化铝薄膜,构成薄膜的氧化铝的熔点高于金属铝的熔点,包在铝的外面,所以熔化的液态铝不会落下来。
反应:4Al+3O2④铝在空气中生锈:4Al+3O2 == Al2O3是一层极薄的物,可阻碍反应的进行。


生物的物质转化与能量转化规律生物体内的各种生物化学反应以及物质转化与能量转化是维持生物生命的基础。
在生物体内,物质与能量相互转化的过程影响着各种生命活动,如新陈代谢、生长、发育、繁殖等。
生物的物质转化与能量转化规律对我们理解生命的本质以及应用于医药、农业和环境保护等领域都具有重要意义。
一、物质转化物质转化是生物体内的一种重要过程。
由于生物体种类的复杂性,物质转化的方式也各有不同。
下面我们将从典型的物质转化过程来探讨一下物质转化的规律。
1. 糖类的转化糖类是生物体内最常见的能量来源,它们可以被分解产生能量。
在有氧条件下,糖类通过三个主要的代谢途径进行转化,即糖酵解、细胞呼吸和肝糖原生成。
糖酵解是一种无需氧气参与的糖类分解方式,通过一系列的反应将葡萄糖分解为乳酸或乙醛酸,生成能量。
细胞呼吸是糖类在有氧条件下的主要代谢途径,通过一系列的反应将葡萄糖分解为二氧化碳和水,同时产生大量的能量。
肝糖原生成是指当机体的能量需求旺盛时,糖类通过某些酶的催化作用生成肝糖原,以满足机体对能量的需要。
糖类的转化规律表明了生物体内糖类利用的复杂性,为我们理解生命物质转化提供了重要的参考。
2. 脂类的转化脂类是生物体内的能量储存体,它主要以三酸甘油脂的形式存在。
脂类的转化过程主要涉及到脂肪分解和β-氧化反应。
脂肪分解是脂肪酸从脂肪中解离出来的过程,产生脂肪酸和甘油。
在细胞内,脂肪酸再经过酯化过程,生成三酸甘油脂。
β-氧化反应是脂肪酸在线粒体中的一种重要代谢过程,通过一系列的反应将脂肪酸分解为乙酰辅酶A,产生大量能量。
脂类的转化规律揭示了生物体内脂类的分解与合成过程,这对于我们研究肥胖、心血管疾病和糖尿病等疾病具有重要意义。
3. 蛋白质的转化蛋白质是生物体内的重要组成部分,它们参与到各种细胞机能的实现中。
蛋白质的转化主要包括合成、降解和转化。
蛋白质的合成是指生物体内蛋白质通过肽链的形式进行合成的过程,合成过程因复杂性而多步骤进行。

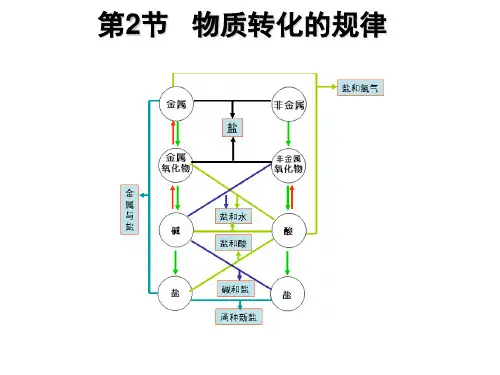

物质间的相互转化规律温馨提醒复分解反应发生的条件:①有沉淀↓(溶解性表)、气体↑或H2O生成;②盐+盐、盐+碱的反应要求反应物都能溶。
3、复分解反应是化合物之间的反应,反应前后化合价没有变化。
关于酸一、金属+酸=盐+氢气1、(实验室制氢气)2、3、二、金属氧化物+酸=盐+水1、2、三、非金属氧化物+碱=盐+水1、2、氢氧化钠在空气中变质3、4、四、酸+碱=盐+水(中和反应)1、2、3、4、五、酸+盐=新酸+新盐1、盐酸和硝酸银(检验Cl—)2、硫酸和硝酸钡(检验SO42—)3、盐酸和碳酸钙(制取CO2)4、盐酸和碳酸钠(检验CO32—)5、6、六、碱+盐=新碱+新盐(要求反应物都能溶于水)1、2、3(制取氢氧化钠)2、氯化铵和氢氧化钠(检验NH4+)七、盐+盐=新盐+新盐(要求反应物都能溶于水)1、2、3、4、八、金属+盐(溶液)=新金属+新盐(根据金属活动性顺序判断)1、2、、金属+氧气=金属氧化物1、2、3、九、金属氧化物+水=碱(只有下列四种可溶性碱)1、2、3、4、十、非金属+氧气=非金属氧化物1、2、3、4、氢气在空气中燃烧十一、非金属氧化物+水=酸1、二氧化碳和水2、二氧化硫和水3、三氧化硫和水十二、金属+非金属=无氧酸盐1、铁和硫2、铁和氯气3、铜和氯气4、钠和氯气十三、金属氧化物+非金属氧化物=含氧酸盐(很少用,别乱写。
)1、氧化钙和二氧化硅十四、金属氧化物+还原剂(H2、C、CO)===金属+非金属氧化物(H2O或CO2)1、氢气还原氧化铜2、氢气还原氧化铁3、炭还原氧化铜4、炭还原氧化铁5、一氧化碳还原氧化铜6、一氧化碳还原氧化铁十五、其它1、碳酸分解2、电解水3、高锰酸钾制氧气4、实验室制取氧气5、甲烷燃烧6、一氧化碳燃烧7、炭还原二氧化碳8、煅烧石灰石9、加热氢氧化铜(不溶性碱)10、加热氢氧化铁(不溶性碱)。
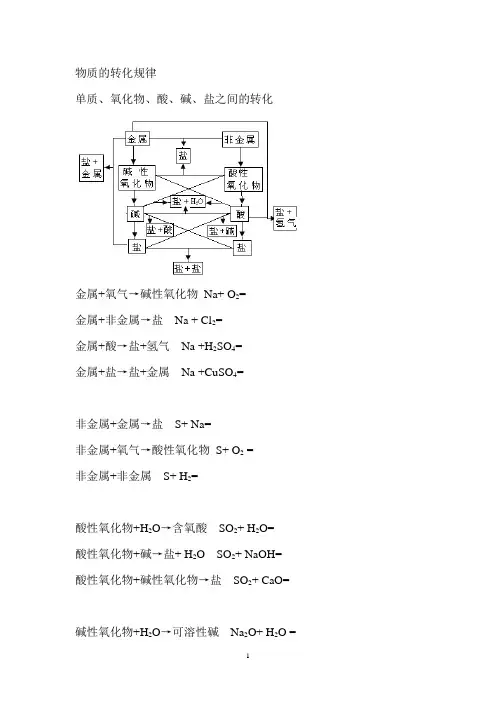
物质的转化规律
单质、氧化物、酸、碱、盐之间的转化
金属+氧气→碱性氧化物Na+ O2=
金属+非金属→盐Na + Cl2=
金属+酸→盐+氢气Na +H2SO4=
金属+盐→盐+金属Na +CuSO4=
非金属+金属→盐S+ Na=
非金属+氧气→酸性氧化物S+ O2 =
非金属+非金属S+ H2=
酸性氧化物+H2O→含氧酸SO2+ H2O=
酸性氧化物+碱→盐+ H2O SO2+ NaOH= 酸性氧化物+碱性氧化物→盐SO2+ CaO=
碱性氧化物+H2O→可溶性碱Na2O+ H2O =
碱性氧化物+酸→盐+ H2O Na2O +HCl=
碱性氧化物+酸性氧化物→盐Na2O+CO2=
酸+金属→盐+氢气H2SO4+Fe=
酸+碱性氧化物→盐+ H2O H2SO4+ CuO=
酸+碱→盐+ H2O H2SO4+ Ba(OH)2=
酸+盐→盐+ 酸(强酸→弱酸、难挥发→易挥发)
H2SO4+Ba(NO3)2=
H2SO4+Na2CO3=
碱+酸性氧化物→盐+ H2O NaOH+CO2=
碱+酸→盐+ H2O NaOH+ H2SO4=
碱+盐→盐+ 碱(反应物均可溶、生成物之一为难溶或难电离)NaOH+ CuSO4=
NaOH+ NH4Cl=
盐+金属→盐+金属 CuSO4+ Zn=
盐+酸→盐+ 酸 BaCl2+ H2SO4
盐+碱→盐+ 碱 CuSO4+ Ba(OH)2=
盐+盐→盐+ 盐(反应物均可溶、生成物之一为难溶)NaCl+AgNO3= BaCl2+Na2SO4=。


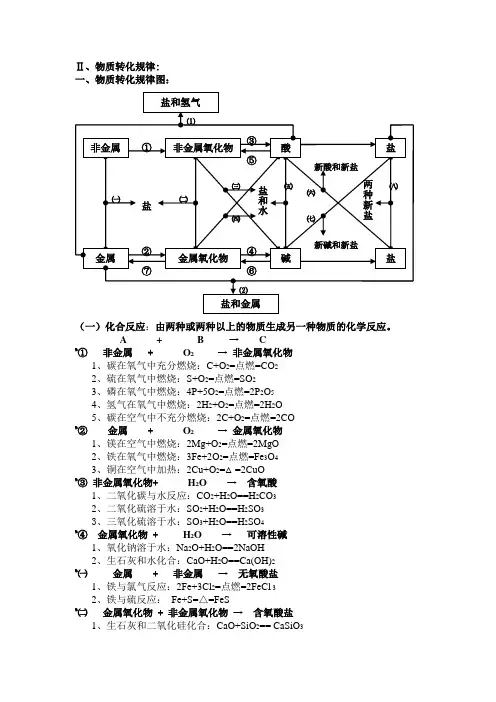
Ⅱ、物质转化规律:一、物质转化规律图:(一)化合反应:由两种或两种以上的物质生成另一种物质的化学反应。
A +B → C%①非金属 + O2 →非金属氧化物1、碳在氧气中充分燃烧:C+O2=点燃=CO22、硫在氧气中燃烧:S+O2=点燃=SO23、磷在氧气中燃烧:4P+5O2=点燃=2P2O54、氢气在氧气中燃烧:2H2+O2=点燃=2H2O5、碳在空气中不充分燃烧:2C+O2=点燃=2CO%②金属 + O2 →金属氧化物1、镁在空气中燃烧:2Mg+O2=点燃=2MgO2、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O43、铜在空气中加热:2Cu+O2=△=2CuO%③非金属氧化物+H2O →含氧酸1、二氧化碳与水反应:CO2+H2O==H2CO32、二氧化硫溶于水:SO2+H2O==H2SO33、三氧化硫溶于水:SO3+H2O==H2SO4%④金属氧化物+ H2O →可溶性碱1、氧化钠溶于水:Na2O+H2O==2NaOH2、生石灰和水化合:CaO+H2O==Ca(OH)2%㈠金属 + 非金属→无氧酸盐1、铁与氯气反应:2Fe+3Cl2=点燃=2FeCl 32、铁与硫反应:Fe+S=△=FeS%㈡金属氧化物+ 非金属氧化物→含氧酸盐1、生石灰和二氧化硅化合:CaO+SiO2== CaSiO3其它化合反应:1、一氧化碳在空气中燃烧:2CO+O2=点燃=2CO22、二氧化碳通过灼热的碳层:CO2+C=高温=2CO3、氢气在氯气中燃烧:H2+Cl2=点燃=2HCl(二)分解反应:由一种物质生成两种或两种以上其它物质的化学反应。
C → A + B%⑤酸分解酸→酸性氧化物+ H2O1、碳酸不稳定分解:H2CO3==H2O+CO2↑%⑥碱分解不溶性碱→碱性氧化物+ H2O1、氢氧化铜受热分解:Cu(OH)2=△=CuO+H2O氧化物分解:1、电解水:2H2O=通电=2H2↑+O2↑盐分解:1、加热高锰酸钾:2KMnO4=△=K2MnO4+MnO2+O2↑2、氯酸钾受热分解(实验室制O2):2KClO3=(MnO2△)=2KCl+3O2↑3、加热碱式碳酸铜:Cu2(OH)2CO3=△=2CuO+H2O+CO2↑4、高温煅烧石灰石:CaCO3=高温=CaO+CO2↑5、硫酸铜晶体受热失去结晶水:CuSO4·5H2O=△=CuSO4+5H2O(三)置换反应:由一种单质跟一种化合物发生反应生成另一种单质和另一种化合物的反应。
一、物质的分类及转化 2、物质的转化规律单质、氧化物、酸、碱、盐之间的转化1、物质的分类(1) 单质金属:钠、镁、铝、铁、铜 非金属:碳、硫、磷(2)氧化物-------按性质分酸性(酸酐) :如N 2O 3 P 2O 5 Mn 2O 7 3、四种基本反应类型与氧化还原反应 碱性:如Na 2O Fe 2O 3 四种基本反应类型包括:化合、分解 两性:如Al 2O 3 ZnO 置换、复分解 不成盐氧化物:如CO NO特殊氧化物:如Na 2O 2 Fe 3O 4 MnO 2 氧化还原反应:有元素化合价发生变化的反应(3)酸------按是否完全电离强酸:如HCl HBr HI HNO 3 H 2SO 4 HClO 4 四大基本反应与氧化还原反应的关系: 弱酸:如HF HClO H 2S H 2SO 3 H 3PO 4-------按挥发性分难挥发性酸:如H 2SO 4 H 3PO 4 易挥发性酸:如浓HCl 浓HNO 3--------对热稳定性 稳定性酸:如HCl H 2SO 4 H 3PO 4 不稳定性酸:如H 2SO 3 H 2CO 3(4)碱------溶解性可溶性碱:如NH 3·H 2O NaOH Ba(OH)2 难溶性碱:如Mg(OH)2 Fe(OH)3(5)盐-------按酸碱中和的程度 正盐:如Na 2CO 3 NH 4NO 3酸式盐:如NaHSO 4 KHSO 3 NaHCO 3 KHS 碱式盐:如Cu 2(OH)2CO 3 Mg(OH)Cl练习:1.下列含有相同元素的化合物组是A.O 2 O 3B.CO CO 2C.KCl AlCl 3D.NaHCO 3、NaHSO 4 2.下列属于纯净物的是A.盐酸B.空气C.Fe 3O 4D.大理石3.由以下给定化合价的五种元素H +1、S +6、O -2、K +1、Na +1,最多可以组成( )种化合物 A .9 B .10 C .11 D .12 4.下列物质属于酸性氧化物的是A.Na 2OB.COC.CaOD.SO 2 5.下列说法正确的是A.酸性氧化物都是非金属氧化物B.非金属氧化物都是酸性氧化物C.金属氧化物都是碱性氧化物D.碱性氧化物都是金属氧化物6.将下列各组物质按酸、碱、盐分类顺序排列,正确的是 A.硫酸,纯碱,石灰石 B.醋酸,烧碱,硫酸铜 C.磷酸,熟石灰,苛性钾 D.醋酸,小苏打,熟石灰 7、下列物质的分类正确的是( )8、若将以下化合物按硫元素的化合价分为三组,请把化学式填在相应短线上。
物质状态之间的转化
物质状态之间的转化主要包括凝固、熔化、升华、凝华、汽化和液化。
1. 凝固:指物质从液态转化为固态的过程。
当物质的温度降低到其凝固点以下时,分子间的相互作用力增强,使得分子排列有序,形成固体。
2. 熔化:指物质从固态转化为液态的过程。
当物质的温度升高到其熔点以上时,分子间的相互作用力减弱,使得分子排列变得无序,形成液体。
3. 升华:指物质从固态直接转化为气态的过程,无液态存在。
当物质的温度升高到其升华点以上时,分子间的相互作用力减弱,使得分子从固态直接脱离形成气体。
4. 凝华:指物质从气态直接转化为固态的过程,无液态存在。
当物质的温度降低到其凝华点以下时,分子间的相互作用力增强,使得分子从气态直接固定在一起形成固体。
5. 汽化:指物质从液态转化为气态的过程。
当物质的温度升高到其沸点以上时,分子间的相互作用力减弱,使得分子从液态脱离形成气体。
6. 液化:指物质从气态转化为液态的过程。
当物质的温度降低到其沸点以下时,分子间的相互作用力增强,使得分子从气态聚集在一起形成液体。
需要注意的是,物质状态之间的转化是与温度和压力紧密相关的。
不同物质的转化过程可能存在一定的差异,但总体上遵循上述的基本规律。
物质的分类和转化规律一.物质的转化规律:1.金属+氧==金属氧化物2.金属氧化物+还原剂=金属+非金属氧化物①CuO+H2== 现象:,H2还原优点是反应生成物之一是,且产物较纯净。
②CuO+CO== (CO有剧毒,实验时一定)③2CuO+C;现象:(虽然C的还原能力强于H2,但固体还原剂与氧化物的充分接触程度没有固体与气体还原剂充分,自然反应温度就比H2要高,最好使用酒精喷灯或加罩的酒精灯。
C要稍微过量。
)④2Fe2O3+3C;⑤Fe2O3+3CO;(加热时一定要持续高温)⑥Fe2O3+3H2 ;现象:3.金属氧化物+水==碱4.碱==金属氧化物+水5.非金属+氧==非金属氧化物①氢气在空气中燃烧:2H2+O2现象:相关知识点: (1)氢气是一种常见的还原剂; (2)点燃前,一定要检验它的纯度否则会爆炸。
②红磷在空气中燃烧:4P+5O2现象:相关知识点: (1)烟是固体小颗粒;雾是液体小颗粒. (2)测量氧气在空气中的体积分数。
(3)可做烟雾弹。
③硫粉在空气中燃烧: S+O2现象:在空气中是发出微弱的火焰,在氧气中是发出明亮的火焰. 有强烈气味。
相关知识点:(1)反应后的产物可用紫色的石蕊试液来检验(紫色变成红色);(2)SO2污染空气,要用溶液进行尾气处理。
(3)SO2是气体,所以测量氧气在空气中的体积分数,若将水改为溶液,也可以测量氧气在空气中的体积分数。
④碳在氧气中充分燃烧:C+O2现象:在空气中是发出 ,在氧气中是发出。
相关知识点:反应后的产物可用来进行检验.⑤碳在氧气中不充分燃烧:2C+O26.非金属氧化物 + 活泼金属 == 非金属+金属氧化物①金属钠与水反应:2Na+2H2O== ,现象:浮(钠块浮在水面上)、游(钠块在水面上无规则游动)、熔(钠块熔化为小球)、响(发出嘶嘶的响声)、红(使滴入酚酞试液的溶液变红)②金属镁与CO2反应:2Mg+CO22MgO+C 现象:发出白光,有白色粉末(MgO)生成,有黑色固体(C)生成,同时放出大量的热。
生物化学中的物质转化规律生物化学是研究生命体系中物质转化的科学,是化学、物理、生物等学科的交叉领域。
生物化学中的物质转化规律是生物体内分子转化的基础,生物体内的物质转化是生命活动的基本过程之一。
在这篇文章中,我们将会通过探讨物质转化规律在生物化学中的应用,来进一步理解生命体系中物质转化的原理和过程。
一、蛋白质的合成蛋白质是生命体系中最基本的分子之一,它们是由氨基酸组成的长链。
生物体内产生蛋白质的过程称作蛋白质合成,蛋白质合成是生物化学中的一个重要领域,对研究生物体内的物质转化机制和生命活动规律具有重要意义。
蛋白质的合成需要有一系列相互配合的物质转化过程。
其中最重要的便是生物体内的基因表达。
基因表达是生物体内物质转化的一个关键环节,在基因表达过程中,基因中蕴含的遗传信息被转化为功能性蛋白质。
这一过程包括了转录、剪接、转运和翻译等一系列的生物化学反应。
转录过程将DNA螺旋的基对序列转录成mRNA链,这些RNA链在细胞质中被翻译成蛋白质。
生物体内的物质转化规律在这一基因表达过程中发挥了非常重要的作用。
二、碳水化合物分解碳水化合物是生命体系中非常重要的营养素,我们的身体中大部分的能量都来自于碳水化合物的分解。
在生物体内,碳水化合物的分解又称为糖解。
糖解是生命体系中最为重要的生化反应之一,也是人体运动时产生能量的主要途径。
糖解的反应过程是复杂的,包含了许多不同的反应步骤。
整个糖解的过程通常被分为两个阶段:糖原裂解和糖原呼吸。
糖原裂解是将体内存储的多聚糖分解为单糖,单糖进入另一个阶段的糖原呼吸。
在糖原呼吸中,单糖被氧化分解,产生能量并转化为能够被身体利用的物质(如乳酸或乙酸)。
三、氧化还原反应生物体内的氧化还原反应是生物化学中的另一个重要领域。
人体内的氧化还原反应是将食物中所含的化学能转化为身体所需的能量的基本方式。
氧化还原反应是生物体内分子转化的一个关键环节,它涉及了大量的化学反应。
在每一个化学反应过程中,某些分子失去了电子(氧化),而另一些分子却得到了电子(还原)。
物质的分类和转化规律 一. 物质的分类:基本概念:.纯净物: 称为纯净物纯净物又分为 和 。
3.混合物: 称为混合物。
4.单质: 称为单质。
元素在单质中存在时称为元素的游离态。
同一种元素的不同种单质叫做同素异形体(如:石墨和 )。
5.化合物: 叫做化合物。
自然界中的物质大多数为化合物。
6.无机化合物:通常指不含 元素的化合物(但包括碳的氧化物、碳酸盐等),简称无机物。
7.有机化合物: 通常指含 元素的化合物,有机化合物主要由 、 、 、 等元素组成。
但一些简单的含碳化合物,如一氧化碳、二氧化碳、碳酸盐、金属碳化物、碳酸等除外。
8.氧化物: 称为氧化物。
另一种元素若为金属元素,则为 ;若为非金属元素,则为 。
9: 酸:电离时生成 的化合物。
10.碱:电离时生成 的化合物。
11.盐:是指一类 或 与结合的化合物。
二. 物质的转化规律:物质纯净物 单质化合物__________,例:Cl 2、 、稀有气体_____氧化物,例:SO 2、_____氧化物,例:Na 2O 、氧化物酸 例:碱 例:盐 例:无机化合物有机化合物,例:__________,例:Na 、混合物 例:盐酸、空气、1. 金属+氧==金属氧化物① 钠放置在空气中。
现象:银白色逐渐退去。
反应:4Na+O 2 == ② 镁条燃烧。
现象: , 反应:2Mg+O 2③ 加热金属铝片。
现象:铝箔熔化,失去光泽,熔化的铝并不滴落,产生这一现象的原因是:铝表面生成了氧化铝薄膜,构成薄膜的氧化铝的熔点高于金属铝的熔点,包在铝的外面,所以熔化的液态铝不会落下来。
反应:4Al+3O 2④ 铝在空气中生锈:4Al+3O 2 == Al 2O 3是一层极薄的 物,可阻碍反应的进行。
⑤ 铁丝在氧气中燃烧。
现象: , 反应:3Fe+2O 2 。
铁钉在空气中生锈。
现象: , 反应:4Fe+3O 2= 。
相关知识点:(1)铁生锈的条件: 、 (2)Fe 可做 中的抗氧化剂(去除 )。
⑥ 加热金属铜丝。
现象: 。
反应:2Cu+O 2== . 2. 金属氧化物+还原剂=金属+非金属氧化物 ①CuO+H 2== 现象: ,H 2还原优点是反应生成物之一是 ,且产物较纯净。
②CuO+CO== (CO 有剧毒,实验时一定 )③2CuO+C ;现象:(虽然C 的还原能力强于H 2,但固体还原剂与氧化物的充分接触程度没有固体与气体还原剂充分,自然反应温度就比H 2要高,最好使用酒精喷灯或加罩的酒精灯。
C 要稍微过量。
)④2Fe2O 3+3C ;⑤Fe 2O 3+3CO;(加热时一定要持续高温)⑥Fe 2O 3+3H 2 ;现象: 总结:金属与金属氧化物之间的转换 ①活泼金属在空气中易与氧气反应,表面生成一层氧化物。
有的氧化膜疏松,不能保护内层金属,如: ;有的氧化膜致密,可以保护内层金属不被继续氧化,如: 表面的氧化层。
在点燃镁条或铝片前,常用砂纸 镁条或铝片。
②除Ag 、Pt 、Au 外的金属, 一般都可与氧气发生化合反应, 金属越活泼与氧化合就越容易, 反应就越剧烈。
生成氧化物的特点是绝大部分反应的结果多为 热量, 的热量愈大,则生成的氧化物愈稳定。
金属氧化物大多数是 性氧化物。
③金属氧化物热还原反应指的是金属氧化物(如Fe 2O 3、CuO 等)在加热或者更高的温度条件下,用一些还原剂(如: )将氧化物中的金属元素以单质形式还原出来的反应。
越活泼的金属,其金属氧化物被还原时所需温度越高。
K →Al 的冶炼只能在矿石熔化状态(不是水溶液)下电解,用H 2、CO 还原。
④用气体做还原剂时,气体“ ”,酒精灯“ ”。
实验开始时,应先通入一段时间CO (或H 2),目的是 ,实验结束后,应先拿走酒精灯,后撤走CO ( 或H 2)导管,目的是 .⑤CO 有剧毒,实验时一定要进行 。
3.金属氧化物+水==碱①生石灰溶于水:CaO+H 2O== 现象: 。
相关知识点: (1)最终所获得的溶液名称为氢氧化钙溶液,俗称 ;(2)在其中滴入无色酚酞,酚酞会变成 色; (3)生石灰可做 干燥剂.②氧化钠溶于水:Na 2O+H 2O== ③氧化钾溶于水:K 2O+H 2O==补充:④K 、Ca 、Na 可以直接与水反应。
如:Ca+2H 2O==Ca(OH)2+H 2↑ 4.碱==金属氧化物+水①Mg→Fe 对应的氢氧化物加热可分解。
如:2Fe(OH)3== 。
②Sn→Cu 对应的氢氧化物微热即分解。
如:2== 。
现象: 。
③Hg→Ag 对应的氢氧化物常温即易分解。
如:2AgOH==Ag 2O+H 2O 。
(常温下不存在) ④特例:NH 4OH== 。
现象: 。
总结:金属氧化物与碱之间的转换① 金属氧化物与水反应生成的碱一定要 溶于水,生成的碱都是 碱。
反应时都 大量的热。
② 弱碱(一般不溶于水的碱)加热可分解,活泼性越强的金属所生成的碱,加热分解需温度越 。
③ 可溶性碱加热一般不分解。
K→Na 对应的氢氧化物 分解。
5.非金属+氧==非金属氧化物①氢气在空气中燃烧:2H2+O2现象:相关知识点: (1)氢气是一种常见的还原剂; (2)点燃前,一定要检验它的纯度否则会爆炸。
②红磷在空气中燃烧:4P+5O2现象:相关知识点: (1)烟是固体小颗粒;雾是液体小颗粒. (2)测量氧气在空气中的体积分数。
(3)可做烟雾弹。
③硫粉在空气中燃烧: S+O2现象:在空气中是发出微弱的火焰,在氧气中是发出明亮的火焰. 有强烈气味。
相关知识点:(1)反应后的产物可用紫色的石蕊试液来检验(紫色变成红色);(2)SO2污染空气,要用溶液进行尾气处理。
(3)SO2是气体,所以测量氧气在空气中的体积分数,若将水改为溶液,也可以测量氧气在空气中的体积分数。
④碳在氧气中充分燃烧:C+O2现象:在空气中是发出,在氧气中是发出。
相关知识点:反应后的产物可用来进行检验.⑤碳在氧气中不充分燃烧:2C+O26.非金属氧化物 + 活泼金属 == 非金属+金属氧化物①金属钠与水反应:2Na+2H2O== ,现象:浮(钠块浮在水面上)、游(钠块在水面上无规则游动)、熔(钠块熔化为小球)、响(发出嘶嘶的响声)、红(使滴入酚酞试液的溶液变红)②金属镁与CO2反应:2Mg+CO22MgO+C现象:发出白光,有白色粉末(MgO)生成,有黑色固体(C)生成,同时放出大量的热。
相关知识点: 非常活泼的金属能在二氧化碳中“燃烧”。
③金属铝与水的反应:2Al+6H2O==2Al(OH)3↓+3H2↑总结:非金属与非金属氧化物之间的转换①在非金属元素与氧形成的化合物里,氧显价,另一种非金属元素显价。
②经点燃,许多非金属都能在空气里燃烧;如是气体燃烧,在燃烧前一定要先。
③活泼金属可以将非金属氧化物中的非金属(不是氧)置换出来。
溶液中或气体之间发生的置换反应在常温下进行,气体与固体或两种固体之间发生的置换反应一般需在高温下进行。
④活泼金属火灾,不能使用和灭火。
⑤K、Ca、Na、Mg不能置换出盐溶液中的不活泼金属的离子。
就是因为活泼金属先与先反应。
H2SO3 == SO2↑+ H2OH2SO4 SO3↑+H2O4HNO== == 4NO↑+O↑+2H O (硝酸要用色瓶密封保存)9.金属+非金属==无氧盐①氯气与金属钠反应,现象:,反应: 2Na+Cl2②铁粉与硫粉混合加热。
现象:反应: Fe+S③铁丝在氯气中燃烧。
现象:产生棕黄色烟,反应:2Fe+3Cl22FeCl3总结:此处的非金属H2、O2除外。
当金属越活泼, 非金属也越活泼时, 反应就越容易进行。
光或金属氧化物①CaCO3高温+ (二氧化碳工业制法)②2CuSO4高温2CuO + 2SO2↑+ O2↑③Cu2(OH)2CO3高温现象:④2Cu(NO3)22CuO + 4NO2↑ + O2↑总结:金属氧化物+非金属氧化物与含氧盐之间的转换①SO3与活泼金属的氧化物在常温下即可反应, 其余的需在加热或高温条件下才能发生反应。
Na2O、K2O比CaO反应速度要快一些(其它常见金属氧化物一般不反应)。
②、的碳酸盐稳定、易溶于水。
Ca、Mg、Cu等的碳酸盐微溶或难溶、受热易。
③Na2SO4, K2SO4等不易分解.其它硫酸盐的分解温度各不相同,Fe2(SO4)3在700℃左右就可以分解为:SO3和Fe2O3;CaSO4在1400℃左右分解:SO3和CaO;BaSO4在1580℃左右分解:SO3和BaO。
④硝酸盐加热易分解.K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气; Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2; Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
补充:其它盐的分解反应①2NaHCO3(侯氏制碱法中的一步)②Ca(HCO3)2CaCO3+CO2↑+H2O (水垢、钟笋石产生的原因)③2KMnO4(实验室制氧气方法之一)相关知识点: (1)紫色变为黑色;(2)生成使带火星木条的气体④2KClO3(实验室制氧气方法之一)相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的和在化学反应前后没有改变;(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:,,.⑤CuSO4·5H2O 现象:12.非金属氧化物+碱=盐+水①Ca(OH)2+CO2=现象:相关知识点: (1)这个反应可用来检验气体的存在.(2)石灰浆糊上墙后变硬的原因。
(3)继续通过量CO2的则溶液又由浑浊变澄清:CaCO3+CO2+H2O==Ca(HCO3)2②2NaOH+CO2=现象没有,可加酸或Ca(OH)2来验证是否反应。
相关知识点:(1)NaOH可用来吸收等气体.(2)NaOH晶体易吸收空气中的和而变质。
补充:检测CO2用,而吸收用。
原因:Ca(OH)2有沉淀;NaOH极易溶于水,吸收的也多。
检测H2O用,而吸收用H2SO4(浓)。
原因:有颜色变化。
H2SO4(浓)吸水多而快。
同时有CO2和H2O要检测时,先后。
同时要吸收CO2和H2O,先后。
③Ca(OH)2+SO2==(有白色沉淀生成)④NaOH+SO2=(工业去废气的方法)⑤2NaOH+SO3=⑥2NaOH+SiO2==Na2SiO3+ H2O (强碱不能用长期盛放)。
总结:①可溶于水的非金属氧化物先与反应,生成对应的,然后再与碱反应。
准确的说,是一个化合反应和酸碱复分解反应的整合。
②碱一定要是溶性碱③碱石灰的主要成分和(或氢氧化钙),是因为氢氧化钠高温下可以与实验室最常用的玻璃仪器(含有大量二氧化硅)发生反应腐蚀仪器,氧化钙的作用是“冲淡”氢氧化钠的浓度。
碱石灰可以吸收和。