物质转化的规律
- 格式:doc
- 大小:66.50 KB
- 文档页数:4
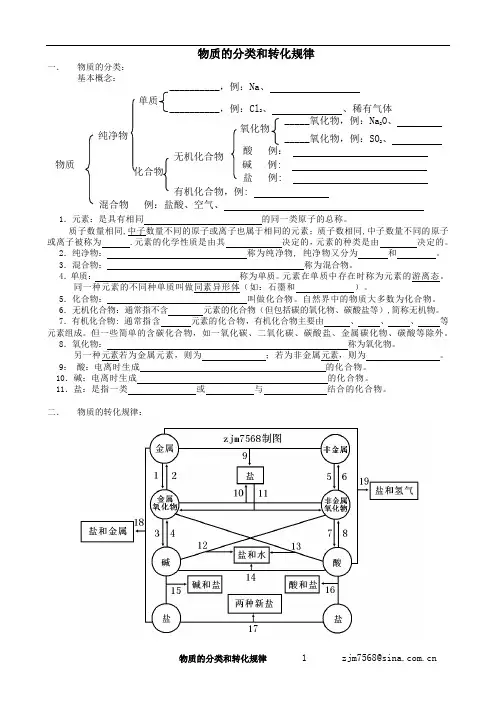
物质的分类和转化规律 一. 物质的分类: 基本概念: 1.元素:是具有相同 的同一类原子的总称。
质子数量相同,中子数量不同的原子或离子也属于相同的元素;质子数相同,中子数量不同的原子或离子被称为 .元素的化学性质是由其 决定的,元素的种类是由 决定的。
2.纯净物: 称为纯净物, 纯净物又分为 和 。
3.混合物: 称为混合物。
4.单质: 称为单质。
元素在单质中存在时称为元素的游离态。
同一种元素的不同种单质叫做同素异形体(如:石墨和 )。
5.化合物: 叫做化合物。
自然界中的物质大多数为化合物。
6.无机化合物:通常指不含 元素的化合物(但包括碳的氧化物、碳酸盐等),简称无机物。
7.有机化合物: 通常指含 元素的化合物,有机化合物主要由 、 、 、 等元素组成。
但一些简单的含碳化合物,如一氧化碳、二氧化碳、碳酸盐、金属碳化物、碳酸等除外。
8.氧化物: 称为氧化物。
另一种元素若为金属元素,则为 ;若为非金属元素,则为 。
9: 酸:电离时生成 的化合物。
10.碱:电离时生成 的化合物。
11.盐:是指一类 或 与 结合的化合物。
二. 物质的转化规律:物质 纯净物 单质 化合物 __________,例:Cl 2、 、稀有气体 _____氧化物,例:SO 2、 _____氧化物,例:Na 2O 、 氧化物 酸 例: 碱 例: 盐 例:无机化合物 有机化合物,例:__________,例:Na 、 混合物 例:盐酸、空气、1.金属+氧==金属氧化物①钠放置在空气中。
现象:银白色逐渐退去。
反应:4Na+O2 ==②镁条燃烧。
现象:,反应:2Mg+O2③加热金属铝片。
现象:铝箔熔化,失去光泽,熔化的铝并不滴落,产生这一现象的原因是:铝表面生成了氧化铝薄膜,构成薄膜的氧化铝的熔点高于金属铝的熔点,包在铝的外面,所以熔化的液态铝不会落下来。
反应:4Al+3O2④铝在空气中生锈:4Al+3O2 == Al2O3是一层极薄的物,可阻碍反应的进行。

化学物质的三态相变规律相变是指物质由一种态转化为另一种态的过程。
在化学中,物质的三态相变包括固态、液态和气态之间的转化。
这些相变过程在我们的日常生活中处处可见,如冰块融化成水、水沸腾成为蒸汽等。
本文将探讨化学物质的三态相变规律,以帮助我们更好地理解这一过程。
一. 固态相变固态是物质最常见的状态之一。
固态物质具有密度高、形状不易改变等特点。
在一定的条件下,固态物质可以发生相变。
固态相变主要包括熔化和升华两个过程。
1. 熔化熔化是指固态物质受热升温,达到一定温度后转变为液态的过程。
这个温度被称为熔点。
熔点是每种物质固定的特性之一。
例如,水的熔点是0摄氏度。
当冰块受热达到0摄氏度时,它开始融化成为液态水。
这是因为热量能够克服分子间的吸引力,使得固态的水分子逐渐变得自由移动起来。
2. 升华升华是固态物质直接转变为气态的过程,而无需经过液态的中间过程。
当固态物质受热达到相应的温度时,分子的活动增加,使得固态分子足够具有足够的动能而直接溢出固体表面成为气态。
例如,干冰的温度低于-78.5摄氏度,当它受热时,直接从固态转变为二氧化碳气体。
二. 液态相变液态是物质的另一种常见状态。
液态物质具有流动性和密度较大等特点。
液态相变主要包括沸腾和冷冻两个过程。
1. 沸腾沸腾是液体受热到达一定温度时,在液体内部产生大量的气泡并从液体表面迅速蒸发的现象。
当液体受热到达其饱和温度时,液体内部的分子获得足够的动能,能够克服液面的表面张力而迅速蒸发成气体。
沸腾的温度称为沸点。
例如,水的沸点是100摄氏度。
当水受热到达100摄氏度时,开始出现气泡并且大量蒸发成水蒸气。
2. 冷冻冷冻是液体由于受冷而发生相变成为固体的过程。
当液体的温度下降到其凝固点以下时,分子间的吸引力逐渐增大,液体分子逐渐减少自由移动起来,形成了有序的固定结构。
例如,水的凝固点是0摄氏度。
当水被冷却到0摄氏度以下时,它逐渐冷冻成为冰。
三. 气态相变气态是物质的第三种状态,气体具有无定形、可被压缩性和弥散性等特点。

生物的物质转化与能量转化规律生物体内的各种生物化学反应以及物质转化与能量转化是维持生物生命的基础。
在生物体内,物质与能量相互转化的过程影响着各种生命活动,如新陈代谢、生长、发育、繁殖等。
生物的物质转化与能量转化规律对我们理解生命的本质以及应用于医药、农业和环境保护等领域都具有重要意义。
一、物质转化物质转化是生物体内的一种重要过程。
由于生物体种类的复杂性,物质转化的方式也各有不同。
下面我们将从典型的物质转化过程来探讨一下物质转化的规律。
1. 糖类的转化糖类是生物体内最常见的能量来源,它们可以被分解产生能量。
在有氧条件下,糖类通过三个主要的代谢途径进行转化,即糖酵解、细胞呼吸和肝糖原生成。
糖酵解是一种无需氧气参与的糖类分解方式,通过一系列的反应将葡萄糖分解为乳酸或乙醛酸,生成能量。
细胞呼吸是糖类在有氧条件下的主要代谢途径,通过一系列的反应将葡萄糖分解为二氧化碳和水,同时产生大量的能量。
肝糖原生成是指当机体的能量需求旺盛时,糖类通过某些酶的催化作用生成肝糖原,以满足机体对能量的需要。
糖类的转化规律表明了生物体内糖类利用的复杂性,为我们理解生命物质转化提供了重要的参考。
2. 脂类的转化脂类是生物体内的能量储存体,它主要以三酸甘油脂的形式存在。
脂类的转化过程主要涉及到脂肪分解和β-氧化反应。
脂肪分解是脂肪酸从脂肪中解离出来的过程,产生脂肪酸和甘油。
在细胞内,脂肪酸再经过酯化过程,生成三酸甘油脂。
β-氧化反应是脂肪酸在线粒体中的一种重要代谢过程,通过一系列的反应将脂肪酸分解为乙酰辅酶A,产生大量能量。
脂类的转化规律揭示了生物体内脂类的分解与合成过程,这对于我们研究肥胖、心血管疾病和糖尿病等疾病具有重要意义。
3. 蛋白质的转化蛋白质是生物体内的重要组成部分,它们参与到各种细胞机能的实现中。
蛋白质的转化主要包括合成、降解和转化。
蛋白质的合成是指生物体内蛋白质通过肽链的形式进行合成的过程,合成过程因复杂性而多步骤进行。

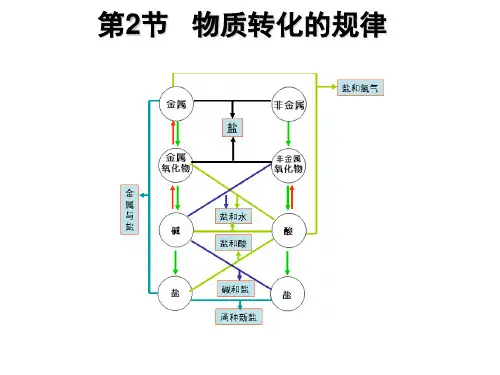

物质间的相互转化规律温馨提醒复分解反应发生的条件:①有沉淀↓(溶解性表)、气体↑或H2O生成;②盐+盐、盐+碱的反应要求反应物都能溶。
3、复分解反应是化合物之间的反应,反应前后化合价没有变化。
关于酸一、金属+酸=盐+氢气1、(实验室制氢气)2、3、二、金属氧化物+酸=盐+水1、2、三、非金属氧化物+碱=盐+水1、2、氢氧化钠在空气中变质3、4、四、酸+碱=盐+水(中和反应)1、2、3、4、五、酸+盐=新酸+新盐1、盐酸和硝酸银(检验Cl—)2、硫酸和硝酸钡(检验SO42—)3、盐酸和碳酸钙(制取CO2)4、盐酸和碳酸钠(检验CO32—)5、6、六、碱+盐=新碱+新盐(要求反应物都能溶于水)1、2、3(制取氢氧化钠)2、氯化铵和氢氧化钠(检验NH4+)七、盐+盐=新盐+新盐(要求反应物都能溶于水)1、2、3、4、八、金属+盐(溶液)=新金属+新盐(根据金属活动性顺序判断)1、2、、金属+氧气=金属氧化物1、2、3、九、金属氧化物+水=碱(只有下列四种可溶性碱)1、2、3、4、十、非金属+氧气=非金属氧化物1、2、3、4、氢气在空气中燃烧十一、非金属氧化物+水=酸1、二氧化碳和水2、二氧化硫和水3、三氧化硫和水十二、金属+非金属=无氧酸盐1、铁和硫2、铁和氯气3、铜和氯气4、钠和氯气十三、金属氧化物+非金属氧化物=含氧酸盐(很少用,别乱写。
)1、氧化钙和二氧化硅十四、金属氧化物+还原剂(H2、C、CO)===金属+非金属氧化物(H2O或CO2)1、氢气还原氧化铜2、氢气还原氧化铁3、炭还原氧化铜4、炭还原氧化铁5、一氧化碳还原氧化铜6、一氧化碳还原氧化铁十五、其它1、碳酸分解2、电解水3、高锰酸钾制氧气4、实验室制取氧气5、甲烷燃烧6、一氧化碳燃烧7、炭还原二氧化碳8、煅烧石灰石9、加热氢氧化铜(不溶性碱)10、加热氢氧化铁(不溶性碱)。
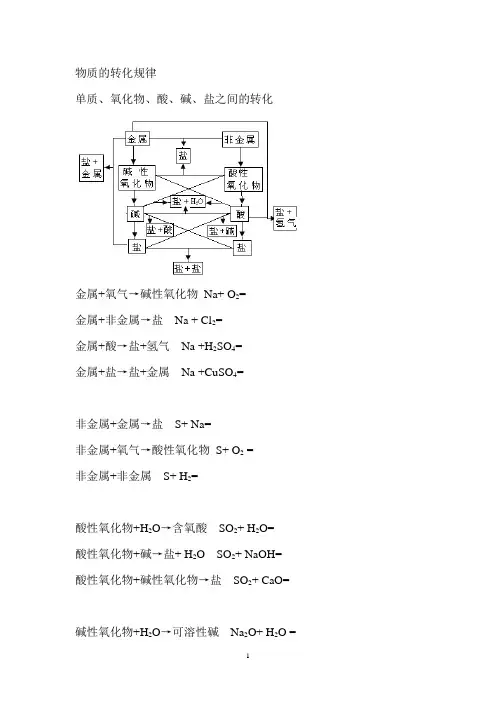
物质的转化规律
单质、氧化物、酸、碱、盐之间的转化
金属+氧气→碱性氧化物Na+ O2=
金属+非金属→盐Na + Cl2=
金属+酸→盐+氢气Na +H2SO4=
金属+盐→盐+金属Na +CuSO4=
非金属+金属→盐S+ Na=
非金属+氧气→酸性氧化物S+ O2 =
非金属+非金属S+ H2=
酸性氧化物+H2O→含氧酸SO2+ H2O=
酸性氧化物+碱→盐+ H2O SO2+ NaOH= 酸性氧化物+碱性氧化物→盐SO2+ CaO=
碱性氧化物+H2O→可溶性碱Na2O+ H2O =
碱性氧化物+酸→盐+ H2O Na2O +HCl=
碱性氧化物+酸性氧化物→盐Na2O+CO2=
酸+金属→盐+氢气H2SO4+Fe=
酸+碱性氧化物→盐+ H2O H2SO4+ CuO=
酸+碱→盐+ H2O H2SO4+ Ba(OH)2=
酸+盐→盐+ 酸(强酸→弱酸、难挥发→易挥发)
H2SO4+Ba(NO3)2=
H2SO4+Na2CO3=
碱+酸性氧化物→盐+ H2O NaOH+CO2=
碱+酸→盐+ H2O NaOH+ H2SO4=
碱+盐→盐+ 碱(反应物均可溶、生成物之一为难溶或难电离)NaOH+ CuSO4=
NaOH+ NH4Cl=
盐+金属→盐+金属 CuSO4+ Zn=
盐+酸→盐+ 酸 BaCl2+ H2SO4
盐+碱→盐+ 碱 CuSO4+ Ba(OH)2=
盐+盐→盐+ 盐(反应物均可溶、生成物之一为难溶)NaCl+AgNO3= BaCl2+Na2SO4=。

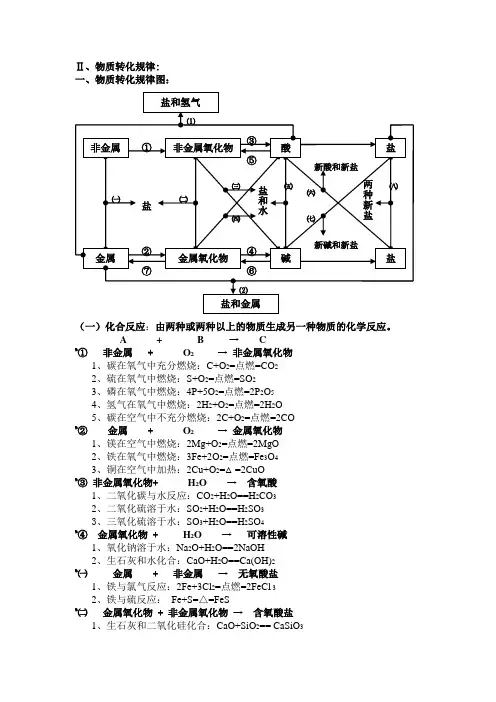
Ⅱ、物质转化规律:一、物质转化规律图:(一)化合反应:由两种或两种以上的物质生成另一种物质的化学反应。
A +B → C%①非金属 + O2 →非金属氧化物1、碳在氧气中充分燃烧:C+O2=点燃=CO22、硫在氧气中燃烧:S+O2=点燃=SO23、磷在氧气中燃烧:4P+5O2=点燃=2P2O54、氢气在氧气中燃烧:2H2+O2=点燃=2H2O5、碳在空气中不充分燃烧:2C+O2=点燃=2CO%②金属 + O2 →金属氧化物1、镁在空气中燃烧:2Mg+O2=点燃=2MgO2、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O43、铜在空气中加热:2Cu+O2=△=2CuO%③非金属氧化物+H2O →含氧酸1、二氧化碳与水反应:CO2+H2O==H2CO32、二氧化硫溶于水:SO2+H2O==H2SO33、三氧化硫溶于水:SO3+H2O==H2SO4%④金属氧化物+ H2O →可溶性碱1、氧化钠溶于水:Na2O+H2O==2NaOH2、生石灰和水化合:CaO+H2O==Ca(OH)2%㈠金属 + 非金属→无氧酸盐1、铁与氯气反应:2Fe+3Cl2=点燃=2FeCl 32、铁与硫反应:Fe+S=△=FeS%㈡金属氧化物+ 非金属氧化物→含氧酸盐1、生石灰和二氧化硅化合:CaO+SiO2== CaSiO3其它化合反应:1、一氧化碳在空气中燃烧:2CO+O2=点燃=2CO22、二氧化碳通过灼热的碳层:CO2+C=高温=2CO3、氢气在氯气中燃烧:H2+Cl2=点燃=2HCl(二)分解反应:由一种物质生成两种或两种以上其它物质的化学反应。
C → A + B%⑤酸分解酸→酸性氧化物+ H2O1、碳酸不稳定分解:H2CO3==H2O+CO2↑%⑥碱分解不溶性碱→碱性氧化物+ H2O1、氢氧化铜受热分解:Cu(OH)2=△=CuO+H2O氧化物分解:1、电解水:2H2O=通电=2H2↑+O2↑盐分解:1、加热高锰酸钾:2KMnO4=△=K2MnO4+MnO2+O2↑2、氯酸钾受热分解(实验室制O2):2KClO3=(MnO2△)=2KCl+3O2↑3、加热碱式碳酸铜:Cu2(OH)2CO3=△=2CuO+H2O+CO2↑4、高温煅烧石灰石:CaCO3=高温=CaO+CO2↑5、硫酸铜晶体受热失去结晶水:CuSO4·5H2O=△=CuSO4+5H2O(三)置换反应:由一种单质跟一种化合物发生反应生成另一种单质和另一种化合物的反应。
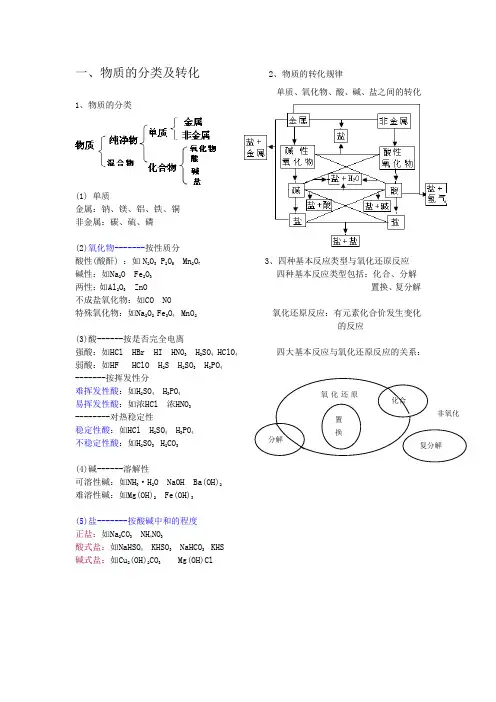
一、物质的分类及转化 2、物质的转化规律单质、氧化物、酸、碱、盐之间的转化1、物质的分类(1) 单质金属:钠、镁、铝、铁、铜 非金属:碳、硫、磷(2)氧化物-------按性质分酸性(酸酐) :如N 2O 3 P 2O 5 Mn 2O 7 3、四种基本反应类型与氧化还原反应 碱性:如Na 2O Fe 2O 3 四种基本反应类型包括:化合、分解 两性:如Al 2O 3 ZnO 置换、复分解 不成盐氧化物:如CO NO特殊氧化物:如Na 2O 2 Fe 3O 4 MnO 2 氧化还原反应:有元素化合价发生变化的反应(3)酸------按是否完全电离强酸:如HCl HBr HI HNO 3 H 2SO 4 HClO 4 四大基本反应与氧化还原反应的关系: 弱酸:如HF HClO H 2S H 2SO 3 H 3PO 4-------按挥发性分难挥发性酸:如H 2SO 4 H 3PO 4 易挥发性酸:如浓HCl 浓HNO 3--------对热稳定性 稳定性酸:如HCl H 2SO 4 H 3PO 4 不稳定性酸:如H 2SO 3 H 2CO 3(4)碱------溶解性可溶性碱:如NH 3·H 2O NaOH Ba(OH)2 难溶性碱:如Mg(OH)2 Fe(OH)3(5)盐-------按酸碱中和的程度 正盐:如Na 2CO 3 NH 4NO 3酸式盐:如NaHSO 4 KHSO 3 NaHCO 3 KHS 碱式盐:如Cu 2(OH)2CO 3 Mg(OH)Cl练习:1.下列含有相同元素的化合物组是A.O 2 O 3B.CO CO 2C.KCl AlCl 3D.NaHCO 3、NaHSO 4 2.下列属于纯净物的是A.盐酸B.空气C.Fe 3O 4D.大理石3.由以下给定化合价的五种元素H +1、S +6、O -2、K +1、Na +1,最多可以组成( )种化合物 A .9 B .10 C .11 D .12 4.下列物质属于酸性氧化物的是A.Na 2OB.COC.CaOD.SO 2 5.下列说法正确的是A.酸性氧化物都是非金属氧化物B.非金属氧化物都是酸性氧化物C.金属氧化物都是碱性氧化物D.碱性氧化物都是金属氧化物6.将下列各组物质按酸、碱、盐分类顺序排列,正确的是 A.硫酸,纯碱,石灰石 B.醋酸,烧碱,硫酸铜 C.磷酸,熟石灰,苛性钾 D.醋酸,小苏打,熟石灰 7、下列物质的分类正确的是( )8、若将以下化合物按硫元素的化合价分为三组,请把化学式填在相应短线上。

物质状态之间的转化
物质状态之间的转化主要包括凝固、熔化、升华、凝华、汽化和液化。
1. 凝固:指物质从液态转化为固态的过程。
当物质的温度降低到其凝固点以下时,分子间的相互作用力增强,使得分子排列有序,形成固体。
2. 熔化:指物质从固态转化为液态的过程。
当物质的温度升高到其熔点以上时,分子间的相互作用力减弱,使得分子排列变得无序,形成液体。
3. 升华:指物质从固态直接转化为气态的过程,无液态存在。
当物质的温度升高到其升华点以上时,分子间的相互作用力减弱,使得分子从固态直接脱离形成气体。
4. 凝华:指物质从气态直接转化为固态的过程,无液态存在。
当物质的温度降低到其凝华点以下时,分子间的相互作用力增强,使得分子从气态直接固定在一起形成固体。
5. 汽化:指物质从液态转化为气态的过程。
当物质的温度升高到其沸点以上时,分子间的相互作用力减弱,使得分子从液态脱离形成气体。
6. 液化:指物质从气态转化为液态的过程。
当物质的温度降低到其沸点以下时,分子间的相互作用力增强,使得分子从气态聚集在一起形成液体。
需要注意的是,物质状态之间的转化是与温度和压力紧密相关的。
不同物质的转化过程可能存在一定的差异,但总体上遵循上述的基本规律。
物质的分类和转化规律一.物质的转化规律:1.金属+氧==金属氧化物2.金属氧化物+还原剂=金属+非金属氧化物①CuO+H2== 现象:,H2还原优点是反应生成物之一是,且产物较纯净。
②CuO+CO== (CO有剧毒,实验时一定)③2CuO+C;现象:(虽然C的还原能力强于H2,但固体还原剂与氧化物的充分接触程度没有固体与气体还原剂充分,自然反应温度就比H2要高,最好使用酒精喷灯或加罩的酒精灯。
C要稍微过量。
)④2Fe2O3+3C;⑤Fe2O3+3CO;(加热时一定要持续高温)⑥Fe2O3+3H2 ;现象:3.金属氧化物+水==碱4.碱==金属氧化物+水5.非金属+氧==非金属氧化物①氢气在空气中燃烧:2H2+O2现象:相关知识点: (1)氢气是一种常见的还原剂; (2)点燃前,一定要检验它的纯度否则会爆炸。
②红磷在空气中燃烧:4P+5O2现象:相关知识点: (1)烟是固体小颗粒;雾是液体小颗粒. (2)测量氧气在空气中的体积分数。
(3)可做烟雾弹。
③硫粉在空气中燃烧: S+O2现象:在空气中是发出微弱的火焰,在氧气中是发出明亮的火焰. 有强烈气味。
相关知识点:(1)反应后的产物可用紫色的石蕊试液来检验(紫色变成红色);(2)SO2污染空气,要用溶液进行尾气处理。
(3)SO2是气体,所以测量氧气在空气中的体积分数,若将水改为溶液,也可以测量氧气在空气中的体积分数。
④碳在氧气中充分燃烧:C+O2现象:在空气中是发出 ,在氧气中是发出。
相关知识点:反应后的产物可用来进行检验.⑤碳在氧气中不充分燃烧:2C+O26.非金属氧化物 + 活泼金属 == 非金属+金属氧化物①金属钠与水反应:2Na+2H2O== ,现象:浮(钠块浮在水面上)、游(钠块在水面上无规则游动)、熔(钠块熔化为小球)、响(发出嘶嘶的响声)、红(使滴入酚酞试液的溶液变红)②金属镁与CO2反应:2Mg+CO22MgO+C 现象:发出白光,有白色粉末(MgO)生成,有黑色固体(C)生成,同时放出大量的热。
第2节物质转化的规律[知识梳理]1.各类物质之间存在相互关系并在一定的条件下可相互转化,其中非金属单质与氧气反应可生成非金属氧化物,某些非金属氧化物与水反应可生成酸,金属单质与氧气反应可生成金属氧化物,某些金属氧化物与水反应可生成碱。
2.金属的冶炼就是利用碳作还原剂夺取金属氧化物中的氧,使之由化合态变为游离态。
常见的还原剂还有一氧化碳和氢气。
[解题指引]例1将CO2通入CaCl2溶液中未见沉淀出现,则再在溶液加入下列哪种物质后就会出现沉淀A.盐酸B.氯化钠溶液C.氢氧化钠溶液D.稀硝酸()指引:往CaCl2溶液中通入CO2不会沉淀生成是因为H2CO3是弱酸,溶液中CO32-离子浓度很小不足于和Ca2+结合生成CaCO3沉淀。
往溶液中加强酸更不会出现沉淀。
往溶液中加碱能出现沉淀,这是因为加碱后与H2CO3中和生成可溶性的碳酸盐,溶液中CO32-离子浓度增大,从而与Ca2+结合生成CaCO3沉淀。
答案:C例2 某学生对过量炭粉与氧化铁反应产物中气体的成分进行研究。
(1)假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:使一定量的氧化铁在隔绝氧气的条件下与过量的炭粉完全反应测得参加反应的碳元素和氧元素的质量比。
(3)查阅资料:氮气不与炭粉、氧化铁反应,可用来隔绝氧气。
((6)结论:根据对数据的处理结果得知,原假设_________(填“成立”或“不成立”),理由是____________________________________________________________。
指引:反应前玻璃管和物质的总重量为3.2克+2克+48.48克=53.68克,反应后质量减少了53.68克-52.24克=1.44克,因为减少的质量小于原碳的质量2克,说明碳有剩余,而氧化铁完全反应。
生成的碳的氧化物中氧元素的质量等于氧化铁中氧元素的质量:3.2克×30%=0.96克,所以参加反应的碳元素质量是1.44克-0.96克=0.48克,根据质量守恒定律得生成的碳的氧化物中碳元素与氧元素的质量比为:0.48:0.96克=1:2,而二氧化碳中两元素的质量比为12: (16×2)=3:8≠1:2,所以产物不只有二氧化碳。
初中化学物质转化总结化学是一门研究物质的性质、组成、结构以及变化规律的学科。
物质转化作为化学的基本概念之一,是指物质从一种形态或状态经过化学反应转变为另一种形态或状态的过程。
通过物质转化,我们可以了解物质的性质和变化规律,也可以应用于生产和科学研究中。
下面我将对初中化学中常见的物质转化进行总结。
1. 光照下的物质转化:光照下的物质转化是指物质在光照条件下发生的变化。
光照能够引起化学反应的发生,例如光合作用。
光合作用是指光能被植物利用,将二氧化碳和水转化成氧气和葡萄糖的过程。
另外,光还可以引发光解反应,例如光解水和光解银氯化物等。
2. 燃烧的物质转化:燃烧是指物质与氧气反应产生光热能的过程。
常见的燃烧反应包括燃烧木材、煤炭和天然气等。
燃烧过程中,物质被氧气氧化生成二氧化碳和水,并释放出大量的热能。
燃烧反应是人类生活和工业生产中常见的物质转化过程。
3. 化学反应的物质转化:化学反应是指物质之间发生的化学变化过程。
常见的化学反应包括酸碱中和反应、金属与非金属元素的反应、氧化还原反应等。
例如,酸和碱反应会生成盐和水,金属与非金属元素的反应会生成化合物,氧化还原反应是指物质的氧化态和还原态发生变化的反应。
化学反应可以控制物质的转化过程,使其适应不同的需求。
4. 晶体结构的物质转化:晶体是由原子、离子或分子按一定的规则排列而成的固体。
晶体结构的转化是指晶体内部原子、离子或分子的位置发生变化的过程。
例如,溶解晶体时,溶剂分子与晶体内部分子发生相互作用,导致晶体结构的破坏。
晶体结构转化的研究有助于我们了解晶体物质的性质和特点。
5. 维生素的物质转化:维生素是人体所需的一类有机化合物,可以促进人体的生长和发育。
在维生素的物质转化过程中,维生素可以与其他物质发生化学反应,从而发生结构变化。
例如,维生素C可以与氧气发生氧化反应,使其失去活性。
维生素的物质转化对于人体健康和营养具有重要意义。
通过对初中化学中物质转化的总结,我们可以看到物质转化作为化学的基本概念,贯穿于化学的各个领域。
初中常见的物质转化关系一、固体与固体的转化固体与固体的转化是指两种固体物质之间发生化学反应或物理变化,导致物质的性质发生改变。
常见的固体与固体的转化包括金属与非金属的反应、金属与金属的反应等。
1. 金属与非金属的转化:金属与非金属之间常发生氧化反应。
例如,铁与氧气反应生成铁(III)氧化物,即铁生锈的过程。
这个过程中,铁中的铁离子与氧气结合生成氧化物。
2. 金属与金属的转化:金属与金属之间也可以发生转化。
其中一个常见的例子是铜与锌的反应,生成黄铜。
黄铜是铜与锌的合金,具有较高的强度和耐腐蚀性。
二、液体与液体的转化液体与液体的转化是指两种液体物质之间的相互作用,导致物质的性质发生改变。
常见的液体与液体的转化包括溶解、混合等。
1. 溶解:溶解是指一个物质在另一个物质中均匀分散,形成溶液的过程。
例如,将食盐加入水中,食盐溶解在水中,形成食盐水溶液。
2. 混合:混合是指将两种或多种液体物质混合在一起,使其均匀分散的过程。
例如,将醋和油混合在一起,形成醋油混合物。
三、固体与液体的转化固体与液体的转化是指固体物质与液体物质之间的相互作用,导致物质的性质发生改变。
常见的固体与液体的转化包括溶解、熔化等。
1. 溶解:与液体与液体的溶解类似,固体物质也可以在液体中溶解。
例如,将糖加入水中,糖分子与水分子相互作用,形成糖水溶液。
2. 熔化:熔化是指固体物质受热而转化为液体的过程。
例如,将冰受热后会熔化成水,这是因为热能使冰的分子振动增强,从而打破了分子之间的固定排列。
四、液体与气体的转化液体与气体的转化是指液体物质转化为气体物质的过程,也称为蒸发。
蒸发是液体分子在表面受到热能作用,从而获得足够的能量逃脱液体表面,进入气相的过程。
1. 蒸发:蒸发是液体与气体的转化过程,液体分子在表面受到热能作用,从而获得足够的能量逃脱液体表面,进入气相的过程。
例如,水在受热后会蒸发成水蒸气。
五、固体与气体的转化固体与气体的转化是指固体物质转化为气体物质的过程,也称为升华。
生物化学中的物质转化规律生物化学是研究生命体系中物质转化的科学,是化学、物理、生物等学科的交叉领域。
生物化学中的物质转化规律是生物体内分子转化的基础,生物体内的物质转化是生命活动的基本过程之一。
在这篇文章中,我们将会通过探讨物质转化规律在生物化学中的应用,来进一步理解生命体系中物质转化的原理和过程。
一、蛋白质的合成蛋白质是生命体系中最基本的分子之一,它们是由氨基酸组成的长链。
生物体内产生蛋白质的过程称作蛋白质合成,蛋白质合成是生物化学中的一个重要领域,对研究生物体内的物质转化机制和生命活动规律具有重要意义。
蛋白质的合成需要有一系列相互配合的物质转化过程。
其中最重要的便是生物体内的基因表达。
基因表达是生物体内物质转化的一个关键环节,在基因表达过程中,基因中蕴含的遗传信息被转化为功能性蛋白质。
这一过程包括了转录、剪接、转运和翻译等一系列的生物化学反应。
转录过程将DNA螺旋的基对序列转录成mRNA链,这些RNA链在细胞质中被翻译成蛋白质。
生物体内的物质转化规律在这一基因表达过程中发挥了非常重要的作用。
二、碳水化合物分解碳水化合物是生命体系中非常重要的营养素,我们的身体中大部分的能量都来自于碳水化合物的分解。
在生物体内,碳水化合物的分解又称为糖解。
糖解是生命体系中最为重要的生化反应之一,也是人体运动时产生能量的主要途径。
糖解的反应过程是复杂的,包含了许多不同的反应步骤。
整个糖解的过程通常被分为两个阶段:糖原裂解和糖原呼吸。
糖原裂解是将体内存储的多聚糖分解为单糖,单糖进入另一个阶段的糖原呼吸。
在糖原呼吸中,单糖被氧化分解,产生能量并转化为能够被身体利用的物质(如乳酸或乙酸)。
三、氧化还原反应生物体内的氧化还原反应是生物化学中的另一个重要领域。
人体内的氧化还原反应是将食物中所含的化学能转化为身体所需的能量的基本方式。
氧化还原反应是生物体内分子转化的一个关键环节,它涉及了大量的化学反应。
在每一个化学反应过程中,某些分子失去了电子(氧化),而另一些分子却得到了电子(还原)。
物质转化的规律(四)
莲花初中黄紫仙
学习目标:
1.知识与技能:知道物质转化的普遍性,认识常见物质间的转化规律;能利用《物质转化规律》查找各类物质的化学性质,寻找各类物质的制取途径。
2.过程与方法:练习寻找物质转化的规律,并运用归纳法加以综合。
3.情感态度与价值观:认识科学与大自然的关系,增强热爱大自然的情感。
重难点:
利用《物质转化规律图》来了解物质的化学性质及物质间的转化规律。
教学过程:
一、温故而知新
昨日:过了把当技术人员的瘾,成功从孔雀石中冶炼出了铜,测测你们的巩固情况:
1、应用原理:
2、采用原料:
3、技术配方:
二、引燃导火线
今日:又要挑战两项新的任务
活动一、比一比,谁能在最短的时间标出路线,帮助探险员成功出逃。
(温馨提示:细读其中的原则,为了确保路线清晰,用笔加以记录。
)
“探险队员”——盐酸不小心走进了化学迷宫(如图所示),不知该
如何走出。
迷宫中有许多“吃人的野兽”(即能与盐酸发生反应的物质),盐酸必须避开它们,否则就无法通过。
请你帮助它走出迷宫(用图中物质的序号连接起来
表示所走的路线)。
入口→ →出口 任务:1、汇报路线
2、脱险的秘诀是什么?
3、一路上都遇见了哪几类物质呢? 板
书
:
活动二:加点要求,利用迷宫中各物质之间的化学方程式,描绘出物质转化的“八卦图”。
规则:相互之间可以反应的用直线,能从A转化成B的用箭头。
但前提是在有实例的基础罗列你的依据。
方式:小组赛一赛,发现一条就接受全班师生的检阅,最后通过比较哪一组拉的线多少来取胜。
附加:纠错成功加以加分
师生共同完成共同任务。
板书:
图化学方程式
课堂练习:1、Ca→CaO→Ca(OH)2→CaCO3
2、C→CO2→H2CO3→Na2CO3
3、设计制取ZnSO4的4种方法。
课堂小结:
1、物质之间是可以相互转化的
2、物质之间的转化是有规律可寻的,找出其中的规律,并加以理
解和应用。
课后作业:
1、书本P53练习2,3,6。
2、某同学写了下面6个化学方程式:
A. Mg+O2===MgO2
B. 2P2+2O5 点燃2P2O5
C. Cu2(OH)2CO3===CuO+H2O+CO2↑
D. 3Fe+2O2↑===Fe3O4
E. Zn+H2SO4===ZnSO4+H2
F. CuO+H2===Cu↓+H2O
其中(请填序号):
(1)化学式写错的有:;
(2)化学式正确但不符合质量守恒定律的有:;(3)反应条件应该注明而未注明的有:;
(4)“↑”、“↓”使用不当或遗漏的有。
教学反思:
通过走迷宫激发了学生的学习乐趣,把本是比较枯燥的物质转化的规律图,以营救探险员的方式让全体学生总动员,这点尝试还是比较成功。
在比拼化学方程式的书写中通过小组比赛获胜的方法,表现出学生的集体荣誉感强,从中也发现了学生书写化学方程式的漏洞比较多,同时也发现学生中还是有很多有实力的。