表面擦拭微生物限度检查法回收率实验方案
- 格式:doc
- 大小:71.00 KB
- 文档页数:4

药品微生物限度检查方法验证一般步骤1.样品及确定验证项目样品要求:不含菌或少量菌验证项目:根据药品用药途径、处方、制法确定。
细菌、霉菌及酵母菌计数验证(一般必作);控制菌检查如为中药制剂必须查标准,根据用药途径、处方、制法确定控制菌检查项目。
特殊的如滴眼剂、用于烧伤、严重创伤等应根据制剂通则项下要求及微生物限度标准来确定。
2. 确定供试液制备方法3. 方法选择预试验(1)目的:确定样品对试验菌有无抑菌活性及计数验证各试验菌的回收试验方法。
(2)查资料,根据样品的功能、主治及所含成分等确定方法选择预试验方案。
(3)根据预试验结果确定各试验菌计数验证方法控制菌验证方法4. 验证试验:选择3个批号样品进行3次独立实验,证明方法的有效性;5. 据验证结果优化试验条件,建立微生物限度检查方法SOP。
6. 写出验证资料。
示教内容11.5.上午:菌液制备方法:一. 新鲜浓菌液制备(要求学员练习操作的内容)新鲜浓菌液接种:细菌大肠埃希菌[CMCC(B)44102]金黄色葡萄球菌[CMCC(B)26003]枯草芽孢杆菌[CMCC(B)63501]生孢梭菌[CMCC(B)64941](厌氧梭菌)铜绿假单胞菌[CMCC(B)10104]培养基:营养肉汤3-5ml、硫乙醇酸盐流体培养基3-5ml接种及培养:1.分别取各试验菌半个--1个菌落分别接种营养肉汤(充分研匀、摇匀),36±1℃培养16-18小时。
2.生孢梭菌新鲜培养物取0.1ml接种硫乙醇酸盐流体培养基(临用前排氧)36±1℃培养18-24小时。
霉菌及酵母菌白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]培养基:改良马丁培养基3-5ml;改良马丁琼脂培养基斜面1.取白色念珠菌的菌落接种改良马丁培养基23-28℃培养24小时(可用36±1℃培养18-24)。
2.黑曲霉孢子悬液的制备:沾取黑曲霉孢子接种改良马丁琼脂培养(红字为示教内容基,培养5-7天待培养物黑色孢子生长(全部变黑,已制备好斜面培养物示教)加入5-10ml0.9%氯化钠溶液,小心振挡洗脱表面的黑色孢子1-2次,吸出洗脱液(注意不要触到菌丝体)即为孢子悬液。

固体制剂生产设备的清洁验证左敏西安利君制药有限责任公司,陕西西安710077文章摘要:介绍了某公司固体制剂生产设备清洁验证的实施过程以及近几年来实施清洁验证的一些心得体会。
文章关键词:清洁验证残留限度擦拭回收率文章快照:。
取样方法的有效性和重现性通过回收率试验来确认。
(1)准备3块与设备表面材质相同的不锈钢板,分别用钢锥画出25em×26cm的矩形区域。
再在此区域内画线使其成为l0个5cm×13cm的方块,每一个方块构成一个单元面积。
(2)对照品的制备:制备3个浓度的对照品。
精密称取一定效价的四环素10nag、15mg、20mg,将其分别溶于l0ml、0.1 mol/1的盐酸溶液当中各取其中的1ml均匀涂布于不锈钢板上25cm×13cm的矩形区域内。
每块钢板上单元面积上的物质量分别为0.1mg、0.15mg、O.2mg。
(3)取样方法:在每块不锈钢板上任意选取3个单元面积,分别用一支在无水乙醇溶剂中处理过的棉签擦拭取样。
取样时将挤去棉签头多余的水分,按在擦拭表面32中国制药装备·2009年8月·第8辑表4取样位置及样点编号取样位置检测项目微生物限度残留限度清洁剂残留上,平稳而缓慢地擦拭取样表面,在向前移动的同时将其从一边移动到另外一边。
擦拭过程应覆盖整个表面。
翻转棉签,让棉签的另一面也进行擦拭,但与前次擦拭的移动方向垂直。
取样后溶于10ml 的溶剂中,进行生物效价检测。
(4)计算擦拭回收率:擦拭回收率=(棉签获取的残留量/单元面积上的物质量)×100%。
(5)所有样品的擦拭回收率均应>5O%作者简介:左敏(1976一),女,工程师,现从事动力、制药设备的管理等工作。
一、首先,取样回收率就是一个试验,通过这个实验可以复原你的取样过程和取样方法的科学性。
举个例子:在设备已经清洁后的表面,你用棉签擦拭,但你并不清楚你是否已经把设备表面的附着物全部擦下来了,比如表面附着50个,你可能只擦拭下来20个,这时候取样回收率就有意义了1、首先注意:每次取样尽可能采用相似的力度、擦拭的速度以及擦拭的路径,消除认为所带来的RSD干扰2、你需要准备一块儿与设备表面材质相同的方板,尽可能平整干净。

擦拭法回收率(TOC)验证方案起草:______________ 起草日期:年月日审核:______________ 审核日期:年月日批准:______________ 批准日期:年月日目录1.概述2.验证范围及目的3.验证小组4.风险评估5.验证前准备6.验证内容7.验证结果与评价8.验证周期9.批准10.附件1.概述1.1验证背景目前公司在进行清洁验证时使用到棉签擦拭法(TOC)检测残留。
为了保证检验结果的准确性、可靠性,现针对擦拭法(TOC)回收率进行验证,以证明所采用的方法适合清洁验证检查。
可接受标准:回收率≥70%;,RSD≤10%;步骤:①准备1块300mm*300mm的平整光洁的不锈钢板;②在钢板上用钢锥划出200mm*200mm的区域每隔100mm划线形成16块50mm*50mm的方块;③配制TOC值为32mg/L的原料水溶液定量装入喷雾器;④将约10ml溶液尽量均匀地喷在200mm*200mm的区域内;⑤根据实际喷出的溶液量计算单位面积上的原料量约20ug/100mm2;⑥自然干燥或用电吹风温和地吹干不锈钢板;⑦用注射用水润湿棉签按擦拭取样方法擦拭钢板每一方块,每块换一根棉签,在钢板上取均布的8个方块;⑧将棉签分别放入TOC专用瓶中,定量加入40ml注射用水,加盖,轻摇,放置10min,使物质溶出,取空白棉签相同操作作为空白溶液;⑨使用TOC分析仪测定此棉签擦拭水样的TOC值;⑩计算擦拭回收率。
1.2验证记录填写注意事项1)文件记录的填写按照《检验数据及记录管理规程》进行记录和填写。
2)在验证过程中如果发现对验证无影响的错别字、排版错误,可由相关验证人进行修改,并签上姓名和日期。
3)每项验证均应由专业人员完成,完成后需签上姓名及日期。
4)验证完成后,各部门/车间应在报告接收后五个工作日内将所负责的项目填写完成经上一级负责人检查无误后提交至验证专员处(检验部在检验结果出具并接收报告后计算),由验证专员及验证小组组长组织完成最终报告并报批,报告应在验证结束后十个工作日内完成。

关于制药设备清洁验证中表面微生物擦拭取样方法和检验方法的验证实验发布时间:2021-12-30T08:36:42.297Z 来源:《中国科技人才》2021年第25期作者:董小燕[导读] 微生物在适当温湿度下以残留物中的有机物为营养可大量繁殖,产生各种代谢物,从而增加残留物复杂性和危害程度,进而对下批产品造成不良影响。
因此必须对药品生产设备的微生物进行严格控制。
此外,擦拭取样能对最难清洁部位直接取样,通过考察有代表性最难清洁部位的残留物水平评价整套生产设备的清洁状况。
哈药集团三精制药有限公司黑龙江省哈尔滨市 150069摘要:为降低药物交叉污染及微生物污染风险,保证用药安全,延长系统或设备使用寿命,提高企业经济效益设备。
药品生产的每道工序完成后,需对药品生产设备进行清洁,并对清洁方法进行验证,在以前清洁验证中要求对化学残留取样方法进行验证,却未要求对微生物取样方法进行确认,而《药品生产质量管理规范》新增了对表面微生物取样和检验方法验证的要求。
关键词:制药设备;清洁验证;表面微生物微生物在适当温湿度下以残留物中的有机物为营养可大量繁殖,产生各种代谢物,从而增加残留物复杂性和危害程度,进而对下批产品造成不良影响。
因此必须对药品生产设备的微生物进行严格控制。
此外,擦拭取样能对最难清洁部位直接取样,通过考察有代表性最难清洁部位的残留物水平评价整套生产设备的清洁状况。
一、清洁验证目的清洁验证是对清洁程序进行的验证方法,一般经过对数据的收集等工作,来证明清洁程度是否能达到清洁设备的标准要求。
此外,若在进行多种药品的生产时,使用同一种设备进行生产,这样会导致问题的出现,因一旦生产完一种产品未及时进行设备的清洗,会直接导致下一批药物生产受到污染,从而影响药品质量。
但在实际生产时,许多药品需一个设备进行生产,并且清洁设备的方法也都无太大差别,这时制药公司就可根据药品所需原料及其溶解性质、稳定因素、需要清洁的剂量等进行有效分析,之后将其安全指数根据数据统一计算。

清洁验证方案1.设备的评估⑴设备的分类,按照设备接触产品的情况,设备可分三类。
①直接接触产品的设备系指在生产工艺中和产品直接接触的设备,如溶液罐、储存桶和原辅料罐。
对于直接接触产品的设备的无效清洁可能造成产品间的交叉污染。
②非接触产品的设备系指在生产工艺中涉及,但是没有和产品直接接触的设备,如封闭设备是外表面。
对于非接触产品的设备的无效清洁一般不会造成产品间的交叉污染。
③非直接或偶然接触产品的设备系指在生产工艺中涉及,单没有和产品直接接触但有肯能污染产品的设备,如冷冻干燥仪或盘式干燥仪的内表面、机械监护装置的内部,还有某些情况下地面、墙面和天花板。
对于非直接产品接触的设备的无效清洁有可能造成产品间的交叉污染。
通常清洁验证包括产品接触的设备,不包括非产品接触的设备,非直接产品接触的设备是否包括在内依实际情况而定。
一次性使用的部件(如硅胶管)可不包括在清洁验证中。
⑵设备表面积的确定①应测定每个设备的产品接触面积,以计算残留限度的接受标准。
②产品接触面积测定的准确度应具有实际意义,不必绝对地精确。
可将复杂设备转化成基本几何图形以便于计算和测量。
③测量的原始记录和计算应作为原始数据进行保存。
2.清洁参照物的选择和残留限度的计算⑴清洁参照物的选择①物料的毒性以及溶解度。
②物料是否会妨碍清洁过程,如油性物料会阻碍表明的湿润。
③芳香剂和色料等特殊物料。
④物料的特性,如有些物料对设备材质有一定的附着力。
⑵残留限度的确定:目前普遍接受的限度标准基于以下原则制定。
①残留物浓度限度:10×10-6。
②生物活性的限度----最低日治疗剂量的1/1000。
③目视洁净。
a擦拭法:用白布或黑布擦拭清洁过的表面,然后检查布上的残留物。
B荧光法:对于在紫外线照射下可发出荧光的物质,还可以采用紫外线辅助检测其残留物。
对于产品专用设备和非产品接触的设备和表面建议采用目视洁净。
⑶微生物污染控制标准:微生物污染水平的制定应满足生产和质量控制的要求。


清洁验证中有关微生物限度检查的确定原则一、2010版GMP有关清洁验证内容如下:(一)清洁操作规程通常应当进行验证。
清洁验证一般应当针对污染物、所用物料对原料药质量有最大风险的状况及工艺步骤。
(二)清洁操作规程的验证应当反映设备实际的使用情况。
如果多个原料药或中间产品共用同一设备生产,且采用同一操作规程进行清洁的,则可选择有代表性的中间产品或原料药作为清洁验证的参照物。
应当根据溶解度、难以清洁的程度以及残留物的限度来选择清洁参照物,而残留物的限度则需根据活性、毒性和稳定性确定。
(三)清洁验证方案应当详细描述需清洁的对象、清洁操作规程、选用的清洁剂、可接受限度、需监控的参数以及检验方法。
该方案还应当说明样品类型(化学或微生物)、取样位置、取样方法和样品标识。
专用生产设备且产品质量稳定的,可采用目检法确定可接受限度。
(四)取样方法包括擦拭法、淋冼法或其它方法(如直接萃取法),以对不溶性和可溶性残留物进行检验。
(五)应当采用经验证的灵敏度高的分析方法检测残留物或污染物。
每种分析方法的检测限必须足够灵敏,能检测残留物或污染物的限度标准。
应当确定分析方法可达到的回收率。
残留物的限度标准应当切实可行,并根据最有害的残留物来确定,可根据原料药的药理、毒理或生理活性来确定,也可根据原料药生产中最有害的组分来确定。
(六)对需控制热原或细菌内毒素污染水平的生产工艺,应当在设备清洁验证文件中有详细阐述。
(七)清洁操作规程经验证后应当按验证中设定的检验方法定期进行监测,保证日常生产中操作规程的有效性。
二、关于清洁验证中的微生物限度,大多数企业在做清洁验证时都不把此作为重点关注项目。
对于无菌产品,清洁验证中的微生物限度自然是必不可少的,甚至还会根据实际需要增加内毒素、热原等项目。
但是对于非无菌产品,清洁验证中的微生物限度如何来确定呢?在2010版GMP实施指南中清洁验证中是这样描述这个问题“企业制定清洁验证的微生物限度时可以考虑产品、剂型、清洁方法的特点以及环境级别等因素。


微生物棉签擦拭取样方法验证方案1.主题内容本方案规定了微生物棉签擦拭取样验证的目的、原理、标准及内容。
2.适用范围本方案适用微生物棉签擦拭法取样。
3.责任人质量部现场监控员:负责棉签擦拭取样方法验证方案的起草及实施。
质量部QC:负责按计划完成相关检验任务,确保检验结论正确可靠。
质量部QA:负责监督验证实施的全过程。
验证管理员:协助验证方案的起草,组织协调验证工作,并总结验证结果,出具验证报告。
质量管理部部长:负责验证方案及验证报告的审核。
质量授权人:负责验证方案及验证报告的批准。
组长:质量管理部部长验证小组成员:QA主管 QC主管微生物限度检验员现场监控员4.内容4.1 概述制药企业生产设备、生产场所、用具等需要清洁,清洁后残留物限度经检验应符合要求。
检验残留物限度的方法有两种:一是最终淋洗水取样;二是擦拭取样。
擦拭取样优点是能对最难清洁部位直接取样,通过考察有代表性的最难清洁部位的残留物限度评价生产设备的清洁状况。
但取样方法需验证其可行性。
因此需通过取样方法验证确定清洁方法的有效性。
能消除药品交叉污染及微生物污染。
4.2 验证目的通过对清洗消毒后微生物取样方法的回收率实验,评价取样方法的有效性、代表性和科学性,并为证明清洁方法有效性提供基本依据。
4.3 验证原理通过物理的擦拭对那些已经干燥的残留物取样。
通过选择适当的擦拭溶剂、擦拭工具和擦拭方法,可将清洗过程中未溶解的,已“干结”在设备表面或溶解度很小的物质擦拭下来。
检验结果能直接反映出个取样点的清洁状况。
4.4 清洁方法执行《XX机清洁SOP》、《房间清洁SOP》。
4.5 验证方法4.5.1.试验器具包括不锈钢载片(规格50mm×50mm)、培养皿Ф90mm、医用棉签,以上器具均需要经过121℃、30分钟灭菌后使用。
4.5.1.1.金黄色葡萄球菌菌液的制备接种金黄色葡萄球菌[CMCC(B)26 003新鲜培养物至营养肉汤或营养琼脂培养基中,30-35℃培养18-24小时。
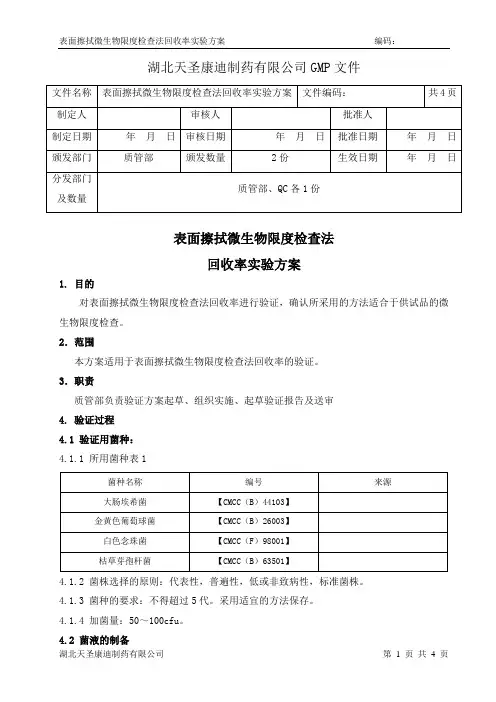
湖北天圣康迪制药有限公司GMP文件表面擦拭微生物限度检查法回收率实验方案1. 目的对表面擦拭微生物限度检查法回收率进行验证,确认所采用的方法适合于供试品的微生物限度检查。
2.范围本方案适用于表面擦拭微生物限度检查法回收率的验证。
3.职责质管部负责验证方案起草、组织实施、起草验证报告及送审4. 验证过程4.1 验证用菌种:4.1.1 所用菌种表14.1.2 菌株选择的原则:代表性,普遍性,低或非致病性,标准菌株。
4.1.3 菌种的要求:不得超过5代。
采用适宜的方法保存。
4.1.4 加菌量:50~100cfu。
4.2 菌液的制备4.2.1 取经37℃培养18-24小时,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌肉汤培养物1ml加9ml生理盐水10倍稀释至10-5~10-7,为50~100个/ml,做活菌计数备用。
4.2.2 取经25℃培养18-24小时的白色念珠菌霉菌液体培养物1ml加9ml生理盐水10倍稀释至10-5~10-6,为50~100个/ml,做活菌计数备用。
4.3 回收率的测定:4.3.1 将经灭菌的开孔面积为20cm2的金属模板放在试验物体表面,分别向无菌物体表面接种1ml金黄色葡萄球菌、大肠埃希菌、白色念珠菌和枯草芽孢杆菌的菌悬液,接种面积为20cm2,并在层流下进行干燥。
验证结束后用75%的酒精擦洗染菌表面。
4.3.2 取无菌棉签用0.9%无菌氯化钠溶液稍沾湿,在板孔范围内擦抹5次,换1无菌棉签同法再擦抹5次, 2支棉签共擦抹10次,然后剪去手接触部分棉棒,将棉签放入含10mL 灭菌生理盐水的采样管内。
摇匀取1mL倒平板,每次倒三个平板。
分别培养计数。
用同样的方法重复操作三次。
4.3.3 试验要进行三次独立操作,每次试验的回收率要≥70%方可认为该方法合适。
4.4 回收率计算试验结果下表,棉签擦拭法的结果是每次试验三个平板的平均菌落数再乘以稀释倍数(10)。
4.4.1 金黄色葡萄球菌试验结果金黄色葡萄球菌试验结果表2根据表中的数据,回收率计算如下表3:符合要求□不符合要求□检查人日期4.4.2 大肠埃希菌试验结果大肠埃希菌试验结果表4根据表中的数据,回收率计算如下表5:符合要求□不符合要求□检查人日期复核人日期4.4.3 白色念珠菌试验结果6白色念珠菌试验结果表根据表中的数据,回收率计算如下表7:复核人日期4.4.4 枯草芽孢杆菌试验结果枯草芽孢杆菌试验结果表8根据表中的数据,回收率计算如下表9:符合要求□不符合要求□检查人日期复核人日期4.5 方法确认结论符合要求□不符合要求□检查人日期复核人日期5. 偏差及处理操作人:复核人:日期:年月日6. 验证报告验证小组负责人根据测试数据,进行统计分析,起草验证报告。

微生物棉签擦拭取样方法及检验方法验证方案文件编号:VP-01-06-00-037起草人_____________ 日期___________审核人_____________ 日期___________批准人_____________ 日期__________1、概述微生物在适当的温湿度下以残留物中的有机物为营养可大量繁殖,产生各种代谢物,从而大大增加残留物的复杂性和危害程度,对下批产品造成污染。
因此必须对药品生产设备的微生物进行严格控制。
制药企业的生产场所、设备、用具等在生产结束后需清洁,根据GMP的要求,清洁后应对清洁效果进行评价,设备表面微生物限度检查应符合要求,擦拭取样优点是能对最难清洁部位直接取样,通过考察有代表性的最难清洁部位的表面微生物限度评价设备的清洁状况。
对棉签擦拭取样方法和检验方法的可行性进行验证,确保清洁方法的有效性,降低药品交叉污染和微生物污染的风险。
2、验证依据:《中华人民共和国药典》2015版四部3、验证目的通过对清洗消毒后微生物取样方法的回收率试验,评价取样方法的有效性、代表性和科学性,并为证明清洗方法有效性提供基本依据。
4 、范围本次验证适合微生物棉签擦拭法取样。
5、验证小组成员及职责表1 验证小组成员及职责6、验证风险评估及范围6.1根据《验证管理规程》对验证的相关要求,对检测过程中可能影响检测结果的因素进行风险分析。
风险定性标准如下:6.1.1严重性(S):危害可能产生后果的程度。
严重程度分为十个等级,如下:6.1.2可能性(P):影响检测结果的事件发生的可能性频率或概率,建立以下等级:6.1.3.可检测性(D):检测到异常情况存在的能力的程度,定义如下:6.2风险优先数量等级判定(RPN)6.2.2风险等级判定标准注:当1≤RPN<27,但严重性S×发生可能性P为10×2或9×2时,仍需按中等以上风险进行后续控制。
重庆麦克福新制药VP-01-06-00-0336.3.风险评估过程6.3.1风险识别采用5M1E分析法从人、机、料、法、环等方面进行分析:6.3.2 阿莫西林胶囊微生物限度检查方法验证风险分析:6.4表面微生物擦拭取样限度检查方法验证的不可接受风险汇总:注:当1≤RPN<27,但严重性S×发生可能性P为10×2或9×2时,仍需按中等以上风险进行后续控制。
微生物棉签擦拭取样方法及检验方法验证方案文件编号:VP-0}起草人_____________ 日期___________审核人_____________ 日期___________批准人_____________ 日期__________:…1、概述微生物在适当的温湿度下以残留物中的有机物为营养可大量繁殖,产生各种代谢物,从而大大增加残留物的复杂性和危害程度,对下批产品造成污染。
因此必须对药品生产设备的微生物进行严格控制。
制药企业的生产场所、设备、用具等在生产结束后需清洁,根据GMP的要求,清洁后应对清洁效果进行评价,设备表面微生物限度检查应符合要求,擦拭取样优点是能对最难清洁部位直接取样,通过考察有代表性的最难清洁部位的表面微生物限度评价设备的清洁状况。
对棉签擦拭取样方法和检验方法的可行性进行验证,确保清洁方法的有效性,降低药品交叉污染和微生物污染的风险。
2、验证依据:《中华人民共和国药典》2015版四部3、验证目的通过对清洗消毒后微生物取样方法的回收率试验,评价取样方法的有效性、代表性和科学性,并为证明清洗方法有效性提供基本依据。
-4 、范围本次验证适合微生物棉签擦拭法取样。
5、验证小组成员及职责表1 验证小组成员及职责6、验证风险评估及范围根据《验证管理规程》对验证的相关要求,对检测过程中可能影响检测结果的因素进行风险分析。
风险定性标准如下:严重性(S):危害可能产生后果的程度。
严重程度分为十个等级,如下:】可能性(P):影响检测结果的事件发生的可能性频率或概率,建立以下等级:可检测性(D):检测到异常情况存在的能力的程度,定义如下:风险优先数量等级判定(RPN))风险等级判定标准的确定风险等级判定标准注:当1≤RPN<27,但严重性S×发生可能性P为10×2或9×2时,仍需按中等以上风险进行后续控制。
.风险评估过程风险识别采用5M1E分析法从人、机、料、法、环等方面进行分析:培养环境及观察环境洁净区环境(供试品溶液检查环境)测环法阿莫西林胶囊微生物限度检查方法验证风险分析:表面微生物擦拭取样限度检查方法验证的不可接受风险汇总:注:当1≤RPN<27,但严重性S×发生可能性P为10×2或9×2时,仍需按中等以上风险进行后续控制。
微生物棉签擦拭取样方法及检验方法验证报告文件编号:VP-01-06-00-038起草人_____________ 日期___________审核人_____________ 日期___________批准人_____________ 日期__________1、概述微生物在适当的温湿度下以残留物中的有机物为营养可大量繁殖,产生各种代谢物,从而大大增加残留物的复杂性和危害程度,对下批产品造成污染。
因此必须对药品生产设备的微生物进行严格控制。
制药企业的生产场所、设备、用具等在生产结束后需清洁,根据GMP的要求,清洁后应对清洁效果进行评价,设备表面微生物限度检查应符合要求,擦拭取样优点是能对最难清洁部位直接取样,通过考察有代表性的最难清洁部位的表面微生物限度评价设备的清洁状况。
对棉签擦拭取样方法和检验方法的可行性进行验证,确保清洁方法的有效性,降低药品交叉污染和微生物污染的风险。
2018年08月19日至8月31日,根据经批准的微生物棉签擦拭取样方法及检验方法验证方案(编号:VP-01-06-00-037),验证小组对微生物棉签擦拭取样方法及检验方法进行了验证,验证过程包括擦拭取样、菌悬液制备、回收率试验。
在验证过程中严格按照验证方案及验证计划进行了验证,其验证方案在验证过程中没有修改,验证结果完整、真实,验证达到预期的效果。
2、验证依据:《中华人民共和国药典》2015版四部3、验证目的通过对清洗消毒后微生物取样方法的回收率试验,评价取样方法的有效性、代表性和科学性,并为证明清洗方法有效性提供基本依据。
4 、范围本次验证适合微生物棉签擦拭法取样。
5、验证小组成员及职责表1 验证小组成员及职责6、验证方案的实施情况6.1证前的准备6.1.1主要验证用仪器仪表的确认6.1.1.1确认方法:查看手提式压力蒸汽灭菌锅、生化培养箱、霉菌培养箱、电热恒温干燥箱、生物安全柜校验日期,确定是否在有效期内;6.1.1.2可接受标准:确认提式压力蒸汽灭菌锅、生化培养箱、霉菌培养箱、电热恒温干燥箱、生物安全柜已经过校验,校验合格。
清洁验证取样方法和检验方法验证方案及报告清洁验证取样方法和检验方法验证方案一、目的:通过对清洁验证取样方法(棉签取样法)的回收率试验,来验证该取样方法的回收率和重现性,及检验方法的线性、精密度(RSD)。
二、范围:适用于本公司设备清洁验证的取样和检验方法。
三、责任人:验证小组取样人员、检验人员。
四、内容:1.概述制药企业生产设备、生产场所、用具等需清洁,清洁后残留物限度经检验应符合要求,检验残留物的限度有两种方法:一是最终淋洗水取样;二是棉签擦拭取样,本公司目前所有设备均采用的是棉签擦拭取样方法。
棉签擦拭取样优点是能对最难清洁部位直接取样,通过考察有代表性的最难清洁部位的残留物限度评价生产设备的清洁状况。
但取样方法需验证其可行性(回收率和重现性),因此须通过取样方法验证确定清洁验证取样方法的有效性,及检验方法的线性、精密度(RSD)。
2.验证目的本验证是通过对清洗消毒后,棉签擦拭取样方法的回收率试验,来验证、评价取样方法的可行性(回收率和重现性)、代表性和科学性,及检验方法的线性、精密度(RSD),为证明清洗方法有效性提供基本的取样和检验依据。
3.范围本次验证适合清洁验证取样方法(棉签擦拭法)和检验方法(高效液相色谱法)。
4.验证选取的参照物本次验证选用黄芩苷(C21H18O11)来做取样方法回收率试验和检验方法的线性、精密度(RSD)。
5.验证周期及验证进度安排验证由起草人和审核人提出完整的验证计划,经批准后实施,整个验证活动分两个阶段完成。
验证小组成员的培训:试验时间:6.验证小组成员及职责验证小组成员所在部门验证小组职务质量部QA负责本次验证的取样人员,监督本次验证过程的实施,异常情况汇报和处理。
质量部QA主管验证小组组长,验证方案及报告的起草,提供取样方法验证方案;负责本次验证方案的培训与指导。
质量部QC负责进行本次验证过程中的检验、数据记录、分析和报告。
质量部QC主管验证方案及报告的审核,提供检验方法验证方案;负责本次验证实施规程中的指导。
37微生物表面擦拭方法验证方案(总22页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--微生物棉签擦拭取样方法及检验方法验证方案文件编号:VP-0起草人_____________ 日期___________审核人_____________ 日期___________批准人_____________ 日期__________1、概述微生物在适当的温湿度下以残留物中的有机物为营养可大量繁殖,产生各种代谢物,从而大大增加残留物的复杂性和危害程度,对下批产品造成污染。
因此必须对药品生产设备的微生物进行严格控制。
制药企业的生产场所、设备、用具等在生产结束后需清洁,根据GMP的要求,清洁后应对清洁效果进行评价,设备表面微生物限度检查应符合要求,擦拭取样优点是能对最难清洁部位直接取样,通过考察有代表性的最难清洁部位的表面微生物限度评价设备的清洁状况。
对棉签擦拭取样方法和检验方法的可行性进行验证,确保清洁方法的有效性,降低药品交叉污染和微生物污染的风险。
2、验证依据:《中华人民共和国药典》2015版四部3、验证目的通过对清洗消毒后微生物取样方法的回收率试验,评价取样方法的有效性、代表性和科学性,并为证明清洗方法有效性提供基本依据。
4 、范围本次验证适合微生物棉签擦拭法取样。
5、验证小组成员及职责表1 验证小组成员及职责6、验证风险评估及范围根据《验证管理规程》对验证的相关要求,对检测过程中可能影响检测结果的因素进行风险分析。
风险定性标准如下:可能性(P):影响检测结果的事件发生的可能性频率或概率,建立以下等级:可检测性(D):检测到异常情况存在的能力的程度,定义如下:风险优先数量等级判定(RPN)风险等级判定标准的确定风险等级判定标准注:当1≤RPN<27,但严重性S×发生可能性P为10×2或9×2时,仍需按中等以上风险进行后续控制。
.风险评估过程风险识别采用5M1E分析法从人、机、料、法、环等方面进行分析:测环法7阿莫西林胶囊微生物限度检查方法验证风险分析:8910表面微生物擦拭取样限度检查方法验证的不可接受风险汇总:注:当1≤RPN<27,但严重性S×发生可能性P为10×2或9×2时,仍需按中等以上风险进行后续控制。
目的:1 生产过程中,由于存在产品的残留,容易对下次生产的产品造成污染,影响产品质量。
这种污染主要来自于对设备清洁不彻底,极易造成微量污染。
因此需要在连续生产一段时间后及换品种时,制定切实可行的设备清洁操作程序并按该程序进行清洁,设备上的残留物(可见的与不可见的,包括前一批次或前一品种的残留物及清洗过程中的残留溶剂)达到了规定的清洁限度要求,不会对将生产的产品造成交叉污染,以保证产品的质量。
2 为再验证提供数据资料。
范围:工程设备部负责验证过程中设备的正常运行,对设备和设备系统的取样和操作提供帮助。
人力资源部负责对验证相关人员组织培训。
生技部负责指派生产人员按对应设备相应的设备清洁操作规程,对设备进行清洁,确保清洁操作满足规范要求,为验证操作及取样提供帮助。
质量部负责组织起草验证方案并组织相关部门、人员实施验证。
内容:1、验证实施小组成员2.1生产过程中,待生产完后,设备中残留的物料为,残留的物料有可能对下批产品产生影响。
因此,在生产完以后按清洁操作规程对设备进行大清洁,清洁后组织实施验证,以确保清洁规程能确实有效的对釜内残留的物料进行清除。
2.2验证时间:与生产时同步进行,记录连续三次大清洁检测结果3、验证内容:板框压滤机:图二 板框压滤机清洗关键点示意图三足离心机:三足离心机清洗关键点示意图振动筛:②出料口周转桶:3.2.2 可接受标准3.2.2.1 化学残留可接受限度:1/1000生产的组小批量为500kg,最大允许残留量为:1/1000 ×500kg = 500g擦拭法取样残留限度:根据计算结果,最大允许残留量为500g,各个产品的内表面积一定,按产品平均分配到各个设备表面,其残留限量为:擦拭测试:擦拭面积以10㎝×10㎝的区域计按工艺要求,的最小批产量为500㎏,其可接受残留限度1/1000为500g,生产中物料接触设备的总面积为98m2,按500g残留产品平均分配到各个设备表面,其残留限量为:a.擦拭测试:擦拭面积以10㎝×10㎝的区域计500g×1000残留限量A=―――――――――×100㎝2×10%(保险系数)×70%(取样回收率) 98m2×10000=3.57㎎/100㎝2残留限度定为:3.57㎎/100㎝2/25ml=0.14mg/ml对棉签溶出液照紫外可见分光光度法,在257nm波长处检测吸光度(磺胺甲恶唑在3%的氢氧化钠溶液中在257nm处有最大吸收),按吸光度计算出残留浓度。
湖北天圣康迪制药有限公司GMP文件表面擦拭微生物限度检查法回收率实验方案1. 目的对表面擦拭微生物限度检查法回收率进行验证,确认所采用的方法适合于供试品的微生物限度检查。
2.范围本方案适用于表面擦拭微生物限度检查法回收率的验证。
3.职责质管部负责验证方案起草、组织实施、起草验证报告及送审4. 验证过程4.1 验证用菌种:4.1.1 所用菌种表14.1.2 菌株选择的原则:代表性,普遍性,低或非致病性,标准菌株。
4.1.3 菌种的要求:不得超过5代。
采用适宜的方法保存。
4.1.4 加菌量:50~100cfu。
4.2 菌液的制备4.2.1 取经37℃培养18-24小时,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌肉汤培养物1ml加9ml生理盐水10倍稀释至10-5~10-7,为50~100个/ml,做活菌计数备用。
4.2.2 取经25℃培养18-24小时的白色念珠菌霉菌液体培养物1ml加9ml生理盐水10倍稀释至10-5~10-6,为50~100个/ml,做活菌计数备用。
4.3 回收率的测定:4.3.1 将经灭菌的开孔面积为20cm2的金属模板放在试验物体表面,分别向无菌物体表面接种1ml金黄色葡萄球菌、大肠埃希菌、白色念珠菌和枯草芽孢杆菌的菌悬液,接种面积为20cm2,并在层流下进行干燥。
验证结束后用75%的酒精擦洗染菌表面。
4.3.2 取无菌棉签用0.9%无菌氯化钠溶液稍沾湿,在板孔范围内擦抹5次,换1无菌棉签同法再擦抹5次, 2支棉签共擦抹10次,然后剪去手接触部分棉棒,将棉签放入含10mL 灭菌生理盐水的采样管内。
摇匀取1mL倒平板,每次倒三个平板。
分别培养计数。
用同样的方法重复操作三次。
4.3.3 试验要进行三次独立操作,每次试验的回收率要≥70%方可认为该方法合适。
4.4 回收率计算试验结果下表,棉签擦拭法的结果是每次试验三个平板的平均菌落数再乘以稀释倍数(10)。
4.4.1 金黄色葡萄球菌试验结果金黄色葡萄球菌试验结果表2根据表中的数据,回收率计算如下表3:符合要求□不符合要求□检查人日期4.4.2 大肠埃希菌试验结果大肠埃希菌试验结果表4根据表中的数据,回收率计算如下表5:符合要求□不符合要求□检查人日期复核人日期4.4.3 白色念珠菌试验结果6白色念珠菌试验结果表根据表中的数据,回收率计算如下表7:复核人日期4.4.4 枯草芽孢杆菌试验结果枯草芽孢杆菌试验结果表8根据表中的数据,回收率计算如下表9:符合要求□不符合要求□检查人日期复核人日期4.5 方法确认结论符合要求□不符合要求□检查人日期复核人日期5. 偏差及处理操作人:复核人:日期:年月日6. 验证报告验证小组负责人根据测试数据,进行统计分析,起草验证报告。
表面擦拭微生物限度检查法
回收率实验方案
1. 目的
对表面擦拭微生物限度检查法回收率进行验证,确认所采用的方法适合于供试品的微生物限度检查。
2.范围
本方案适用于表面擦拭微生物限度检查法回收率的验证。
3.职责
质管部负责验证方案起草、组织实施、起草验证报告及送审
4. 验证过程
4.1 验证用菌种:
4.1.1 所用菌种表1
4.1.2 菌株选择的原则:代表性,普遍性,低或非致病性,标准菌株。
4.1.3 菌种的要求:不得超过5代。
采用适宜的方法保存。
4.1.4 加菌量:50~100cfu。
4.2 菌液的制备
4.2.1 取经37℃培养18-24小时,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌肉汤培养物1ml加9ml生理盐水10倍稀释至10-5~10-7,为50~100个/ml,做活菌计数备用。
4.2.2 取经25℃培养18-24小时的白色念珠菌霉菌液体培养物1ml加9ml生理盐水10倍稀释至10-5~10-6,为50~100个/ml,做活菌计数备用。
4.3 回收率的测定:
4.3.1 将经灭菌的开孔面积为20cm2的金属模板放在试验物体表面,分别向无菌物体表
面接种1ml金黄色葡萄球菌、大肠埃希菌、白色念珠菌和枯草芽孢杆菌的菌悬液,接种面积为20cm2,并在层流下进行干燥。
验证结束后用75%的酒精擦洗染菌表面。
4.3.2 取无菌棉签用0.9%无菌氯化钠溶液稍沾湿,在板孔范围内擦抹5次,换1无菌棉签同法再擦抹5次, 2支棉签共擦抹10次,然后剪去手接触部分棉棒,将棉签放入含10mL 灭菌生理盐水的采样管内。
摇匀取1mL倒平板,每次倒三个平板。
分别培养计数。
用同样的方法重复操作三次。
4.3.3 试验要进行三次独立操作,每次试验的回收率要≥70%方可认为该方法合适。
4.4 回收率计算
试验结果下表,棉签擦拭法的结果是每次试验三个平板的平均菌落数再乘以稀释倍数(10)。
4.4.1 金黄色葡萄球菌试验结果
金黄色葡萄球菌试验结果表2
根据表中的数据,回收率计算如下表3:
符合要求□不符合要求□
检查人日期
复核人日期
4.4.2 大肠埃希菌试验结果
大肠埃希菌试验结果表4
根据表中的数据,回收率计算如下表5:
符合要求□不符合要求□
检查人日期
复核人日期
4.4.3 白色念珠菌试验结果
6
白色念珠菌试验结果表
根据表中的数据,回收率计算如下表7:
符合要求□不符合要求□
检查人日期
复核人日期
4.4.4 枯草芽孢杆菌试验结果
枯草芽孢杆菌试验结果表8
根据表中的数据,回收率计算如下表9:
符合要求□不符合要求□
检查人日期
复核人日期
4.5 方法确认结论
符合要求□不符合要求□
检查人日期
复核人日期
5. 偏差及处理
操作人:复核人:日期:年月日
6. 验证报告
验证小组负责人根据测试数据,进行统计分析,起草验证报告。
并根据验证结果拟定再验证周期。