高中化学 7.1 硫酸亚铁铵的制备试题1 苏教版选修6
- 格式:doc
- 大小:76.51 KB
- 文档页数:2

高中化学精选内容重点知识精选高中更注重自学的能力,到大学之后这一能力会得到升华。
在开学之前就自己学习,不仅能纠正初中的学习方式,也能做到先人一步,做到温故而知新。
而对于升高二的同学,如果已经偏科了,那么可以利用假期把知识点巩固复习,不然后期就更难学习了!今天给大家整理了《高中化学全册笔记》每一章的基础知识点都有。
化学基础打好,内容知识熟记,肯定可以拿高分哟!高中化学和你一起共同进步学业有成!TB:小初高题库班级:姓名:硫酸亚铁铵的制备2013/3/13一、硫酸亚铁铵的性质1、分子式为、_____ _色晶体,商品名为______ ___,是一种______盐,溶于水,溶于乙醇2、一般亚铁盐在空气中易被____ __,形成复盐后就比较稳定,被氧化3、与其他复盐一样,(NH4)2 SO4·FeSO4·6H2O在水中的溶解度比组成它的每一种盐FeSO4或(NH4)2SO4都要__ __二、硫酸亚铁铵的制备1、制备原理(1)(NH4)2 SO4·FeSO4·6H2O在水中的溶解度比组成它的每一种盐FeSO4或(NH4)2SO4都要__ __。
将等物质的量的FeSO4、(NH4)2SO4溶液___ ___,冷却至室温,则析出______ ___晶体。
FeSO4可由与稀硫酸反应制得化学方程式如下:_______ ____________________,______ ___________________________________ (2)主要原料:硫酸铵、铁屑、稀硫酸2、硫酸亚铁铵的制备(1)铁屑的净化5g铁屑→15mL1mol/LNa2CO3溶液浸泡(煮沸)→倾析法分离→洗涤→晾干1)N a2CO3溶液浸泡的目的:2)将碱液倒掉的方法:【倾析法】①当沉淀的结晶颗粒时,静置后容易沉降至容器底部,此时将上层清夜沿倒入另一容器,即可使沉淀和清夜分离②若沉淀要洗涤,可注入水(或其他洗涤剂),充分搅拌后使沉淀沉降,再用倾析法分离,重复数次。
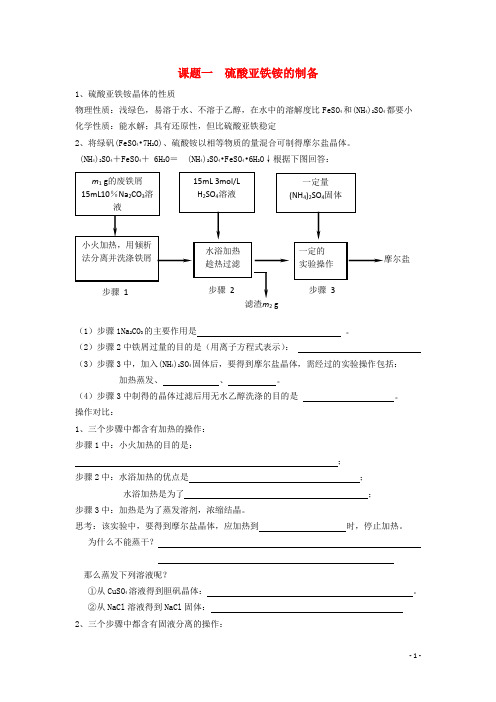
课题一硫酸亚铁铵的制备1、硫酸亚铁铵晶体的性质物理性质:浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小化学性质:能水解;具有还原性,但比硫酸亚铁稳定2、将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体。
(NH4)2SO4+FeSO4+ 6H2O= (NH4)2SO4•FeSO4•6H2O↓根据下图回答:(1)步骤1Na2CO3的主要作用是。
(2)步骤2中铁屑过量的目的是(用离子方程式表示):(3)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、、。
(4)步骤3中制得的晶体过滤后用无水乙醇洗涤的目的是。
操作对比:1、三个步骤中都含有加热的操作:步骤1中:小火加热的目的是:;步骤2中:水浴加热的优点是;水浴加热是为了;步骤3中:加热是为了蒸发溶剂,浓缩结晶。
思考:该实验中,要得到摩尔盐晶体,应加热到时,停止加热。
为什么不能蒸干?那么蒸发下列溶液呢?①从CuSO4溶液得到胆矾晶体:。
②从NaCl溶液得到NaCl固体:2、三个步骤中都含有固液分离的操作:步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有:A、沉淀的颗粒较大B、沉淀容易沉降C、沉淀呈胶状D、沉淀呈絮状步骤2中溶液趁热过滤的原因是。
步骤3中可以用如下装置进行过滤:(1)这种过滤方式称为:(2)这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是:。
(3)你能讲出仪器A、B、C的名称么?摩尔盐产品中离子的检验:例:为检验硫酸亚铁铵晶体中的NH4+、Fe2+、SO42-,(1)甲同学提出可以用湿润的试纸、稀盐酸和溶液检验出这三种离子。
(2)乙同学提出检验产品中的Fe2+ 、可以用KSCN溶液和另一种试剂来检验,试简述操作和现象:。
但是实际操作中,乙加入KSCN溶液后发现溶液变为浅红色,于是对自己提出的方法产生怀疑。
丙同学仔细思考后认为,可以从另一现象证明产品中的Fe2+,该现象是:。

硫酸亚铁铵的制备硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2·6H2O,商品名为摩尔盐。
硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后即比较稳定。
已知三种盐的溶解度(单位为g/100g水)如下表:某化学兴趣小组利用铁屑、稀硫酸和硫酸铵制备硫酸亚铁铵,具体实验步骤如下:1.Fe屑的处理和称量【操作】称取约5g铁屑,放入锥形瓶,加入15 mL10%Na2CO3溶液,小火加热10 min以除去Fe屑表面的油污,将剩余的碱液倒出,置于回收瓶中,用蒸馏水把Fe冲洗干净,干燥后称其质量,记为m1(Fe),备用。
【问题】Na2CO3溶液用以除油污的原因是,加热更有利于提高去污能力的原因是,将剩余的碱液倒掉的方法是。
2.FeSO4的制备【操作】将称量好的Fe屑放入锥形瓶中,加入25 mL 3mol/L H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3mol/L H2SO4,趁热过滤,将滤液转移至蒸发皿中。
【问题】①反应的化学方程式为,②水浴加热过程中要注意往锥形瓶中补充适量水分,理由是。
③制备FeSO4溶液时,用右图装置趁热过滤是。
该操作中所需的主要玻璃仪器有。
④趁热过滤的目的是。
⑤反应结束时再加入1 mL 3mol/L H2SO4的作用是;⑥在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是。
3.(NH4)2SO4·FeSO4·6HO的制备【操作】称取一定量的(NH4)2SO4并将其加入上面实验的蒸发皿中,缓缓加热,浓缩。
放置冷却,得到硫酸亚铁铵的晶体。
抽滤后,用无水乙醇洗涤晶体,除去其表面的水分,观察生成的硫酸亚铁铵的颜色和状态。
称量为m2g。
【问题】①称取的(NH4)2SO4质量为。
②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是。
③加热、浓缩溶液时,不浓缩至干的理由是。
④实验时,使摩尔盐结晶可以采取的方法是。

Evaluation Only. Created with Aspose.Words. Copyright 2003-2016 Aspose Pty Ltd.7.1《硫酸亚铁铵的制备》同步检测1.(2011年宿迁高二检测)用硫酸和铁屑制备硫酸亚铁,反应结束后,需将反应液进行过滤,但过滤时常毁灭漏斗颈下端管口堵塞的现象,可实行的措施是( ) A .将一般漏斗改为分液漏斗 B .将漏斗预热,进行热过滤 C .增加滤纸层数 D .向溶液中加一些稀硫酸解析:选B 。
反应后的溶液是几乎饱和的硫酸亚铁溶液,进行过滤时常毁灭漏斗颈下端管口堵塞的现象,是由于滤液在漏斗颈下端遇冷析出晶体造成的,可实行的措施是将漏斗预热,进行热过滤。
2.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常实行的措施是( ) A .硫酸过量 B .铁屑过量C .硫酸和铁的物质的量之比为1∶1D .需要用浓硫酸解析:选B 。
铁屑过量可以还原氧化生成的Fe 3+,Fe +2Fe 3+===3Fe 2+,保证Fe 2+稳定、纯洁地存在,削减产物中的Fe 3+杂质。
3.用倾析法进行分别适用于( ) A .沉淀的结晶颗粒较小 B .沉淀的结晶颗粒较大 C .沉淀不简洁沉降D .沉淀的质量较小解析:选B 。
当沉淀的结晶颗粒较大,静置后简洁沉降至容器底部时,常用倾析法(也称倾注法)进行分别或洗涤。
4.(2011年徐州高二检测)在试验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( ) A .CCO ――→CuO△CO 2Na 2CO 3 B .CuCu(NO 3)2溶液Cu(OH)2 C .FeFe 2O 3Fe 2(SO 4)3溶液 D .CaOCa(OH)2溶液NaOH 溶液解析:选D 。
A 在操作上不行行,经济上也不合理;B 在经济上不合理;C 中Fe 在氧气中燃烧的产物是Fe 3O 4,而不是Fe 2O 3,理论上不正确。


课题一硫酸亚铁铵的制备(时间:45分钟)1.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是( ) A.硫酸过量B.铁屑过量C.硫酸和铁的物质的量之比为1∶1D.需要用浓硫酸解析铁屑过量可以还原氧化生成的Fe3+,Fe+2Fe3+===3Fe2+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质。
答案 B2.用倾析法进行分离适用于( )A.沉淀的结晶颗粒较小B.沉淀的结晶颗粒较大C.沉淀不容易沉降D.沉淀的质量较小解析当沉淀的结晶颗粒较大,静置后容易沉降至容器底部时,常用倾析法(也称倾注法)进行分离或洗涤。
答案 B3.用硫酸和铁屑制备硫酸亚铁,反应结束后,需将反应液进行过滤,但过滤时常出现漏斗颈下端管口堵塞的现象,可采取的措施是( )A.将普通漏斗改为分液漏斗B.将漏斗预热,进行热过滤C.增加滤纸层数D.向溶液中加一些稀硫酸解析反应后的溶液是几乎饱和的硫酸亚铁溶液,进行过滤时常出现漏斗颈下端管口堵塞的现象,是由于滤液在漏斗颈下端遇冷析出晶体造成的,可采取的措施是将漏斗预热,进行热过滤。
答案 B4.下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是( )A .用装置甲制取氨气B .用装置乙除去氨气中的水蒸气C .用装置丙验证氨气具有还原性D .用装置丁吸收尾气解析 A 项,NH 3的溶解度较大,不加热,NH 3不会从溶液中出来,错误;B 项,NH 3显碱性,会被浓H 2SO 4吸收,故不可用浓H 2SO 4作干燥剂,错误;C 项,发生的反应为3CuO +2NH 3=====△3Cu +N 2+3H 2O ,反应中NH 3作还原剂,正确;D 项,NH 3通入溶液中,首先接触的是水,故会发生倒吸,错误。
答案 C5.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )A .C ――————→在空气中点燃CO ――——→CuO △CO 2――————→NaOH 溶液Na 2CO 3B .Cu ―——―→AgNO 3Cu(NO 3)2溶液―——―→NaOH 溶液Cu(OH)2 C .Fe ――——→点燃Fe 2O 3―——―→H 2SO 4溶液Fe 2(SO 4)3溶液 D .CaO ―——―→H 2O Ca(OH)2溶液―——―→Na 2CO 3溶液NaOH 溶液解析 A 在操作上不可行,经济上也不合理;B 在经济上不合理;C 中Fe 在氧气中燃烧的产物是Fe 3O 4,而不是Fe 2O 3,理论上不正确。
高中化学学习材料唐玲出品高二实验化学专题7课题1——硫酸亚铁铵的制备班级学号姓名1.摩尔盐的组成可用(NH4)2SO4·FeSO4·6H2O表示,下列关于该物质的叙述不正确的是 ( ) A.它是由(NH4)2SO4与FeSO4组成的混合物 B.它是一种纯净物C.它是一种复盐 D.它是一种结晶水合物2.下列关于硫酸亚铁铵的溶解度大小的叙述正确的是 ( ) A.比硫酸亚铁大 B.比硫酸铵大C.比硫酸亚铁、硫酸铵都小 D.比硫酸亚铁、硫酸铵都大3.将硫酸亚铁溶液和硫酸铵溶液按溶质物质的量之比为1︰1混合,加热浓缩,再冷却结晶,最先析出的晶体是 ( ) A.硫酸亚铁 B.硫酸铵C.硫酸亚铁铵 D.硫酸亚铁和硫酸铵的混合晶体4.用倾析法进行分离适用于 ( ) A.沉淀的结晶颗粒较小 B.沉淀的结晶颗粒较大C.沉淀不容易沉降 D.沉淀的质量较小5.工业上常用过量废铁屑与硫酸反应生产硫酸亚铁,铁屑中常含有下列杂质,其中对产品硫酸亚铁的纯度影响不大的是 ( ) A.油污 B.铁锈 C.锌 D.硫化物6.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是 ( ) A.铁屑过量 B.硫酸过量C.硫酸和铁的物质的量之比为1︰1 D.需要用浓H2SO47.用硫酸和铁屑制备硫酸亚铁,反应结束后,需将反应液进行过滤,但过滤时常出现漏斗颈下端管口堵塞的现象,可采取的措施是 ( ) A.将普通漏斗改为分液漏斗 B.将漏斗预热,进行热过滤C.增加滤纸层数 D.向溶液中加一些稀硫酸8.设计学生实验要注意安全、无污染、现象明显。
根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。
若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸出)。
下列气体的制取宜使用该装置的是 ( ) A.用二氧化锰(粉末)与双氧水制氧气B.用锌粒与稀硫酸制氢气C.用硫化亚铁(块状)与盐酸制硫化氢(有毒气体)D.用碳酸钙(块状)与稀硫酸制二氧化碳9.下列操作不是..从安全角度考虑的是 ( ) A.做氢气还原氧化铜实验时,先通氢气排净装置中空气再加热B.稀释浓硫酸时将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌C.给试管中的液体加热时,试管口不能对着自己或他人D.用废铁屑制硫酸亚铁时,先将废铁屑放在碱液中加热1~2 min10.化学实验中,常将溶液或试剂酸化,下列酸化处理的措施中正确的是 ( ) A.定性检验SO32-,将BaCl2溶液用HNO3酸化B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化C.检验某溶液中是否含Cl–,用HNO3酸化的AgNO3溶液D.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度11.在制备硫酸亚铁铵晶体的过程中,下列说法不正确的是 ( ) A.应保持H2SO4适当过量,抑制Fe2+、NH4+的水解B.将铁屑放入Na2CO3溶液中浸泡数分钟是为了除去铁屑表面的油污C.将FeSO4和(NH4)2SO4的混合溶液加热蒸干即可得到硫酸亚铁铵D.洗涤硫酸亚铁铵晶体时,应用少量酒精洗去晶体表面附着的水分12. 硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2•6H2O,商品名为摩尔盐。
专题7 物质的制备与合成课题1 硫酸亚铁铵的制备某小组利用铁屑、稀硫酸和硫酸铵制备硫酸亚铁铵,具体实验步骤如下:1.Fe屑的处理和称量【操作】称取约5g铁屑,放入锥形瓶,加入15 mL10%Na2CO3溶液,小火加热10 min以除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量,记为m1(Fe),备用。
【问题】Na2CO3溶液用以除油污的原因是,加热更有利于提高去污能力的原因是,将剩余的碱液倒掉的方法是2.FeSO4的制备【操作】将称量好的Fe屑放入锥形瓶中,加入25 mL 3mol/L H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3mol/L H2SO4,趁热过滤,将滤液转移至蒸发皿中。
【问题】反应反应的化学方程式为,趁热过滤的目的是,反应结束时再加入1 mL 3mol/L H2SO4的作用是,在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是3.(NH4)2SO4·FeSO4·6HO的制备【操作】称取一定量的(NH4)2SO4并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。
放置冷却,得到硫酸亚铁铵的晶体。
抽滤后,用无水乙醇洗涤晶体,除去其表面的水分,观察生成的硫酸亚铁铵的颜色和状态。
称量为m2g。
【问题】制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,根据是,硫酸亚铁铵,商品名称为摩尔盐,其化学式为,色晶体是一种复盐。
溶于水,溶于酒精。
(NH4)2SO4和硫酸亚铁溶液混合,加热浓缩即可制得硫酸亚铁铵,其主要原理是硫酸亚铁铵的产率为。
【对位专练】按照下列方案进行“由废铝(只含杂质铁)制备硫酸铝晶体”的实验:步骤1:取ag含铁废铝(含杂质铁b%),加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
专题7物质的制备与合成课时1 硫酸亚铁铵的制备一.实验目标(1)以用废铁屑制备硫酸亚铁铵为例,初步体验无机物质制备的过程。
(2)训练物质的称量、溶解、加热、结晶、抽滤、水浴加热、倾析法分离和洗涤的操作技(3)了解复盐硫酸亚铁铵的制备原理和方法。
二、实验原理物质性质:硫酸亚铁铵俗称莫尔盐,浅绿色透明晶体,易溶于水,在空气中比一般的亚铁铵盐稳定,不易被氧化。
FeSO4在空气中容易被氧化,可以用SCN-来检验FeSO4溶液是否变质。
由于硫酸亚铁铵在水中的溶解度在0~60 ℃内比组成它的简单盐硫酸铵和硫酸亚铁要小,只要将它们按一定的比例在水中溶解、混合,即可制得硫酸亚铁铵的晶体。
基本原理:1、将金属铁溶于稀硫酸,制备硫酸亚铁。
Fe+H2SO4=FeSO4+H2↑2、将制得的硫酸亚铁溶液与等物质的量的(NH4)2SO4在溶液中混合,经加热浓缩、冷却后得到溶解度较小的硫酸亚铁铵晶体。
三、实验步骤1、铁屑的净化操作要点:称取5g的铁屑注入15mL1mol/LNa2CO3溶液→浸泡(水浴加热)→倾析法分离→用蒸馏水洗涤数次→晾干(烘干)操作注意点:(1)为缩短反应时间,应设法增大铁的表面积,最好选用刨花车间加工的生铁碎铁屑(丝),避免使用锈蚀程度过大的铁屑,因其表面Fe2O3过多无法被铁完全还原,会导致Fe3+留在溶液中而影响产品的质量。
(2)为加快除油污的速度,可加热至沸,并用玻璃棒不断搅拌,如果铁屑油污不多,时间可短些,大概2-3分钟即可。
(3)为缩短实验时间,洗涤后的铁屑最好烘干,如果实验室没有烘箱,可以采用课件中的两种装置烘干。
(参看课件)2、制取硫酸亚铁溶液操作要点:称取4.2g铁屑记总质量为为m1,加入25mL3mol/LH2SO4溶液水浴加热→振荡补充水→加1mL3mol/L H2SO4→趁热过滤→洗涤瓶、渣(用少量热水)→转移至蒸发皿→将过滤后的固体烘干称量记作m2→计算m1-m2即为实际参加反应铁的质量操作注意点:(1)由于铁屑不纯,往往产生有毒的气体,需要在通风橱内进行,或者接尾气吸收装置。
专题7 物质的制备与合成
课题1 硫酸亚铁铵的制备
某小组利用铁屑、稀硫酸和硫酸铵制备硫酸亚铁铵,具体实验步骤如下:
1.Fe屑的处理和称量
【操作】称取约5g铁屑,放入锥形瓶,加入15 mL10%Na2CO3溶液,小火加热10 min以除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量,记为m1(Fe),备用。
【问题】Na2CO3溶液用以除油污的原因是,加热更有利于提高去污能力的原因是,将剩余的碱液倒掉的方法是
2.FeSO4的制备
【操作】将称量好的Fe屑放入锥形瓶中,加入25 mL 3mol/L H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3mol/L H2SO4,趁热过滤,将滤液转移至蒸发皿中。
【问题】反应反应的化学方程式为,趁热过滤的目的是,反应结束时再加入1 mL 3mol/L H2SO4的作用是,
在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是
3.(NH4)2SO4·FeSO4·6HO的制备
【操作】称取一定量的(NH4)2SO4并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。
放置冷却,得到硫酸亚铁铵的晶体。
抽滤后,用无水乙醇洗涤晶体,除去其表面的水分,观察生成的硫酸亚铁铵的颜色和状态。
称量为m2g。
【问题】制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,根据是,硫酸亚铁铵,商品名称为摩尔盐,其化学式为,色晶体是一种复盐。
溶于水,溶于酒精。
(NH4)2SO4和硫酸亚铁溶液混合,加热浓缩即可制得硫酸亚铁铵,其主要原理是
硫酸亚铁铵的产率为。
【对位专练】按照下列方案进行“由废铝(只含杂质铁)制备硫酸铝晶体”的实验:步骤1:取ag含铁废铝(含杂质铁b%),加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥,得固体物质Cg。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、___________、__________等玻璃仪器。
⑵步骤1发生反应的离子方程式为。
⑶当步骤2中的溶液调整到pH=8~9,其主要目的是。
(4)该实验中Al2(SO4)3的产率为。
(只要求列出计算式,不必化简)
参考答案
【对位专练】
(1)普通漏斗(1分)烧杯
(2) 2Al+2OH-+2H2O= 2Al3++3H2
(3)使Al(OH)3沉淀完全
(4) 54c / 342a(1-b%)。