无机化学期中试题
- 格式:doc
- 大小:78.00 KB
- 文档页数:4

无机化学期中试题答案广州市生物医药高级职业技术学校无机化学期中考试试卷-A学校:班别:学号:姓名:评分:注意事项(考试时间:90分钟)1、请首先按要求在试卷的标封处填写您的姓名、考号和所在单位的名称。
2、请仔细阅读各题目的回答要求,在规定的位置填写您的答案。
3、不要在试卷上乱写乱画,不要在标封区填写无关内容。
一、填空。
(每空2分,共10分)1.主量子数n=2,则l=0,1 ;m=0,-1,+1。
2. 等性sp2、sp3杂化轨道的夹角分别为120°,109。
28,。
3.分子间力包括取向力、诱导力、色散力。
三、判断题。
(请将答案填入下面表格,每小题1分,共10分)四、完成下列各题。
(每题10分,共20分)1.写出下列原子在基态时的电子排布。
(每小题3分,共6分)(1). Mn: 1s22s22p63s23p63d54s2;(2). Cu:1s22s22p63s23p63d104s1;2. 判断半径大小。
(每小题2分,共4分)(1)Fe2+与Fe3+Fe2+>Fe3+同一元素离子,正电荷越高则半径越小。
(2)O、S、As As > S > O3.计算下列中心原子的价层电子对数,并判断下列分子的分子构型以及有无极性。
(每小题5分,共10分) 1. CO 2价层电子对数=(4+0)/2=2;直线型;无极性 2.NH 3价层电子对数=(5+1*3)/2=4;三角锥体;有极性五、计算题。
(每题10分,共30分)1.已知某原子的电子分布是1s22s 2 2p 63s 2 3p 64s 2(1)这元素的原子序数是多少?并写出该原子的轨道分布图(3分)(2)这元素属第几周期?第几族?是主族元素还是过渡元素?(3分)(3)请写出这个原子的价电子排布式。
(4分)解:(1)20(2)第四周期,IIA ;主族元素.(3)4s 22.在给定的条件下,氮气和氢气在密闭容器中合成氨,已知,反应之前氮气和氢气的浓度为1.0mol/l,3.0mol/l ;反应4s 后,测得氮气、氢气和氨各自的浓度为0.8mol/l ,2.4mol/l ,0.4mol/l ,求该反应的平均速率。

无机化学期中考试参考答案一、单项选择题(共15分)二、真空题(每空1分,共20分)16. 阳离子电荷与其半径之比,阳离子的极化能力, BeCl 2 > CaCl 2 > HgCl 2,BaCO 3 > SrCO 3 > CaCO 3 > MgCO 3 > BeCO 317. <18. [Fe(CN)5CO]3-; [PtCl 2(OH)2(NH 3)2]; [CrBr 2(H 2O)4]Br ·2H 2O19. 62g t 0g e ; 32g t 2g e20.PF 3<PCl 3<PBr 3<PI 321.(σ 1s )2 (σ *1s )2 (σ 2s )2 (σ *2s )2 (π 2py )2 (π 2pz )2 (σ 2px )2 3 反磁性 CO (N 2) 22.重铬酸根有氧化性,氨离子有还原性23. 阴离子半径较大时,其盐的溶解度常随阳离子的半径增大而减小 24. 6:6, 8:8, 4:4 三、简答题25. 酸性顺序: HClO <HClO 3<HClO 4。
氧化性顺序: HClO >HClO 3>HClO 4。
原因:①三分子中非羟氧依次增多,诱导效应增大;②酸根结构的影响。
酸根结构的稳定性依次增强,ClO 4-是四面体结构,最为稳定。
26.27.四、计算题与判断(共30分)28. 解:① 因 Cu + + e - == Cu φ(Cu + /Cu)= 0.521VΔr G = - n F φ F = 96.5 kJ·V -1·mol -1 G 终 — r G 始 = - n F φ G = n F φ + G = 1×96.5×0.521 = 50.28 kJ·mol -1 ② 因Cu 的G 最低,所以最稳定;③ 因CuO + 的G 最高,所以氧化性最强;④ 因Cu + 位于Cu 和Cu 2+ 连线的上方,所以Cu + 会发生歧化反应2Cu + == Cu + Cu 2+29.30.ϕ([Co(CN)6]3-/[Co(CN)6]4-) =ϕ(Co 3+/Co 2+) - 0.0591 lg)])Co(CN ([)])Co(CN ([466−稳稳K K= 1.808 - 0.0591 lg 1964100.1100.1⨯⨯= -0.852 V按 ϕ值,H 2O 可氧化[Co(CN)6]4-2[Co(CN)6]4- + 2H 2O 2[Co(CN)6]3- + 2OH − + H 2↑lg K = 0591.0)]852.0(829.0[2−−−= 0.778 K = 6.0所以[Co(CN)6]4-在水溶液中不稳定。
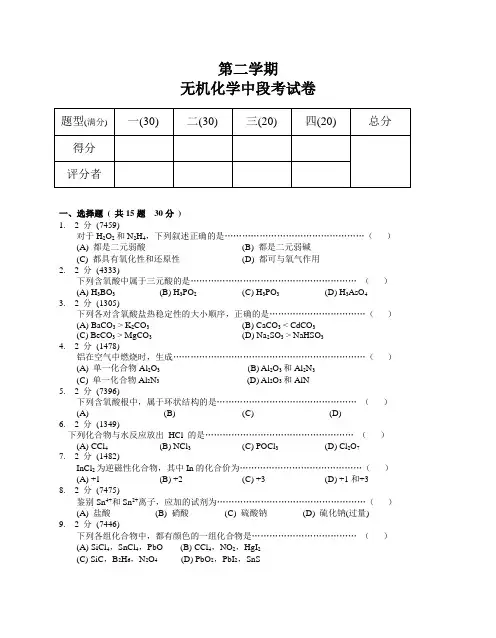
第二学期无机化学中段考试卷题型(满分)一(30)二(30)三(20)四(20)总分得分评分者一、选择题( 共15题30分)1. 2 分(7459)对于H2O2和N2H4,下列叙述正确的是…………………………………………()(A) 都是二元弱酸(B) 都是二元弱碱(C) 都具有氧化性和还原性(D) 都可与氧气作用2. 2 分(4333)下列含氧酸中属于三元酸的是…………………………………………………()(A) H3BO3(B) H3PO2(C) H3PO3(D) H3AsO43. 2 分(1305)下列各对含氧酸盐热稳定性的大小顺序,正确的是……………………………()(A) BaCO3 > K2CO3(B) CaCO3 < CdCO3(C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO34. 2 分(1478)铝在空气中燃烧时,生成…………………………………………………………()(A) 单一化合物Al2O3(B) Al2O3和Al2N3(C) 单一化合物Al2N3(D) Al2O3和AlN5. 2 分(7396)下列含氧酸根中,属于环状结构的是…………………………………………()(A) (B) (C) (D)6. 2 分(1349)下列化合物与水反应放出HCl 的是……………………………………………()(A) CCl4(B) NCl3(C) POCl3(D) Cl2O77. 2 分(1482)InCl2为逆磁性化合物,其中In的化合价为……………………………………()(A) +1 (B) +2 (C) +3 (D) +1和+38. 2 分(7475)鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)9. 2 分(7446)下列各组化合物中,都有颜色的一组化合物是………………………………()(A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2(C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF(C) Na2SiO3,Na2SiF6(D) SiO2,HF11. 2 分(1421)将NCl3通入碱性溶液,其水解产物是…………………………………………()(A) NH3和ClO-(B) NH3和Cl-(C)和Cl-(D)和Cl-12. 2 分(4348)PCl3和水反应的产物是…………………………………………………………()(A) POCl3和HCl (B) H3PO3和HCl(C) H3PO4和HCl (D) PH3和HClO13. 2 分(7463)下列各对物质,水解能力对比,正确的是………………………………………()(A)>(B)>(C) SnCl2 > SnCl4(D) PCl3 > BiCl314. 2 分(4361)二氧化氮溶解在NaOH溶液中可得到:(A) NaNO2和H2O (B) NaNO2,O2和H2O(C) NaNO3,N2O5和H2O (D) NaNO3,NaNO2和H2O15. 2 分(1460)下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S3二、填空题( 共12题30分)16. 5 分(7452)N2O3很容易分解为和。

杭州师范大学化材学院2014-2015学年一学期无机化学期中考试试卷(B卷)班级:___________学号:___________姓名:___________得分:___________题目部分,(卷面共有51题,100.0分,各大题标有题量和总分)一、是非题(16小题,共16.0分)(1分)[1]p原子轨道的角度分布图是两个外切的等径圆,图中的正、负号代表电荷符号。
()(1分)[2] 原子的s轨道角度分布图是球形对称的。
()(1分)[3] 电子在原子核外运动的能级越高,它与原子核的距离就越远。
因为E (1s) < E (2s),所以任何时候1s电子比2s电子靠近原子核。
( )(1分)[4] 在周期系第三周期中,Si、P、S、Cl 的原子半径依次减小。
因此,Si4-、P3-、S2-、Cl-的离子半径也依次减小。
( )(1分)[5] 在CS2、C2H2分子中,均有σ键和π键。
( )(1分)[6] 某原子所形成共价键的数目,等于该原子基态时未成对电子的数目。
( )(1分)[7] 相同原子间双键的键能等于单键键能的两倍,叁键键能等于单键键能的三倍。
( )(1分)[8] 烷烃分子中C - C 键的键长是炔烃分子中C≡C 键长的三倍。
( )(1分)[9] 原子轨道发生杂化后可以增强成键能力。
( )(1分)[10]SnCl2分子和H2O 分子的空间构型均为V 型,表明它们的中心原子采取相同方式的杂化轨道成键。
( )(1分)[11] 含有奇数电子的分子是顺磁性分子。
( )(1分)[12] 由分子轨道理论可推知O2、O2-、O22-键能的大小顺序为O2 > O2- > O22-。
( )(1分)[13] 分子中的共价键有极性,分子不一定是极性分子。
( ) (1分)[14]H2的极化率比He 的小。
( )(1分)[15] 对由非极性分子组成的物质来说,其沸点越高,则极化率越大。
( )(1分)[16] 晶格能是由指定单质生成一摩尔(按化学式计)的离子化合物所释放的能量。

最新精选全文完整版(可编辑修改)常熟理工学院2011~2012学年第一学期《无机及分析化学》期中考试试卷试题总分: 100 分 考试时限:120 分钟一、选择题(每空11. 已知K a (HAc) = 1.8⨯10-5,K a (HCN) = 6.17⨯10-10,K b (NH 3) = 1.8⨯10-5 浓度相同的 NaCl ,NH 4Ac ,NaAc 和NaCN 水溶液,按它们的c (H +)从大到小排列的顺序为:……..........................................................................( )A. NaCl>NaAc>NH 4Ac>NaCN ;B. NaAc>NaCl ≈ NH 4Ac>NaCN ;C. NaCl≈NH 4Ac>NaAc>NaCN ;D. NaCN>NaAc>NaCl ≈ NH 4Ac 。
2. 下列各各实验数据中,有效数字为四位的是……………………………………..……….…………………….( )A. c (H +) = 0.0205;B. pH = 10.42;C. w (CaCO 3) =92.12%;D. p K a =11.80。
3. 0.01mol.L -1某一元弱酸能被准确滴定的条件是…………....……………………................................................( )A. K a θ≥10-6;B. K a θ≥10-8;C. K b θ≥10-6;D. K b θ≥10-8。
4. 使人体血液pH 值维持在7.35左右的主要缓冲系统是………………………………...……………………….…( )A. NaAc + HAc[K a (HAc) =1.8⨯10-5];B. NaHCO 3+H 2CO 3[K a1(H 2CO 3) = 4.3⨯10-7];C. Na 2CO 3+NaHCO 3[K a2(H 2CO 3)=5.6⨯10-11];D.NH 4C1+NH 3⋅H 2O[K b (NH 3⋅H 2O)=1.77⨯10-5]。

中专二年级期中无机化学试题班级_____________ 姓名_____________将选择题答案填入下列表格:一﹑选择题(每题 3 分,共45 分)1.氧化还原反应的本质是()A.化合价的升降B.电子的转移C.与化合价无关D.与得失电子无关2.氧化还原反应的判断标准是()A. 电子的转移B. 与化合价无关C. 化合价的升降D.与得失电子无关3.关于氧化还原反应中得失电子的说法正确的是()A.得电子过程发生时,无失电子过程B.得失电子同时发生C. 失电子过程发生时,无得电子过程D.不发生得失电子4.下列物质中能做氧化剂的是()A. FeB.AlC.H+D.Cu5.下列物质中能做还原剂的是()A.Fe2+B.Fe3+C.H+D.Al3+6.关于原电池的说法正确的是()A.原电池是将化学能转化为电能的装置B. 原电池是将电能转化为化学能的装置C. 原电池是将热能转化为电能的装置D. 原电池是将生物能能转化为电能的装置7.下列关于氧化还原反应和原电池的说法错误的是()A.从理论上讲,凡是氧化还原反应都有可能组成原电池 B.电对相同的两个半电池,不能发生氧化还原反应,也不能组成原电池 C 只要原电池的两极的电极电势不相等,就能产生电动势..D.在一个原电池中,总是电极电势高的电对作正极8.关于Cu-Zn 原电池的下列说法中错误的是()A.盐桥中的电解质可保持两个半电池中的电荷平衡B.盐桥用于维系氧化还原反应的进行C.盐桥中的电解质不能参与电池反应D. 电子通过盐桥流动9.不属于金属的防护的是()A.加保护层B.制成耐腐蚀的合金C.电化学保护D.焊接10.同位素的定义为()A.质子数相同而中子数不同的一类原子称为同位素B. 质子数相同而中子数相同的一类原子称为同位素C. 质子数不同而中子数不同的一类原子称为同位素D. 质子数不同而中子相同的一类原子称为同位素11.主量子数有几个取值()A.4B.5C.6D.712.对于核外电子运动状态的描述中,m 表示哪个量子数()A.主量子数B.角量子数C.磁量子数D.自旋量子数13.电子的自选状态有几种()A.1B.2C.3D.414.下列哪个键不属于化学键()A.色散力B.金属键C.离子键D.共价键15.不属于范德华力的是()A.取向力B.色散力C.诱导力D.氢键二、填空题(每空 1 分,共25 分)1 2 3 4 5 6 7 8 9 10 11 12 13 14 151.在氧化还原反应中,得电子的物质叫_________,它的反应产物是________;失电子的物质叫__________ ,它的反应产物是____________。


无机化学期中考试参考答案及评分标准一、选择题(27分,每小题3分)C D B A A C B B B二、填空题 (多空题每空1分,单空题每空2分,共30分 )10、(6分,每空1分)(-) Zn│Zn 2+(C θ)‖H +(C θ)│H 2(P θ)│Pt(+)正极反应:2H + + 2e - = H 2 负极反应:Zn - 2e - = Zn 2+电池反应:Zn +2H + = Zn 2+ + H 2E θMF =0-(-0.763)=+0.763(V)平衡常数:lgK θ = 0.763 ⨯ 2 / 0.0591 = 25.82K θ= 6.62 ⨯ 102511、(2分)0.1412、(4分,每空1分) NH 2- ;NH 3 ;(CH 3)2NH 2+ ;C 6H 5NH 3+13、(2分)PH=6.3914、(2分,)(4)<(3)<(2)<(1)15、(2分)K θSP ={Ca 2+}3[ PO 43-]2 ;S =16、(2分)(4)>(1)>(2)>(3)17、(6分)每空1分) -1 -3 +2 , -0.5mol ,-1.5mol, -1mol18、(4分)每空1分)减小,减小,正向,增大三、计算题(共四题,43分)19 、(8分)解:Ac -+ H 2O = HAc + OH -10514θa θw θb 105.6101.8101.0(HAc)K K )(Ac K ----⨯=⨯⨯== (4分) ∵500K c a0≥θ,∴可用最简式。
1610o θb OH L mol 107.50.100105.6c K c ----⋅⨯=⨯⨯=⋅=pH=14-pOH=14-lg7.5⨯10-6=8.88 (4分)20、(8分)解: (CuI)K 1lg 10.0592)/Cu (Cu E /CuI)(Cu E θsp 2θ2θ+=+++ =0.159+0.0592lg 12101.271-⨯=0.742(V)21、(13分) 解:(1) CaCO 3(s) = CaO (s) + CO 2 (g)13θm f 2θm f θm f θm r mol kJ 178.3)1206.9(] ) 393.5(635.1[s),(CaCO H Δg)],(CO H Δs)(CaO,H [Δ(298.15K)H Δ-⋅=---+-=-+=113θm 2θm θm θm r K m ol 160.4J 92.9213.6][39.7s),(CaCO S g)],(CO S s)(CaO,[S (298.15K)S --⋅⋅=-+=-+=Δ)15.298()15.298()15.298(K m rS T K m rH K m rG θθθ∆-∆=∆=178.3-298.15⨯160.4⨯10-3=130.5kJ ·mol -1 (6分) ∵)K 15.298(m rG θ∆<0,所以在常温下该反应不能自发进行。

无机化学期中测试题一.选择题(以下四个选项只有一个是正确的,请选出正确答案,每小题2分,共20分)1.根据元素的核电荷数,不能..确定的是 ( ) A .原子核内质子数 B .原子核中子数C .核外的价电子数D .原子的电子数2.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为( )A .57B .47C .61D .2933.下列关于188O 的叙述中,错误的是A .质子数为8B .中子数为8C .电子数为8D .质量数为184. 下列属于同位素的一组是 ( )A .O 2、O 3B .Na 2O 、Na 2O 2C .1940K 、2040CaD .氕、氘、氚5.下列物质中, 不存在化学键的是( )A .水B .食盐C .氯气D . 氦气6.下列物质中, 既含离子键、又含共价键的是A .NaOHB .Na 2OC .NH 4ClD .CaCl 27.根据元素在周期表中的位置判断,下列元素中原子半径最小的是A .氧B .氟C .碳D . 氮8.下列物质中,含有离子键的是A .N2B .CO2C .NaOHD .CH49.提出元素周期律并绘制了第一个元素周期表的科学家是A.戴维B.阿伏加德罗C.门捷列夫 D.道尔顿10.下列的氢氧化物中,碱性最强..的是 ( ) A. LiOH B. NaOH C. KOH D.RbOH二.填空题(25×2分,共50分)1.核电荷数=________________=__________________2. 质量数=______________+_______________3. 原子是由____________和______________构成的。
4 .能量低的电子通常在离核_______(填远或者近)的区域运动,能量高的电子通常在离核_______(填远或者近)的区域运动5 .不同元素的核电荷数不同,把元素按核电荷数由小到大的顺序排列起来所编的序号叫做该元素的_ _ _ _ _6. 含有配位键的一个典型例子是_ _ _ _ _ _,举两个含有氢键的分子的例子_ _ _ _ _和_ _ _ _ _ _。

西北民族大学 化工 学院期中考试无机化学I 试卷(A 卷)专业: 课程代码: 2000B002学号: 姓 名:并将其代码填入题干后的括号内。
每小题2分,共20分)1.在25 ℃,101.3kPa 时,下面几种气体的混合气体中分压最大的是:( )A. 0.1 g H 2B. 1.0 g HeC. 5.0 g N 2D. 10g CO 22.由NH 4NO 2分解得氮气和水。
在23 ℃,95549.5 Pa 条件下,用排水取气法收集到57.5 cm 3氮气。
已知水的饱和蒸汽压为2813.1 Pa ,则干燥后氮气的体积为( )A .55.8 cm 3B .27.9 cm 3C .46.5 cm 3D .18.6 cm 33.已知下列反应及其标准平衡常数C (S) + H 2O (g) CO (g) + H 2(g) K ө1CO (g) + H 2O (g) CO 2(g) + H 2(g) K ө2C (S) + 2H 2O (g) CO 2(g) + 2H 2(g) K ө3C (S) + CO 2(g) 2CO (g) K ө4试确定下列关系式中错误的是( )A .K ө3=K ө1·K ө2B .K ө4=K ө1/K ө2C .K ө1=K ө3/K ө2D .K ө2=K ө3/K ө44.下列符号不表示状态函数的是( )A .GB .QC .SD .H5.有一吸热反应,如升高反应温度,则有利于( )的进行。
A .正反应B .逆反应C .无法判断D .正、逆反应情况相同。
6. 定压和不做非体积功的过程中,封闭系统从环境所吸收的热等于系统( )的增加。
A .热力学能B .焓C .吉布斯自由能D .熵7.将PH=8.00与PH=10.00的NaOH 溶液等体积混合,则混合溶液的PH 为( )A .9.00B .8.00C .9.70D .10.008.下列各种盐在水溶液中水解生成沉淀的是()A.NH4Cl B.SnCl2C.NaAc D.Na2CO39.固体氨的摩尔熔化焓变Δfus Hөm = 5.65 kJ·mol-1,摩尔熔化熵变Δfus Sөm = 28.9 J·mol-1·K-1。

无机化学第二学期期终考试试卷(C)(安徽师范大学试卷)一、选择题(24分,每小题2分)1、钠在空气中燃烧时,主要产物是A、Na2OB、Na2O2C、NaO2D、NaO32、下列叙述中错误的是A、碳族元素从上到下随着原子序数的增加,非金属性依此增强,而金属性依此递减B、具有相同电子数和原子数(不包括H、He、Li原子数)的分子或离子称为等电子体C、碳族元素的电负性,从上到下随着原子序数的增加而减小D、在锗、锡、铅中,随着原子序数的增加,稳定的氧化数由+4变为+2,其原因是ns2逐渐变成了惰性电子对3、金属离子氧化态都发生变化的一组是(1)、(NH4)2S + Fe (2)、Cu2SO4+ H2O(3)、Cr3+ + H2O2(4)、Cu2+ + CN-(5)、Hg22+ + NH3 H2OA、(1)(2)(4)(5)B、(1)(2)(3)(5)C、(1)(2)(3)(4)D、(2)(3)(4)(5)4、下列各物质中,热稳定性顺序正确的是A、NaHCO3<Na2CO3<BaCO3B、Na2CO3<NaHCO3<BaCO3C、BaCO3<NaHCO3<Na2CO3D、NaHCO3<BaCO3<Na2CO35、溶于NH3H2O中生成配合物的是A、Cd(OH)2B、Pb(OH)2C、Fe(OH)3D、Ag2S6、稀硝酸与锌反应,除生成Zn(NO3)2外,还可能有A、NOB、N2OC、NH4+D、以上产物都可能存在7、下列方程式中与实验事实相符合的是A、MgCl26H2O = MgCl2 + 6H2OB、P bS + 4H2O2 = PbSO4 + 4H2OC、C uSO4 + 2HI = CuI + H2SO4D、Hg2Cl2 + 2NH3 + H2O = Hg2O + 2NH4Cl8、联氨是一种A、二元弱碱B、一元中强碱C、两性物质D、一元弱碱9、下列氢氧化物中是两性化合物的有A、Ni(OH)2B、Cr(OH)3C、Co(OH)2D、Mn(OH)210、在含有I-的溶液中通入Cl2,产物可能是A、I2和Cl-B、IO3-和Cl-C、ICl2-D、以上产物均可能11、加稀HCl到含有Al3+、Ba2+、Hg22+、Cu2+、Ag+、Na+等离子溶液中,能产生沉淀的是A、只有Ag+B、Ba2+和Cu2+C、Ag+和Hg22+D、Al3+和Ag+12、单质硼晶体的基本结构单元是A、B6正八面体B、B4正四面体C、B8立方体D、B12正二十面体二、多项选择题(12分,每小题2分,多答或少答均不得分)1、氮族元素中不能形成(或极不稳定)五氯化物的元素是A、NB、AsC、SbD、Bi2、下列叙述中错误的是A、铋原子中的6S电子对,由于其钻穿作用较大,能级比6P显著地低,成为不易成键的“惰性电子对”B、N2和NH3都具有孤电子对,都属于路易斯酸C、对同一元素来说,氧化数高的氧化物及其水化物比氧化数低的酸性强D、在稀溶液中,亚硝酸根的氧化性比硝酸根的弱3、下列酸都是一元酸的是A、H3PO2、H3BO3B、H3BO3、H3PO3C、H3PO2、H3SbO4D、H3SbO3、H3PO34、在标准状态下,含氧酸氧化性的大小顺序正确的是A、HNO3>HNO2B、HClO3>HBrO3C、HClO>HClO4D、HClO4>H2SO45、下列氧化物和浓盐酸反应有氯气放出的是A、Co2O3B、Cu2OC、MnO2D、TiO26、镧系收缩的结果使得很难分离的元素对是A、Zr、HfB、Rh、IrC、Pd、PtD、Nb、Ta三、填空题(20分)1、辰砂、重晶石、钾长石、熟石膏的分子式分别为_____________,________________,_______________,_________________。
《无机化学》期中试卷-参考答案一.简答题:(40分)1. 下列四种水溶液(1)0.2 mol·dm --3KCl ;(2)0.1 mol·dm -3C 12H 22O 11;(3)0.25 mol·dm -3NH 3;(4)0.04 mol·dm -3BaCl 2 按凝固点由高到低应该如何排列?答:(2)(4)(3)(1)分子或离子(质点)浓度越大,凝固点越低2.下列两个反应在298K 和标准态时均为非自发反应,哪一个在高温时仍为非自发反应?(1) HgO (s) === Hg (l) +21O 2 (g) (2) 2 N 2 (g) + O 2 (g) === 2 N 2O (g)答:反应 (2) 在高温时仍为非自发反应,因为该反应为熵减反应。
3.试举例说明在什么情况下θr m H ∆、θf m H ∆ 和θc m H ∆的数值相等。
答:符号θf m H ∆ 表示的是某温度下,由处于标准状态的各种元素的指定单质生成标准状态的1mol 某纯物质时的热效应。
符号θc m H ∆表示的是在100 kPa 的压强下1mol 物质完全燃烧时的热效应。
完全燃烧在热力学上有严格的规定,碳的燃烧产物为CO 2 (g),氢的燃烧产物是H 2O (l),氮、硫、氯的燃烧产物分别为N 2 (g),SO 2 (g) 和HCl (aq)。
如:1mol H 2(g)完全燃烧反应H 2 (g) +21O 2 (g) === H 2O (l) 的θr m H ∆、θf m H ∆ 和θc m H ∆在数值上相等,即该反应的焓变等于H 2 (g)的标准摩尔燃烧焓,也等于H 2O (l)的标准摩尔生成焓,即2θc m ,H (g)H ∆= 2θf m,H O (l)H ∆ = θr m H ∆注意:如果上述反应的产物是H 2O (g),则2θc m ,H (g)H ∆≠2θfm,H O (l)H ∆ 因为H 2 (g) 完全燃烧的产物应是液态H 2O ,而不是气态H 2O 。
西北民族大学 化工 学院期中考试无机化学I 试卷(A 卷)专业: 课程代码: 2000B002 学号: 姓 名:一、单项选择题(在每小题的四个备选答案中,选出一个正确的答案,并将其代码填入题干后的括号内。
每小题2分,共20分)1.在25 ℃,101.3kPa 时,下面几种气体的混合气体中分压最大的是:( )A. 0.1 g H 2B. 1.0 g HeC. 5.0 g N 2D. 10g CO 2 2.由NH 4NO 2分解得氮气和水。
在23 ℃,95549.5 Pa 条件下,用排水取气法收集到57.5 cm 3氮气。
已知水的饱和蒸汽压为2813.1 Pa ,则干燥后氮气的体积为( )A .55.8 cm 3B .27.9 cm 3C .46.5 cm 3D .18.6 cm 3 3.已知下列反应及其标准平衡常数C (S) + H 2O (g) CO (g) + H 2(g) K ө1 CO (g) + H 2O (g) CO 2(g) + H 2(g) K ө2 C (S) + 2H 2O (g) CO 2(g) + 2H 2(g) K ө3 C (S) + CO 2(g) 2CO (g) K ө4 试确定下列关系式中错误的是( ) A .K ө3=K ө1·K ө2 B .K ө4=K ө1/K ө2 C .K ө1=K ө3/K ө2D .K ө2=K ө3/K ө4 4.下列符号不表示状态函数的是( ) A .G B .Q C .S D .H5.有一吸热反应,如升高反应温度,则有利于( )的进行。
A .正反应B .逆反应C .无法判断D .正、逆反应情况相同。
6.定压和不做非体积功的过程中,封闭系统从环境所吸收的热等于系统()的增加。
A.热力学能B.焓C.吉布斯自由能D.熵7.将PH=8.00与PH=10.00的NaOH溶液等体积混合,则混合溶液的PH为()A.9.00 B.8.00 C.9.70 D.10.008.下列各种盐在水溶液中水解生成沉淀的是()A.NH4Cl B.SnCl2C.NaAc D.Na2CO39.固体氨的摩尔熔化焓变Δfus Hөm = 5.65 kJ·mol-1,摩尔熔化熵变Δfus Sөm = 28.9 J·mol-1·K-1。
2015-2016-1《无机化学》期中考试参考答案与评分标准一、选择题(每小题2分)二、填空题(每空1分)1、<,>。
2、右;增加。
3、0级;2级。
三、是非题(每小题1分)1、错;2、对;3、错;4、对;5、错;6、对;7、错;8、对;9、错;四、问答题(每小题6分)1、解:该反应是气体分子数减少的放热反应,高压有利于反应向右移动,使CH3OH平衡时的含量提高。
(2分)温度升高不利于生成CH3OH,但是可以加快反应速率;加入催化剂也有利于提高反应速率。
应特别指出的是催化剂只有在适当高的温度下,才能具有催化活性和选择性。
因此催化反应的温度往往比较高。
(2分)氢气含量提高,有利于平衡向右移动,可提高CO的转化率。
(2分)2、解:p(反应物)或c(反应物)增大,k不变,v(正)增大,K不变,平衡向右移动;(2分)T升高,k增大,△r H<0,k(正)和k(逆)都增大,但k(逆)增大的倍数比k(正)增大的倍数大,K减小,平衡向左移动;(2分)加入催化剂,k(正)、k(逆)都增大,K不变,(k(正)、k(逆)增大倍数相同),平衡不移动。
(2分)五、计算题(每小题9分,共18分)1、解:C(s)+2S(s)→CS2(l)△r H=87.9kJ·mol-1△r S=(151.0-2×31.9-5.7)J·mol-1·K-1 = 81.5J·mol-1·K-1△r G=(87.9-298×10-3×81.5)kJ·mol-1 =63.6kJ·mol-1△f G(CS2,l)=△r G=63.6kJ·mol-1T≥()K=1.08×103K2、解:NiO(s)+CO(g)Ni(s)+CO2(g) 开始n/mol 2.0 x 0平衡n/mol x-2.0 2.0n(总) = x molK=θθC CO C CO ][][2=0.20.2-x 1.0 x =4.0 n (CO)=4.0mol△r G=-RT ln K=-8.314J·mol-1·K-1×10-3T ln1.0=0kJ·mol-1。
北华大学2015-2016学年第二学期无机化学期中考试卷1.氟与水猛烈反应,并伴随燃烧现象,其主要反应产物有( )A . HF 和O 2 B. HF 和FOH C. HF 、O 2和FOH D. HF 和O 32.实验室中制取少量HBr 所采用的方法是( ) A.红磷与Br 2混合后滴加H 2O 固体与浓H 2SO 4 C .红磷与H 2O 混合后滴加Br 2 在水中歧化反应3.下列含氧酸的氧化性递变不正确的是( )>H 2SO 4>H 3PO 4 >HClO 4>H 5IO 6 >HClO 3>HClO 4 >HClO 3>HIO 3 4.在热碱溶液中,Cl 2的歧化产物为( )-和ClO - -和ClO -2 -和ClO -3 -和ClO -45.卤素单质与磷反应能生成三卤化磷而不能生成五卤化磷的是( ) 2 C6.下列物质的水解产物中既有酸又有碱的是( )3C7.下列单质硫在常温下稳定性最大的是( )A.斜方硫B.单斜硫C.弹性硫D.无定形硫8.分子结构和中心原子杂化类型都与O3相同是()2C9.为使已变暗的古油画恢复原来的白色,使用的方法是()A.用SO2漂白B.用稀H2O2溶液擦洗 C.用氯水擦洗 D.用O3漂白10.与Zn粉反应可生成Na2S2O4的试剂是()3C11.与FeSO4和浓硫酸发生棕色环反应的是()2C和S22-反应的产物是( )和S 和S13. 在磷酸二氢钠溶液中加入硝酸银溶液,以下叙述正确的是( )A. 析出白色AgH2PO4B. 析出黄色Ag2HPO4沉淀C. 析出黄色Ag3PO4沉淀 D. 不析出沉淀14.黄磷与KOH溶液共热,反应产物为( )和K3P 和3C和K3P 和PH315.与Na2CO3溶液反应生成碱式盐沉淀的离子是()++++发生水解反应的产物是( )(g) (s) (s)17.在硼酸中加入下列何种物质,可以提高其酸性( )4 C D .多羟基醇18.下列几种碳酸盐中,热稳定性最高的是 ( )3 C19.下列氢化物的酸性从小到大的顺序是( ) >H 2S >HF >H 2O >HF >H 2S >H 2O >HCl >HBr >HI >HF >HBr >HI20.检验某溶液是否含有S 2O 32-的方法为( )A.加稀盐酸溶液变浑浊 B .加稀盐酸溶液变浑浊且有刺激性气味的气体生成C.该溶液能使AgBr 沉淀溶解D.加入AgNO 3至生成白色沉淀二、填空题(每空1分,共20分)HCl 时,是充分考虑了HCl 的(弱还原)性,(易溶于水)性和(易挥发)性。
⼀学期⽆机化学期中考试试卷(A卷)杭州师范⼤学化材学院2014-2015学年⼀学期⽆机化学期中考试试卷(B卷)班级:___________学号:___________姓名:___________得分:___________题⽬部分,(卷⾯共有51题,100.0分,各⼤题标有题量和总分)⼀、是⾮题(16⼩题,共16.0分)(1分)[1]p原⼦轨道的⾓度分布图是两个外切的等径圆,图中的正、负号代表电荷符号。
()(1分)[2] 原⼦的s轨道⾓度分布图是球形对称的。
()(1分)[3] 电⼦在原⼦核外运动的能级越⾼,它与原⼦核的距离就越远。
因为E (1s) < E (2s),所以任何时候1s电⼦⽐2s电⼦靠近原⼦核。
( )(1分)[4] 在周期系第三周期中,Si、P、S、Cl 的原⼦半径依次减⼩。
因此,Si4-、P3-、S2-、Cl-的离⼦半径也依次减⼩。
( ) (1分)[5] 在CS2、C2H2分⼦中,均有σ键和π键。
( )(1分)[6] 某原⼦所形成共价键的数⽬,等于该原⼦基态时未成对电⼦的数⽬。
( )(1分)[7] 相同原⼦间双键的键能等于单键键能的两倍,叁键键能等于单键键能的三倍。
( )(1分)[8] 烷烃分⼦中C - C 键的键长是炔烃分⼦中C≡C 键长的三倍。
( )(1分)[9] 原⼦轨道发⽣杂化后可以增强成键能⼒。
( )(1分)[10]SnCl2分⼦和H2O 分⼦的空间构型均为V 型,表明它们的中⼼原⼦采取相同⽅式的杂化轨道成键。
( )(1分)[11] 含有奇数电⼦的分⼦是顺磁性分⼦。
( )(1分)[12] 由分⼦轨道理论可推知O2、O2-、O22-键能的⼤⼩顺序为O2 > O2- > O22-。
( )(1分)[13] 分⼦中的共价键有极性,分⼦不⼀定是极性分⼦。
( ) (1分)[14]H2的极化率⽐He 的⼩。
( )(1分)[15] 对由⾮极性分⼦组成的物质来说,其沸点越⾼,则极化率越⼤。
一、判断对错(10分)( )1. 元 素 的 电 负 性 是 指 原 子 在 分 子 中 吸 引 电 子 的能 力。
某 元 素 的 电 负 性 越 大, 表 明 其 原 子 在 分 子 中 吸 引 电 子 的 能 力 越 强。
( )2. 由 弱 碱 及 其 盐 组 成 的 缓 冲 溶 液, 当 二 者 浓 度 相等 并 且 浓 度 越 大 时, 缓 冲 能 力 越 强。
( )3. 某 元 素 的 原 子 处 在 基 态 时, 3d 亚 层 有 2 个 电 子, 该 元 素 的 原 子 序 数 为 22。
( ) 4. 根 据 酸 碱 电 子 理 论, 提 供 电 子 对 的 分 子 或 离 子 是 酸, 接 受 电 子 对 的 是 碱。
( )5. 氢 键 的 键 能 与 一 般 的 共 价 键 键 能 相 当。
( )6. [Al F 6]3- 的 空 间 构 型 为 八 面 体,Al 原 子 采 用 sp 3d 2 杂 化。
( )7. 杂 化 轨 道 与 原 子 轨 道 一 样 既 可 以 形 成 σ 键, 也 可 以 形 成 π 键。
( ) 8.在 一 定 温 度 下, 随 着 可 逆 反 应 2SO 2 (g) + O 2(g) 2SO 3 (g)的 进 行,p (O 2 )、p (SO 2 ) 不 断 减 少,p (SO 3 ) 不 断 增 大, 所 以 标 准 平 衡 常 数 K 不 断 增 大。
( )9.通 常 对 于 无 气 体 参 与 的 可 逆 反 应, 压 力 的 改 变多 半 不 会 使 平 衡 发 生 移 动。
( )10. 反 应 CaCO 3(s) CaO (s) + CO 2 (g), 当 p (CO 2 ) 减 少, 或 加 入CaCO 3 (s), 都 能 使 反 应 向 右 进 行。
选择题(44分)( )1. 某 弱 酸 HA 的 K a = 1.0⨯10-4 , 则 其 1mol ⋅L -1 水 溶 液 的 pH 值为 :A. 2.0 ;B. 3.0;C. 4.0;D. 6.0( )2. 用 0.01mol ⋅L -1 NaOH 标 准 溶 液 滴 定 0.1mol ⋅L -1 的 HA ( p K a ~4 ) 溶 液, 应 选 指 示 剂 为 :A . 甲 基 橙 ( 3.1 ~ 4.4 ); B. 中 性 红 (6.8 ~ 8.0 );C. 酚 酞 ( 8.0 ~ 10.0 );D. 百 里 酚 蓝 ( 9.4 ~ 10.6 )( )3. 以 H 2C 2O 4 ⋅ 2H 2O 作 基 准 物 质, 用 来 标 定 NaOH 溶 液的 浓 度。
但 因 保 存 不 当, 草 酸 失 去 部 分 结 晶 水, 问 用 此 草 酸 标 定 NaOH 溶 液 浓 度 的 结 果 是 :A. 偏 低;B. 偏 高;C. 无 影 响;D. 不 确 定( )4. 下 列 各 组 原 子 或 离 子 半 径 大 小 顺 序, 其 中 错误 的 是:(A ) Ca 2+ < K + < S 2-; (B) Na + > Mg 2+ > Al 3+; (C) Ne > N 3- > B r -;(D) N 3- > O 2- > F -。
( )5. 一 元 弱 酸 HA ( K a = 10-5 )在 pH = 5.0 的 水 溶 液 中 ,[ A - ] 这 种 形 式 所 占 的 百 分 比 是 :A. 10%;B. 25%;C. 50%;D. 80%答()( )6. 下 列 说 法 中正 确 的 是 : A . NaHCO 3 中 含 有 氢 , 故 其 水 溶 液 呈 酸 性;B. 浓 H OA c ( 17mol ⋅L -1 ) 的 酸 度 大 于 17mol ⋅L -1H 2SO 4 水 溶 液 的 酸 度; C. 浓 度( 单 位 : mol ⋅L -1 ) 相 等 的 一 元酸 和 一 元 碱 反 应 后, 其 溶液 呈 中 性;D. 当 [ H + ] 大 于[ OH -] 时, 溶 液 呈 酸 性。
( )7. 用 纯 水 把 下 列 溶 液 稀 释 10 倍 时, 其 中 pH 值 变化 最 大 的 是 :A . 0.1mol ⋅L -1H Cl ; B. 1mol ⋅L -1NH 3⋅H 2O;C. 0.1mol ⋅L -1 H OA c;D. 1mol ⋅L -1 HOA c+1mol ⋅L -1 NaOA c( )8. 平 衡 系 统:2Cl 2 (g) + 2H 2O (g) 4H Cl (g) + O 2 (g) 中, 保 持 温度 和 体 积 不 变, 通 入 惰 性 气 体, 则 HCl 的 量: (A) 增 加; (B) 不 变; (C) 减 小; (D) 不 能 确 定。
( )9. 在 一 定 温 度 下, 有 HCl , H 2SO 4 ,HOA c 及 NH 3 ⋅H 2O 四 种 溶液, 其 浓 度 都 为 0.1mol ⋅L -1 。
下 列 结 论 正 确 的 是 :A . HCl 和 H 2SO 4 溶 液 的 [ H + ] 相 等;B . 将 HA c 稀 释 一 倍, [ H + ] 减 半; C. 将 等 体 积 H Cl 和 NH 3⋅H 2O 溶 液 混 合 溶 液 呈 中 性; D. 四 种 溶 液 的 [ H + ][ OH - ] 乘 积 均 相 等( )10. 已 知 H 2SO 4 K a2 = 1.02⨯10-2 0。
0.010mol ⋅L -1 Na 2SO 4 溶 液 的 pH 值为 :A . 7.40;B. 7.15;C. 7.00;D. 7.30( )11. 下 列 各 组 分 子 中, 中 心 原 子 均 发 生 sp 杂 化, 分子 空 间 构 型 均 为 直 线 形 的 是:(A ) H 2S 、CO 2; (B) CS 2、SO 2;(C) H gCl 2、CS 2;(D) H 2O 、H gCl 2。
( )12. NCl 3 分 子 的 几 何 构 型 是 三 角 锥 形, 这 是 由 于 N原 子 采 用 的 轨 道 杂 化 方 式 是:(A ) sp ; (B ) 不 等 性 sp 3; (C) sp 2; (D) dsp 2。
( )13. 欲 配 制 pH =9 的 缓 冲 溶 液, 应 选 用 的 弱 酸 或 弱碱 和 它 们 的( 强 碱 或 强 酸 的 ) 的 盐 为:A. NH 2OH ( K b = 1⨯10-9);B. NH 3⋅H 2O(K b =1⨯10-5);C. HOA c (K a =1⨯10-5 );D. HCOOH ( K a =1⨯10-4 );( )14. 对 于 一 个 反 键 分 子 轨 道, 下 列 叙 述 中 正 确 的是:(A) 它 不 能 有 电 子 占 有;(B) 它 的 能 级 比 所 在 分 子 中 所 有 成 键 分 子 轨道 的 能 级 都 高;(C) 它 的 能 级 比 相 应 的 原 子 轨 道 能 级 高; (D) 有 电 子 进 入 反 键 轨 道 就 不 能 形 成 有 一 定稳 定 性 的 分 子。
( )15. 用 价 层 电 子 对 互 斥 理 论 推 测 CO 32- 的 几 何 形 为:(A) 平 面 三 角 形; (B) 三 角 锥 形; (C) “T ” 字 形; (D) “V ” 字 形。
( )16. NaOH 溶 液 保 存 不 当, 吸 收 了 空 气 中 CO 2 , 用 邻 苯二 甲 酸 氢 钾 为 基 准 物 标定 浓 度 后, 用 于 测 定 HOAc 。
测 定 结 果 :A. 偏 高;B. 偏 低;C. 无 影 响;D. 不 定( )17. 下 列 各 化 合 物 的 分 子 间, 氢 键 作 用 最 强 的 是:(A ) NH 3; (B ) H 2S ; (C) HCl ; (D) HF 。
( )18. 下 列 关 于 范 德 华 (van der W aal s) 力 的 叙 述 中, 错 误的 是:(A) 非 极 性 分 子 间 没 有 取 向 力; (B) 色 散 力 通 常 是 主 要 的;(C) 分 子 的 极 性 越 大, 取 向 力 越 大; (D) 极 性 分 子 间 没 有 色 散 力。
( )19. 将 含 有 0.10 mol ·L -1 HA c 、0.10 mol ·L -1 NaA c 溶 液 加 水 稀 释至 原 体 积 的 二 倍 时, 其 pH 值 的 变 化 为:(A ) 增 加 l g 2 倍; (B) 减 小 两 个2 倍; (C) 增 大 2 倍;(D) 基 本 不 变。
( )20. 下 列 化 合 物 中 仅 有 共 价 键 的 是:(A ) K 2SO 4; (B ) PCl 3; (C) A gF ; (D) SrCl 2。
( )21. 下 列 分 子 中 几 何 构 型 为 三 角 形 的 是:(A ) Cl F 3; (B ) BF 3; (C) NH 3; (D) PCl 3。
()22.在一个多电子原子中,具有下列各套量子数的电子,能量大的电子具有的量子数是:(A)3,2,+1,+12;(B) 2,1,+1,-12;(C) 3,1,0,-12;(D) 3,1,-1,+12。
二、填空(16分)1. 在Na2SO4晶体中有__________ 和__________ 离子,两者以_________ 键结合,在__________ 离子中有共价键。
2. 成键原子轨道重叠程度越大,所形成的共价键越________;两原子间形成共价键时,必定有一个________ 键。
3. C2的分子轨道排布式为________________________________,键级为____________,在磁场中呈________ 磁性,__________ 稳定存在。
4. H2O 分子间存在的作用力有__________________________________________________,其中以______________ 最强。
5. BBr3的中心原子的价层电子对数为____________,杂化方式为______________,孤对电子数为__________。
BBr3的几何构型为__________________。
6. 质子理论认为,H SO4-是___________ , 它给出质子后,剩下的SO42-对于质子是具有一定的亲和力,能接受质子,因而SO42-是一种____________。