胆汁酸测定试剂盒(循环酶法)标准化操作规程TBA-SOP
- 格式:docx
- 大小:29.22 KB
- 文档页数:5

总胆汁酸(TBA)试剂盒标准操作程序1.摘要本试剂盒供医疗机构用于体外定量测定人血清或血浆样本中总胆汁酸(TBA)的含量。
2.适用范围程序适用于日立7600自动生化分析仪检测血清或血浆样本中总胆汁酸(TBA)的含量。
3.职责使用日立7600自动生化分析仪进行测定直接胆红素浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法上海科华生物工程股份有限公司生产的总胆汁酸(TBA)试剂盒采用的是循环酶法。
5.原理血清中微量的胆汁酸(3α-羟甾醇)会被3α-羟甾醇脱氢酶(3α-HSD)及β-硫代烟酰胺腺嘌呤二核苷酸氧化型(Thio-NAD)特异性氧化生成3α-酮甾醇,同时Thio-NAD被还原成β-硫代烟酰胺腺嘌呤二核苷酸还原型(Thio-NADH)。
新生成的3α-酮甾醇在3α-HSD及β-烟酰胺腺嘌呤二核苷酸还化型(NADH)存在下,还原成胆汁酸,同时NADH氧化为β-烟酰胺腺嘌呤二核苷酸氧化型(NAD)。
这样,血清中微量的胆汁酸在多次酶循环的过程中被放大,同时可使生成的Thio-NADH扩增。
在405nm处测定Thio-NADH吸光度的变化值,可以求得血清中胆汁酸的含量。
胆汁酸THio−NAD3α−HSD→THio−NADHNAD←NADH3α−铜羟甾醇6.仪器日立7600自动生化分析仪7.试剂7.1试剂来源:上海科华生物工程股份有限公司提供7.2注册号:沪食药监械(准)字2011第2400009号7.3试剂瓶内主要成分:R1: -硫烟酰胺腺嘌呤二核苷酸氧化型(THio-NAD)、Good’s缓冲液;R2 :β-硫烟酰胺腺嘌呤二核苷酸还原型(NADH)、3α-羟甾醇脱氢酶(3α-HSD)、Good’s 缓冲液、叠氮钠7.4试剂稳定性:试剂于2℃-8℃避光保存,有效期为一年;开瓶后2-8℃避光保存,可稳定一个月8.标准品和质量控制8.1校准程序:使用某某公司的校准品对自动分析仪进行校准。

血清总胆汁酸测定(循环酶法)标准操作规程1 检验申请单独检验项目申请:血清总胆汁酸测定(缩写TBA);组合项目申请:血生化中肝功能测定加选本项目。
临床医生根据需要提出检验申请。
2 标本采集与处理2.1标本采集2.1.1常规静脉采血约2ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5下列标本为不合格标本2.1.5.1标本量不足:少于0.3ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2对反应吸光度有干扰的标本,包括严重溶血、严重浑浊的标本。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在30min内将标本离心分离出血清。
2.2.2标本保存时间:室温(15~25℃)下可稳定一周,在冰箱中(2~8℃)稳定一个月。
为避免标本中水分挥发使血清浓缩,对保存时间超过1天的标本均加塞密闭或覆盖湿巾。
2.2.3已完成测试的标本保持完整的识别号,置4~8℃冰箱内保存7天。
2.3标本采集的注意事项2.3.1采血前使受检者保持平静、松弛和空腹状态。
2.3.2不建议采集抗凝血标本,如果必须使用血浆,推荐的抗凝剂是肝素。
3 方法原理循环酶法。
胆汁酸被3a-羟基类固醇脱氢酶(3a-HSDH)及β-硫代烟酰胺腺嘌呤二核苷酸氧化型(Thio-NAD)氧化,生成3酮类固醇及β-硫代烟酰胺腺嘌呤二核苷酸还原型(Thio-NAD)。
生成的3酮类固醇在3a-羟基类固醇脱氢酶及β-烟酰胺腺嘌呤二核苷酸还原型(Thio-NAD)存在下,生成胆汁酸及β-烟酰胺腺嘌呤二核苷酸氧化型(Thio-NAD)。
如此进行循环反应,最后测定生成的β-硫代烟酰胺腺嘌呤二核苷酸还原型(Thio-NAD)的吸光度,求得胆汁酸浓度值。

胆汁酸测定试剂盒(循环酶法)标准化操作规程1 目的规范实验室操作,保证检验工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过的实验室检验人员。
3 适用范围本试剂适用于体外定量检测人血清或血浆中胆汁酸的含量。
4 检验方法本试剂盒采用循环酶法测定胆汁酸的含量。
5 检验原理本试剂采用酶分析法测定血清总胆汁酸。
3α-羟基类固醇脱氢酶特异性作用于3α-羟甾族化合物,使之转化为相应的酮类固醇,反应中thio-NAD被还原为thio-NADH。
通过在405nm波长处测定单位时间内吸光度的变化值,可以计算出样品中总胆汁酸的含量。
6 标本要求6.1 样本为空腹患者血清。
样本应及时离心分离,不得使用溶血或被污染的样本。
6.2 样本应避免微生物污染,在2℃~8℃可稳定数月。
7 试剂及配套品7.1试剂来源长春迪瑞医疗科技股份有限公司胆汁酸试剂盒(循环酶法)7.27.3试剂的稳定性与贮存:7.3.1 试剂在2℃~8℃条件下,干燥、避光、密封贮存,有效期为12个月。
7.3.2 试剂开封后在2℃~8℃条件下可稳定30天。
8 实验仪器及性能指标8.1 实验仪器迪瑞CS系列全自动生化分析仪8.2试剂性能指标8.2.1 试剂空白:试剂空白吸光度:A≤0.800。
试剂空白吸光度变化率:△A/min≤0.040。
8.2.2 分析灵敏度:测试1μmol/L被测物时,吸光度变化率(△A/min)>0.0002。
8.2.3 线性范围:1μmol/L~180μmol/L;线性相关系数r≥0.9900;[1,36]μmol/L区间内,线性绝对偏差应不超过±7.2µmol/L;(36,180]μmol/L区间内,相对偏差不超过±15%。
8.2.4 准确度:比对试验:r≥0.9900;[1,36]μmol/L区间内,绝对偏差不超过±7.2μmol/L,(36,180]μmol/L区间内,相对偏差不超过±15%。

1外观性状
1.1试剂盒各组分应齐全、完整、无液体渗漏;中文包装标签应清晰,准确、牢固;
1.2R1 组分应为澄清透明、无絮状物、无肉眼可见颗粒及沉淀的液体。
1.3R2 组分应为澄清透明、无絮状物、无肉眼可见颗粒及沉淀的液体。
2
试剂盒装量
试剂净含量应不小于标示值。
3准确度
与比对试剂盒做比对试验,两组结果的相关系数 r 应≥0.975,相对偏差应≤10%。
4灵敏度
测定TBA含量为50.0μmol/L的样品时,平均每分钟吸光度变化值(△A/min)≥0.08。
5试剂空白
在温度37℃、波长405nm条件下检测,试剂空白吸光度≤0.40(比色杯光径1.0cm);试剂空白吸光度变化率(△A/min)≤0.1(比色杯光径1.0cm)。
6线性范围
a)线性范围(0.5-150)μmol/L,相关系数 r 应≥0.990; b)(0.5~5.0)μmol/L范围内偏差绝对值不大于1.0μmol/L;(5.0以上
~150)μmol/L范围内线性偏差应≤15%。
7测量精密度
7.1重复性
CV%应≤5%。
7.2批间差
相对偏差(R)应≤8%。
8特异性
胆红素≤342μmol/L,甘油三酯≤5.6mmol/L,血红蛋白≤2.0g/L,维生素
C≤0.3g/L 对测定结果造成的干扰,偏倚在±15%内。
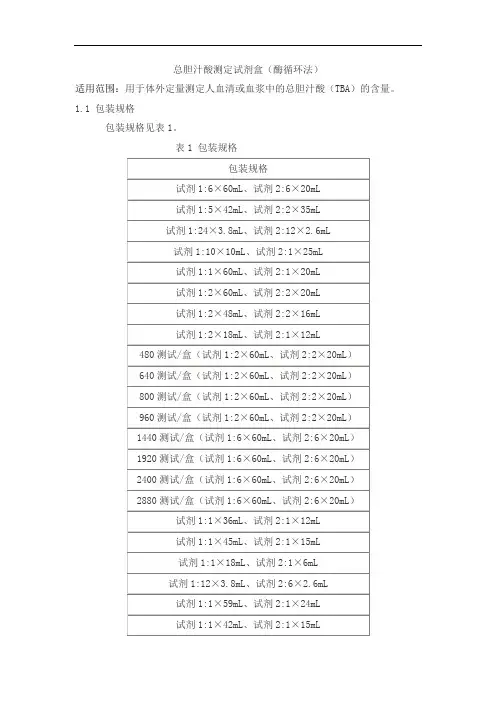
总胆汁酸测定试剂盒(酶循环法)适用范围:用于体外定量测定人血清或血浆中的总胆汁酸(TBA)的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品赋值有差异,具体赋值详见靶值单。
2. 性能指标2.1 外观试剂1为黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白2.3.1 试剂空白吸光度A405nm下测定空白吸光度应≤0.8000。
2.3.2 试剂空白吸光度A405nm下测定的空白吸光度变化率(ΔA/min)应≤0.0400。
2.4 准确度与已上市的产品进行比对试验:在[5,180]μmol/L区间内,相关系数r ≥0.975,在[5,40]μmol/L区间内测定的绝对偏差应不超过±6μmol/L,在(40,180]μmol/L区间内测定的相对偏差应不超过±15%。
2.5 分析灵敏度样本浓度为40μmol/L时,其吸光度变化在0.0200~0.0800之间。
2.6 线性区间在[5,180]μmol/L区间内,线性相关系数r≥0.99,在[5,20]μmol/L区间内测定的绝对偏差应不超过±2μmol/L,在(20,180]μmol/L区间内测定的相对偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性对高、低不同浓度的同一血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于5%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。

总胆汁酸测定试剂盒(酶循环法)适用范围:用于定量检测人血清中总胆汁酸(TBA)浓度。
1.1包装规格a) 试剂1:2×45ml,试剂2:2×15ml;b) 试剂1:4×45ml,试剂2:4×15ml;c) 试剂1:6×60ml,试剂2:2×60ml;d)试剂1:3×60ml,试剂2:3×20ml;e)试剂1:2×300ml,试剂2:2×100ml;f)试剂1:12×16.8ml,试剂2:12×5.6ml;g)试剂1:2×54ml,试剂2:2×18ml;h)试剂1:1×30ml,试剂2:1×10ml。
1.2试剂主要组成成分试剂1主要组成成分甘氨酸缓冲液25 mmol/Lβ-硫烟酰胺腺嘌呤二核苷氧化型(Thio-NAD) 1 mmol/L试剂2主要组成成分Tris缓冲液25 mmol/L烟酰胺腺嘌呤二核苷还原型(NADH)10 mmol/L3α-羟类固醇脱氢酶(3α-HSD)12500 U/L2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1 试剂空白吸光度测定试剂空白吸光度,应<0.5。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.04。
2.4 分析灵敏度测试150umol/L的被测物时,吸光度变化率(ΔA/min)应不低于0.02。
2.5 准确度回收率90%~110% 范围内。
2.6 精密度2.6.1批内精密度批内变异系数应不大于5%。
2.6.2批间精密度批间相对极差应不大于10%。
2.7 线性区间2.7.1在[2,180)umol/L区间内,线性回归的相关系数(r)应不低于0.990;2.7.2在(50,180)umol/L区间内,相对偏差不超过±15%;2.7.3在[2,50]umol/L区间内,绝对偏差不超过±5umol/L。

总胆汁酸(TBA)测定试剂盒
(酶循环法)
2.1外观和性状
外观和性状应符合表2要求。
表2 试剂盒内各组分的外观性状
2.2试剂空白
2.2.1试剂空白吸光度
试剂以蒸馏水为空白时,在波长 405nm,光径 1.0 cm,温度 37℃条件下,吸光度≤0.80。
2.2.2试剂空白吸光度变化率
试剂以蒸馏水为空白时,在波长 405nm,光径 1.0 cm,温度 37℃条件下,吸光度变化率≤0.02。
2.3分析灵敏度
试剂盒测试浓度为10 μmol/L被测物时,吸光度变化率≥0.005。
2.4线性范围
2.4.1试剂盒在2~180 μmol /L区间(范围)内,其回归系数r≥0.9900。
2.4.2相对偏差或绝对偏差应符合表 3 要求。
表3 相对偏差或绝对偏差
2.5精密度
2.5.1试剂盒批内精密度 CV 值应≤5.0%。
2.5.2试剂盒批间相对极差(R)应≤10.0%。
2.6准确度
相对偏差(Bias%)应在参考物质靶值±10%以内。
2.7液体装量
试剂盒不同规格的净含量应不少于其标示量。

试剂标准操作规程目录1.检测原理2.标本采集与处理2.1 受检者的准备2.2 静脉采血2.3 抗凝剂2.4 标本处理3. 试剂3.1 试剂3.2 校准血清3.3 试剂与校准血清的稳定性4. 仪器5. 操作6. 计算7. 操作性能7.1 精密度7.2 准确度7.3 灵敏度7.4 可报告范围7.5 特异性7.6 干扰8. 参考值9. 临床意义附录A: 参数1. 检测原理胆汁酸与3a-羟基类固醇脱氢酶(3a-HSDH)及氧化型b-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)发生反应,生成3-酮类固醇以及还原型b-硫代烟酰胺脲嘌呤二核苷酸(Thio-NADH)。
3-酮类固醇在3a-HSDH和Thio-NADH作用下,生成胆汁酸及Thio-NAD。
通过循环酶而使微量的胆汁酸量得到放大。
通过测定生成物Thio-NADH在405nm吸光度的变化,可测量样品中胆汁酸的浓度。
2.标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:血浆使用肝素或EDTANa2(1mg/mL)作为抗凝剂。
2.4 标本处理:血标本室温放置30min~45min后离心分离血清或血浆,置洁净试管加盖低温保存。
3.试剂3.1 试剂:威特曼生物科技(南京)有限公司TBA试剂盒,为液体双试剂,各组分如下:3.2:校准血清使用威特曼生物科技(南京)有限公司提供的校准血清或使用TBA的专用标准液。

目录目录 (1)第1章目的和范围 (2)1.1 目的 (2)1.2 适用范围 (2)第2章操作规程 (2)2.1 测定原理 (2)2.2 试剂贮存与稳定性 (2)2.3 试剂与样本准备 (2)2.4 测定参数 (2)2.5 操作步骤 (3)2.6 校准和质控 (3)第3章结果计算 (3)3.1 吸光度变化率的计算 (3)3.2 活性的计算 (3)第4章方法学特性 (3)4.1 正常参考范围 (3)4.2 线性范围 (3)第5章临床意义 (4)第6章安全防护 (4)第1章目的和范围1.1目的为用户使用迈瑞公司TBA试剂时,提供正确的操作流程和操作规范。
1.2适用范围适用于各级医疗机构的用户。
第2章操作规程2.1测定原理γ-GT催化胆汁酸会被3α-羟甾醇脱氢(3α-HSD)以及β-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)特异性地氧化,生成3-酮类固醇以及β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)。
此外生成的3-酮类固醇在3α-羟甾醇脱氢(3α-HSD)及β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)存在下,生成胆汁酸及β-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)。
如上所述,依据循环酶而放大微量的胆汁酸量,测定单位时间内生成的β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)在405nm处的吸光度变化,以求得胆汁酸的浓度。
2.2试剂贮存与稳定性试剂贮存在2~8℃环境时,在试剂盒上规定的有效期前可以保持稳定。
2.3试剂与样本准备本试剂为液体双试剂,取出后可以直接使用。
样本可以为血清、肝素或EDTA抗凝的血浆。
尽量使用新鲜标本。
2.4测定参数测定波长:405nm;分析类型:连续监测法,扣除试剂空白;孵育时间:3分钟;延迟时间:1分钟;读数时间:3分钟;第一试剂/样本/第二试剂比例:270/4/90。
2.5 操作步骤A/min· R1: 270 μl2.6 校准和质控请使用迈瑞公司推荐的校准品和质控品。

人总胆汁酸(TBA)酶联免疫吸附测定试剂盒使用说明书本试剂盒仅供体外研究使用、不用于临床诊断!预期应用ELISA法定量测定人血清、血浆或其它相关生物液体中总胆汁酸(TBA)含量。
实验原理用纯化的TBA抗体包被微孔板,制成固相载体,往微孔中依次加入标本或标准品、生物素化的TBA抗体、HRP 标记的亲和素,经过彻底洗涤后用底物(TMB)显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的TBA呈正相关。
用酶标仪在450nm波长下测定吸光度(值),计算样品浓度。
试剂盒组成及试剂配制1、酶标板:一块(96孔)2、标准品(冻干品):2瓶,请临用前15分钟内配制。
每瓶以样品稀释液稀释至1ml,盖好后室温静置大约10分钟,同时反复颠倒/搓动以助溶解,其浓度为5,000ng/ml,然后做系列倍比稀释(注:不要直接在板中进行倍比稀释),分别配制成5,000ng/ml,2,500ng/ml,1,250ng/ml,625ng/ml,312ng/ml,156 ng/ml,78ng/ml,样品稀释液直接作为空白孔0ng/ml。
如配制2,500ng/ml标准品:取0.5ml(不要少于0.5ml)5,000ng/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3、样品稀释液:1×20ml。
4、检测稀释液A:1×10ml。
5、检测稀释液B:1×10ml。
6、检测溶液A:1×120/瓶(1:100)。
临用前以检测稀释液A1:100稀释(如:10检测溶液A/990检测稀释液A),充分混匀,稀释前根据预先计算好的每次实验所需的总量配制(100/孔),实际配制时应多配制0.1-0.2ml。
7、检测溶液B:1×120/瓶(1:100)。
临用前以检测稀释液B1:100稀释。
稀释方法同检测溶液A。
8、底物溶液:1×10ml/瓶。

总胆汁酸(TBA)测定试剂盒(酶循环法)说明书【产品名称】总胆汁酸(TBA)测定试剂盒(酶循环法)【包装规格】a)试剂1:2×45mL 试剂2:2×15mL b)试剂1:4×60mL 试剂2:4×20mL c)试剂1:2×60mL试剂2:2×20mL【预期用途】用于体外定量测定人体血清中总胆汁酸的含量。
血清中TBA 水平升高见于急性病毒性肝炎、肝硬化、胆汁淤积性胆管炎、慢性活动性肝炎、酒精性肝炎、阻塞性黄疸、肝囊性纤维变性[1]。
【检验原理】胆汁酸被3α-HSD 及THIO-NAD 特异性的氧化,生成3-酮类固及还原型硫代辅酶Ⅰ(THIO -NADH )。
此外,生成的3-酮类固醇在3α羟基类固醇脱氢酶及还原型硫代辅酶Ⅰ(THIO -NADH )存在下,生成胆汁酸及氧化型硫代辅酶Ⅰ(THIO -NAD )。
如上述,据循环酶而放大微量的胆汁酸量,测定在单位时间内生成的还原型硫代辅酶Ⅰ在405nm 处的吸光度变化,可求得样本中总胆汁酸的含量。
【主要组成成分】试剂1主要组分磷酸氢二钠-柠檬酸缓冲液100mmol/L 氧化型硫代辅酶Ⅰ(THIO-NAD)950mg/L还原型辅酶(NADH)6g/L 聚氧乙烯油醇醚适量试剂2主要组分Tris 缓冲液100mmol/L 3α-羟基类固醇脱氢酶(3α-HSDH)12.5KU/L聚氧乙烯油醇醚适量注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】贮存于2~8℃,有效期为18个月,生产日期、有效期见标签。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI 7020型/7060型/7180型/7600型/LABOSPECT 008AS 型;贝克曼AU400/AU480/AU640/AU680/AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR /TBA-2000FR ;罗氏cobas 8000c 702/cobas 8000c 701/cobas 8000c 502;西门子SIEMENS ADVIA 1800/ADVIA 2400;雅培ABBOTT ARCHITECT c8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C ;科华KHB 卓越310/卓越330/卓越400/卓越450/ZY-1200/ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/CS-600A/CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/BS-400/BS-430/BS-600/BS-800/BS-2000M ;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray 420;英诺华D280;特康TC6010L ;锦瑞GS400;普康6066。
总胆汁酸测定试剂盒(酶循环法)
适用范围:本产品适用于体外定量测定人血清中的总胆汁酸(TBA)的含量。
1.1 产品规格
1.2 主要组成成分
2.1外观
2.1.1试剂盒标签标识清晰,外包装完整无破损;
2.1.2试剂1为黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;
2.1.3试剂2为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
2.2净含量
净含量不低于标示值。
2.3试剂空白
2.3.1空白吸光度
在405nm(主)、660nm(副)下测定空白吸光度应不大于0.8。
2.3.2空白吸光度变化率
空白变化率△A/min≤0.04。
2.4线性范围
(5,150)μmol/L范围内,相关系数r≥0.990。
2.5分析灵敏度
在产品说明书规定参数设定条件下,测定浓度为40μmol/L样本,△A/min ≥0.020。
2.6 精密度
2.6.1批内重复性
CV≤5.0%。
2.6.2 批间差
相对极差R≤10.0%。
2.7 准确度
与已上市产品比对:(5,150)μmol/L范围内,相关系数r≥0.990;(5,30]μmol/L范围内,绝对偏差不超过±3μmol/L;(30,150)μmol/L范围内,相对偏差不超过±10%。
2.8 稳定性
未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测,检测结果应满足2.1、2.3、2.4、2.5、2.6.1、2.7的规定。
1.检验目的与胆汁酸校准品配合使用,用于测定血清或者血浆中的总胆汁酸(TBA)含量。
2. 测定方法和原理血清中胆汁酸在3α-羟类固醇脱氢酶(3α-HSD)及β-硫烟酰胺腺苷二核苷酸氧化型 (Thio-NAD)作用下酸脱氢酶(G-6-PDH )被氧化,生成3-酮类固醇及β-硫烟酰胺腺苷二核苷酸还原型(Thio-NADH)。
生成的3-酮类固醇在3α-HSD 及β-烟酰胺腺苷二核苷酸还原型(NADH)的作用下,生成胆汁酸及β-烟酰胺腺苷二核苷酸氧化型(NAD)。
通过酶的循环反应,微量的胆汁酸被扩增。
通过检测生成的Thio-NADH 在405nm 吸光度变化而求出血清中胆汁酸的浓度变化。
计算公式如下:TBA 浓度(μmol/L )=ΔA 样品/ΔA 标准×标准品浓度 3.标本采集与处理3.1标本种类:请使用新鲜血清或者血浆标本。
请勿使用全血标本或者尿液标本。
3.1.1 抗凝剂的影响根据NCC EP7-A 方法进行研究表明:抗凝剂肝素(heparin )、柠檬酸钠、草酸铵、氟化钠、 EDTA-2Na ,在不超过以下浓度的情况下,不会影响测试结果。
3.2 受检者的准备:空腹,采集前静坐5min ,如有输液,应在停止输液3min 后在另一侧肢体静脉采集。
3.3 静脉采血:除非是卧床病人,一般取坐位从肘静脉采血,使用止血带的时间不超过1min ,穿刺成功后立即松开止血带。
3.4 采集:通常用含助凝剂的分离胶真空采血管(黄头管)采集2-3ml 血液标本。
3.5 患者标本的处理1) 采血后大约40~60 分钟完全凝固的血液。
以2500~3000rpm 的速度(大约1000G),离心5~10 分钟。
离心后标本可直接上机。
3.6 标本保存条件和稳定性:标本在采集、处理后,立即测定标本。
在不能立即测定血清标本的情况下,应遵循下表的保存条件和稳定期进行保存:3.7 标本拒收标准:1)严重溶血2)标本标识不明3)采血量不足2ml3.8 储存条件及时间:已检标本封盖后放2~8℃,保存1 周后由医院按感染标本统一处理。
总胆汁酸(TBA)测定试剂盒(酶循环法)适用范围:本产品用于体外定量测定人血清或血浆中总胆汁酸含量。
1.1规格试剂1(R1): 2×60mL、试剂2(R2): 2×20mL;试剂1(R1): 1×60mL、试剂2(R2): 1×20mL;试剂1(R1): 2×300mL、试剂2(R2): 1×200mL;试剂1(R1): 2×45mL、试剂2(R2): 2×15mL;试剂1(R1): 1×300mL、试剂2(R2): 1×100mL;试剂1(R1): 2×60mL、试剂2(R2): 2×20mL;试剂1(R1): 1×18mL、试剂2(R2): 1×6mL;试剂1(R1):2×75mL、试剂2(R2): 2×25mL;试剂1(R1):1×75mL、试剂2(R2): 1×25mL;试剂1(R1):2×12mL、试剂2(R2): 2×4mL;试剂1(R1):5×12mL、试剂2(R2): 5×4mL;试剂1(R1):10×12mL、试剂2(R2): 10×4mL;试剂1(R1):20×12mL、试剂2(R2): 20×4mL;试剂1(R1):2×15mL、试剂2(R2): 2×5mL;试剂1(R1):5×15mL、试剂2(R2): 5×5mL;试剂1(R1):10×15mL、试剂2(R2): 10×5mL;试剂1(R1):20×15mL、试剂2(R2): 20×5mL;480测试/盒:【试剂1(R1):142.4mL、试剂2(R2):51.2mL】;校准品(选配):1×1mL。
总胆汁酸(TBA)测定试剂盒(酶循环法)适用范围:该试剂盒用于体外定量测定人血清中总胆汁酸的浓度。
1.1 产品规格1.2 组成成分该试剂盒由试剂1(R1)、试剂2(R2)和校准品(选配)组成。
1.2.1试剂组成试剂1: 2-(N-吗啉代)乙磺酸(MES)缓冲液≥20.0mmol/L氧化型硫代烟酰胺腺嘌呤二核苷酸(Thio-NAD+)≥1.0mmol/L试剂2: 三羟甲基甲胺基丙磺酸(TAPS)缓冲液≥100.0mmol/L3-α羟基类固醇脱氢酶(3α-HSD)≥10.0KU/L烟酰胺腺嘌呤二核苷酸(NADH)≥2.0mmol/L1.2.2 校准品组成甘氨脱氧胆酸钠目标浓度:50μmol/L 该校准品为水基质液体校准品2.1 外观a) R1应为淡黄色至黄色溶液,无混浊,无未溶解物。
b) R2应为无色至棕褐色溶液,无混浊,无未溶解物。
c) 校准品应为无色溶液,无混浊,无未溶解物2.2 净含量液体组分不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度应不大于0.800。
2.3.2试剂空白吸光度变化率应不大于0.04/min。
2.4 分析灵敏度TBA试剂盒测定浓度100μmol/L的被测物时,吸光度差值(ΔA)应不小于0.010。
2.5 准确度回收实验:测定回收率,应在90%-110%之间。
2.6 精密度2.6.1重复性变异系数应不大于5%。
2.6.2批间差批间相对极差(R)应不大于10%。
2.7 线性在(0,180]μmol/L范围内,TBA试剂盒的线性相关系数r应不低于0.9900;在(0,50]范围内绝对偏差应不超过5μmol/L,在(50,180]范围内相对偏差应不超过±10%。
2.8校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供总胆汁酸校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至纯品(Sigma公司,纯度≥97%)。
总胆汁酸测定 (循环酶法)Total Bile Acids (TBA)1检验目的本方法用于体外定量测定人血清或血浆总胆汁酸。
2方法第五代循环酶方法,检测采用速率法。
3原理胆汁酸会被3α-羟甾醇脱氢(3α-HSD)以及β-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)特异性地氧化,生成3-酮类固醇以及β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)。
此外生成的3-酮类固醇在3α-羟甾醇脱氢(3α-HSD)及β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)存在下,生成胆汁酸及β-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)。
如上所述,依据循环酶而放大微量的胆汁酸量,测定单位时间内生成的β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)在405nm处的吸光度变化,以求得胆汁酸的浓度。
4 标本血清、肝素或EDTA处理的血浆。
应使用新鲜标本,标本必须避光保存!标本稳定性:4℃保存可稳定7天,-20℃保存可稳定3个月,不可使用已被污染的标本。
5 试剂5.1在测定时的各组分和浓度试剂1(R1):952.9 mg/Lβ-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)Good’s缓冲液120 mmol/L试剂2(R2):β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH) 6.1 g/L3α-羟甾醇脱氢酶(3α-HSD) 12500 mmol/LGood’s缓冲液120 mmol/L表面活性剂,稳定剂适量5.2试剂稳定性与贮存试剂避光保存于2~8℃,若无污染,可稳定至失效期。
试剂不可冰冻!试剂2必须避光保存。
6 仪器OLYMPUS AU400全自动生化分析仪7测定程序见参数表8 校准品和质控品8.1使用Roche公司提供的Roche多项目定标液对自动分析仪进行校准。
每批样品检测时,使用Roche 公司提供的Roche定标液和控制品进行内部质量控制。
8.2质控物的保存和稳定性:质控物存放于4-8℃可保存一个月,分装存放于-20℃至有效期。
目录目录 (1)第1章目的和范围 (2)1.1 目的 (2)1.2 适用范围 (2)第2章操作规程 (2)2.1 测定原理 (2)2.2 试剂贮存与稳定性 (2)2.3 试剂与样本准备 (2)2.4 测定参数 (2)2.5 操作步骤 (3)2.6 校准和质控 (3)第3章结果计算 (3)3.1 吸光度变化率的计算 (3)3.2 活性的计算 (3)第4章方法学特性 (3)4.1 正常参考范围 (3)4.2 线性范围 (3)第5章临床意义 (4)第6章安全防护 (4)第1章目的和范围1.1目的为用户使用迈瑞公司TBA试剂时,提供正确的操作流程和操作规范。
1.2适用范围适用于各级医疗机构的用户。
第2章操作规程2.1测定原理γ-GT催化胆汁酸会被3α-羟甾醇脱氢(3α-HSD)以及β-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)特异性地氧化,生成3-酮类固醇以及β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)。
此外生成的3-酮类固醇在3α-羟甾醇脱氢(3α-HSD)及β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)存在下,生成胆汁酸及β-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)。
如上所述,依据循环酶而放大微量的胆汁酸量,测定单位时间内生成的β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)在405nm处的吸光度变化,以求得胆汁酸的浓度。
2.2试剂贮存与稳定性试剂贮存在2~8℃环境时,在试剂盒上规定的有效期前可以保持稳定。
2.3试剂与样本准备本试剂为液体双试剂,取出后可以直接使用。
样本可以为血清、肝素或EDTA抗凝的血浆。
尽量使用新鲜标本。
2.4测定参数测定波长:405nm;分析类型:连续监测法,扣除试剂空白;孵育时间:3分钟;延迟时间:1分钟;读数时间:3分钟;第一试剂/样本/第二试剂比例:270/4/90。
2.5 操作步骤A/min· R1: 270 μl2.6 校准和质控请使用迈瑞公司推荐的校准品和质控品。
胆汁酸测定试剂盒(循环酶法)标准化操作规程
1 目的
规范实验室操作,保证检验工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过的实验室检验人员。
3 适用范围本试剂适用于体外定量检测人血清或血浆中胆汁酸的含量。
4 检验方法
本试剂盒采用循环酶法测定胆汁酸的含量。
5 检验原理
本试剂采用酶分析法测定血清总胆汁酸。
3α-羟基类固醇脱氢酶特异性作用于3α-羟甾族化合物,使之转化为相应的酮类固醇,反应中thio-NAD被还原为thio-NADH。
通过在405nm波长处测定单位时间内吸光度的变化值,可以计算出样品中总胆汁酸的含量。
6 标本要求
6.1 样本为空腹患者血清。
样本应及时离心分离,不得使用溶血或被污染的样本。
6.2 样本应避免微生物污染,在2℃~8℃可稳定数月。
7 试剂及配套品
7.1试剂来源
长春迪瑞医疗科技股份有限公司胆汁酸试剂盒(循环酶法)
7.2
7.3试剂的稳定性与贮存:
7.3.1 试剂在2℃~8℃条件下,干燥、避光、密封贮存,有效期为12个月。
7.3.2 试剂开封后在2℃~8℃条件下可稳定30天。
8 实验仪器及性能指标
8.1 实验仪器
迪瑞CS系列全自动生化分析仪
8.2试剂性能指标
8.2.1 试剂空白:
试剂空白吸光度:A≤0.800。
试剂空白吸光度变化率:△A/min≤0.040。
8.2.2 分析灵敏度:测试1μmol/L被测物时,吸光度变化率(△A/min)>0.0002。
8.2.3 线性范围:1μmol/L~180μmol/L;线性相关系数r≥0.9900;[1,36]μmol/L区间内,线性绝对偏差应不超过±7.2µmol/L;(36,180]μmol/L区间内,相对偏差不超过±15%。
8.2.4 准确度:比对试验:r≥0.9900;[1,36]μmol/L区间内,绝对偏差不超过±7.2μmol/L,(36,180]μmol/L区间内,相对偏差不超过±15%。
8.2.5 测量精密度:
重复性:CV≤5.0%。
批间差:R≤6.0%。
9 校准程序
9.1校准品来源
长春迪瑞医疗科技股份有限公司生产的临床化学校准血清
9.2校准品的组成:人血清
9.3校准品使用
9.3.1 小心打开瓶盖,避免内容物的任何损失;
9.3.2在20-25℃的室温下,准确量取5ml蒸馏水复溶1瓶校准血清;
9.3.3拧紧瓶盖,避光放置30分钟,使之完全溶解;
9.3.4轻轻混匀,确保溶液均一性。
勿摇晃小瓶,避免泡沫产生;
9.3.5使用时,移取所需的体积后,把校准血清盖紧瓶盖放回冰箱中保存;
9.3.6复溶后的校准血清可用于手工测试,也可用于全自动生化分析仪
9.4校准品使用注意事项
9.4.1 若该复溶血清受细菌污染,将会降低许多成分的稳定性。
9.4.2 不同批号的校准血清不能交叉使用,因为批号于批号之间的赋值不同。
9.4.3 请勿用嘴直接吸取试剂,避免接触皮肤、眼睛及粘膜,一旦接触,应立即用大量水冲洗。
9.5 校准程序
建议使用试剂盒配套的校准品,以纯化水和校准品进行2点校准测定。
测定后仪器自动拟合成校准曲线。
当试剂批号更换或质控失控时,需要重新校准。
10 质量控制
10.1质控品来源
长春迪瑞医疗科技股份有限公司生产的临床化学质控血清(水平I和水平II) 10.2质控品组成:人血清
10.3质控品存贮
未复溶的校准血清在避光条件下,2~8℃可稳定至标签失效期。
复溶后校准血清在避光条件下,2~8℃可稳定7天;15~25℃可稳定1天;-20℃可稳定30天。
10.4质控品使用注意事项
10.4.1若该复溶血清受细菌污染,将会降低许多成分的稳定性。
10.4.2请勿用嘴直接吸取试剂,避免接触皮肤、眼睛及粘膜,一旦接触,应立即用大量水冲洗。
10.4.3 因批与批之间的质控血清赋值不同,所以不同批号的质控血清不能当做校准血清使用。
10.5 质量控制
建议使用迪瑞公司的质控品,进行质量控制。
实验室应自行建立质控区间和限值。
若质控值失控,每个实验室应采取纠正措施。
11操作程序 11.1试剂配制
试剂1和试剂2均为液体试剂,可直接使用。
11.2
11.3 样本测试步骤:
11.4计算方法
)校准液浓度(校准管样本管)=
总胆汁酸浓度(L A A L /mol min
/min
//mol μμ⨯∆∆
11.5注意事项
11.5.1本品仅用于体外诊断。
11.5.2避免测试中途添加试剂。
11.5.3试剂和样本用量可根据不同仪器的要求按比例改变。
11.5.4测定过程中应保持恒温。
11.5.5试剂使用前需进行校准。
12结果判断
12.1 当样本中胆汁酸含量大于180μmol/L时,样本应用生理盐水稀释后再进行测定,计算结果时乘以稀释倍数。
12.2 人血清中胆汁酸含量的检测只是临床医师对患者进行诊断的指标之一,临床医师还要根据患者的体症、病史以及其它的诊断项目、诊断手段进行综合判断。
13 参考区间
1~12 μmol/L
引用的参考值范围代表本法的期望值,仅供参考,建议各实验室验证这一参考范围或建立自己的参考值范围。
14 临床意义
人体总胆汁酸库日—日间是相对平衡的。
每日胆汁酸主要从粪便排出,平衡是通过肝脏以胆固醇为原料进行的胆汁酸净合成实现的。
当患有肝脏疾病和胆汁酸吸收作用损害时,随着溢出增加,血清胆汁酸浓度增高,这是肝病加重的反应。
血清总胆汁酸测定常用于肝病的检查,在急性肝炎、慢性肝炎等各类病症中总胆汁酸有不同程度的升高。
15复检操作程序
按仪器使用说明书进行复查操作。
16方法局限性
16.1 检验结果的准确性依赖于仪器的校正和测定温度、时间的控制。
16.2 当样本中黄疸>855μmol/L、甘油三脂>2.8mmol/L、血红蛋白>1.5g/L、抗坏血酸>5.7mmol/L时可能会影响检测结果。
17 注意事项
样本、废液等有潜在生物传染性,操作者应遵守实验室安全操作规定,并按当地医疗废弃物、感染性废弃物、产业废弃物等规定处理废液。
18 个人防护
18.1 请把标本当作可能感染HIV、HBV、HCV等的危险物质处置。
为了避免或减少相关的传染风险,请使用一次性手套。
18.2若本试剂误入眼内或口中、或接触到皮肤时,请迅速用水冲洗,必要时请
接受医生治疗。
19 当检测系统不能工作时,所采取的补救措施
当仪器发生故障时,迅速联系仪器厂家进行维修。
20参考文献
20.1 Samuel J. Levin and Morton K. Schwartz. Serum Bile Acids in Patients with Liver Disease. Clin Chem 1965; 12: 547.
20.2 Linnet K. Kelbaek H. The patterns of glycine and taurine conjugates of bile acids in serum in hepatobiliary disease. Scand J Gastroenterol 1982; 17: 919.
20.3 Hofann AF. Small DM. Detergent properties of bile acids: correlation with physiological function. Annu Rev Med 1967; 18: 333.
20.4NCCLS . Interference Testing in Clinical Chemistry;Approved Guideline, 2005.。