人教版高一化学必修一第二章物质的量同步练习题(含解析)
- 格式:docx
- 大小:90.66 KB
- 文档页数:7
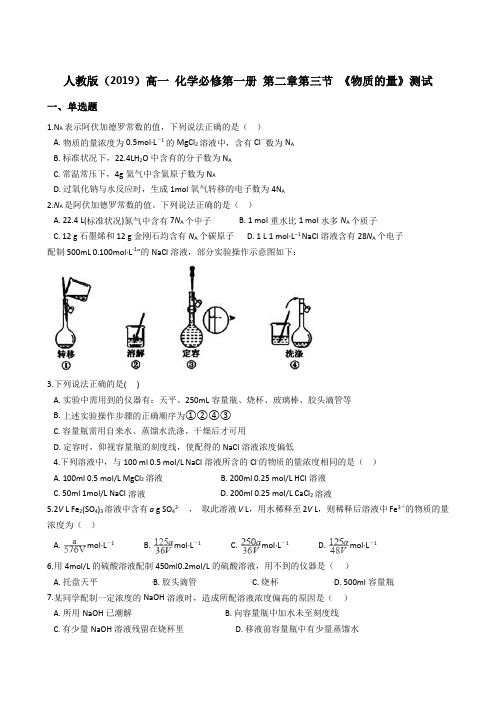
人教版(2019)高一化学必修第一册第二章第三节《物质的量》测试一、单选题1.N A表示阿伏加德罗常数的值,下列说法正确的是()A. 物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为N AB. 标准状况下,22.4LH2O中含有的分子数为N AC. 常温常压下,4g氦气中含氦原子数为N AD. 过氧化钠与水反应时,生成1mol氧气转移的电子数为4N A2.N A是阿伏加德罗常数的值。
下列说法正确的是()A. 22.4 L(标准状况)氮气中含有7N A个中子B. 1 mol重水比1 mol水多N A个质子C. 12 g石墨烯和12 g金刚石均含有N A个碳原子D. 1 L 1 mol·L−1 NaCl溶液含有28N A个电子配制500mL 0.100mol·L-1”的NaCl溶液,部分实验操作示意图如下:3.下列说法正确的是( )A. 实验中需用到的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等B. 上述实验操作步骤的正确顺序为①②④③C. 容量瓶需用自来水、蒸馏水洗涤,干燥后才可用D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低4.下列溶液中,与100 ml 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是()A. 100ml 0.5 mol/L MgCl2溶液B. 200ml 0.25 mol/L HCl溶液C. 50ml 1mol/L NaCl溶液D. 200ml 0.25 mol/L CaCl2溶液5.2V L Fe2(SO4)3溶液中含有a g SO42-,取此溶液V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为()A. mol·L-1B. mol·L-1C. mol·L-1D. mol·L-16.用4mol/L的硫酸溶液配制450ml0.2mol/L的硫酸溶液,用不到的仪器是()A. 托盘天平B. 胶头滴管C. 烧杯D. 500ml容量瓶7.某同学配制一定浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是()A. 所用NaOH已潮解B. 向容量瓶中加水未至刻度线C. 有少量NaOH溶液残留在烧杯里D. 移液前容量瓶中有少量蒸馏水8.在AlCl3、MgCl2、MgSO4的混合溶液中,c(Al3+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.50mol/L,则c(SO42-)为A. 0.10mol/LB. 0.15mol/LC. 0.20mol/LD. 0.30mol/L9.向25mL 2mol·L-1稀硫酸中加入25mL 1mol·L-1的BaCl2溶液,充分反应后,溶液中H+物质的量浓度为(设稀溶液相混后总体积为原分体积之和)()A. 2mol·L-1B. 1mol·L-1C. 0.5mol·L-1D. 0.25mol·L-110.某气体在标准状况下的密度为1.25 g / L,该气体的相对分子质量为()A. 44B. 28C. 32D. 1611.某一Na2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.5mol/L,SO42-的物质的量浓度为0.8 mol/L,则此溶液中Na+的物质的量浓度为()A. 0.1mol/LB. 0.15 mol/LC. 0.2 mol/LD. 0.25 mol/L12.下列有关气体摩尔体积的描述正确的是()A. 通常状况下,气体摩尔体积约为22.4LB. 标准状况下,气体摩尔体积约为22.4LC. 相同物质的量的气体,摩尔体积相同D. 同温同压的气体,摩尔体积相同13.常温常压下,用等质量的He、CH4、O2、SO2分别吹出四个气球,其中气体为He的是( )A. B. C. D.14.VL Fe2(SO4)3溶液中含有a g Fe3+,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中SO42-的物质的量的浓度为( )A. B. C. D.15.固体A在一定温度下分解生成气体B、C和D:2A(s)=B(g)+2C(g)+3D(g)。

高中化学学习材料金戈铁骑整理制作§1-2物质的量(1)一、选择题1.下列叙述正确的是( )A .每摩尔物质约含有6.02×1023个粒子B .摩尔是七个基本物理量之一C .摩尔是物质的质量单位D .摩尔是物质的数量单位解析:根据物质的量的概念要点分析,每摩尔物质约含有6.02×1023个粒子,故A 项正确;物质的量是七个基本物理量之一,摩尔是其单位,故B 项错;摩尔是物质的量的单位,而不是质量和数量的单位,质量的单位是kg ,数量是一个值,无单位,故C 、D 两项均错。
答案:A2.(双选题)下列说法正确的是( )A .H 2的摩尔质量是2 gB .1 mol H 2O 的质量是18 gC .氧气的摩尔质量是32 g·mol -1D .2 g H 2含1 mol H解析:摩尔质量的单位是g·mol -1,故A 项错误,C 项正确;1 mol H 2O 的质量是18 g ,故B 项正确;2 g H 2的物质的量是1 mol ,含有2 mol H ,故D 项错误。
答案:BC3.设N A 为阿伏加德罗常数的值,下列说法错误的是( )A .32 g O 2所含的原子数目为N AB .0.5 mol H 2O 含有的原子数目为1.5 N AC .1 mol SO 2含有的SO 2分子数目为N AD .0.5 N A 个Cl 2的物质的量是0.5 mol 解析:32 g÷32 g/mol =1 mol ,故32 g O 2所含分子数为N A ,原子数为2N A ,A 项错误。
答案:A4.下列物质含分子数最多的是( )A .0.8 mol SO 2B .1.806×1022 H 2OC .11.2 g COD .32 g SO 2解析:根据公式计算,B 项是0.3 mol ,C 项是0.4 mol ,D 项是0.5 mol 。
答案:A5.1 mol MgSO 4·7H 2O 含有结晶水的质量为( )A .16 gB .18 gC .112 gD .126 g答案:D6.在0.1 mol Na 2SO 4中所含Na +数目为( )A .6.02×1022 个B .1.202×1023 个C .0.1个D .0.2个解析:0.1 mol Na 2SO 4中含Na +0.2 mol,0.2×6.02×1023=1.204×1023个。

第一节物质的分类1.“白马非马”的论断正确性的原因()A.矛盾的对立统一B.事物总存在共性和特性C.论断随时代而变D.物质分类的结果2.给物质分类时由于标准不同往往会出现()A.树状分类法B.环状分类法C.球状分类法D.交叉分类法3.人们把球分成篮球、排球、羽毛球等属于( )A.树状分类法B.环状分类法C. 球状分类法D.交叉分类法4.给物质分类的好处在于:( )A.有利于认识事物B.有利于弥补事物的先天不足C.有利于人们开拓视野D.有利于发现事物的特性5.根据分散剂和分散质的状态不同可以组成( )种分散系A. 3B. 11C. 9D. 66.下关于列关于溶液的叙述正确的是( )A.所有溶液都是无色的B.由分散质和分散剂组成的分散系一定是溶液C.、均一稳定的液体是溶液D.溶液是由溶质和溶剂组成的7.下列物质①过滤后的天然水②变浑浊的石灰水③石蕊试液④牛奶⑤盐酸⑥碘酒,其中属于溶液的是( )A.①③B. ②④ C ③⑤⑥ D ①③⑤⑥8.下列物质中属于溶液的是( ),属于浊液的是( ),属于胶体的是( )A.将少量二氧化碳通入石灰水后得到的混合物B.液氮C.碘酒D.煮沸的FeCl3溶液9.下列关于胶体的性质叙述正确的是( )A.只带正电荷B.能产生丁达尔效应C.相当稳定D.都是透明的10.从一杯蔗糖溶液的上部取一些溶液,测定它的密度为 a g/cm3,再从下部取一些溶液,测定它的密度数值应为( )A.大于aB.小于aC.等于aD.无法确定11.当分散系是水或其他液体时,如果按照分散质粒子大小可以把分散系分为、、。
12.通常使用的分类方法是、。
13.将A中的人按B中的分类标准分类,14.请按下列线条提示,画出Fe、Cu、S、H2、HCl、NaOH、H2So4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl 的树状分类图:15.根据下表中各元素的性质,按金属或非金属进行分类,并说明理由。
元素外观相对原子质量单质导电性A 无色气体14.0 无B 无色气体39.9 无C 坚硬的银白色固体40.0 有D 银白色液体200.6 有(1))金属是:,理由是;(2)非金属是,理由是。

人教版(2019)高中化学必修一第二章第三节物质的量专项巩固练习(附答案)一、单选题1.意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,下列说法正确的是()A.N4与N2的摩尔质量相等B.N4属于一种新型的化合物C.等质量的N4与N2所含的原子个数比为1∶1D.等质量的N4与N2所含的分子个数比为2∶12.配制体积为100ml、溶质物质的量为0.2mol的NaOH溶液时,不需要用到的仪器是( ) A.B.C.D.3.a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )A.(b4a)mol-1B.(ba)mol-1C.(ab)mol-1D.(a4b)mol-14.VLFe2(SO4)3溶液中含有ag2-4SO,取此溶液0.5VL,用水稀释至2VL,则稀释后的溶液中Fe3+的物质的量浓度为( )A.a576Vmol·L-1B.125a36Vmol·L-1C.250a26Vmol·L-1D.250a48Vmol·L-15.下列溶液中,溶质的物质的量浓度不是1 mol·L-1的是( ) A.10g NaOH固体溶解在水中配成250mL溶液B.将1mol SO3溶于水并配成1L的溶液C.将0.5mo1·L-1的NaNO3溶液100mL加热蒸发掉50g水的溶液D.标况下,将22.4L氯化氢气体溶于水配成1L溶液6.3.6g碳在一定量的氧气中燃烧,反应后生成一氧化碳和二氧化碳混合气体的平均摩尔质量是32g·mol -1,则生成的一氧化碳的质量是( )A.3.3g B.6.3g C.8.4g D.13.2g7.若50滴水正好是mmL,水的密度为1g•mL-1,则1滴水所含的分子数是()A.m×50×18×6.02×1023B.23 m 6.02105018⨯⨯⨯C.2318m 6.021050⨯⨯D.23m50186.0210⨯⨯⨯8.下列说法正确的是( )A.硫酸、磷酸的摩尔质量均为98gB.20℃、1.0×10 5Pa时,同体积的O2与CO2含有相同的分子数C.标准状况下,16gO2与24g Mg所占的体积相同D.当1mol气态物质的体积为22.4L时,该气体一定处于标准状况9.我国药学家屠呦呦因发现青蒿素开创了治疗疟疾的新方法,荣获了诺贝尔奖。

1.2.1 物质的量1.在1.5molNa2SO4中,含有的数是A. B. C. D.3【答案】A【解析】因为在1.5molNa2SO4中,含有的物质的量是为3mol, 含有的数为,根据N=N A n=3 6.021023= ,故A选项符合题意,故A正确;答案为A。
2.下列有关氧气的摩尔质量表示正确的是A.32 B.32 g C.32 mol D.32 g/mol【答案】D【解析】氧气的摩尔质量是32g/mol或32g·mol-1,答案选D。
3.下列说法中,正确地是()A.一个氮原子的质量就是氮的相对原子质量B.一个碳原子的质量约为1.99×10-23gC.氧气的摩尔质量在数值上等于它们的相对分子质量D.氢氧化钠的摩尔质量是40g【答案】B【解析】A、相对原子质量的概念:以一种碳原子(即碳12原子)质量的1/2作为标准,其它原子的质量(实际质量)跟它相比较所得的值,就称为该原子的相对原子质量,所以相对原子质量不是一个原子的质量,故A错误;B、一个碳原子的质量可以根据碳原子的摩尔质量和阿伏加德罗常数计算出:12g/mol÷(6.02×1023)/mol=1.99×10-23g ,故 B正确;C、氧气的相对分子质量为32,其摩尔质量为32g/mol或0.032kg/mol,因此,只有在摩尔质量的单位用g/mol时,物质的摩尔质量在数值上才等于它的相对分子质量,故C错误;D、氢氧化钠的摩尔质量是40g/mol,故D错误;综上所述,本题应选B。
4.下列物质中,摩尔质量最大的是A.10 mL H2O B.0.8 mol H2SO4 C.54 g Al D.1 g CaCO3【答案】D【解析】试题分析:摩尔质量在数值上等于其相对原子质量或相对分子质量,A、18g/mol;B、98g/mol;C、27g/mol;D、100g/mol;因此摩尔质量最大的是碳酸钙,即选项D正确。

人教版(2019)高中化学必修一第二章第三节物质的量专题练习(附答案)一、单选题1.在放电条件下发生下列反应:3O 2→放电2O 3。
如有30%O 2转化为O 3,则放电后混合气体对氢气的相对密度是( )A .16B .17.8C .18.4D .352.若N A 表示阿伏加德罗常数的值,下列叙述中正确的是( )A .1mol Cl 2参加化学反应,转移的电子数一定为2N AB .7.8g Na 2O 2晶体中阴阳离子总数为0.4N AC .标准状况下,32 g 氧气(O 2)和32 g 臭氧(O 3)都含有2N A 个氧原子D .14g 氮气中含有3.5N A 个电子3.设N A 为阿伏加德罗常数,下列关于0.2mol·L -1硝酸钡溶液的说法不正确的是() A .1L 溶液中所含阴、阳离子总数是0.6N AB .1L 溶液中含有0.2N A 个NO 3-C .500 mL 溶液中含有0.2N A 个NO 3-D .500 mL 溶液中Ba 2+浓度为0.2 mol·L -14.设N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .6.4g Cu 与足量浓硝酸反应生成NO 2分子数目为2N AB .反应O 3+2KI+H 2O=2KOH+O 2+I 2中,每1mol O 3参与反应转移的电子数为6N AC .100g 9.8%的硫酸与磷酸的混合液中含有氧原子数为0.4N AD .标准状况下,2mol Na 2O 2与44.8L SO 2完全反应,转移的电子数目为4N A5.. 用A N 表示阿伏加德罗常数的值.下列说法中正确的是( )A .标准状况下,22.4L 酒精中含有的分子数目为A NB .常温常压下,lmol /L 盐酸中含有的氯离子数目为A NC .常温常压下,224gO 和324gO 含有的氧原子数目都为A 1.5ND .标准状况下,2.24L 氯气与足量NaOH 溶液反应转移的电子数为A 0.2N6.有一真空储气瓶质量为300 g ,在相同条件下,装满O 2时质量为304 g ,装满另一种气体甲时质量为305.5 g ,则气体甲可能是( )A .CO 2B .N 2C .HClD .H 2S7.下列有关实验用品的使用或操作的叙述中,正确的是( )A .用红色石蕊试纸检验溶液的酸性B .用容量瓶配制准确浓度的溶液,但不能作为反应容器使用C .配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释D .称量NaOH 固体时,将NaOH 放在托盘上的两张大小相等的同种纸上8.下列有关说法不正确的是( )A .向包有 Na 2O 2的脱脂棉上滴几滴水,脱脂棉剧烈燃烧,说明 Na 2O 2与H 2O 的反应是放热反应B .同温同压下,相同体积的任何气体都具有相同的原子数目C .将 4mol ⋅L −1 的盐酸 100mL ,加水稀释至 500mL ,稀释后盐酸的物质的量的浓度为0.8mol ⋅L −1D .3.2gO 2和 3.2gO 3气体中所含氧原子数均为 0.2N A9.将5mo1‧L -1的Mg(NO 3)2溶液amL 稀释至bmL ,稀释后溶液中NO 3-的物质的量浓度为( ) A .5a/bmo1·L -1 B .a/bmo1·L -1 C .b/5amo1·L -1 D .10a/bmo1·L -110.若50滴水正好是m mL,则1滴水所含的分子数是()A.m×50×18×6.02×1023B.m5018⨯×6.02×1023C.18m50×6.02×1023D.231850m6.0210⨯⨯⨯11.VmLA12(SO4)3溶液中含Al3+ag,取14VmL溶液稀释到4VmL,则稀释后溶液中2-4SO的物质的量浓度是( )A.125a9Vmol/L B.125a36Vmol/L C.125a18Vmol/L D.125a54Vmol/L12.标准状况下,某恒容密闭容器充满CH4后质量为108g,若充满O2后质量为116g,现若充满A气体则质量为113g,那么A气体的摩尔质量为()A.14g/mol B.26 g/mol C.36 g/mol D.44 g/mol13.欲使1L0.5mol/L的NaOH溶液的浓度增大一倍,可采取的合理措施是()A.加入20gNaOH固体,搅拌、溶解B.将溶液加热浓缩至0.2LC.加入1L1.5mol/L的NaOH溶液混合均匀D.加入10mol/L的NaOH溶液0.1L,再稀释至1.5L14.下列说法正确的是()A.酸性氧化物可以与金属氧化物发生氧化还原反应B.物质的摩尔质量就是该物质的相对分子质量C.发生化学反应时失电子数越多的金属原子,还原能力越强D.两个等容容器,一个盛CO,另一个盛Ar、O3混合气体,同温同压下两容器内气体分子总数一定相同,原子总数也一定相同15.配制90mL1mol·L-1Na2CO3溶液,下列操作正确的是()A.称取28.6gNa2CO3·10H2O,配成90mL溶液B.称取28.6gNa2CO3·10H2O,配成100mL溶液C.称取10.6g无水碳酸钠,加入100mL蒸馏水,搅拌、溶解D.称取10.6g无水碳酸钠,加入100mL容量瓶中,加水溶解、定容二、实验题16.人体血液里Ca2+的浓度一般采用mg/cm3来表示。
人教版化学必修一第二章第三节物质的量重点训练一、选择题1.【2019·河南安阳一中高一月考】下列有关物质的量和摩尔的叙述,不正确的是()A.摩尔是国际单位制中七个基本单位之一B.物质的量可用n表示,1 mol 粒子的数目约为6.02×1023C.摩尔的计量对象可以是分子、离子、原子、质子、中子、电子和原子团D.用摩尔表示物质的量时,要用化学式指明粒子种类,而不用该粒子的中文名称2.【2019·广东清远期末】下列物质中,所含分子数最多的是()A.1.806×1023个H2OB.含N A个氢原子的H2C.1.2 mol H2SO4D.11.2 g CO3.【2021·山东济南历城二中高一监测】下列叙述错误的是()A.1 mol 任何物质都含有6.02×1023个分子B.1 mol Ne中含有6.02×1024个电子C.1 mol H2O中含有2 mol H 和1 mol OD.1 mol H2O中含有3 mol 原子4.【2019·山东省实验中学高一月考】1.6g某气体中含有6.02×1022个分子,则该物质的相对分子质量为()A.16B.64C.32D.965.【2019·湖南攸县一中高一月考】常温常压下,气体体积的大小取决于()A.粒子的直径B.粒子的质量C.粒子的数目D.粒子间的平均距离6.【2019·陕西渭南中学高一质检】(双选)下列有关气体摩尔体积的叙述中正确的是()A.单位物质的量的气体所占的体积就是气体的摩尔体积B.通常情况下,1 mol 气体的体积约为22.4LC.标准状况下,气体摩尔体积约为22.4LD.相同条件下的气体,气体摩尔体积相同7.李兰娟院士说,据初步测试,在体外细胞实验中显示:达芦那韦在300 μmol·L-1浓度下,能显著抑制病毒复制,与未用药处理组比较,抑制效率达到280倍。
物质的量1.【学习目标】了解物质的量的单位——摩尔。
2.掌握物质的量、物质的质量、微粒数目、标准状况下气体体积之间的关系。
【要点梳理】知识点一:物质的量及其单位(摩尔)大量的微观粒子如何计量是化学研究中面临的重要问题。
由于一切反应都是以微观粒子的相互作用为基础的,所以必须找到合适的方法来计量微粒。
数目巨大和看不见摸不着是最大的障碍。
用下面的方法把具有一定质量的微粒规定为一个集体,一切的其他微粒群体都和它进行比较来衡量微粒的多少是很好的一种解决方案。
所以就产生了新的物理量——物质的量。
物质的量通常是表示物质所含微观粒子数目多少的物理量。
要点诠释:化学实验中,取用的药品无论是单质还是化合物,都是可以用器具称量的。
而物质间发生的化学反应是原子、离子或分子之间按一定的数目关系进行的,对此,不仅我们用肉眼直接看不到,也难以称量。
国际科学家建议用“物质的量”将一定数目的原子、离子或分子等微观粒子与可称量物质联系起来(1).物质的量的含义:表示含有一定数目粒子的集合体。
特别提示:(1)物质的量(符号为n),是国际单位制中的七个基本物理量之一,其单位为摩尔(符号为mol)。
除SI外,物质的量的单位还有kmol、mmol等。
(2)“物质的量”四个字是一个整体,不可分割或插入其他字。
它不具有字面含义,不能望文生义。
将其理解为“物质的质量”或“物质的数量”,这些都是错误的。
(3)物质的量是一个基本物理量,它与国际单位制中的其他六个基本物理量呈并列关系。
“物质的量”与“摩尔”的关系,就像“长度”与“米”、“质量”与“千克”、“时间”与“秒”的关系一样,是基本物理量与其单位名称的关系。
(4)物质的量的计量对象是构成物质的微观粒子(如分子、原子、离子、电子等)或某些微观粒子的特定组合(如NaCl)等。
不可用其计量宏观物质。
如“1 mol铁钉”“1 mol牛”等说法都是错误的。
使用摩尔作单位时必须用化学式指明粒子的种类,如1 mol H表示1摩尔氢原子,1 mol H2表示1摩尔氢分子,1 mol H+表示1摩尔氢离子。
物质的量热身题一、[判断正误]1、摩尔是七个物理量之一()2、摩尔是物质的质量单位()3、摩尔是物质的数量单位()4、1摩尔小麦含有6.02 ×1023个麦粒()5、3mol氢()6、4.5molNH3 ( )7.摩尔是国际科学界建议采用的一种物理量( )8.摩尔是物质的量的单位,简称摩,符号为mol ( )9.我们把含有约6.02×1023个粒子的任何粒子的集体计量为1摩尔( )10.1mol氧含6.02×1023个O2 ( )二、计算1、某物质中含有6.02×1022个Na+,则Na+物质的量为多少?2、2.5molO2多少个O原子?3、已知1mol Al 所含Al原子的个数为阿佛伽德罗常数,那么0.5mol Al 所含Al原子的个数为, 2mol Al 所含Al原子的个数为。
4、 9.03×1023个H2O的物质的量为 .所含H的物质的量为 .所含氧原子的物质的量为 .三、填空1、1.5molH2SO4的物质的量为_____,所含H+的物质的量为____________.硫酸根离子的物质的量为__________,所含硫酸分子的数目为_________.2、1mol CO和______mol CO2所含氧原子数相等?3、0.5molH2O中有________mol原子.物质的量练习题一一、选择题(每小题1~2个正确答案)1、下列关于摩尔质量的说法正确的是()A、氯气的摩尔质量是71克B、氯化氢的摩尔质量为36.5 g/moLC、1摩氢气的质量为2克D、O2的摩尔质量为16g/moL。
2、对于相同质量的二氧化硫和三氧化硫来说,下列关系正确的是()A、含氧原子的个数比为2∶3B、含硫元素的质量比是5∶4C、含氧元素的质量比为5∶6D、含硫原子的个数比为1∶13、1克氯气含有n个Cl2分子,则阿佛加德罗常数可表示为()A、71nB、 (1/71)nC、35.5nD、(1/35.5).n4、将a g氯化钾溶于1.8L水中,恰使K+离子数与水分子数之比为1∶100,则a值为() A.0.745 B.0.39 C.39 D.74.55、在一定体积的容器中加入1.5mol氙气(Xe)和7.5mol氟气,于400℃和2633kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是()A.1∶2 B.1∶3 C.1∶4 D.1∶66、下列各指定粒子数目不等于阿伏加德罗常数值的是()A.1g H2所含的原子个数 B.4g氦气所含的原子个数C.23g金属Na全部转变为金属离子时失去的电子个数D.16g O2所含的分子个数7、过氧化钠与水反应时,氧化剂与还原剂物质的量之比是()A.1:1 B.1:2 C.2:1 D.2:38、设N A表示阿伏加德罗常数,下列说法中正确的是()A.N A个N2分子和N A个CO分子质量比为1∶1B.1 mol H2O的质量等于N A个H2O质量的总和C.在任何条件下1mol H2所含的原子数为N AD.1mol H2SO4中所含的粒子数目一定是N A9、若某氖原子质量是a g,12C的原子质量是b g,N A是阿伏加德罗常数的值,下列说法正确的是()A.氖元素的相对原子质量一定是12a/b B.该氖原子的摩尔质量是a N A gC.Wg该氖原子的物质的量一定是W/(a N A)mol D.Wg该氖原子所含质子数是10W/a10、a mol H2和2a mol氦气具有相同的()A.分子数 B.原子数 C.质子数 D.质量11、下列说法错误的是()A.1mol任何物质都含有约6.02×1023个原子 B.0.012kg12C约含有6.02×1023个碳原子C.使用物质的量时,应用化学式指明粒子的种类 D.1mol H2的质量是1g二、填空题12、0.2 mol Al2(SO4)3中含有Al3+ mol、SO42-g。
高中化学必修一物质的量练习题(有答案)1.选择题:1.正确答案为D。
可以通过查找元素周期表得出氯气的摩尔质量为71 g/mol。
2.正确答案为B。
可以通过化学式得出二氧化硫中含有2个氧原子,三氧化硫中含有3个氧原子,因此含氧原子的个数比为2:3.3.正确答案为C。
根据分子式Cl2,可以得出1克氯气中含有1/71摩尔的Cl2分子,因此阿佛加德罗常数可表示为(1/35.5)n。
4.正确答案为B。
根据题意可列出K+离子数与水分子数的比例关系式,解得a=0.39 g。
5.正确答案为D。
根据题意可得到氙气和氟气的摩尔比为1:5,因此氙气和氟气的原子个数之比为1:6.6.正确答案为C。
23 g金属Na全部转变为金属离子时失去的电子个数可以通过Na的原子序数和电子排布规律计算得出。
7.正确答案为C。
过氧化钠与水反应时,氧化剂与还原剂物质的量之比为2:1.8.正确答案为C。
在任何条件下1mol H2所含的原子数为N_A。
9.正确答案为A。
相对原子质量是元素相对于12C的原子质量比,因此该氖原子的相对原子质量一定是12a/b。
10.正确答案为A。
根据理想气体状态方程,相同体积的氢气和氦气在相同条件下具有相同的分子数。
2.改写后的文章:物质的量练题1.选择题:1.下列关于XXX的说法中,正确的是()A。
氯气的摩尔质量是71克B。
氯化氢的摩尔质量为36.5 g/molC。
1摩氢气的质量为2克D。
O2的摩尔质量为16 g/mol。
2.对于相同质量的二氧化硫和三氧化硫来说,下列关系正确的是()A。
含氧原子的个数比为2∶3B。
含硫元素的质量比是5∶4C。
含氧元素的质量比为5∶6D。
含硫原子的个数比为1∶13.将1克氯气含有n个Cl2分子,则阿佛加德罗常数可表示为()A。
71nB。
(1/71)nC。
35.5nD。
(1/35.5)n4.将a g氯化钾溶于1.8L水中,恰使K+离子数与水分子数之比为1∶100,则a值为()A。
0.745B。