七年级科学浓酸的强腐蚀性(201911)
- 格式:ppt
- 大小:375.50 KB
- 文档页数:19



第十单元课题1常见的酸和碱浓硫酸的腐蚀性和酸的化学性质(第二课时)教学设计一、教学设计思路本课是课题《常见的酸和碱》的第二课时,酸是一类重要的化合物,在学生已经熟悉了几种常见酸物理性质和用途的基础上,本节课介绍浓硫腐蚀性和酸的化学性质,本节课在设计上注意联系学生实际,选择学生日常生活或平时实验中常见的物质,通过实验来说明浓硫腐蚀性和酸的性质。
同时,通过活动与探究,讨论等方法,培养学生的创新精神和实践能力,训练学生进行科学探究的方法。
二、教学目标知识与技能(1)认识酸的腐蚀性及使用时的安全注意事项。
(2)掌握酸的化学性质过程与方法(1)进一步认识和体验科学探究的过程。
(2)运用实验的方法获取信息,运用比较概括等方法对获取的信息进行加工。
情感态度与价值观(1)进一步增强探究物质的好奇心和求知欲。
三、教学重点盐酸,硫酸的化学性质。
四、教学难点酸的化学性质五、教学方法实验方法,自主探究,合作交流,巩固练习。
六、教具准备教师用具:仪器烧杯,玻璃棒,锥形瓶,带双孔塞,短玻璃棒,分液漏斗,短玻璃管,药品浓硫酸水学生用具:仪器点滴板, 试管,玻璃棒,玻璃片药品浓硫酸稀盐酸, 稀硫酸,紫色石蕊试液,无色酚酞试液,生锈的铁钉.其他纸张,小木棍,小花布七、教学过程上一节课我们学习了常见的酸的物理性质和用途,打开浓盐酸试剂瓶时看见什么现象,说明浓盐酸有什么性质?(挥发性)那么浓硫酸呢?(吸水性)引入新课师:浓硫酸有吸水性,还会有什么性质呢。
演示鸡爪浸入浓硫酸的实验,说明浓硫酸有强烈的腐蚀性。
在使用浓硫酸时我们应该注意安全不要将浓硫酸沾到皮肤和衣服上。
下面请我们同学自己通过实验来探究一下浓硫酸的腐蚀性。
将纸、小木棍、布放在玻璃片上做实验,记录实验现象。
(学生开始分组操作,教师巡回指导)分析产生这些现象的原因,讨论通过实验你得到哪些启发。
(使用浓硫酸时,必须十分小心,切不可将浓硫酸滴在衣服和皮肤上。
)提问:为什么纸张,小木棍,布料都变黑了呢?老师讲解:浓硫酸具有强烈的腐蚀性,它能把纸张、木材、布料、皮肤中的氢氧元素按水的组成比脱去,生成黑色的炭。

安全使用溶液(一)
一、教学目标
知识与技能:
1、认识稀盐酸对金属、大理石的腐蚀性。
2、认识浓硫酸具有强腐蚀性。
3、认识浓氢氧化钠溶液具有腐蚀性。
过程与方法:
通过实验,培养学生实验中仔细观察、认真比较、及时记录的好习惯。
情感态度与价值观:
通过活动,学生能树立一定的安全意识和自我保护意识
二、重点与难点
【重点】认识一些酸、碱溶液的腐蚀性。
【难点】描述稀盐酸与金属的反应。
三、教学准备
【器材】
活动一:试管、试管夹及试管架、锌粒、镊子、稀盐酸、木条、酒精灯、镁条、铜片、铁片。
活动二:大理石颗粒、试管、镊子、稀盐酸、澄清石灰水、单孔橡皮塞、导管。
活动三:表面皿、白卡片、浓硫酸、安全眼镜、布条、猪肉。
活动四:试管、试管夹、浓氢氧化钠溶液、全羊毛绒线、玻璃棒、酒精灯、烧杯、叶片、镊子、三脚架、石棉网。
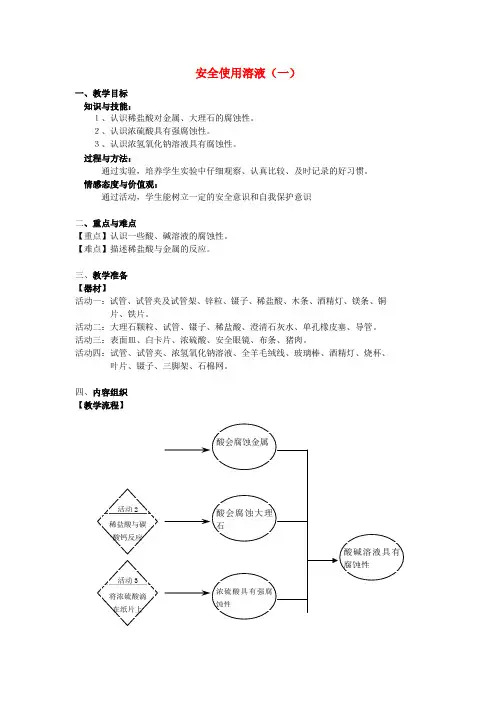
四、内容组织
【教学流程】
【活动设计】
活动一:稀盐酸和金属反应
活动目标:
1、通过实验,培养学生实验中仔细观察、认真比较、及时记录的好习惯。
2、能够描述稀盐酸与金属的反应。
活动二:稀盐酸与碳酸钙的反应
活动目标:
1、通过实验了解稀盐酸与大理石的反应。
2、运用所学解释大理石雕刻的腐蚀问题。
活动三:浓硫酸的强腐蚀性
活动目标:
1、通过观察实验,了解浓硫酸具有强腐蚀性。
活动四:浓的氢氧化钠溶液的腐蚀性
活动目标:。



初中化学强腐蚀性物质教案教学目标:1. 了解强腐蚀性物质的定义和特点;2. 掌握常见的强腐蚀性物质及其用途;3. 能够正确处理和使用强腐蚀性物质,避免危险发生。
教学重点:1. 强腐蚀性物质的定义和特点;2. 常见强腐蚀性物质及其用途;3. 强腐蚀性物质的安全使用和处理。
教学难点:1. 强腐蚀性物质的安全使用和处理;2. 学生能够根据实际情况判断和处理腐蚀性事故。
教学准备:1. 教师准备PPT或黑板,展示强腐蚀性物质的图片和信息;2. 准备一些实际案例,用于引导学生思考和讨论。
教学过程:一、导入(5分钟)1. 向学生介绍强腐蚀性物质的定义和特点;2. 引导学生思考为什么需要学习和了解强腐蚀性物质。
二、学习强腐蚀性物质(15分钟)1. 教师展示PPT或黑板,介绍常见的强腐蚀性物质,如盐酸、硫酸、硝酸、氢氧化钠等;2. 学生通过观察图片和阅读教材,了解这些物质的物理和化学性质;3. 教师引导学生了解强腐蚀性物质的用途,如工业生产、实验室研究等。
三、案例分析(15分钟)1. 教师提供一些实际案例,描述一些因不当使用或处理强腐蚀性物质而引发的事故;2. 学生分组讨论,分析案例中存在的问题和可以采取的预防措施;3. 各小组向全班汇报讨论结果,教师进行点评和总结。
四、安全使用和处理强腐蚀性物质(15分钟)1. 教师引导学生了解如何正确使用和处理强腐蚀性物质,如穿戴防护用品、避免接触皮肤和眼睛等;2. 学生通过实验或观看实验视频,了解强腐蚀性物质的危险性和正确操作方法;3. 教师强调在实验室或家庭中使用强腐蚀性物质时的注意事项。
五、巩固练习(10分钟)1. 教师给出一些练习题,巩固学生对强腐蚀性物质的知识掌握;2. 学生独立完成练习题,教师进行点评和解答。
六、总结和反思(5分钟)1. 教师引导学生总结本节课所学的内容,强调强腐蚀性物质的重要性和安全使用;2. 学生分享自己的学习心得和收获,提出问题和疑惑。
教学延伸:1. 邀请实验室专家或医生来校进行专题讲座,让学生更深入了解强腐蚀性物质的安全使用和处理;2. 组织学生参观实验室或工厂,实地了解强腐蚀性物质的应用和安全管理。



初中化学强腐蚀性物质教案主题:强腐蚀性物质年级:初中课时:1课时教学目标:1.了解强腐蚀性物质的定义及特点。
2.学习正确使用强腐蚀性物质的方法。
3.掌握强腐蚀性物质对人体和环境的危害。
教学内容:1.什么是强腐蚀性物质?2.强腐蚀性物质的常见种类。
3.使用强腐蚀性物质的注意事项。
4.强腐蚀性物质对人体和环境的危害。
教学过程:一、导入(5分钟)教师引导学生回顾上一课时学到的化学知识,引出本节课的主题——强腐蚀性物质。
二、讲解强腐蚀性物质(10分钟)1.通过PPT或实物展示,向学生介绍强腐蚀性物质的定义和特点。
2.列举一些常见的强腐蚀性物质,如硫酸、氢氟酸等。
三、使用方法(10分钟)1.讲解正确使用强腐蚀性物质的方法,包括佩戴防护装备、小心操作、及时清洁等。
2.举例说明在实验室或日常生活中如何正确使用强腐蚀性物质。
四、危害及应急措施(15分钟)1.讲解强腐蚀性物质对人体和环境的危害,包括皮肤灼伤、眼睛损伤等。
2.介绍遇到强腐蚀性物质意外时的应急措施,如立即用清水冲洗受伤处等。
五、小结(5分钟)教师帮助学生总结本节课的重点内容,强调正确使用强腐蚀性物质的重要性。
六、作业(5分钟)布置作业:请学生整理一份强腐蚀性物质的安全使用手册,包括定义、常见种类、使用方法和应急措施等。
教学反思:本节课主要围绕强腐蚀性物质展开教学,通过理论讲解和实例说明,帮助学生了解强腐蚀性物质的特点、正确使用方法以及危害及应急措施。
同时,通过作业巩固学生对知识的理解和应用,提高他们对强腐蚀性物质的安全意识和应对能力。
《浓硫酸的腐蚀性》进阶练习一、单选题1.下列有关酸的性质说法正确的是()A.浓硫酸与浓盐酸都具有吸水性B.稀硫酸与稀盐酸都可以除铁锈C.打开盛有浓硫酸与浓盐酸的试剂瓶瓶塞瓶口都有白雾D.浓硫酸与浓硝酸长期放置液体的质量都会减少2.下列说法错误的是()A.用pH试纸测得醋酸溶液的pH为9B.用稀盐酸除去铁表面的铁锈C.用熟石灰改良酸性土壤D.浓硫酸有吸水性,可用于干燥剂3.认真细致地观察和分析实验现象,有助于获得化学知识并学会科学探究的方法,以下分析你认为合理的是()A.某两种物质反应,生成了盐和水,所以该反应一定是中和反应B.将浓盐硫酸滴在火柴梗上,火柴梗变黑,可证明浓硫酸具有吸水性C.某固体化肥与熟石灰混合研磨产生刺激性气味的气体,可证明该化肥一定是铵态氮肥D.某物质大红加入稀盐酸,有气泡产生,可证明该物质一定是碳酸盐二、简答题4.(4分)在实验室中,下列做法正确的是。
A.不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,再涂上3%-5%的碳酸氢钠溶液B.氢氧化钠有强烈的腐蚀性,实验使用时,最好戴上防护眼镜C.在实验室里不能用品尝的办法区别食盐和蔗糖晶体D.配制稀硫酸时,可先在量筒中加入一定量的浓硫酸,再慢慢注入水并不断搅拌E.加热试管里的液体时,试管外壁应干燥F.用pH试纸测定溶液的酸碱度时,将pH试纸放入待测液中蘸取为了验证木炭可被浓H2SO4氧化成CO2,选用如图所示仪器(内含物质)组装成实验装置:5.为了验证木炭可被浓H2SO4氧化成CO2,选用如图所示仪器(内含物质)组装成实验装置:(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):________接________,________接________,________接________.(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中______________________,丙中___________________________.(3)丁中酸性KMnO4溶液的作用是_____________________________________.(4)写出甲中反应的化学方程式__________________________________参考答案1.B2.A3.C4. ABCE5.(1)A F E C D B(2)乙中澄清石灰水变浑浊丙中品红溶液未褪色(3)吸收SO2(4)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O【解析】1. 解:A、浓硫酸具有吸水性,浓盐酸具有挥发性,故错误;B、稀盐酸和稀硫酸都可与铁锈中的氧化铁反应,所以都可用于除铁锈,故B正确;C、浓硫酸具有吸水性不具有挥发性,浓盐酸具有挥发性挥发出氯化氢气体,氯化氢与空气中的水蒸气接触形成盐酸小液滴,所以瓶口有白雾,故C错误;D、浓硫酸具有吸水性,浓硝酸具有挥发性,因此,浓硫酸长期放置液体的质量会增加,浓硝酸长期放置液体的质量会减少,故错误。