制药用水系统1.1
- 格式:ppt
- 大小:366.50 KB
- 文档页数:3

制药污水处理工艺引言概述:制药行业是一个重要的工业部门,但同时也是一个产生大量污水的行业。
制药污水的处理是保护环境和人类健康的重要环节。
本文将介绍制药污水处理工艺的相关内容,包括预处理、生物处理、物理化学处理和终端处理。
一、预处理1.1 调节pH值:制药废水中的pH值通常偏酸或偏碱,需要通过加碱或加酸来调节pH值,以便于后续处理。
1.2 沉淀处理:通过加入适量的沉淀剂,使污水中的悬浮物和重金属离子形成沉淀,以便于后续处理。
1.3 溶解氧去除:通过通入氮气或其他气体,将溶解氧从污水中去除,以减少后续生物处理过程中的氧化反应。
二、生物处理2.1 好氧处理:将经过预处理的制药污水引入好氧生物反应器,利用好氧微生物对有机物进行降解,产生二氧化碳和水。
2.2 厌氧处理:将经过好氧处理的污水引入厌氧生物反应器,利用厌氧微生物对有机物进行降解,产生甲烷和二氧化碳。
2.3 污泥处理:通过沉淀、浓缩和脱水等步骤,将生物处理过程中产生的污泥进行处理,以减少废物的排放。
三、物理化学处理3.1 活性炭吸附:将生物处理后的污水引入活性炭吸附器,利用活性炭对有机物和一些难以降解的有害物质进行吸附,提高水质。
3.2 氧化反应:通过加入氧化剂,如氯或臭氧,对污水中的有机物进行氧化反应,降解有机物的浓度。
3.3 深度过滤:通过过滤器或滤料,将污水中的悬浮物、胶体和微生物等进行深度过滤,提高水质。
四、终端处理4.1 紫外线消毒:将经过物理化学处理的污水引入紫外线消毒器,利用紫外线辐射杀灭残留的微生物,确保出水符合排放标准。
4.2 残留物处理:对终端处理后产生的残留物进行处理,如干燥、焚烧或填埋等方式,以减少对环境的影响。
4.3 监测与控制:建立完善的监测系统,对处理过程进行实时监测,确保处理效果符合要求,并进行必要的调整和控制。
总结:制药污水处理是一个复杂而重要的过程,需要经过预处理、生物处理、物理化学处理和终端处理等多个阶段。
通过合理选择和组合不同的处理工艺,可以有效地降低制药污水对环境的影响,保护环境和人类健康。

制药用水指南目录一.综述(一)制药用水(二)水系统二.定义三.水的质量标准(一)饮用水(二)纯化水(三)注射用水(四)非药典要求用水四.饮用水、非药典要求用水及药典要求用水的使用(一)饮用水(二)非药典要求用水(三)药典要求用水五.药典要求用水制造系统的设计(一)水纯化方法(二)总设计(三)纯化水(四)注射用水六.水系统储罐及环路的设计(一)总体要求(二)典型的纯化水储存及分配环路模式(三)典型的注射用水储存及分配环路模式(四)储罐(五)呼吸滤器(六)管道(七)循环泵(八)热交换器(九)使用点(十)过程测量与控制七.建材及方法(一)纯化水与注射用水(二)绝热(三)其它八.水系统的试运行与验证(一)试运行(二)系统确认文件(三)系统确认及其取样程序(四)验收标准及验证报告(五)变更控制与再确认九.水系统的日常监控(一)饮用水(二)工艺水系统(三)纯化水与注射用水十.水系统日常运行及维护保养(一)清洁与钝化十一.实验室用水十二.取样(一)取样规程(二)纯化水系统代表性取样点的选择(三)取样操作和检测十三.参考文献一.综述(一)制药用水在药品制造过程不同阶段的工艺用水及其检测过程中,水是使用最广泛的物质、原料或起始物料。
药品的不同给药方式,决定了水的不同质量等级需求。
用于药品制造过程不同阶段的工艺用水及实验室用水均需满足各自的要求。
在整个处理、储存和分配过程中,水的质量(包括微生物学和化学质量)控制是人们关注的焦点。
与其他产品和组份不同,水通常根据需要从水系统中获得,使用前不经过质量检验或批质量评价程序。
因此,应当保证其质量符合特定的标准。
另外,某些微生物检验可能需要一段培养时间,因此,其检验结果很可能滞后于水的使用。
应优先考虑控制制药用水的微生物学质量。
某些微生物可能在水处理单元、储存和分配环节繁殖。
通过日常的消毒和各种防止微生物繁殖的方法以尽量避免生物污染至关重要。
(二)水系统制药用水的生产、储存和分配系统的设计、选材、建设、安装、试运行、验证和维护,应能确保其能够可靠地生产具有相应质量的水。


水系统1、概述水在制药工业中是应用最广泛的工艺原料,用做药品的成份、溶剂、稀释剂等。
制药用水作为制药原料,各国药典定义了不同质量标准和使用用途的工艺用水,并要求定期检测。
水极易滋生微生物并助其生长,微生物指标是其最重要的质量指标,在水系统设计,安装,验证,运行和维护中需采取各种措施抑制其生长。
水是良好的溶剂、尤其是与自然界失去平衡的纯化水和注射用水,具有极强的溶解能力和极少的杂质,广泛用于制药设备和系统的清洗。
鉴于水在制药工业中的既作为原料又作为清洗剂,各国药典对制药用水的质量标准,用途都有明确的定义和要求;各个国家和组织的GMP将制药用水的生产和储存分配系统视为制药生产的关键系统,对其设计,安装,验证,运行和维护等提出明确要求。
在指南第二章将具体介绍我国和其他国家药典和GMP对制药用水的要求。
我国幅员辽阔,各地水质不同,季节的变化也会导致水质的巨大变化,我国制药企业使用的最初原料水未必常年符合饮用水的标准要求,需将其依次处理成饮用水,纯化水,注射用水等制药用水,适合不同的工艺需求。
在指南第三章中将介绍制药用水处理的各种技术,工艺和设备。
制药生产中其它原料、辅料、包装材料是按批检验和释放的,而作为原料的制药用水(饮用水,纯化水或注射用水)通常是通过管道连续流出的,随时取用的,其微生物属性等质量指标通常无法连续地实时检测到。
通常是先使用到产品中,若干天后才能知道其微生物指标是否合格,为保证制药用水系统生产出的水在任何时候是好的,即水系统生产质量的稳定性和一致性是各国药品监管部门和制药企业共同关注的重大问题。
各国GMP对水系统的设计和验证有严格要求,第四章将介绍水系统的设计和验证。
在水系统的设计、验证和运行过程中,制药企业、药监部门都遇到各种各样的疑问、问题和争议,我们参照国际组织尤其是ISPE(国际制药工程协会)的指南和工程实践,在第五章对常见问题进行了讨论。
第六章介绍一些关于水的化学和微生物知识以及水系统的钝化技术。
原水(自来水、井水、湖泊水等)、制药用水(非药典水与药典水)、非药典水(饮用水、软化水、去离子水、反渗透水、超滤水等)、药典水(纯化水、注射用水、灭菌注射用水),其中纯化水与注射用水为原料水,灭菌注射用水为产品水。
在GMP里面,能找出来的需要用制药用水的话语不多,其中进入制药车间的必须是制药用水,最低标准的制药用水为饮用水,所以,饮用水是可以被引入的最低档次的制药用水.有些同事说用自来水洗手,肯定不合适,因为它不符合制药用水范畴,为什么我国大量存在纯化水洗手,是因为我们没有饮用水,所以,企业只能拔高要求,用纯化水当可以洗手用的水。
GMP规定,非无菌药品生产的最终清洗用水及配液用水需要用纯化水,无菌药品生产的最终清洗用水及配液用水需要用注射用水,但没有法规规定注射剂车间必须有纯化水,这一点大家务必理解!与法规不同,中国药典给了我们一个门槛,制备注射用水必须是“蒸馏法+纯化水,所以,中国几乎所有的本土企业和95%的外企都是纯化水+注射用水的标配,且两个系统都严格参考三阶段法进行验证。
问题来了,很多企业规模很大,如果这样严格执行,质量部基本上都累趴下了。
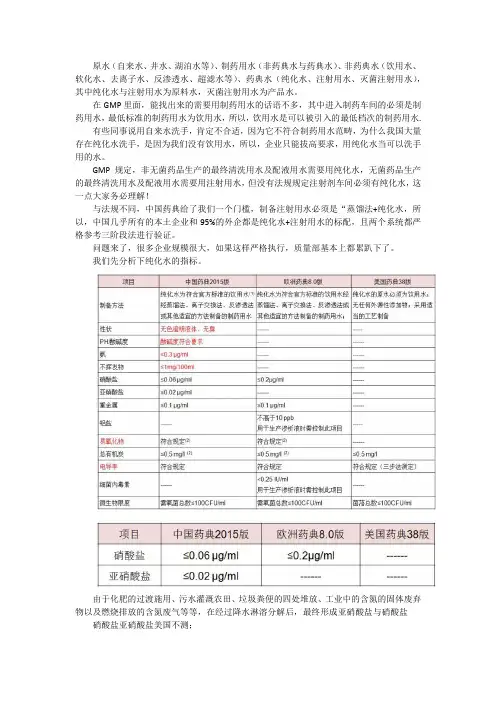
我们先分析下纯化水的指标。
由于化肥的过渡施用、污水灌溉农田、垃圾粪便的四处堆放、工业中的含氮的固体废弃物以及燃烧排放的含氮废气等等,在经过降水淋溶分解后,最终形成亚硝酸盐与硝酸盐硝酸盐亚硝酸盐美国不测;饮用水中硝酸盐和亚硝酸盐浓度过高对人体会造成危害,易致癌(主要对消化器官)和诱发高铁血红蛋白症(尤其是婴儿青紫症)。
水中的亚硝酸盐不稳定,易在微生物或氧化剂的作用下转化为硝酸盐和氨氮。
中国的原水因为农药化肥污染,的确对于硝酸盐等需要严格监控,所以,我认为参考中国或者欧盟的规定,测定该指标是有意义的,未来我们发展到一定阶段,再考虑取消来得及。
这四个指标,害了不少企业,谁能告诉我不挥发物能测定吗?【这一个括号,不是张老师讲述的,是群友发的一个,可以看看:“不挥发物:取本品100ml,置105℃恒重的蒸发皿中,在水浴上蒸干,并在105℃干燥至恒重,遗留残渣不得过1mg。

目的:本程序依据《药品生产质量管理规范》(2010修订版)规定了生产用水的管理。
范围:本程序适用于各生产工序。
职责:质量管理部、生产部
内容:
1使用范围
1.1饮用水:一般生产区工艺用水及清洁、消毒液配制用水。
1.2纯化水:洁净区工艺用水及清洁用水。
2饮用水管理
2.1饮用水每一年由卫生防疫部门检测一次,有合格检测报告。
2.2二次给水设施(包括高低位水箱,水泵、管道),有专人管理,水池、水箱必须加盖。
2.3纯化水管理:
2.3.1制备的纯化水各项检验指标合格方可使用。
2.3.2化验室每周取样全检,并出具检测报告。
2.3.3制水系统水箱及管道每三个月清洗一次。
2.4贮罐和管路的清洁及消毒:
2.4.1清洁
a)清洁频次:每三个月一次。
b)清洁方法:
○1用饮用水冲洗管路及贮罐(必要时水加热)。
○2用纯水冲洗至中性。
2.4.2 消毒
a)消毒频次:供水时。
b)消毒方法:用紫外灯、臭氧消毒。

食品和药品管理局罗克维尔MD 208572000年10月27日亲爱的同事,食品和药品管理局很荣幸与国际制药工程协会在《水系统的制药工程基准指南》的制定方面合作。
我们非常感谢工程师们努力合作和十分专注的工作,他们是自发的开始制定这个指南。
这是通过公众和个人的合作努力,使产业和消费者都能获益的很好的典范。
这个文件包括了新的水和蒸汽系统工程的设计、构造和操作方面。
它是对现有FDA指南关于水系统方面的详述。
这个指南是国际制药工程协会独家制定和拥有的。
这个指南不是FDA规则、标准或是指导文件,根据这个指南构建的水系统或许不能达到FDA的要求。
FDA为国际制药工程协会提出建议作为制定本指南的参考。
它对工程专业的人与设计、建造和操作新的水和蒸汽系统的行业很有帮助。
FDA很高兴这个文件的制定,我们也很期待以后继续的合作关系,因为未来的《制药工程基准指南》正在制定。
真诚的,珍妮特伍德可克,MD药品研发评估中心理事丹尼斯贝克法规部门联合专员国际制药工程协会制药工程指南概要多年来,制药行业经历了新设备投入成本的提高,成本的提高一部分是由于符合规则的要求的不确定性。
涉及到的某些重要的领域有验证,特别是和自动控制系统有关,还有对源设施的验证。
由于没有统一和被广泛接受的对有些规则的解释,导致了FDA高人一等的作风。
建造技术日益先进的设备的做法导致了成本的增加、更长的引导时间、有些情况下会导致新产品推迟上市。
在1994年5月,制药行业的工程代表和国际制药工程协会以及食品和药品管理局展开了探讨。
1994年11月的讨论的结果决定国际制药工程协会开始致力于9种设备的工程指南的制定,就是现在所说的《制药工程基准指南》。
首先是“化学制药指南”在1996年6月出版。
接着是“固体口服剂形态指南,”在1998年2月出版,然后就是“灭菌生产设备指南,”在1999年2月出版。
这是第四个出版的指南,包括了制药水和蒸汽系统。
每个工程指南是都是国际制药工程协会独家制定和拥有的。


制药企业常见的几种污水处理工艺技术随着我国医药工业的发展,制药污水已逐渐成为重要的污染源之一,如何处理该类污水是当今环境保护的一个难题。
制药污水处理设备处理制药工业污水主要包括抗生素生产污水、合成药物生产污水、中成药生产污水以及各类制剂生产过程的洗涤水和冲洗污水四大类。
其污水的特点是成分复杂、有机物含量高、毒性大、色度深和含盐量高,特别是生化性很差,且间歇排放,属难处理的工业污水。
制药污水的处理工艺及选择制药污水的水质特点使得多数制药污水单独采用生化法处理根本无法达标,所以在生化处理前必须进行必要的预处理.一般应设调节池,调节水质水量和pH,且根据实际情况采用某种物化或化学法作为预处理工序,以降低水中的SS、盐度及部分COD,减少污水中的生物抑制性物质,并提高污水的可降解性,以利于污水的后续生化处理。
预处理后的污水,可根据其水质特征选取某种厌氧和好氧工艺进行处理,若出水要求较高,好氧处理工艺后还需继续进行后处理.具体工艺的选择应综合考虑污水的性质、工艺的处理效果、基建投资及运行维护等因素,做到技术可行,经济合理。
总的工艺路线为预处理—厌氧—好氧-(后处理)组合工艺。
如陈明辉等采用水解吸附-接触氧化—过滤组合工艺处理含人工胰岛素等的综合制药污水,处理后出水水质优于GB8978-1996的一级标准。
气浮-水解-接触氧化工艺处理化学制药污水、复合微氧水解—复合好氧—砂滤工艺处理抗生素污水、气浮—UBF-CASS工艺处理高浓度中药提取污水等都取得了较好的处理效果。
1 制药污水的处理方法制药污水的处理方法可归纳为以下几种:物化处理、化学处理、生化处理以及多种方法的组合处理等,各种处理方法具有各自的优势及不足。
1。
1 物化处理根据制药污水的水质特点,在其处理过程中需要采用物化处理作为生化处理的预处理或后处理工序.目前应用的物化处理方法主要包括混凝、气浮、吸附、氨吹脱、电解、离子交换和膜分离法等。
1。
1.1 混凝法该技术是目前国内外普遍采用的一种水质处理方法,它被广泛用于制药污水预处理及后处理过程中,如硫酸铝和聚合硫酸铁等用于中药污水等.高效混凝处理的关键在于恰当地选择和投加性能优良的混凝剂.近年来混凝剂的发展方向是由低分子向聚合高分子发展,由成分功能单一型向复合型发展.刘明华等以其研制的一种高效复合型絮凝剂F—1处理急支糖浆生产污水,在pH 为6。
标准操作规程进行。
适用范围:纯化水制备系统。
责任人:操作人,工程部。
一、标准操作程序:1.概述:本系统分为预处理部分、反渗透部分、离子交换部分、供水部分、系统控制部分。
1.1预处理部分:原水箱、原水泵、机械过滤器、活性炭过滤器、软化器。
1.2反渗透部分:保安过滤器、高压泵、反渗透组件。
1.3离子交换部分:中间水箱、混床、树脂截留器。
1.4供水部分:纯水箱、纯水泵、紫外线杀菌器、精密过滤器、纯化水管道。
1.5系统控制部分:PLC、漏电保护开关、交流接触器、继电器、压力传感器、流量计、电导率仪。
2.系统标准操作程序:2.1启动运行:2.1.1确定水、电正常,系统所有阀门处于正确位。
2.1.2接通电源,所有开关置于自动位,系统即处于自动运行状态。
2.2过滤器正反冲洗:每班下班前必须反洗和正洗机械过滤器一次,每隔三天反洗和正洗一次活性炭过滤器。
(参见机械过滤器、活性炭过滤器正、反洗操作程序。
)2.3停止运行:2.3.1将电源开关置于停止位即可,若停机时间较长,应将开关全部置于停止位并将总电源切断。
2.3.2关闭进水阀。
2.3.3排空中间水箱、纯水箱贮水,并关闭排水阀。
2.3.4及时清场,挂“设备完好”状态牌。
2.3.5及时、如实、认真、完整填写相关记录。
3.机械过滤器标准操作程序:3.1初次运行:开启V2、V3,关闭出水阀进行反冲洗,等反冲出水口出水后,关闭泵及阀门,使滤料浸泡4小时,再开启V2和V3及原水泵进行反冲洗,至反冲出水清澈为止。
3.2标准运行:开启进水阀V1。
调节标准流量即为正常运行。
一般每天进行反冲一次。
3.3反冲洗:3.3.1打开V2、V3。
3.3.2将面板上的原水泵开关打到手动位置(其余泵开关置于停止位),冲洗30分钟。
3.4正洗:反冲洗后,需要进行正冲洗:3.4.1打开V1、V4。
3.4.2将面板上的原水泵开关打到手动位置,冲洗20分钟。
3.4.3冲洗完毕,打开V1,投入正常运行。
4、活性碳过滤器标准操作程序:4.1初次运行:启动活性炭过滤器,开启V6、V7进行反冲洗,等反冲出水口出水后,关闭水泵及阀门,使滤料(活性碳)浸泡约8小时。
制药用水简介制药用水通常指制药工艺过程中用到的各种质量标准的水。
制药用水是制药生产过程的重要原料,参与了整个生产工艺过程,包括原料生产、分离纯化、成品制备、洗涤过程、清洗过程和消毒过程等。
因此,在制药生产过程中,制药用水系统是至关重要的组成部分。
制药用蒸汽系统是湿热灭菌的一种介质,主要应用于注射用水系统、湿热灭菌柜、生物反应器、配液罐、管路系统、过滤器等重要设备与系统的灭菌。
常见的制药用蒸汽系统主要为纯蒸汽系统,纯蒸汽的冷凝水直接与设备或物品表面接触,或者接触到用以分析物品性质的物料,纯蒸汽冷凝后的水质需满足注射用水质量标准,因此,制药用蒸汽系统也是医药行业无菌生产工艺过程中一个非常重要的组成部分。
制药用水和制药用蒸汽的质量从药品生产质量管理规范(GMP)和药典的角度来看非常重要,从良好的工程管理规范(GEP)和经济的角度来看也同样重要,制药生产企业必须证明其所使用的制药用水系统与制药用蒸汽系统能始终如一地提供达到质量标准的制药用水与制药用蒸汽。
通常情况下,制药行业将制药用水系统与制药用蒸汽系统统称为制药用水系统,简称水系统。
制备制药用水的本质是减少或消灭潜在的污染源,欧盟和WHO将制药用水中的杂质列为潜在杂质来源之一,基于这个问题的考虑,本书提出如何进行制药用水制备、储存与分配系统的设计并确保污染风险得到控制。
1.1 制药用水的分类对制药用水的定义和用途,通常以药典为准,各国药典对制药用水通常有不同的定义、不同的用途规定。
从使用角度分类,制药用水主要分为散装水与包装水两大类。
散装水特指制药生产企业按相关生产工艺自制的制药用水,例如,中国药典认可的散装水包括纯化水和注射用水;欧盟药典认可的散装水包括散装纯化水、草药提取用水和注射用水;美国药典认可的散装水包括散装纯化水、血液透析用水和注射用水等。
包装水也称成品水,特指按制药工艺生产的包装成品水,例如,中国药典收录了灭菌注射用水;欧盟药典收录了包装纯化水和灭菌注射用水等;美国药典收录了抑菌注射用水、灭菌吸入用水、灭菌注射用水、灭菌冲洗用水和灭菌纯化水等多种产品水(表1)。
GMP制药用水及制药用蒸汽技术指南(讨论稿)2009-10-29GMP工程技术中心发布目录一、引言二、适用范围三、水的质量标准(一)饮用水(二)纯化水(三)注射用水(四)其他级别的水四、不同级别的水在药品生产中的应用五、制水系统的设计(一)总体设计要求(二)纯化水系统(三)纯蒸汽发生器及蒸馏水机六、储罐和环路的设计(一)总体设计要求(二)典型的纯化水储存及分配环路模式(三)典型的注射用水储存及分配环路模式(四)储罐(五)呼吸滤器(六)管道(七)循环泵(八)热交换器(九)使用点(十)过程检测与控制七、制药用水材料及安装工艺要求(一)接触材料(二)保温(三)清洁与钝化(四)其他八、工艺用水管理九、水系统运行与验证(一)试运行(二)系统确认文件(三)系统确认及其取样程序(四)验收标准与确认报告十、水系统的日常监控(一)水系统的日常监测(二)特定工艺用水系统(三)纯化水与注射用水(四)制药用水常见问题十一、制药用水系统的消毒和灭菌(一)部分细菌和真菌在不同温度条件下的生长情况(二)常见细菌的致死时间(三)制药用水中热源的去除(四)紫外线杀菌在水处理中的应用(五)臭氧灭菌在水处理中的应用十二、水系统日常运行及维护保养十三、实验室用水十四、取样(一)取样规程(二)纯化水和WFI监控点阀门的选用(三)取样和检测十五、制药用蒸汽(一)引言(二)蒸汽的制备和分配(三)蒸汽质量属性及其检测(四)纯蒸汽系统的性能确认(五)纯蒸汽系统的常规监测与再确认十六、术语十七、参考文献一、引言水是药物生产中用量最大、使用最广的一种原料,用于生产过程及药物制剂的制备。
不同要求的药品,决定了对水的不同质量的需求。
Water is the most widely used substances, raw material, or ingredient in the production, processing, and formulation of compendial articles. (USP General Informationsection 1231)在水的处理、储存和分配的过程中,水的质量(包括微生物学和化学质量)控制是人们关注的焦点。
水系统1、概述水在制药工业中是应用最广泛的工艺原料,用做药品的成份、溶剂、稀释剂等。
制药用水作为制药原料,各国药典定义了不同质量标准和使用用途的工艺用水,并要求定期检测。
水极易滋生微生物并助其生长,微生物指标是其最重要的质量指标,在水系统设计,安装,验证,运行和维护中需采取各种措施抑制其生长。
水是良好的溶剂、尤其是与自然界失去平衡的纯化水和注射用水,具有极强的溶解能力和极少的杂质,广泛用于制药设备和系统的清洗。
鉴于水在制药工业中的既作为原料又作为清洗剂,各国药典对制药用水的质量标准,用途都有明确的定义和要求;各个国家和组织的GMP将制药用水的生产和储存分配系统视为制药生产的关键系统,对其设计,安装,验证,运行和维护等提出明确要求。
在指南第二章将具体介绍我国和其他国家药典和GMP对制药用水的要求。
我国幅员辽阔,各地水质不同,季节的变化也会导致水质的巨大变化,我国制药企业使用的最初原料水未必常年符合饮用水的标准要求,需将其依次处理成饮用水,纯化水,注射用水等制药用水,适合不同的工艺需求。
在指南第三章中将介绍制药用水处理的各种技术,工艺和设备。
制药生产中其它原料、辅料、包装材料是按批检验和释放的,而作为原料的制药用水(饮用水,纯化水或注射用水)通常是通过管道连续流出的,随时取用的,其微生物属性等质量指标通常无法连续地实时检测到。
通常是先使用到产品中,若干天后才能知道其微生物指标是否合格,为保证制药用水系统生产出的水在任何时候是好的,即水系统生产质量的稳定性和一致性是各国药品监管部门和制药企业共同关注的重大问题。
各国GMP对水系统的设计和验证有严格要求,第四章将介绍水系统的设计和验证。
在水系统的设计、验证和运行过程中,制药企业、药监部门都遇到各种各样的疑问、问题和争议,我们参照国际组织尤其是ISPE(国际制药工程协会)的指南和工程实践,在第五章对常见问题进行了讨论。
第六章介绍一些关于水的化学和微生物知识以及水系统的钝化技术。