血液安全技术核查指南医疗机构
- 格式:docx
- 大小:20.97 KB
- 文档页数:9

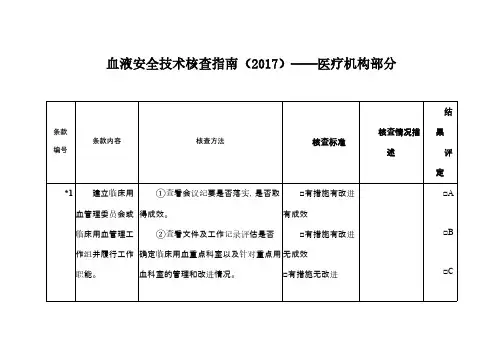
血液安全技术核查指南(2017)――医疗机构部分
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为
B,符合第三项评为C,符合第四项评为D (第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B; “良”:所有条款没有得D,同时得到6-9个A或10-14个B; “合格”:所有条款没有得D,同时少于6个A或10个B; “不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“ * ”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
被检查单位临床用血负责人(签名):
核查人员(签名):
核查日期:2017年。
的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期:2017年月日。
血液安全技术核查指南(2017)——医疗机构部
分
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符合第三项评为C,符合第四项评为D (第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期:2017年月日。
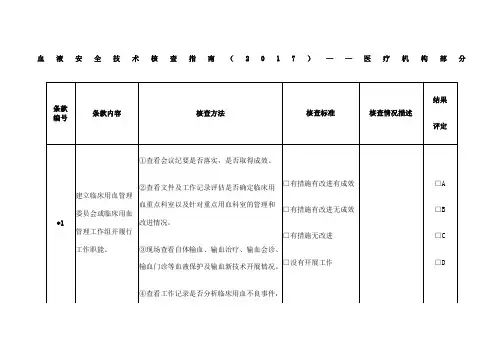
血液安全技术核查指南(2017)——医疗机构部分
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符合第三项评为C,符合第四项评为D(第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期: 2017年月日。
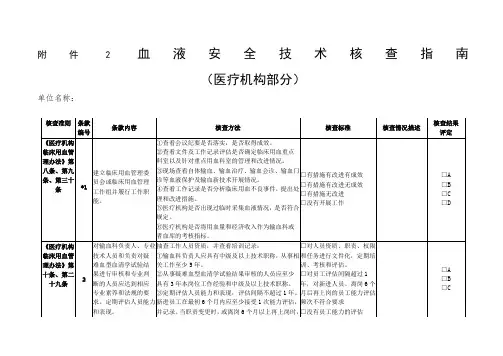
附件2血液安全技术核查指南
(医疗机构部分)
单位名称:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符
合第三项评为C,符合第四项评为D(第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;
“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期:2017年月日。

最新血液安全技术核查指南一、背景血液安全是医疗领域的重要组成部分,涉及到病人的生命安全和社会公共利益。
为确保血液产品的质量和安全,各国都建立了相应的法规和技术标准。
我国自上世纪80年代开始发展血液事业,经过多年的努力,血液安全水平得到了显著提高。
然而,随着血液制品需求的不断增加,血液安全问题仍然面临诸多挑战。
为此,本指南旨在为血液安全技术核查提供一套系统的、科学的方法,以保障血液产品的质量和安全。
二、核查目标1. 确保血液采集、制备、储存、运输和使用的各个环节符合国家法规和技术标准;2. 识别和评估血液安全潜在风险,提高风险防控能力;3. 促进血液制品质量的持续改进和提高;4. 增强血液安全管理体系的科学性、规范性和有效性。
三、核查内容1. 法规与标准:核查血液采集、制备、储存、运输和使用等相关法规和技术标准是否得到有效执行。
2. 人员培训:核查血液工作人员的专业培训情况,包括岗位培训、复训和资格认证等。
3. 设备与设施:核查血液采集、制备、储存、运输和使用的设备与设施是否符合国家法规和技术标准,包括设备性能、设施环境、操作程序等。
4. 质量控制:核查血液质量控制体系的建设及运行情况,包括质量方针、质量目标、质量手册、程序文件等。
5. 生物安全:核查血液制品生物安全管理情况,包括生物防护、废物处理、实验室安全等。
6. 血液制品追溯:核查血液制品追溯系统的建立和运行情况,确保制品可追溯、可追踪。
7. 临床应用:核查血液制品临床应用管理情况,包括临床使用规范、不良反应监测、输血并发症处理等。
四、核查方法1. 文档审查:对血液安全相关文件进行审查,包括法规、标准、操作规程、质量记录等。
2. 现场检查:对血液采集、制备、储存、运输和使用等环节进行现场检查,包括设备设施、操作过程、环境条件等。
3. 访谈调查:与血液工作人员进行访谈,了解其在工作中遇到的问题及建议。
4. 样品抽检:对血液制品进行抽检,检验其质量是否符合国家法规和技术标准。

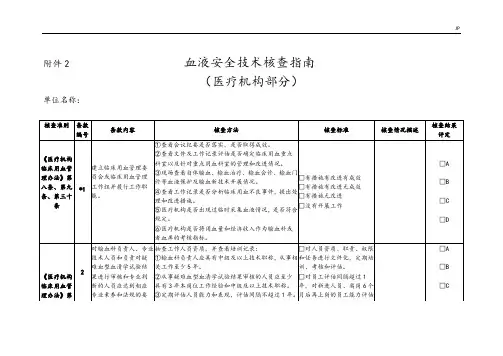
附件2 血液安全技术核查指南
(医疗机构部分)单位名称:
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符合第三项评为
C,符合第四项评为D(第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;“良”:所有
条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期:年月日。

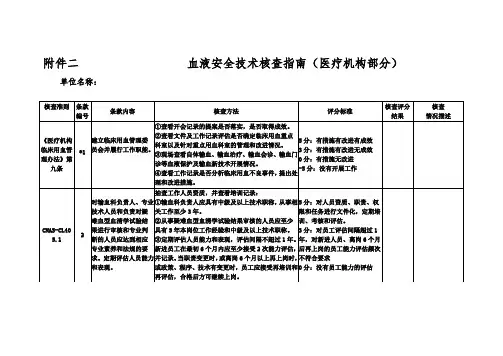
2021血液安全技术核查指南(医疗机构)附件2血液安全技术核查指南(医疗机构)单位名称:《医疗机构临床用血管理办法》第八条、第九条、第三十条验证标准编号验证结果评价内容验证方法验证标准验证说明① 检查会议记录是否落实有效。
② 检查文件和工作记录,评估是否确定临床重点血液科室以及重点血液科室的管理和改进。
建立临床用血管理委员会③ 检查新的血液保护和输血技术的发展,如自体输血、输血治疗、输血咨询、输血门员工会议或临床用血管理□ 有措施、改进和有效的诊断*1。
工作组成员并履行其职责④ 检查工作记录是否对临床用血不良事件进行分析,并提出来源□ 有措施,有改进,没有效果。
□ 是否有改进措施和改进措施。
□ 没有进行任何工作⑤ 医疗机构是否临时采集血液,是否符合规定。
⑥ 医疗机构是否将用血量和经济收入作为输血科或血库的考核指标。
□ A.□ B□ C□ D在《医疗机构临床用血管理办法》中,对输血科负责人和专业人员进行资格抽查,并查看培训记录:□ 人员资格、职责、权限、技术人员和负责人① 输血科负责人应当具有中级以上技术职称,从事阶段和任务的备案工作,并定期对困难血型血清学检测的结清进行至少5年的培训。
培训、评估和评估。
2.审查和专业判断② 参与审核困难血型血清学检测结果的人员至少应□ 考核间隔超过1次的人员应达到相应级别,具有3年工作经验和中级以上技术职称。
年,对于新员工和离职人员的六项职业素质和规定,③ 应定期对人员的能力和业绩进行评估,评估间隔不得超过1年。
月后工作的员工的能力评估□ A.□ B□ C第1页,共1页十条、第二十九条《医疗机构临床用血管理办法》第十条《实验室生物安全通用要求》求。
定期评估人员能力新进员工在最初6个月内应至少接受1次能力评估,频次不符合要求和表现。
并记录。
当职责变更时,或离岗6个月以上再上岗时,□没有员工能力的评估或政策、程序、技术有变更时,员工应接受再培训和再评估,合格后方可继续上岗。
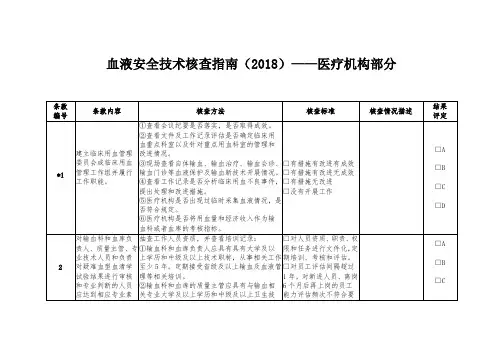
血液安全技术核查指南(2018)——医疗机构部分
2018年手术患者自体输血率为。
[计算公式:手术患者自体输血率(%)=手术患者自体输血量/(手术患者异体输血量+自体输血量)x100%(注:回收式自体输血以回输血量计算,100毫升红细胞为1个单位,贮存式和稀释式自体输血以200毫升全血为1个单位)]
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符合第三项评为C,符合第四项评为D(第1、8、10、15和20条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期:年月日。
血液安全技术核查指南(医疗机构部分)管理要符合PDCA循环,有制度流程,相关事件记录,通常每三个月汇总分析评估(使用管理工具),提出改进措施(可以是通知/培训),再分析评估;*条款从严管理要符合PDCA循环,有制度流程,相关事件记录,通常每三个月汇总分析评估(使用管理工具),提出改进措施(可以是通知/培训),再分析评估;*条款从严管理要符合PDCA循环,有制度流程,相关事件记录,通常每三个月汇总分析评估(使用管理工具),提出改进措施(可以是通知/培训),再分析评估;*条款从严管理要符合PDCA循环,有制度流程,相关事件记录,通常每三个月汇总分析评估(使用管理工具),提出改进措施(可以是通知/培训),再分析评估;*条款从严管理要符合PDCA循环,有制度流程,相关事件记录,通常每三个月汇总分析评估(使用管理工具),提出改进措施(可以是通知/培训),再分析评估;*条款从严管理要符合PDCA循环,有制度流程,相关事件记录,通常每三个月汇总分析评估(使用管理工具),提出改进措施(可以是通知/培训),再分析评估;*条款从严管理要符合PDCA循环,有制度流程,相关事件记录,通常每三个月汇总分析评估(使用管理工具),提出改进措施(可以是通知/培训),再分析评估;*条款从严管理要符合PDCA循环,有制度流程,相关事件记录,通常每三个月汇总分析评估(使用管理工具),提出改进措施(可以是通知/培训),再分析评估;*条款从严备注:1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符合第三项评为C,符合第四项评为D(第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
可编辑修改精选全文完整版
血液安全技术核查指南(2017)——医疗机构部分
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符合第三项评为C,符合第四项评为D(第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期: 2017年月日。
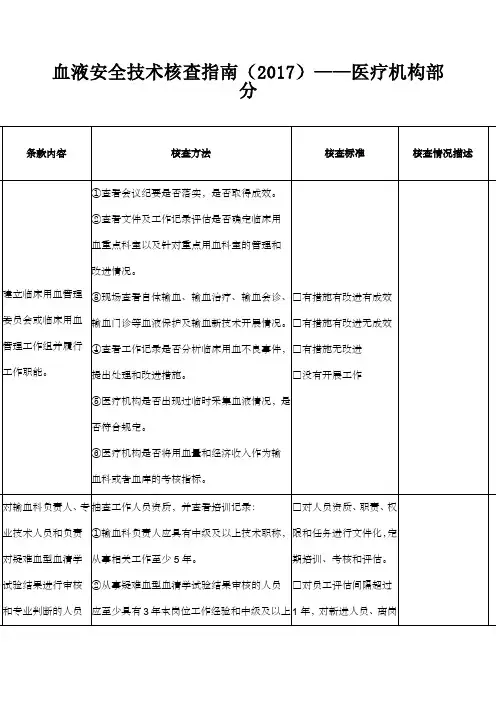
血液安全技术核查指南(医疗机构部分)-最终版9.17附件2 血液安全技术核查指南(医疗机构部分)单位名称:核查准则条款编号条款内容核查方法核查标准核查情况描述核查结果评定《医疗机构临床用*1建立临床用血管理委员会或临床用血管理工作组并履行工①查看会议纪要是否落实,是否取得成效。
②查看文件及工作记录评估是否确定临床用血重点科室以及针对重点用血科□有措施有改进有成效□有措施有改进无成效□有措施无改□A□B□C□D血管理办法》第八条、第九条、第三十条作职能。
室的管理和改进情况。
③现场查看自体输血、输血治疗、输血会诊、输血门诊等血液保护及输血新技术开展情况。
④查看工作记录是否分析临床用血不良事件,提出处理和改进措施。
⑤医疗机构是否出现过临时采集血液情况,是否符合规定。
⑥医疗机构是否将用血量和经济收入作为输血科或进□没有开展工作者血库的考核指标。
《医疗机构临床用血管理办法》第十条、2对输血科负责人、专业技术人员和负责对疑难血型血清学试验结果进行审核和专业判断的人员应达到相应专业素养和法规的要抽查工作人员资质,并查看培训记录:①输血科负责人应具有中级及以上技术职称,从事相关工作至少5年。
②从事疑难血型血清学试验结果审核的人员应至少具有3年本岗位工作经验和中级及以上技术职称。
③定期评估人员能力和表现,评估间隔不超过1年。
□对人员资质、职责、权限和任务进行文件化,定期培训、考核和评估。
□对员工评估间隔超过1年,对新进人员、离岗6个月后再上岗的员工□A□B□C第二十九条求。
定期评估人员能力和表现。
新进员工在最初6个月内应至少接受1次能力评估,并记录。
当职责变更时,或离岗6个月以上再上岗时,或政策、程序、技术有变更时,员工应接受再培训和再评估,合格后方可继续上岗。
能力评估频次不符合要求□没有员工能力的评估《医疗机构临床用血管3输血科配备与输血工作相适应的场地与基础设施。
查看现场区域分配:①应有:血液处置室(区)、储血室、发血室、标本接收室(区)、独立实验室、值班室。
血液安全技术核查指南(2017)——医疗机构部分
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符合第三项评为C,符合第四项评为D(第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期:2017年月日。
血液安全技术核查指南
(医疗机构部分)单位名称:
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项
评为B,符合第三项评为C,符合第四项评为D (第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个
及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或
10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况
4.凡有“ * ”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查
5. 此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:核查人员(签名):被检查单位临床用血负责人(签
名):核查日期:2017 年月日。