高中化学知识点:烯烃的同分异构体类型详解
- 格式:doc
- 大小:23.00 KB
- 文档页数:2

烃类化合物的同分异构体在化学的世界里,烃类化合物是一类非常重要的有机化合物,它们由碳和氢两种元素组成。
而同分异构体的存在,为烃类化合物增添了丰富的多样性和复杂性。
什么是同分异构体呢?简单来说,同分异构体就是具有相同分子式,但结构不同的化合物。
就好比同样的一堆积木,可以搭建成不同的形状和结构。
对于烃类化合物而言,由于碳链的排列方式、官能团的位置等因素的不同,会产生各种各样的同分异构体。
先来说说烷烃的同分异构体。
以丁烷为例,它的分子式是C₄H₁₀。
正丁烷的结构是直链,也就是所有的碳原子依次相连。
而异丁烷则是一个带有支链的结构,其中一个碳原子连接在主链的中间位置。
随着碳原子数目的增加,烷烃的同分异构体数量会迅速增多。
比如戊烷就有三种同分异构体,分别是正戊烷、异戊烷和新戊烷。
再看烯烃的同分异构体。
以丙烯为例,它的分子式是 C₃H₆。
除了双键位置的不同会产生同分异构体外,碳链的结构也可能有所变化。
比如说 2-丁烯就有顺反两种异构体,这是由于双键两侧的基团在空间排列方式的不同所导致的。
芳烃的同分异构体同样丰富多样。
以甲苯为例,当苯环上的取代基位置不同时,就会产生不同的同分异构体。
比如邻二甲苯、间二甲苯和对二甲苯。
同分异构体的存在对于烃类化合物的性质有着重要的影响。
由于结构的不同,它们的物理性质,如沸点、熔点、密度等,可能会有较大的差异。
在化学性质方面,反应活性、反应的选择性也会有所不同。
比如说,正丁烷和异丁烷的沸点就有所不同。
正丁烷的沸点约为-05℃,而异丁烷的沸点则约为-117℃。
这是因为它们的分子结构不同,导致分子间的作用力有所差异。
在化学反应中,由于双键位置或者取代基位置的不同,反应的位点和难易程度也会不同。
同分异构体的研究不仅在理论上具有重要意义,在实际应用中也发挥着巨大的作用。
在石油化工领域,通过对烃类化合物同分异构体的分离和分析,可以更好地了解石油的组成和性质,从而优化炼油工艺,提高产品质量和产量。

烯烃的相关知识点高三化学烯烃的相关知识烯烃是有机化合物中的一类重要物质,具有特殊的化学性质和广泛的应用。
本文将从结构、性质和应用方面介绍烯烃的相关知识。
一、结构烯烃是由碳原子构成的碳氢化合物,分子中含有一个或多个碳-碳双键。
烯烃的分子式通常为CnH2n,其中n表示双键中碳原子的个数。
以最简单的乙烯(C2H4)为例,其分子结构为CH2=CH2。
二、性质1. 物理性质烯烃大多数为无色气体或液体,具有较低的沸点和密度。
由于含有双键结构,烯烃分子之间的相互作用较弱,所以烯烃通常较易挥发和燃烧。
2. 化学性质烯烃具有多样化学反应,主要包括加成反应、聚合反应、氧化反应等。
(1)加成反应:烯烃可以与其他物质进行加成反应,例如与氢气加成生成烷烃,与卤素加成生成卤代烃等。
(2)聚合反应:烯烃可以进行聚合反应,形成聚合物。
例如,乙烯可以聚合生成聚乙烯。
(3)氧化反应:烯烃可以与氧气发生氧化反应,在适当条件下生成醇、醛、酮等。
三、应用烯烃在工业和生活中有广泛的应用。
1. 石油化工:烯烃是石油化工的重要原料,通过石油加工过程中的裂化反应可以得到大量的烯烃。
2. 塑料工业:烯烃是合成塑料的主要原料,例如聚乙烯、聚丙烯等。
塑料制品广泛应用于包装、建材、家具等领域。
3. 橡胶工业:烯烃是橡胶合成中的重要成分,例如合成橡胶中的丁苯胶、丁腈胶等。
4. 农药和医药工业:烯烃可以合成农药、医药等有机化合物,例如对虫害的杀虫剂、对细菌感染的抗生素等。
5. 燃料工业:烯烃可以作为燃料使用,例如乙烯可以作为工业燃料和照明燃料。
总结:烯烃是一类重要的有机化合物,具有特殊的化学性质和广泛的应用。
对于烯烃的结构、性质和应用有了初步的了解,有助于我们进一步认识有机化合物的世界。
在未来的学习和研究中,希望我们能够更加深入地探索烯烃的相关知识。

《烯烃》知识清单一、烯烃的定义与结构烯烃是一类含有碳碳双键(C=C)的不饱和烃。
最简单的烯烃是乙烯(C₂H₄),其结构中两个碳原子以双键相连,每个碳原子还分别与两个氢原子结合。
碳碳双键是由一个σ键和一个π键组成。
σ键较为稳定,而π键相对较弱,容易发生加成反应。
烯烃中碳原子的杂化方式通常为 sp²杂化,这使得碳原子形成平面三角形的构型。
二、烯烃的通式烯烃的通式为 CₙH₂ₙ(n≥2)。
例如,丙烯(C₃H₆)、丁烯(C₄H₈)等都符合这一通式。
三、烯烃的命名1、选择含有碳碳双键的最长碳链作为主链。
2、从距离双键最近的一端开始给主链碳原子编号。
3、标明双键的位置,将双键的碳原子编号写在烯烃名称的前面。
例如,CH₃CH=CHCH₃命名为 2-丁烯。
四、烯烃的物理性质1、状态在常温常压下,C₂C₄的烯烃为气体,C₅C₁₈的烯烃为液体,C₁₉以上的烯烃为固体。
2、溶解性烯烃难溶于水,易溶于有机溶剂。
3、密度烯烃的密度一般小于水。
五、烯烃的化学性质1、加成反应(1)与氢气加成例如,乙烯与氢气在催化剂的作用下发生加成反应生成乙烷:CH₂=CH₂+ H₂ → CH₃CH₃(2)与卤素加成如乙烯与溴水发生加成反应,使溴水褪色:CH₂=CH₂+ Br₂ → CH₂BrCH₂Br(3)与卤化氢加成丙烯与氯化氢加成可能生成 1-氯丙烷或 2-氯丙烷。
(4)与水加成在一定条件下,乙烯与水发生加成反应生成乙醇:CH₂=CH₂+H₂O → CH₃CH₂OH2、氧化反应(1)燃烧烯烃燃烧生成二氧化碳和水,如乙烯燃烧的化学方程式:C₂H₄+3O₂ → 2CO₂+ 2H₂O(2)使酸性高锰酸钾溶液褪色这是鉴别烯烃和烷烃的一种常用方法。
3、聚合反应烯烃可以发生加聚反应生成高分子化合物。
例如,乙烯发生加聚反应生成聚乙烯:nCH₂=CH₂ → CH₂CH₂ₙ六、烯烃的制备1、醇的脱水在一定条件下,醇可以脱水生成烯烃。
例如,乙醇在浓硫酸的作用下,加热到 170℃时发生脱水反应生成乙烯:CH₃CH₂OH → CH₂=CH₂↑ + H₂O2、卤代烃的消去反应七、烯烃的用途1、重要的化工原料用于生产塑料、橡胶、纤维等高分子材料。

烯烃的同分异构-概述说明以及解释1.引言1.1 概述烯烃是一类重要的有机化合物,在化学领域中具有广泛的应用。
烯烃的同分异构现象是指同一种分子式但结构不同的烯烃化合物。
同分异构的出现使得烯烃化合物的性质和用途产生了显著的变化。
研究烯烃的同分异构机理,对于深入理解其结构特点、性质变化以及应用方面的发展具有重要意义。
本文将首先介绍烯烃的定义和特点,包括其分子结构、化学性质等方面的基本知识。
随后将详细探讨烯烃的同分异构现象,包括同一分子式下存在的不同结构和其对性质的影响。
同时,为了更好地理解同分异构的产生和变化,我们将深入研究烯烃的同分异构机理,涉及到分子结构之间的键合、键角等方面的变化。
在文章的结论部分,我们将重点探讨同分异构对烯烃性质的影响以及其在工业生产中的应用。
通过对同分异构性质和变化的研究,可以更好地利用烯烃化合物的特性,提高其在工业制造中的应用效率。
最后,本文将展望烯烃同分异构研究的未来发展方向,包括进一步深入研究机理、探索新的合成方法以及应用的拓展等。
通过本文的阐述,我们期望读者能够更全面地了解烯烃的同分异构现象,认识其对性质和应用的影响,并对未来的相关研究具有更清晰的认识。
烯烃的同分异构是一个有趣而重要的课题,对于提高烯烃化合物的应用性能,促进相关领域的发展具有重要的指导意义。
1.2文章结构文章结构部分的内容可以包括以下内容:本文将主要从以下几个方面探讨烯烃的同分异构现象:烯烃的定义和特点、烯烃的同分异构现象、烯烃的同分异构机理。
在正文的基础上,结论部分将讨论同分异构对烯烃性质的影响、同分异构在工业生产中的应用以及对烯烃同分异构研究的展望。
首先,引言部分会对整篇文章进行一个概述,简要介绍烯烃和同分异构的概念,并给出本文的目的。
在正文部分,我们将首先介绍烯烃的定义和特点,包括其分子结构和性质的特点,为后续的同分异构现象做好铺垫。
接下来,我们将详细探讨烯烃的同分异构现象,包括同分异构现象的定义、发生的条件和原因,以及在不同环境下的具体表现。


c6h12烯烃同分异构体C6H12是一种分子式为C6H12的烯烃,它包含了6个碳原子和12个氢原子。
由于碳原子的空间构型的变化,C6H12具有多种同分异构体。
同分异构体是指化学式相同但结构不同的分子。
C6H12的同分异构体有四种,分别是环己烷、1-己烯、3-己烯和2-己烯。
下面将逐一介绍这四种同分异构体。
第一种同分异构体是环己烷,它的结构呈现出一个六元环,环上没有任何双键存在,所有碳原子的杂化方式为sp3。
环己烷是一种无色液体,常见于石油中,具有较低的密度和挥发性。
它主要用作溶剂和工业原料,在有机合成中也有广泛应用。
第二种同分异构体是1-己烯,它的结构包含一个六元环和一个双键。
双键位于环的第一位碳和第二位碳之间。
1-己烯是无色液体,具有较强的挥发性。
它主要用于制造橡胶和合成农药等化学产品。
第三种同分异构体是3-己烯,它的结构也包含一个六元环和一个双键,但双键位于环的第三位碳和第四位碳之间。
3-己烯是透明液体,常用于制备合成橡胶和聚合物材料。
最后一种同分异构体是2-己烯,它的结构同样包含了六元环和双键,但双键位于环的第二位碳和第三位碳之间。
2-己烯是无色液体,广泛应用于胶粘剂、油墨和环氧树脂等领域。
以上四种同分异构体都具有不同的化学性质和用途。
它们的存在表明,即使化学式相同,分子的结构也能产生显著的影响。
同分异构体的出现是由于碳原子的四价特性和其杂化方式的不同所导致的。
同分异构体在有机化学及相关领域具有重要地位。
研究同分异构体的结构和特性有助于深入理解分子的构造和反应机理。
此外,在合成化学和药物研发过程中,了解同分异构体的存在和特性,对于目标化合物的选择和定位也具有重要意义。
综上所述,C6H12烯烃的同分异构体共有四种,分别是环己烷、1-己烯、3-己烯和2-己烯。
它们的结构差异导致了化学性质和用途的变化,对于有机化学和相关领域的研究具有重要意义。

高中化学重要知识点有机化合物的同分异构体同分异构体是有机化学中常见的现象,指的是化学式相同,结构式和性质却不同的化合物。
它们具有相同的分子式,但由于原子间的排列方式不同,导致它们的结构和性质差异显著。
同分异构体的存在在化学研究和应用中具有重要意义,它们的发现和研究有助于人们对有机化合物的理解和利用。
一、同分异构体的分类同分异构体主要分为以下几种类型:1. 结构异构体:分子内原子的连接方式不同,分为链式异构体、位置异构体、环式异构体等。
比如正丁烷和异丁烷就是典型的结构异构体,它们的化学式均为C4H10,但分子结构不同,导致性质的差异。
2. 功能异构体:具有相同分子式,但它们在空间结构中的部位不同,从而产生不同的功能。
比如右旋糖和左旋糖就是功能异构体,它们都是分子式为C6H12O6的己醛,但是它们的旋光性质不同,右旋糖旋光,左旋糖则左旋光。
3. 立体异构体:分子内原子空间排列方式的不同,可分为构型异构体和对映异构体。
构型异构体是指在空间中存在固定的构型,如顺式异构体和反式异构体。
对映异构体则是指分子结构中具有手性中心的异构体,它们的镜像关系可以通过非重叠重叠一一对应。
二、同分异构体的性质差异同分异构体之间具有显著的性质差异,主要体现在以下几个方面:1. 物理性质:对于同分异构体来说,它们在物理性质上常常有明显的差异,如沸点、熔点、密度等。
2. 化学性质:同分异构体的化学性质也会存在差异,如反应活性、稳定性等。
不同结构的同分异构体由于原子间连接方式的不同,使得它们对不同的反应条件和环境的响应不同,从而表现出不同的化学性质。
3. 生物活性:对于一些有机化合物来说,同分异构体的生物活性差异常常十分显著,具有重要的医药和生物学研究价值。
例如,药物的同分异构体可能表现出不同的药效或毒性。
三、同分异构体的应用同分异构体不仅在化学研究中有重要作用,也在实际应用中有广泛的应用:1. 准确鉴定:对于有机化合物来说,同分异构体的存在使得对化合物的准确鉴定变得更具挑战性,需要借助各种分析技术来区分同分异构体。

烯烃的同分异构全文共四篇示例,供读者参考第一篇示例:烯烃是一类含有碳碳双键的碳氢化合物,其化学式为CnH2n。
由于烯烃中含有不饱和的碳碳双键,因此烯烃具有一系列同分异构体。
同分异构是指分子式相同,结构式不同的化合物。
烯烃的同分异构体之间的结构差异主要体现在碳碳双键的位置不同以及碳链的长度不同。
首先我们来看一下烯烃的同分异构体之间的结构差异。
烯烃的同分异构体主要是由于碳碳双键的位置不同而产生的。
以C4H8为例,烯烃的分子式为C4H8,可有两种不同位置的同分异构体:1-丁烯和2-丁烯。
1-丁烯的结构式为CH2=CH-CH2-CH3,2-丁烯的结构式为CH3-CH=CH-CH3。
可以看到,这两种同分异构体的碳碳双键的位置不同,导致它们的化学性质和物理性质也会有所区别。
烯烃的同分异构体在化学性质和物理性质上也有所不同。
由于碳碳双键的存在,烯烃的同分异构体比饱和烃更容易发生加成反应和氧化反应。
在加成反应中,碳碳双键会被破裂,生成新的化学键;在氧化反应中,烯烃会和氧气发生反应,生成醇和醛等氧化产物。
烯烃的同分异构体之间的沸点、密度、溶解性等物理性质也会有所差异,这些差异主要源于分子结构的不同。
第二篇示例:烯烃是一类具有双键结构的碳氢化合物,分子式为CnH2n,其中n为整数。
烯烃是碳氢化合物中重要的一类,其同分异构特性极为突出,拥有许多种不同结构的同分异构体。
烯烃同分异构是指具有相同分子式但结构式不同的烯烃化合物。
由于双键的存在,烯烃分子结构中的双键位置可以发生变化,从而形成不同的同分异构体。
烯烃的同分异构体可以通过双键位置的不同来区分,常见的同分异构体包括1-烯烃、2-烯烃、3-烯烃等。
1-烯烃是指分子中的双键位于碳链的第一个碳原子上,例如乙烯(C2H4)就是一种1-烯烃。
2-烯烃是指双键位于碳链的第二个碳原子上,例如丙烯(C3H6)就是一种2-烯烃。
3-烯烃则是指双键位于碳链的第三个碳原子上,常见的例子包括1-丁烯(C4H8)。

烯烃归纳总结烯烃是一类重要的有机化合物,其分子结构中含有碳-碳双键,具有广泛的应用和研究价值。
烯烃的种类繁多,具有不同的化学性质和用途。
在本文中,我们将对烯烃的分类、性质及应用进行综合总结。
一、烯烃的分类根据双键的位置以及碳原子的连接方式,烯烃可以分为线性烯烃、支链烯烃和环烯烃三类。
1. 线性烯烃:双键在直链结构中的烯烃称为线性烯烃。
代表性的线性烯烃有丙烯和丁烯等。
2. 支链烯烃:双键连接在支链结构上的烯烃称为支链烯烃。
与直链烯烃相比,支链烯烃具有更高的立体异构性。
以异戊烯为例,它可以存在多种立体异构体。
3. 环烯烃:分子结构中含有环状结构的烯烃称为环烯烃。
环烯烃具有特殊的环张力,因此在反应中常常表现出特殊的性质。
环己烯是最简单的环烯烃。
二、烯烃的性质1. 物理性质:烯烃一般为无色气体或液体,具有较低的沸点和蒸汽压。
2. 化学性质:由于烯烃分子中含有碳-碳双键,使其具有较高的反应活性。
烯烃可以通过加成反应、聚合反应和氧化反应等多种途径发生化学反应。
3. 稳定性:烯烃分子中的碳-碳双键容易受到空气、光线和热等条件的影响而发生聚合反应,导致分子结构的改变和性质的变化。
因此,烯烃在储存和使用过程中需要采取适当的稳定化措施。
三、烯烃的应用由于烯烃具有丰富的反应性和可塑性,广泛应用于化工、医药、材料等领域。
1. 化工领域:烯烃是合成各种有机化合物的重要原料,例如丙烯酸、丙烯腈等可用于制备塑料、纤维和橡胶等材料。
烯烃也是合成聚合物的关键单体,通过聚合反应可以制备聚乙烯、聚丙烯等高分子化合物。
2. 医药领域:烯烃衍生物具有广泛的药理活性,被广泛应用于药物合成和药物研发中。
例如,环烯烃类抗生素被用于治疗感染病因菌。
3. 材料领域:烯烃及其聚合物具有良好的物理性能和化学稳定性,广泛应用于塑料、弹性体、纤维和油墨等材料的制备。
四、烯烃的技术难题在烯烃的生产和应用过程中,也存在一些技术难题需要解决。
1. 高选择性合成:烯烃的合成通常需要高温、高压和复杂催化条件,同时容易发生副反应。

有四个碳原子的烯烃的同分异构体有哪几种,麻烦全画一下有四个碳原子的烯烃的同分异构体有哪几种,麻烦全画一下有四个碳原子的烯烃的同分异构体有哪几种,单烯烃:1-丁烯,2-丁烯(有顺反异构),2-甲基丙烯。
CH3—CH2—CH=CH2 ;CH3—CH=CH—CH3 ;(CH3—)2C=CH2 。
环烯烃:环丁烯,1-甲基环丙烯,3-甲基环丙烯,1-亚甲基-(1,1‘)环丙烯。
这些就不画了吧。
二烯烃:1,2-丁二烯,1,3-丁二烯(有顺反异构)。
CH3—CH=C=CH2 ;CH2=CH—CH=CH2 。
主链为4个碳原子的某烷烃有2种同分异构体,则相同碳原子数、主链也为4个碳原子的烯烃,其同分异构体有几种丁烷3种主链为4个碳原子的某烷烃有2种同分异构体,则相同碳原子数、主链也为4个碳原子的烯烃,其同分异构体有4种?如果说4种是考虑了顺反异构的四种分别是1-丁烯2-甲基丙烯顺-2-丁烯(两个甲基在双键同侧)反-2-丁烯(两个甲基在双键异侧)4个碳原子的烷烃有两种同分异构体,含有相同的碳原子数单烯烃的同分异构体种数有选B 3种单烯烃就是只含有一个碳碳双键的烯烃.分子式为C6H12,主链为四个碳原子的烯烃同分异构体有几种4种:2.3-二甲基-1-丁烯,3.3-二甲基-1-丁烯,2.3-二甲基-二-丁烯,2-乙基-1-丁烯⌒_⌒ 希望可以帮到you~分子式为C6H12主链为四个碳原子的烯烃同分异构体共有几种?4种根据分子式,应该是只有一个双键,四个炭为主链,中间对称有两种烯烃,再连上两个甲基,可能在同一个炭上,有六种,如果不在同一个炭上,先固定一个,共有十一种,如果一起作为乙基连,有六种,环烃虽不饱和,但还是烷烃,不算有三种:2,3-二甲基-1-丁烯3,3-二甲基-1-丁烯2,3-二甲基-2-丁烯1、双键在1位上,侧链为乙基(两个碳连在一起时)只有一种。
2、双键在1位上,侧链为两个甲基时有三种同分异构体(在不同碳上只一种,在相同碳上第2位和第3位上各一种)。
烯烃的同分异构体-概述说明以及解释1.引言1.1 概述概述部分的内容:烯烃是一类常见的有机化合物,其分子结构中含有一个或多个共轭双键。
由于烯烃分子中的双键具有较高的反应活性,使得烯烃在化学领域具有重要的地位和广泛的应用。
然而,同一种烯烃分子却可以存在不同的结构,这就是烯烃的同分异构体现象。
同分异构体是指分子式相同但结构不同的化合物。
烯烃的同分异构体通常是由于共轭双键的位置不同引起的。
由于烯烃分子的双键可以存在不同的位置,导致了同分异构体的产生。
这些同分异构体在物理性质和化学性质上可能会有很大的差异,因此对于研究和应用烯烃分子来说,了解和掌握同分异构体的性质和特点非常重要。
同分异构体的存在给化学研究和应用带来了一定的复杂性和挑战性。
在化学实验中,需要对同分异构体进行准确的分离和鉴定,以确保实验结果的可靠性。
在化学工业中,同分异构体的存在可能会影响产品的纯度和质量,因此需要采取相应的措施进行控制和调整。
烯烃的同分异构体研究也具有重要的理论和应用意义。
通过研究和探索烯烃同分异构体的结构和性质,可以深入了解烯烃的反应机理和反应规律,为有机合成和催化反应的设计提供基础和指导。
此外,烯烃同分异构体的研究还有助于开发新型的功能性材料和药物,拓展其在材料科学和医药领域的应用前景。
本文将重点介绍烯烃的同分异构体的定义、分类和例子,并探讨其在化学领域的重要性和展望。
通过对烯烃同分异构体的深入了解,我们可以更好地利用和应用这类重要的有机化合物。
1.2文章结构文章结构(Article Structure)本文将按照以下结构进行撰写。
首先,在引言部分将概述同分异构体的概念以及本文的目的。
接着,正文部分将分为两个小节,分别介绍同分异构体的定义和特点以及烯烃的同分异构体的分类和例子。
最后,在结论部分将强调同分异构体在化学领域的重要性,并展望烯烃同分异构体的研究和应用前景。
通过以上结构的安排,本文将系统地介绍同分异构体这一化学概念,并重点探讨烯烃同分异构体的分类和例子。
烯烃知识点总结1. 烯烃的概念烯烃是一类含有碳-碳双键的有机化合物,通式为CnH2n,其中n为整数。
烯烃中的碳-碳双键与碳原子之间的结合为σ键和π键,其中σ键为单键,π键为双键。
烯烃中的碳-碳双键的存在使得分子具有不饱和性,容易发生加成反应。
2. 烯烃的结构烯烃的结构可以分为直链烯烃和支链烯烃两种类型。
直链烯烃的碳原子按照直链排列,支链烯烃的碳原子上带有支链基团。
烯烃还可以根据双键的位置分为内烯烃和外烯烃两种类型。
内烯烃的双键位于碳原子链的中间,外烯烃的双键位于碳原子链的两端。
3. 烯烃的性质烯烃具有许多特殊的物理和化学性质。
首先,烯烃分子中的碳-碳双键使得分子不饱和,因此烯烃易于发生加成反应。
其次,烯烃分子中的碳-碳双键还使得分子具有特殊的空间构型,导致分子的立体异构体。
此外,烯烃还具有较低的沸点和密度等物理性质。
4. 烯烃的制备烯烃可以通过各种不同的方法来制备。
常见的制备方法包括蒸馏、裂解、脱氢和氧化等方法。
其中,裂解是一种常用的制备烯烃的方法,通过高温对烃烷或脂肪酸的加热分解可以得到烯烃。
5. 烯烃的应用烯烃具有许多重要的应用。
首先,烯烃是一类重要的石油化工产品,可以用于生产乙烯、丙烯等化工原料,用于制造塑料、合成橡胶等产品。
其次,烯烃还可以用作有机合成反应的重要原料,可以制备醇、醛、酮和酯等化合物。
此外,烯烃还具有一定的生物活性,可以用于制备医药、农药和香料等产品。
总之,烯烃是一类重要的有机化合物,具有多种重要的应用。
对于烯烃的研究和开发具有重要的意义,可以推动石油化工产业的发展,促进化工产品的创新和生产。
希望本文的介绍可以对读者对烯烃有更深入的了解。
己烯的13种同分异构体己烯是一种重要的烯烃化合物,具有广泛的应用领域,如化学品生产、聚合物合成、有机合成等。
由于其分子结构中存在多个不同的双键位置,导致存在着多种同分异构体,这些同分异构体在性质和用途上都有所不同。
本文将介绍己烯的13种同分异构体及其特性。
1. 1-己烯1-己烯是最简单的己烯同分异构体,其分子结构中双键位于碳1和碳2之间。
1-己烯是一种无色液体,具有较强的烷基活性,可被氢气加氢生成正己烷。
2. 2-己烯2-己烯的双键位于碳2和碳3之间,是一种无色液体。
2-己烯可用于制备聚合物、有机合成和医药等领域。
3. 3-己烯3-己烯是一种无色液体,其双键位于碳3和碳4之间。
3-己烯可用于制备聚合物、表面活性剂和涂料等。
4. 4-己烯4-己烯的双键位于碳4和碳5之间,是一种无色液体。
4-己烯可用于制备聚合物、表面活性剂和涂料等。
5. 5-己烯5-己烯是一种无色液体,其双键位于碳5和碳6之间。
5-己烯可用于制备聚合物、表面活性剂和涂料等。
6. 6-己烯6-己烯的双键位于碳6和碳7之间,是一种无色液体。
6-己烯可用于制备聚合物、表面活性剂和涂料等。
7. 1,2-己烯1,2-己烯的双键位于碳1和碳2之间,是一种无色液体。
1,2-己烯可用于制备聚合物、表面活性剂和涂料等。
8. 1,3-己烯1,3-己烯是一种无色液体,其双键位于碳1和碳3之间。
1,3-己烯可用于制备聚合物、表面活性剂和涂料等。
9. 1,4-己烯1,4-己烯的双键位于碳1和碳4之间,是一种无色液体。
1,4-己烯可用于制备聚合物、表面活性剂和涂料等。
10. 2,3-己烯2,3-己烯是一种无色液体,其双键位于碳2和碳3之间。
2,3-己烯可用于制备聚合物、表面活性剂和涂料等。
11. 2,4-己烯2,4-己烯的双键位于碳2和碳4之间,是一种无色液体。
2,4-己烯可用于制备聚合物、表面活性剂和涂料等。
12. 2,5-己烯2,5-己烯是一种无色液体,其双键位于碳2和碳5之间。
分子式为c5h10的烯烃的同分异构体有几种分子式为c5h10的烯烃的同分异构体有几种烯烃(5种)+环烷烃(4种)=9种做这种题的常用办法:从两方面考虑,类别异构和结构异构.类别异构体有:1、烯烃和环烷烃CnH2n(n>=3)2、炔烃和二烯烃CnH2n-2(n>=4)3、饱和一元醇和醚CnH2n+2O(n>=3)4、饱和一元醛和酮CnH2nO(n>=3)5、饱和一元羧酸和酯CnH2nO2(n>=2)6、苯酚的同系物、芳香醇、芳香醚CnH2n-6O(n>=7)7、氨基酸和硝基化合物CnH2n+1O2n(n>=2)结构异构包括官能团位置异构、主链碳原子个数异构和支链位置异构,用画结构图的方法很容易数出个数,建议先从主链碳原子个数异构画起,再在此基础上画支链位置异构,就不会数丢了。
五种,正戊烷对应的烯烃有:1-戊烯,2-戊烯,异戊烷对应的烯烃有:2-甲基-1-丁烯,2-甲基-2-丁烯,3-甲基-1-丁烯分子式为C5H10的烃有几种同分异构体3CH3(CH2)3CH3正戊烷CH3CH2CH(CH3)CH3异戊烷CH3C(CH3)(CH3)CH3新戊烷望采纳C5H10的烯烃同分异构体有多少种?一共9种环状4种直链的有两种带1个甲基的有3种带两个甲基的没有有问题可以问分子式为C5H11Cl的同分异构体共有几种分子式为C5H11Cl的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH2Cl;CH3CH2CH2CHClCH3;CH3CH2CHClCH2CH3;主链有4个碳原子的:CH3CH(CH3)CH2CH2Cl;CH3CH(CH3)CHClCH3;CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;主链有3个碳原子的:CH2C(CH3)2CH2Cl;共有8种情况.C5H12有三种同分异构体,正戊烷的一氯代物有三种,2-甲基丁烷的一氯代物有四种,新戊烷(2,2-二甲基丙烷)的一氯代物有一种所以总共8种!首先看一看戊烷的结构正戊烷 CH3CH2CH2CH2CH3异戊烷 (CH3)2CH2CH2CH3新戊烷 C(CH3)4正戊烷取代后有三种同分异构体Cl-CH2CH2CH2CH2CH3CH3CHClCH2CH2CH3CH3CH2CHClCH2CH3新戊烷取代后有四种同分异构体(CH3)2CHClCH2CH3(CH3)2CH2CHClCH3(CH3)2CH2CH2CH2ClCl-CH-CH2CH2CH3|CH3新戊烷取代后只有一种同分异构体(CH3)3-C-CH2-Cl所以分子式为C5H11Cl的同分异构体共有8种C5H12的同分异构体有3种:正戊烷,异戊烷,新戊烷。
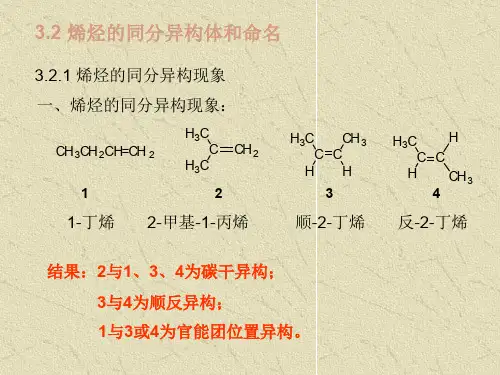
高中化学知识点:烯烃的同分异构体类型详解
有机物具有相同分子式,但由于分子中原子的连接方式不同,具有不同的结构的现象称为同分异构现象。
具有同分异构想象的化合物互称为同分异构体。
同分异构体可以是同类物质,也可以是不同类物质,因此同分异构体的类型有三类:碳链异构、官能团位置异构和官能团异构同分异构体的书写规律: 主链由长到短, 支链由整到散, 位置由心到边, 排列由对到邻到间同分异构体的种类及其书写规律: (1) 种类: 碳链异构: 指碳原子的连接次序不同引起的异构, 如: 位置异构: 官能团的位置不同引起的异构: 官能团异构: 官能团不同引起的异构, 如: 烯烃和环烷烃书写方法: 碳链异构→位置异构→官能团异构一共4个碳原子,那么一条链的就是4个碳原子,双键在1、2之间和2、3之间就是2种同分异构体。
缩短碳链为3个碳原子,那么甲基只能连在中间那个碳原子上,否则又变成4个碳原子链了。
还有一种就是成环的,有4个碳原子形成一个四元环,还有三元环再接一个甲基的2种同分异构体烯烃的同分异构体种类很多,除了碳链异构外,还有因双键在碳链中的位置不同而引起位置异构,另外,由于烯烃和环烷烃的通式相同,所以碳原子数目相同的烯烃和环烷烃也能相互成为同分异构体,这类同分异构体成为官能团异构(或称类别异构) 在烯烃中,由于双键的存在,使得烯烃的同分异构体数目要比含有相同数目碳原子的烷烃的同分异构体多,碳碳双键位置的不同是烯烃同分异构体数目较多的原因之一,初因双键位置不同而产生的同分异构体外,在烯烃中还有称为顺反异构(也称几何异构)的现象当碳碳双键上的两个碳原子所连接的原子或原子团不相同时,就会有两种不同的排列方式,这是由于与双键相连接的两个碳原子不能围绕他们之间的键键轴自由旋转的缘故两个相同基团居于同一边的为顺势,分居两边的为反式书写烯烃同分异构体首先把烯当作烷,写出所有的同分异构体,然后在每一种里面改变双键的位置就可以了。