烷烃 烯烃 烯烃的顺反异构
- 格式:pptx
- 大小:1.48 MB
- 文档页数:33

第一节脂肪烃第1课时烷烃和烯烃烯烃的顺反异构[知识梳理]一、烷烃和烯烃1.烷烃和烯烃的物理性质2.烷烃的化学性质(1)稳定性:常温下烷烃很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件下(如光照或高温)才能发生某些反应。
(2)特征反应——取代反应烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
如乙烷与氯气反应生成一氯乙烷,化学方程式为CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
(3)氧化反应——可燃性烷烃可在空气或氧气中燃烧生成CO 2和H 2O ,燃烧的通式为C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
(4)分解反应——高温裂化或裂解烷烃受热时会分解产生含碳原子数较少的烷烃和烯烃,如:C 16H 34――→催化剂高温C 8H 16+C 8H 18。
3.烯烃的化学性质 (1)特征反应——加成反应丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷的化学方程式为(2)氧化反应①烯烃能使高锰酸钾酸性溶液的紫色褪去。
②可燃性烯烃燃烧的通式为C n H 2n +3n 2O 2――→点燃n CO 2+n H 2O 。
(3)加聚反应烯烃加聚反应的通式:n R 1—CH===CH —R 2――→催化剂。
二、烯烃的顺反异构 1.产生原因由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同。
2.存在条件每个双键碳原子上连接了两个不同的原子或原子团。
3.异构分类(1)顺式结构:两个相同的原子或原子团排列在双键的同一侧。
(2)反式结构:两个相同的原子或原子团分别排列在双键的两侧。
4.性质特点化学性质基本相同,物理性质有一定的差异。
[自果检测]1.判断正误,正确的打“√”,错误的打“×”。
(1)乙烷的结构简式为CH3CH3,乙烯的结构简式为CH2CH2,乙炔的结构简式为CHCH。
(×)解析碳碳单键可以省略,烯烃中的碳碳双键以及炔烃中的碳碳三键不能省略。

【知识拓展】烯烃-----烯烃结构与命名
(一)烯烃的同分异构现象
烯烃的通式: CnH2n。
烯烃的官能团:C=C
1.构造异构
2.顺反异构
(a)反-2-丁烯(b) 顺-2-丁烯
(二)烯烃的结构
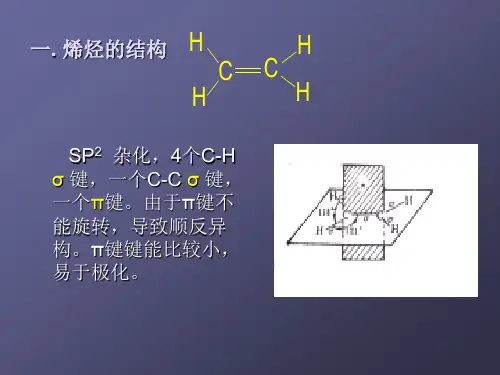
1.碳的sp2杂化及乙烯的结构
碳原子的sp2杂化过程如下:
乙烯分子形成时,两个碳原子各以一个sp2杂化轨道沿键轴方向重叠形成一个C—Cσ键,并以剩余的两个sp2杂化轨道分别与两个氢原子的1s轨道沿键轴方向重叠形成四个等同的C—Hσ键,五个σ键都在同一平面内,因此乙烯为平面构型。
此外,每个碳原子上还有一个未参与杂化的p轨道,两个碳原子的p轨道相互平行,于是侧面重叠成键。
这种成键原子的p轨道侧面重叠形成的共价键叫做π键。
乙烯分子中的σ键和π键如图3-2所示。
乙烯分子的结构。








烯烃加成顺反-概述说明以及解释1.引言1.1 概述概述烯烃加成顺反是一种重要的有机合成反应,它可以将烯烃与其他分子加成形成新的化合物。
这种反应在有机合成领域有着广泛的应用,并且在药物合成、材料科学以及天然产物合成等领域发挥着关键作用。
烯烃加成顺反指的是在烯烃分子中的双键上发生加成反应,形成新的化学键。
顺加成是指在烯烃的同一侧加成,而反加成是指在烯烃的两侧分别发生加成。
这种反应可以通过催化剂的作用来实现,常见的催化剂有过渡金属配合物和酸碱催化剂等。
烯烃加成顺反的机理有多种,其中最常见的是负电子攻击机理和正离子攻击机理。
在负电子攻击机理中,催化剂可以通过给予烯烃中的电子使其形成新的键;在正离子攻击机理中,催化剂会使烯烃中的双键发生开环反应,从而形成新的键。
烯烃加成顺反在有机合成中有着广泛的应用。
它可以用于构建复杂有机分子的核心骨架,实现结构的多样性和功能的引入。
此外,烯烃加成顺反还可以用于合成药物分子、功能材料以及天然产物的合成等领域。
它为有机合成提供了一种高效、经济的方法。
总而言之,烯烃加成顺反是一种重要的有机合成反应,其在有机合成领域有着广泛的应用。
通过研究其机理和应用,我们可以更好地理解和利用烯烃加成顺反这一反应,从而推动有机化学的发展。
本文将对烯烃加成顺反的概念、机理和应用进行详细的探讨,并对其在未来的研究方向进行展望。
1.2文章结构文章结构是指文章的组织架构和内容安排,它决定了文章的逻辑性和可读性。
在本文中,我们将按照以下方式组织文章的结构:1. 引言1.1 概述在引言部分,我们将简要介绍烯烃加成反应的背景和意义,说明其在有机合成中的重要性,并提出本文的研究目的和意义。
1.2 文章结构在本节中,我们将详细介绍文章的结构,以帮助读者更好地理解和跟随文章的内容。
本文的结构如下:2. 正文2.1 烯烃加成反应的概念在该部分中,我们将介绍烯烃加成反应的基本概念,包括定义、特点和相关背景知识,以确保读者对烯烃加成反应有一个清晰的认识。
第一节脂肪烃第1课时烷烃和烯烃烯烃的顺反异构[知识梳理]一、烷烃和烯烃1.烷烃和烯烃的物理性质2.烷烃的化学性质(1)稳定性:常温下烷烃很不活泼,与强酸、强碱、强氧化剂等都不发生反应,只有在特殊条件下(如光照或高温)才能发生某些反应。
(2)特征反应——取代反应烷烃可与卤素单质在光照下发生取代反应生成卤代烃和卤化氢。
如乙烷与氯气反应生成一氯乙烷,化学方程式为CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
(3)氧化反应——可燃性烷烃可在空气或氧气中燃烧生成CO 2和H 2O ,其燃烧的通式为C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
(4)分解反应——高温裂化或裂解烷烃受热时会分解产生含碳原子数较少的烷烃和烯烃,如:C 16H 34――→催化剂高温C 8H 16+C 8H 18。
3.烯烃的化学性质 (1)特征反应——加成反应①丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷的化学方程式为。
②二烯烃的加成反应(2)氧化反应①烯烃能使高锰酸钾酸性溶液的紫色褪去。
②可燃性烯烃燃烧的通式为C n H 2n +3n 2O 2――→点燃n CO 2+n H 2O 。
(3)加聚反应烯烃加聚反应的通式:n R 1—CH===CH —R 2――→催化剂。
【自主思考】1.从烷烃、单烯烃同系物的分子式分析,烷烃、单烯烃分子式通式分别是什么? 提示 烷烃:C n H 2n +2(n ≥1),单烯烃:C n H 2n (n ≥2)。
2.在光照条件下,等物质的量的乙烷和Cl 2混合发生取代反应生成的有机产物中只有一氯乙烷吗?提示 不是。
乙烷和Cl 2的取代反应是连续的,产物是从一氯乙烷至六氯乙烷的混合物。
二、烯烃的顺反异构 1.产生原因由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同。
2.存在条件每个双键碳原子上连接了两个不同的原子或原子团。
烷烃烷烃按照碳骨架可以分为链烷烃和环烷烃。
链烷烃:链烷烃的反应类型⎪⎩⎪⎨⎧取代异构化、裂解氧化1、氧化烷烃在空气中燃烧,放出热量,生成二氧化碳和水。
CnH 2n+2+(3n+1/2)O 2=nCO 2+(n+1)H 2O一定条件下,烷烃可以被氧化为含氧化合物。
如在KMnO 4、MnO 2作用下,用空气氧化高级烷烃,可以得到高级脂肪酸。
2、异构化,裂解由一种化合物转变为其异构体的反应叫做异构化反应。
如。
正丁烷在溴化氢和三溴化铝催化下,27℃时可以异构化生成异丁烷。
高温下使烷烃分子发生裂解的过程称为裂化。
裂化反应通常较复杂,烷烃分子含的碳原子越多,裂化产物越复杂。
且反应条件不同,产物也不同。
3、取代反应烷烃可以与某些试剂发生作用,结果烷烃分子中的氢原子被其它原子或基团所取代。
当卤素取代氢原子时叫做卤化反应。
烷烃的卤代反应都是自由基取代。
其过程通式如下:链引发:链增长:链终止:.......................................① 甲烷的卤代甲烷的卤代通式如下:链引发:链增长:链终止:甲烷的卤代过程如下:X 2----------->2X-CH 4+X- --------->CH 3-+HX (a )CH 3-+X 2-------->CH 3X+X- (b)在a步中,C为sp3杂化,形状为正四面体结构,在该步反应中,X- 自由基逐渐接近CH4的一个H,X- 进一步靠近,并与甲烷形成X--H--CH3的过渡态,H--X键逐渐形成,C--H 键逐渐断裂,最后生成HX和CH3-,而中心碳的轨道杂化类型也由sp3变为sp2,形状也由正四面体变为平面三角形。
其中甲基自由基的中心碳上只有七个电子,且其倾向于形八隅体稳定结构,因此其是一个缺电子结构。
在b步中,CH3-中的C为sp2杂化,三个sp2杂化轨道两两夹角为60°,形成平面等边三角形形状,且分别与三个氢原子的1S轨道重叠形成σ键,剩余的一个2p轨道垂直于平面,2p轨道上有一个单电子,在此步中,X2逐渐从平面上方接近中心碳原子的2p轨道,形成X--X--CH3的过渡态,C--X键逐渐形成,X--X键逐渐断裂,最终X--X键均裂,生成CH3X 和X- 。
第一节 脂肪烃什么样的烃是烷烃呢?请大家回忆一下。
一、烷烃1、结构特点和通式:仅含C —C 键和C —H 键的饱和链烃,又叫烷烃。
(若C —C 连成环状,称为环烷烃。
) 烷烃的通式:C n H 2n+2 (n ≥1)接下来大家通过下表中给出的数据,仔细观察、思考、总结,看自己能得到什么信息? 表2—1 部分烷烃的沸点和相对密度 名称 结构简式 沸点/ºC 相对密度 甲烷 CH 4 -164 0.466 乙烷 CH 3CH 3 -88.6 0.572 丁烷 CH 3(CH 2) 2CH 3 -0.5 0.578 (根据上表总结出烷烃的物理性质的递变规律) 2、物理性质烷烃的物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高,相对密度逐渐增大;常温下的存在状态,也由气态(n ≤4)逐渐过渡到液态、固态。
还有,烷烃的密度比水小,不溶于水,易溶于有 我们知道同系物的结构相似,相似的结构决定了其他烷烃具有与甲烷相似的化学性质。
3、化学性质(与甲烷相似)(1)取代反应如:CH 3CH 3 + Cl 2 →CH 3CH 2Cl + HCl (2)氧化反应C n H 2n+2 + — O 2 → nCO 2 +(n+1)H 2O 烷烃不能使酸性高锰酸钾溶液褪色接下来大家回忆一下乙烯的结构和性质,便于进一步学习烯烃。
二、烯烃1、概念:分子里含有碳碳双键的不饱和链烃叫做烯烃。
通式:C n H 2n (n ≥2) 例:乙烯 丙烯 1-丁烯 2-丁烯师:请大家根据下表总结出烯烃的物理性质的递变规律。
表2—1 部分烯烃的沸点和相对密度 名称 结构简式 沸点/ºC 相对密度 乙烯 CH 2=CH 2 -103.7 0.566 丙烯 CH 2=CHCH 3 -47.4 0.519(根据上表总结出烯烃的物理性质的递变规律) 2、物理性质(变化规律与烷烃相似)烯烃结构上的相似性决定了它们具有与乙烯相似的化学性质。