持续性房颤导管消融策略新进展
- 格式:pdf
- 大小:244.67 KB
- 文档页数:1

心房颤动的高效消融治疗进展(全文)心房颤动是最常见的持续性心律失常,目前,经皮导管消融术已成为房颤患者的重要治疗手段之一,以肺静脉前庭隔离为基石的导管消融术也取得了确切的成就。
成功的肺静脉隔离(Pulmonary Vein Isolation,PVI)取决于肺静脉开口或前庭周围能够产生连续的、跨壁的组织损伤,且对邻近器官不造成损伤[1-2]。
射频导管消融为逐点消融,即使是单一的消融损伤间隙也可能导致房颤的复发。
此外,手术并发症的发生率仍然是一个严重的问题。
射频消融持久损伤的产生取决于多种因素,其中三个关键变量是消融功率、持续时间和接触力。
传统的PVI策略应用的能量输送范围为25-35W,即低功率长时程(low power and long duration, LPLD)的消融方式逐点消融[3-4],这导致手术时间较长和相关并发症的风险较高。
最近,由于射频消融导管和相应系统的改进,消融接触力可以控制,人们对高功率消融策略(45-70W),又称之为高功率短时程(high power short duration,HPSD)的消融方式,越来越感兴趣。
多项研究证明HPSD 可能获得相似的病变深度和较少的并发症,且消融时间明显缩短,效率明显提高[5-6]。
此外,近年来出现了多种新型的消融能量及技术,如多电极射频球囊消融导管、热球囊消融、可视激光球囊消融和脉冲电场消融等。
一、射频消融原理射频消融的过程存在两个主要的加热阶段:阻抗式加热和传导式加热。
阻抗热会直接导致局部心肌不可逆的损伤和死亡,形成透壁损伤。
传导热则被动传导至更深的心肌组织层,造成深层组织的潜在可逆损伤(水肿)[7]。
传导热是由于阻抗热传导而来,具有时间依赖性[8]。
我们的目的是选择合适的能量及时间的分配,使消融产生的阻抗热既能够达到左房透壁性损伤,又能尽量减少长时程消融产生过多的传导热导致邻近组织的损伤。
因此人们提出了HPSD消融。
高功率短时间消融中阻抗热发挥主要作用,大大减少了传导热带来的对周边组织损伤的不确定性。



心房颤动导管消融的进展自Haissaguerre于1997年开创导管消融方法治疗心房颤动至今,导管消融已历时二十余年并成为房颤的主要治疗手段之一。
近年来相关指南进一步肯定了导管消融在房颤治疗当中的地位,药物治疗无效的阵发性房颤为导管消融的I类适应症(证据级别A);持续性房颤为导管消融的IIa类适应症(证据级别B);长程持续性房颤为导管消融的IIb类适应症(证据级别C)。
房颤导管消融的方法主要包括:肺静脉前庭电隔离术、左心房线性消融术、心房碎裂电位消融术等。
其中,新版共识肯定了肺静脉隔离为房颤导管消融的基石。
肺静脉隔离的原理与方法大约有84%-90%的房颤患者,其房颤的触发点在肺静脉。
与左心房的心肌细胞相比,肺静脉肌袖心肌细胞的不应期更短,触发活动更多。
此外,肺静脉与左房的连接处心肌细胞传导的各向异性为微折返提供了条件。
因此,肺静脉电隔离为房颤导管消融治疗的基石。
随着消融技术的进步,肺静脉隔离的部位也由肺静脉开口转移至左心房内肺静脉前庭以增加成功率,同时减少肺静脉狭窄的风险。
肺静脉电位隔离PVI最常用的方法为连续性点射频消融。
通常是在三维电解剖标测系统以及放置于肺静脉口的环形多极标测导管的指导下,部分消融肺静脉段或大片环状消融左右肺静脉与心房之间的环形区域,以达到肺静脉与左心房的双向电隔离。
三维电解剖技术使用依赖电磁或阻抗的导管定位来构建心房的3D模型。
3D电解剖技术实现了无X线透视的支持下,导管在心房内的精确可视化,从而减少了透视时间、手术时间、对患者和术者的辐射剂量]。
目前应用的主要有3种标测系统,EnSite三维电解剖测系统(美国圣犹达医疗),CARTO 磁电结合标测系统(美国强生医疗),Rhythmia三维标测系统(美国波士顿科学)。
仅仅依靠可视化虽可以清楚的显示出导管在心腔内的位置关系,但并不能展示出导管在心内膜的贴靠情况,近些年发展起来的压力感应技术可以即刻感知消融导管顶端与心内膜的贴靠压力,使得术者可以通过压力数值来得知导管贴靠情况,指导下一步操作。

心房颤动导管消融的进展自Haissaguerre于1997年开创导管消融方法治疗心房颤动至今,导管消融已历时二十余年并成为房颤的主要治疗手段之一。
近年来相关指南进一步肯定了导管消融在房颤治疗当中的地位,药物治疗无效的阵发性房颤为导管消融的I类适应症(证据级别A);持续性房颤为导管消融的IIa类适应症(证据级别B);长程持续性房颤为导管消融的IIb类适应症(证据级别C)。
房颤导管消融的方法主要包括:肺静脉前庭电隔离术、左心房线性消融术、心房碎裂电位消融术等。
其中,新版共识肯定了肺静脉隔离为房颤导管消融的基石。
肺静脉隔离的原理与方法大约有84%-90%的房颤患者,其房颤的触发点在肺静脉。
与左心房的心肌细胞相比,肺静脉肌袖心肌细胞的不应期更短,触发活动更多。
此外,肺静脉与左房的连接处心肌细胞传导的各向异性为微折返提供了条件。
因此,肺静脉电隔离为房颤导管消融治疗的基石。
随着消融技术的进步,肺静脉隔离的部位也由肺静脉开口转移至左心房内肺静脉前庭以增加成功率,同时减少肺静脉狭窄的风险。
肺静脉电位隔离PVI最常用的方法为连续性点射频消融。
通常是在三维电解剖标测系统以及放置于肺静脉口的环形多极标测导管的指导下,部分消融肺静脉段或大片环状消融左右肺静脉与心房之间的环形区域,以达到肺静脉与左心房的双向电隔离。
三维电解剖技术使用依赖电磁或阻抗的导管定位来构建心房的3D模型。
3D电解剖技术实现了无X线透视的支持下,导管在心房内的精确可视化,从而减少了透视时间、手术时间、对患者和术者的辐射剂量]。
目前应用的主要有3种标测系统,EnSite三维电解剖测系统(美国圣犹达医疗),CARTO 磁电结合标测系统(美国强生医疗),Rhythmia三维标测系统(美国波士顿科学)。
仅仅依靠可视化虽可以清楚的显示出导管在心腔内的位置关系,但并不能展示出导管在心内膜的贴靠情况,近些年发展起来的压力感应技术可以即刻感知消融导管顶端与心内膜的贴靠压力,使得术者可以通过压力数值来得知导管贴靠情况,指导下一步操作。

持续性房颤导管消融策略新进展辽宁省大连市中心医院辽宁大连 116033近年来,心房颤动(房颤)的导管消融发展迅猛,它已经成为阵发性房颤治疗的I类适应症、持续性房颤IIa类适应症。
然而,持续性房颤消融成功率低、二次或多次消融的比例高等问题仍未得到理想的解决方法。
随着房颤触发机制及维持机制,尤其是维持机制的研究和标测新技术不断涌现,也衍生出多种消融策略,本文将从以下几个方面总结1.环肺静脉隔离(CPVI)环肺静脉隔离最早由意大利的Pappone等1提出,是在三维电解剖标测系统指导下,建立肺静脉和左心房的模拟三维图像,分别于两侧肺静脉外口1-2cm处做环状消融,实际上,相比节段性肺静脉电隔离达到的肺静脉与心房之间的完全电隔离,环肺静脉隔离实现了肺静脉的解剖学隔离,它不仅隔离了来源于肺静脉的触发灶,而且改良了左心房基质,即破坏了房颤的维持机制。
Pratola等2随访经环肺静脉隔离治疗成功的持续性房颤患者后发现,只需完整的解剖学隔离即可彻底治愈大部分持续性房颤。
如何达到完整的解剖学隔离呢,Ouyang等3认为环肺静脉隔离术中的消融径线必须连续而完整,对此,我国的施海峰等4的研究提示下述原因可能是影响消融成功率的因素:由于心房特殊解剖结构导致标测及消融导管不能准确贴靠;术中为减少患者疼痛而减少消融能量;担心消融损伤而降低消融能量和温度。
2.心房线性消融左房线性消融是借鉴房颤外科迷宫术,在左心房增加线性消融,将心房分为不同部分,即可终止左心房内折返。
目前,多数研究也证实,左房线性消融术可以明显降低持续性房颤术后大折返性房速的发生。
常用的消融径线包括左房顶部、二尖瓣峡部、三尖瓣峡部,消融终点是双向阻滞。
而实践中,多数情况是只完成了三维标测下消融径线连续而完整,并未达到双向阻滞的消融终点,尤其是二尖瓣峡部消融径线。
二尖瓣峡部消融困难的主要原因是导管贴壁不佳,组织较厚,形态多变。
刘旭等5研究发现二尖瓣峡部的消融阻滞率80%,其中60%二尖瓣峡部消融需要深入冠状窦内消融,使消融难度增大。

心房颤动导管射频消融治疗进展随着心房纤颤机制的研究深入,越来越多数据表明,导管消融治疗心房纤颤的技术有望成为最终转复和长期维持窦性心律的有效方法,其适应证也在不断扩展和更新。
现就心房颤动导管射频消融治疗研究进展进行简要综述。
标签:心房颤动,导管射频消融,进展心房颤动发病率高,机制复杂,对人民健康危害大,药物治疗效果不理想,因此心房颤动的非药物治疗已成为研究的热点,尤其是导管射频消融术,其治疗有效性和安全性越来越得到认可与接受。
笔者对房颤导管消融的进展进行综述。
1.病因与机制导致心房肌病变的因素都是产生房颤的病因,自主神经调节障碍也会对心房的电生理特性产生影响。
心房肌病变主要表现为心房扩张、心房肌增生、缺血、纤维化、炎性浸润和渗出改变等。
高龄是房颤首要原因,冠心病、高血压是常见原因,其次肺心病、甲亢、预激综合征、孤立性房颤。
房颤的发病机制复杂且有争议,较早时期Moe提出了多子波折返学说,Winfree提出自旋波折返学说。
随着研究深入,越来越多的证据支持房颤为多机制所致的观点,认为“局部驱动伴向周围的颤动样传导”和肺静脉波学说是主要机制,多子波折返仅仅是房颤时心房激动的一种电活动表现形式,而不是房颤得以维持的关键因素。
来自肺静脉的电活动是驱动房颤的关键,这些驱动可为自律性增强、触发活动、局部微折返、外部刺激,然后在肺静脉前庭及其周围心房组织处不能形成1:1的激动传导,则导致颤动性传导。
或在此处形成折返,使房颤的维持更具自稳性。
此外,心房电重构、炎症与自主神经系统在房颤维持中有一定作用。
2.房颤导管消融起源基于子波折返理论,1992年COX率先报道了外科迷宫手术并取得不错的效果,受此影响,1994年Swartz首先用消融室上速的普通射频导管线性消融左右心房模拟迷宫手术取得一定效果。
随后Beukema等对258例病人在实施心脏手术同期行射频消融改良迷宫手术,术后窦性心律维持1年69%、5年52%,结果令人鼓舞。

心房颤动的导管消融治疗指南解读房颤“率与律”控制的循证医学包括多个著名的临床研究。
多中心随机临床试验:PIAF、RACE 、STAF 、HOT CAFE 、AFFIRM 研究结果一致提示,节律控制并不能有效减少死亡、卒中率。
即节律控制并不优于室率控制。
但是,上述的临床试验入选标准受条件制约:年龄、心功能、房颤的类型等。
而且,上述的临床试验随访时间均小于5年。
此外,抗心律失常药物长期治疗,不能忽视的是抗心律失常药物的致心律失常作用。
目前,我们缺乏理想的抗心律失常药物。
2012年Raluca 房颤节律和室率控制的长期随访观察研究发现,从第5年开始,节律控制患者死亡率较室率控制有所下降;第8年节律组死亡率下降达28%。
提示节律控制可能在长期治疗中存在优势。
房颤导管消融恢复窦律的几率要远高于药物治疗。
有效避免因服用抗心律失常药物带来的致心律失常作用与副作用。
对有适应证的患者导管消融治疗已经成为房颤节律控制的最佳治疗选择。
房颤节律控制中,导管消融对比药物治疗RAAFT-1 研究(Wazni,2005),MANTRA -PAF 研究(Cosedis-Nielsen,2012),RAAFT-2 研究(Mo rillo,2014),三个大规模随机试验(研究关于房颤消融VS 药物治疗作为一线选择),房颤复发率的Meta 分析指出,消融手术相对于药物治疗减少37%的复发率。
鉴于此,2012 HRS/EHRA/ECAS 专家共识,2014 ACC/AHA/HRS 指南、2016ESC 指南把房颤射频治疗作为一线选择分别写入指南。
2016ESC房颤指南指出: 1、症状明显的阵发性房颤患者,为改善症状和预防房颤再发,根据患者的意愿,比较获益/风险后,导管消融可以作为一线治疗手段来替代药物治疗Ⅱa B;(跳过抗心律失常药物,直接推荐导管消融)2、对于药物治疗无效、反复发作、症状明显的阵发性房颤患者推荐导管消融治疗ⅠA; 3、导管消融应该推荐给伴有心衰和EF降低的症状性房颤患者(心动过速心肌病所致的心衰)Ⅱa C ;4、对于症状明显的持续性或长程持久性房颤,如果药物不能改善症状,结合患者的意愿,经过房颤团队评估获益/风险后,可以考虑导管消融Ⅱa C。
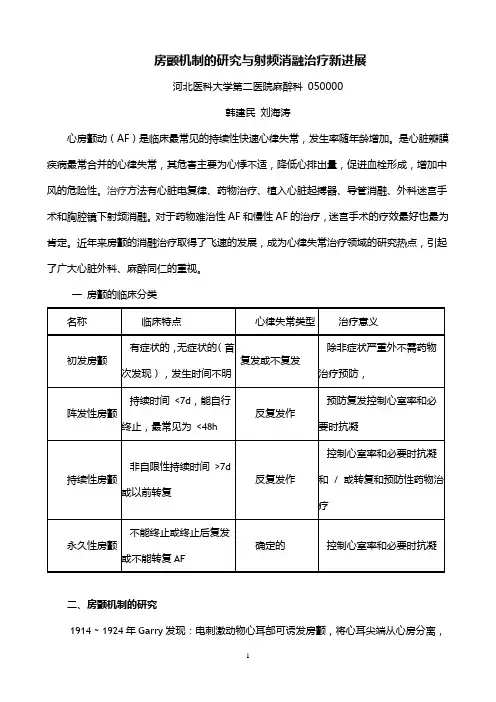
房颤机制的研究与射频消融治疗新进展河北医科大学第二医院麻醉科050000韩建民刘海涛心房颤动(AF)是临床最常见的持续性快速心律失常,发生率随年龄增加。
是心脏瓣膜疾病最常合并的心律失常,其危害主要为心悸不适,降低心排出量,促进血栓形成,增加中风的危险性。
治疗方法有心脏电复律、药物治疗、植入心脏起搏器、导管消融、外科迷宫手术和胸腔镜下射频消融。
对于药物难治性AF和慢性AF的治疗,迷宫手术的疗效最好也最为肯定。
近年来房颤的消融治疗取得了飞速的发展,成为心律失常治疗领域的研究热点,引起了广大心脏外科、麻醉同仁的重视。
一房颤的临床分类二、房颤机制的研究1914 ~ 1924年Garry发现:电刺激动物心耳部可诱发房颤,将心耳尖端从心房分离,离去心耳组织则不颤动,未被离去的心房组织颤动。
提出了房颤是由一系列飘忽不定、高度复杂的环形运动组成。
1947 年Scher 提出了房颤局灶机制假说:心房的局灶发放高频电激动可导致房颤。
当兔心房局部注射乌头碱后可诱发房颤,切除注射乌头碱的部位心房后房颤终止。
1955 年Nahum 和Hoff通过刺激犬的胆碱能神经能够诱发房颤或房性早搏。
为房颤的去迷走神经治疗的提供理论基础。
1959 年Moe 和Abildskov通过犬迷走神经介导的房颤模型研究,提出了“ 多发子波折返” 假说:房颤的维持有赖于心房内一定数量(至少3~5 个)折返子波的同时存在,折返环路与心房解剖无关,由心房局部的有效不应期和可兴奋性决定。
这些折返子波之间可以发生碰撞、湮灭、分裂、融合等多种作用方式,导致折返子波的数量、折返环的大小、速度等改变。
较好解释房颤的多种电生理特性。
1982 年Allessie 等在犬心通过灌注乙酰胆碱和快速心房起搏诱发出持续性房颤,并在心内膜密集标测;结果证实了M oe 和Abildskov的多发性子波折返学说。
1992年,Schuessler研究结果显示,心房内存在着的周长很短的“8”字形密闭的功能性折返环,这种周长很短的折返环可使折返环周围心房肌组织产生颤动样传导从而导致房颤。

心房颤动导管消融器械进展(全文)心房颤动是最常见的持续性心律失常,导管消融已成为心房颤动的一线治疗方法,导管消融新的器械技术也不断发展,为我们提供了更多的可选方案,本文将介绍心房颤动导管消融的器械进展,重点介绍心脏脉冲场消融,并包括一些其他新技术。
一、心脏脉冲电场消融Pulsed field ablation in cardiac arrhythmia心脏脉冲电场消融,是一种利用脉冲场为能量的新型消融方式。
因其对心肌组织的优先选择性、非热能消融、瞬时的能量释放和不易损伤临近组织器官等特点,受到愈来愈多的关注。
近年,大量证据包括动物及临床实验证实,心脏脉冲电场消融是一种安全、有效的新能量。
脉冲电场消融采用短时程,高电压的多个电脉冲来进行消融能量的释放,使得消融过程为非热能消融(无焦耳产热)。
脉冲电场消融的基本原理是电穿孔。
细胞膜由磷脂双分子层组成。
磷脂双分子层在电场作用下发生重排,形成纳米级亲水孔道,使细胞膜通透性增高。
若电场强度低、施加时间短,则产生的孔径小,电场施加之后细胞膜迅速将孔道再封。
此过程被称为可逆性电穿孔,用于细胞的基因转染等操作。
若电场强度高,施加时间长,则会在细胞膜上形成大孔径,多孔道,导致钾离子和酶的外泄,细胞内钙离子超载。
最终细胞内稳态破坏,细胞走向凋亡或坏死,此过程被称为不可逆电穿孔。
1、脉冲电场消融的特点与传统的射频和冷冻能量相比,脉冲电场消融为非热能消融。
相较于血液细胞、血管平滑肌、内皮及神经细胞,心肌细胞对电穿孔的阈值低[11–13]。
因此,脉冲电场可选择性的损伤心肌,而保留血管、神经及心脏周围组织,如肺、食管、膈神经等。
心脏脉冲电场消融的特点包括。
(1)不损伤冠状动脉:研究提示,消融过程中可有一过性冠状动脉筋挛,术后3个月行消融损伤灶组织切片发现冠状动脉无明显损伤,冠状动脉切片除部分内膜增生外,未见明显改变,冠状动脉内膜增生并非每次都能被观察到,提示心外膜侧电场消融不损伤冠状动脉。

持续性心房颤动导管消融房颤是一种以快速、无序心房电活动为特征的室上性快速性心律失常。
1998年,Haissaguerre等在N Engl J Med发表了消融肺静脉触发点治疗房颤的报道,为现代房颤导管消融的发展奠定了基础。
在此后的近20年间,房颤导管消融如火如荼,取得了令人瞩目的成就。
近期Natale 等报道,通过单次或多次肺静脉前庭隔离,阵发性房颤的12年成功率达到87%。
可以说,与阵发性室上性心动过速类似,阵发性房颤已经被征服。
导管消融已经被最新指南推荐为阵发性房颤的一线治疗(IIa类推荐),尤其是药物难治的阵发性房颤(I类推荐)。
然而,对于持续性房颤尤其是长程持续性房颤,导管消融的成功率仍然难以令人满意。
目前关于持续性房颤的消融术式,还处于探索阶段。
1.环肺静脉电隔离术自从1998年Haissaguerre等提出肺静脉是房颤的主要触发灶后,关于肺静脉触发灶的消融经历了点状消融、节段性消融和环状隔离等多个阶段。
点状消融必须寻找房颤发作时的最早激动点[1],因此需要反复诱发房颤和电复律,消融靶点可能深入肺静脉远端,从而造成肺静脉狭窄,并且房颤发作时往往有多个触发灶,所以无论从手术难度、效果和安全性方面都存在不足。
2000年Haissaguerre等又提出肺静脉节段性消融,即寻找可致心律失常的肺静脉,然后在肺静脉口15mm内根据激动早晚进行消融,直到肺静脉电位消失。
同年Pappone等提出利用三维标测系统(Carto)进行基于解剖的肺静脉前庭环状隔离[5],肺静脉前庭是肺静脉与左房的移行区,肺静脉前庭既存在触发灶,又常常是房颤折返的关键部位,与节段性消融相比,该术式不需要寻找所谓的致心律失常性肺静脉,且消融点更偏房侧,在手术难度和预防肺静脉狭窄的发生等方面都有优势,且三维标测系统的应用更是大大简化了手术,提高了消融的精确性。
最初的肺静脉前庭环状隔离是围绕每个肺静脉分别消融,该术式虽然也追求肺静脉隔离,但由于未采用环状电极,在判断消融终点时主要以肺静脉内电位振幅显著变低和传导延迟作为终点。
Carto射频消融对永久性房颤的最新进展【关键词】心房颤动;导管消融;三维标测【中图分类号】r541 【文献标识码】a 【文章编号】1004-7484(2012)09-0559-01心房颤动(atrial fibrillation)简称房颤,是最常见的心律失常。
随着年龄增长,房颤发生率不断增加,75岁以上人群可达9%。
对于我国老龄化严重上涨的趋势,预防和治疗房颤的问题迫在眉睫。
随着心脏电生理技术的广泛开展及其射频消融术实践的不断更新,推动了根治性射频消融术等房颤治疗领域的进展,近年来carto指导房颤射频消融术治疗永久性房颤技术趋于成熟,随着其成功率的不断提高,射频消融将可成为治疗永久性房颤的首选。
阵发性房颤的治疗:阵发性房颤是指不经治疗在2-7天内 24小时内自行恢复窦律的房颤。
往往临床应用抗心律失常药物后会很快缓解症状,常用的抗心律失常药物有ia类ic类iii类,主要作用于心房,延长心房动作电位不应期。
常用药物有胺碘酮、索他洛尔、伊布利特、利多卡因、奎尼丁、普罗帕酮等,虽然抗心律失常药物可以导致出现不少不良反应,但通过停药后都能得到有效的减轻。
根据2010年10月,欧洲心脏病学会( esc)正式发布了最新心房颤动治疗指南中明确指出了治疗阵发性房颤中抗心律失常药物做为一线首选[1、2]。
持续性房颤的治疗:随着对房颤疾病不断认识和研究,发现持续性房颤导致左房电重构,细胞内钙平衡和血流动力学改变,消弱了心肌细胞收缩力,再加上快速而不规则的心室率,这些病理学改变均使左房肌受损,顺应性减低,使左房丧失有效的收缩和舒张活动。
所以人们开始积极的消除房颤的诱因及病因。
常用射频消融治疗持续性房颤的方法如下:①线性消融自1994年首次实施外科迷宫术的消融,对36例慢性持续性房颤患者进行消融,成功率达到80%,但2例患者发生了与消融相关的脑血管意外,1例发生心包填塞。
haissaguerre[3],进一步研究发现,如果在右心房径线的基础上加左房矩形消融,则成功率可以明显提高,早期的探索证实了经导管消融治疗房颤的可行性,也使人们认识到射频消融对治疗持续性房颤治疗的重要性,为后续的工作打下了一定的基础。
最新:长程持续性房颤导管消融导管消融是目前治疗房颤的最有效手段,肺静脉电隔离(Pulmonary vein isolation,PVI)是导管消融的基石策略。
肺静脉电隔离在阵发性房颤患者中效果较好,然而在持续性房颤中单纯肺静脉电电隔离成功率仍然有限,理论上持续性房颤在肺静脉隔离后增加额外消融会提高导管消融成功率。
STAR-AF II是一项多中心RCT研究,该研究比较了肺静脉隔离增加辅助线或碎裂电位消融与单纯肺静脉隔离相比,能否提高导管消融成功率,然而结果令人遗憾,PVI之外增加线性消融或CAFEs消融并未提高持续性房颤导管消融成功率。
持续性房颤的导管消融策略再次进入新的探索路程。
目前关于持续性房颤导管消融的学术讨论主要集中于两个方面:(1)消融策略的探讨,目前主要探索针对房颤发作过程中的特殊现象进行干预,如Rotor消融,房颤律下瘢痕基质标测与改良,后壁box隔离,非肺静脉外触发灶的标测与消融等;(2)消融方式和手段的探讨,如高功率短时程消融方法、脉冲场消融等。
本文将总结现有的临床研究证据,介绍持续房颤消融的挑战与进展。
1. Rotor消融策略Lammers教授在1993年提出了房颤的多波子折返假说,理论上来讲通过消融或破坏这些多波子折返,房颤就可以消除,但是起今为止标测这些所谓“rotor”仍然相对较困难。
64极网篮标测导管和252极体外标测背心的应用能够在房颤过程中标测到部分“rotor”。
Narayan等人最先报道了Rotor 消融的结果,与单纯肺静脉电隔离比,消融成功率提高15%以上,该研究中Rotor是稳定、且持续的。
Haissaguerre等利用252极体外标测背心的标测手段标测并消融rotor即刻房颤终止率显著提高,且房颤复发率明显降低,但该研究中标测的Rotor不稳定、多变重复性差。
另外一些标测手段如Carto Finder、时空离散度等均显示了较好的结果,70-80%的Rotor 位于左房,20%左右的Rotor位于右房,随访1年成果率在70-85%之间,但大部分为小样本、单中心研究。
基金项目:上海市优秀学术/技术带头人计划(19XD1423600);军委后勤保障部保健专项(20BJZ11);上海市“医苑新星”杰出青年医学人才培养资助计划(20224Z0007);上海市自然科学基金面上项目(20ZR1456700)通信作者:郭志福,E mail:guozhifu@126.com·综述·心房颤动导管消融术的创新和策略转变赵海娟 李珂 赵耀 黄松群 郭志福(海军军医大学第一附属医院心血管内科,上海200433)【摘要】心房颤动的治疗在过去几十年中发生了巨大的变化,尤其是在非药物治疗方面取得了重要进展,导管消融术正逐步成为心房颤动患者的一线治疗方案。
肺静脉隔离是导管消融的基石,但由于肺静脉隔离不完全和其他非肺静脉触发灶等因素,通常需再次行导管消融术,因此还需进一步开发消融设备,改进消融策略。
现概述心房颤动导管消融术的发展,介绍最新技术以及临床研究和未来发展方向。
【关键词】心房颤动;肺静脉隔离;导管消融;心房颤动复发【DOI】10 16806/j.cnki.issn.1004 3934 2023 06 001InnovationsandParadigmShiftsinAtrialFibrillationAblationZHAOHaijuan,LIKe,ZHAOYao,HUANGSongqun,GUOZhifu(DepartmentofCardiology,TheFirstAffiliatedHospitalofNavalMedicalUniversity,Shanghai200433,China)【Abstract】Treatmentofatrialfibrillationhasseendramaticbreakthroughsinthepastdecades,especiallyinthefieldofnon pharmacologicaltreatment.Inordertohaveabetterrhythmcontrol,catheterablationhasgraduallybecomethefirst linetherapyforpatientswithatrialfibrillation.Pulmonaryveinisolationisthecornerstoneofcatheterablation.However,re doproceduresareoftennecessaryduetoincompletepulmonaryveinisolationandnon pulmonaryveintriggers.Therefore,thereisfurtherneedfordevelopingablationtoolsandstrategiesthatreproduciblyisolatethepulmonaryveintransmurally.Inthisreview,wewillsummarizethedevelopmentofcatheterablationinatrialfibrillation,andintroducethelatesttechnologies,clinicalresearchesandfutureendeavours.【Keywords】Atrialfibrillation;Pulmonaryveinisolation;Catheterablation;Atrialfibrillationrecurrence 心房颤动(房颤)是最常见的持续性心律失常,以其高发病率和高死亡率引起广泛关注。
心电与循环2019年第38卷第5期陈明龙,主任医师、教授、博士生导师。
现任南京医科大学第一附属医院心内科副主任,徐州医科大学附属医院院长,中华医学会心电生理与起搏分会副主任委员,中国生物医学工程学会心律学分会副主任委员,亚太心律学会会员分会主席,国际四大学会官方杂志JACC Clinical Elec -trophysiology 、Journal of Cardiovascular Electrophysi -ology 、Journal of Arrhythmia 、HeartRhythm Case Re -ports 编委,并作为亚太心律学会组长参与国际室性心律失常射频消融指南编写。
相关研究成果被心血管病学“圣经”Braunwald 's Heart Disease 、美国和欧洲的室性心律失常导管消融指南、2017美国心律学会房颤消融指南、美国心律失常专科医师培训教材Catheter Ablation of Cardiac Arrhythmias 等引用。
心房颤动(简称房颤)可诱发心力衰竭、多脏器血栓栓塞事件,导致较高的致残率和致死率。
目前导管消融治疗房颤已广泛应用于临床,并获得各国指南推荐。
关于消融策略,自[1]1998年率先提出房颤触发灶来源于肺静脉,环肺静脉隔离(circumferential pulmonary vein isolation ,CPVI )已成为房颤消融治疗的基石。
然而,与阵发性房颤相比,单纯CPVI 治疗持续性房颤的成功率并不理想[2]。
这让电生理医生意识到,心房的基质在持续性房颤的发生和维持中可能扮演着比肺静脉更为重要的角色。
因此,针对持续性房颤,在CPVI 基础上,经验性的线性消融、复杂碎裂电位消融、或两者结合的步进式消融等更为激进的消融策略被广泛尝试。
然而,更激进的经验性消融能否产生更好的消融效果?所有持续性房颤患者均接受激进的消融,是否有必要?一些研究对此提出了质疑[3-5]。
持续性房颤导管消融策略新进展
发表时间:2016-06-16T15:24:53.383Z 来源:《健康世界》2016年第5期作者:张芳夏振伟[导读] 本文将从以下几个方面总结。
辽宁省大连市中心医院辽宁大连 116033近年来,心房颤动(房颤)的导管消融发展迅猛,它已经成为阵发性房颤治疗的I类适应症、持续性房颤IIa类适应症。
然而,持续性房颤消融成功率低、二次或多次消融的比例高等问题仍未得到理想的解决方法。
随着房颤触发机制及维持机制,尤其是维持机制的研究和标
测新技术不断涌现,也衍生出多种消融策略,本文将从以下几个方面总结 1.环肺静脉隔离(CPVI)
环肺静脉隔离最早由意大利的Pappone等1提出,是在三维电解剖标测系统指导下,建立肺静脉和左心房的模拟三维图像,分别于两侧肺静脉外口1-2cm处做环状消融,实际上,相比节段性肺静脉电隔离达到的肺静脉与心房之间的完全电隔离,环肺静脉隔离实现了肺静脉的解剖学隔离,它不仅隔离了来源于肺静脉的触发灶,而且改良了左心房基质,即破坏了房颤的维持机制。
Pratola等2随访经环肺静脉隔离治疗成功的持续性房颤患者后发现,只需完整的解剖学隔离即可彻底治愈大部分持续性房颤。
如何达到完整的解剖学隔离呢,Ouyang等3认为环肺静脉隔离术中的消融径线必须连续而完整,对此,我国的施海峰等4的研究提示下述原因可能是影响消融成功率的因素:由于心房特殊解剖结构导致标测及消融导管不能准确贴靠;术中为减少患者疼痛而减少消融能量;担心消融损伤而降低消融能量和温度。
2.心房线性消融
左房线性消融是借鉴房颤外科迷宫术,在左心房增加线性消融,将心房分为不同部分,即可终止左心房内折返。
目前,多数研究也证实,左房线性消融术可以明显降低持续性房颤术后大折返性房速的发生。
常用的消融径线包括左房顶部、二尖瓣峡部、三尖瓣峡部,消融终点是双向阻滞。
而实践中,多数情况是只完成了三维标测下消融径线连续而完整,并未达到双向阻滞的消融终点,尤其是二尖瓣峡部消融径线。
二尖瓣峡部消融困难的主要原因是导管贴壁不佳,组织较厚,形态多变。
刘旭等5研究发现二尖瓣峡部的消融阻滞率80%,其中60%二尖瓣峡部消融需要深入冠状窦内消融,使消融难度增大。
如果径线不能消融彻底,同样是术后房速的复发的重要因素。
此外左心房的大面积消融也可引起左房功能下降。
3.心房碎裂电位(CFAEs)消融 2004年,Nademanee首次定义复杂碎裂电图(complex fractionated atrial electrograms,CFAEs),并提出CFAEs是房颤维持基质,对其消融后可提高的持续性房颤消融治疗的成功率6,但遗憾的是该结果没有在多家心脏电生理中心复制,考虑原因如下:各电生理中心对CFAEs的定义不同,记录及分析的方法有差异,术者的经验也时刻影响标测的结果,消融终点缺乏统一标准,消融造成的心房损伤更大,术后“医源性”心律失常发生更高。
鉴于上述多种问题尚未解决,目前多家电生理中心更愿意将CFAEs作为消融的辅助措施。
新近,刘兴鹏等7另辟蹊径,通过术中应用伊布利特评估心房基质,进而减少不必要的CFAEs消融。
该方法简单易行,适合在临床大范围推广,更值得注意的是在短时期内标测及消融设备尚不能满足所有临床需要的时候,这种方法更像是“四两拨千斤”的解决了问题,节省的大量的人力物力,值得学习和借鉴。
4.转子(rolor)消融
转子是指规则的功能性折返激动,可能是快速性心律失常和颤动的驱动灶,因为标测困难,所以临床开展较少。
2012年,Narayan等8通过特殊的篮状电极标测出心房转子后对其进行消融,单次随访成功率高于单纯肺静脉隔离,且心房损伤小、消融时间短。
但该标测电极及软件未能在临床广泛开展,因而缺乏大规模的临床对照结果。
尽管新的消融策略不断涌现,但持续性房颤的单次消融成功率仍不满意,甚至单纯的环肺静脉隔离与环肺静脉隔离+左房线性消融及环肺静脉隔离+碎裂电位消融相比,三者的复发率无差异9。
考虑到诱发及维持房颤的因素多种多样,持续性房颤的触发及维持机制不明,目前的基质标测不满意,所有我们期待更多的基础及临床研究结果、更方便有效的标测消融设备,最终攻克持续性房颤。
参考文献:
[1]Pappone C,RosanioS,Chunlmonary J,et al.Circumferential radiofrequency ablation of pulmonary vein ostia:A new anatomic approach for curing atrial fibrillation [J].Circulation,2000,102:2619-2628.
[2]姜伟峰,刘旭,王新华,施海峰,等。
环肺静脉电隔离术后心房-肺静脉电位恢复情况的随访。
中国心脏起搏与心电生理杂志,2010,24:329-332。
[3]王新华,刘旭,施海峰,等。
慢性心房颤动导管消融:碎裂电位消融和线性消融的比较。
中国心脏起搏与心电生理杂志,2011,25:206-209。
[4]Nademanee K,McKenzie J,Kosar E,et al.A new approach for catheter ablation of atrial fibrillation:mapping of electrophysiologic substrate.J Am Coll Cardiol,2004,43:2044-2053.
[5]刘兴鹏,田颖,尹先东,等。
小剂量伊布利特辅助的持续性房颤导管消融治疗。
中华心律失常学杂志,2014,18:83-88。
[6]AtulVerma,Chen-yang Jiang,Timothy R,et al.Approaches to Catheter Ablation for Persistent Atrial Fibrillation.N ENGL J MED 2015 372;19 1812-1822.。