中考化学流程图题专题
- 格式:doc
- 大小:341.50 KB
- 文档页数:4

一、中考初中化学流程图1.镁是一种用途很广的金属,目前世界上60%的镁是从海水(溶质主要含NaCl 和MgCl 2等)中提取的,主要步骤如下:(1)工业生产中,加入试剂①发生反应的化学方程式为______,试剂②的名称为______; (2)写出无水MgCl 2在熔融状态下电解制取金属镁的化学方程式______,该反应属于基本反应类型中的______反应。
【答案】MgCl 2+Ca (OH )2=Mg (OH )2↓+CaCl 2 稀盐酸 MgCl 2通电Mg+Cl 2↑ 分解【解析】【分析】流程图题,由图分析氯化镁转化为氢氧化镁,通常加入氢氧化钙,通过氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,过滤可实现分离;氢氧化镁转化为氯化镁,加入稀盐酸,氢氧化镁和稀盐酸反应生成氯化镁和水;无水氯化镁熔融状态下电解生成镁和氯气,属于分解反应。
【详解】(1)、氯化镁转化为氢氧化镁需要加入氢氧化钙进行反应,氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:2222MgCl +Ca(OH)=CaCl +Mg(OH)↓;结合流程图分析,由氢氧化镁转化为氯化镁,需加入的试剂为稀盐酸,因此试剂②为稀盐酸;(2)、由流程图可知无水氯化镁在熔融状态下电解生成镁和氯气,化学反应方程式为:22MgCl ()Cl +Mg ↑电解熔融;该反应一种反应物,生成两种生成物,故反应的类型为分解反应。
【点睛】本题为流程图题,解题时认真观察流程图,结合物质之间的转化关系选择合适的试剂,再正确书写方程式,选择合适的方法实现物质的分离。
需要注意的时利用海水中的氯化镁转化为氢氧化镁时,加入碱液实现转化,工业上通常加入的物质是氢氧化钙溶液,成本比氢氧化钠要低,再利用氢氧化镁和稀盐酸反应生成氯化镁,得到无水氯化镁之后,在熔融状态下电解可以得到单质镁和氯气。
2.侯德榜制碱法的原理是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱.此过程可以表示为:①3223NaCl()NH CO H O NaHCO ()+++=↓+饱和 (此反应是放热反应) ②煅烧碳酸氢钠后,得到纯碱。




2024成都中考化学复习第二部分 重难题型分类练 题型四 流程图题 类型1 制备与生产流程考向1 金属及金属氧化物的制备流程1.(中华优秀传统文化) (2023岳阳)《梦溪笔谈》中记载了用“苦泉水”制取铜的方法:“挹其水熬之,则成胆矾,烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜”。
此文记录了两种冶铜工艺,主要流程如图所示。
资料:“熬成胆矾”是将硫酸铜溶液蒸发制得硫酸铜晶体,该化学反应为:CuSO 4+5H 2O =====加热CuSO 4·5H 2O 。
(1)写出“铁釜”中发生反应的化学方程式________________________________。
(2)上述生产过程中,没有涉及到的化学反应类型是________(填字母)。
A.化合反应B.分解反应C.置换反应D.复分解反应(3)实验室从硫酸铜溶液中分离出硫酸铜晶体的操作过程为:①加热蒸发到饱和;②降温析出晶体;③______(填操作名称)。
(4)生产生活中铁釜(铁锅)易锈蚀,请写出一种金属防锈的方法_____________。
2.(2022江西改编)某化工厂以生产钛白粉的主要副产物(含硫酸亚铁)为原料,制取含高纯度氧化铁的氧化铁红,其工业流程如下:(1)操作1能得到硫酸亚铁晶体,说明硫酸亚铁的溶解度随温度的升高而________。
(2)实验室中完成操作2时,玻璃棒的作用是________。
(3)操作3中,硫酸亚铁在空气中煅烧得到氧化铁和三氧化硫的化学方程式为___________。
(4)操作4吸收三氧化硫时水由顶端喷洒的目的是_____。
3.(2023昆明)铬是一种用途广泛的金属。
工业上以铬铁矿[主要成分Fe(CrO2)2]为原料冶炼铬,流程如下:回答下列问题:(1)操作a的名称是________。
(2)反应Ⅱ的化学方程式为8Na2CrO4+3X+20H2O=== 8Y↓+3Na2SO4+16NaOH,X、Y表示两种物质,Y的化学式为________________________________________________。
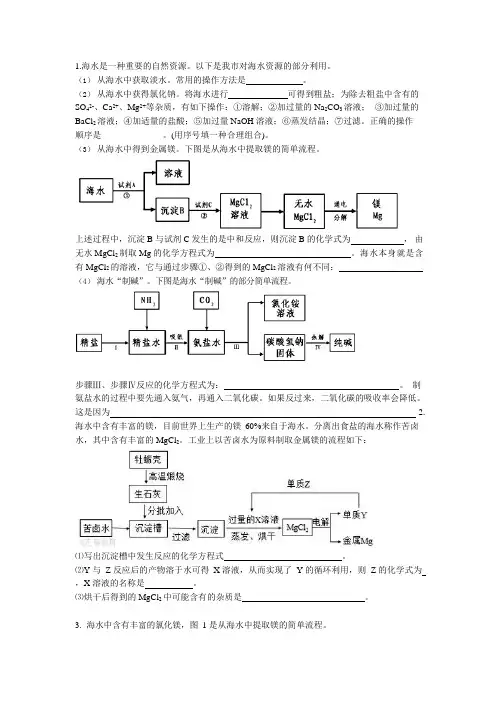
1.海水是一种重要的自然资源。
以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。
常用的操作方法是。
(2)从海水中获得氯化钠。
将海水进行可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液;③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH 溶液;⑥蒸发结晶;⑦过滤。
正确的操作顺序是。
(用序号填一种合理组合)。
(3)从海水中得到金属镁。
下图是从海水中提取镁的简单流程。
上述过程中,沉淀B 与试剂C 发生的是中和反应,则沉淀B 的化学式为,由无水MgCl2制取Mg 的化学方程式为。
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:(4)海水“制碱”。
下图是海水“制碱”的部分简单流程。
步骤Ⅲ、步骤Ⅳ反应的化学方程式为:。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。
如果反过来,二氧化碳的吸收率会降低。
这是因为 2.海水中含有丰富的镁,目前世界上生产的镁60%来自于海水。
分离出食盐的海水称作苦卤水,其中含有丰富的MgCl2。
工业上以苦卤水为原料制取金属镁的流程如下:⑴写出沉淀槽中发生反应的化学方程式。
⑵Y 与Z 反应后的产物溶于水可得X 溶液,从而实现了Y 的循环利用,则Z 的化学式为,X 溶液的名称是。
⑶烘干后得到的MgCl2中可能含有的杂质是。
3.海水中含有丰富的氯化镁,图1 是从海水中提取镁的简单流程。
(1)上述提取Mg 的过程中,试剂A 可选用,沉淀B 与试剂C 发生的是中和反应,则沉淀B 的化学式为。
(2)上述提取Mg 的过程中,操作①为。
(3)由无水MgCl2电解制取Mg 的化学方程式为(4)电解无水MgCl2过程中所发生的能量转化与下列哪个过程相同A.给蓄电池充电B.水力发电C.用电热水器烧开水D.干电池使小灯泡发光(5)已知氯化镁的溶解度曲线如图2 所示,从氯化镁溶液中取得氯化镁晶体,应选择结晶方式.(选填“蒸发溶剂”、“降低温度”)4.通过海水晾晒可得粗盐,粗盐除NaCl 外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验方案,各步操作流程如下:(1)在第①步粗盐溶解操作中要用搅拌,作用是.(2)第②步操作的目的是除去粗盐中的(填化学式,下同)(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、。

一、中考初中化学流程图1.如图是常见物质的转化关系图(个别产物可能略去).其中A、B常温下均为液态,且组成元素相同;F是大理石的主要成分.请回答:(1)A的名称是_____,在反应①中,物质X起_____作用;(2)说出物质Z的一个用途_____;(3)反应②的化学方程式为_____;(4)反应⑥的化学方程式为_____;(5)反应①﹣⑥涉及的基本反应类型有_____种.【答案】双氧水或过氧化氢溶液催化做导线等 CaO+H2O = Ca(OH)2CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ 3种【解析】【分析】已知F是大理石的主要成分,则F是碳酸钙,最后得到了蓝色沉淀,由此可以推出D为氢氧化钙,则可想到是生石灰和水化合生成了氢氧化钙,又因为已知A、B常温下均为液态,且组成元素相同,可以推知B是水,A是双氧水,双氧水在二氧化锰的催化作用下可生成水和氧气,所以X是二氧化锰,C是氧气,最后生成的蓝色沉淀是氢氧化铜,则往前推一下可知H是硫酸铜,再往前推测可知E是氧化铜,则Z是铜。
【详解】(1)A的名称是过氧化氢溶液,在反应①中,二氧化锰是过氧化氢溶液分解的催化剂,物质X起催化作用;(2)物质Z是铜,它的一个用途是做电线;(3)反应②是氧化钙和水反应生成氢氧化钙,反应的化学方程式为CaO+H2O = Ca(OH)2;(4)反应⑥是氢氧化钠和硫酸铜反应生成氢氧化铜和硫酸钠,反应的化学方程式为CuSO4+2NaOH=Na2SO4+Cu(OH)2↓;(5)反应①过氧化氢生成氧气和水是分解反应;反应②是氧化钙和水反应生成氢氧化钙、反应③是氧气和铜反应生成氧化铜都是化合反应,④⑤⑥都是复分解反应,涉及的基本反应类型有3种.2.实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3•3H2O.其主要实验过程如图:已知:SiO 2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)“酸溶”时发生反应的化学方程式为_____和_____。

实用文档 一、中考初中化学流程图1.黄铜矿(主要成分2CuFeS )经初步处理后,所得溶液甲中的溶质为243Fe SO ()、4CuSO 及24H SO 。
某同学通过废铁屑与溶液甲反应,制取补血剂的原料碳酸亚铁并回收铜。
主要步骤如下图所示:温馨提示:2434+Fe (SO )Fe=3FeSO﹙1﹚操作a 的名称是________,该操作中会用到玻璃棒,其作用是___________ 。
﹙2﹚不溶物的成分为___________________ 。
﹙3﹚步骤Ⅰ中生成铜的化学方程式为_________;废铁屑中含有少量铁锈,却对产物的成分没有影响,原因是________。
步骤Ⅲ中加入一种可溶性试剂可实现转化,从复分解反应的条件分析,该试剂可以是___________(填化学式)溶液。
【答案】过滤 引流 Cu 、Fe 44=Fe+CuSO FeSO +Cu 铁锈可与硫酸反应生成硫酸铁,硫酸铁再和铁反应生成硫酸亚铁 23Na CO【解析】【分析】铁和硫酸铜反应生成硫酸亚铁和铜,氧化铁能和稀硫酸反应生成硫酸铁和水,硫酸铁能和铁反应生成硫酸亚铁。
【详解】(1)操作a 的名称是过滤,该操作中会用到玻璃棒,其作用是引流;(2)不溶物的成分为铁和硫酸铜反应生成的铜和过量的铁;故不溶物的成分为Cu 、Fe 。
(3)步骤I 中,铁和硫酸铜反应生成硫酸亚铁和铜,生成铜的化学方程式为44=Fe+CuSO FeSO +Cu ;废铁屑中含有少量铁绣,却对产物的成分没有影响,原因是铁锈中的氧化铁能和稀硫酸反应生成硫酸铁,硫酸铁能和铁反应生成硫酸亚铁。
步骤Ⅲ中,加入碳酸钠溶液时,碳酸钠能和硫酸亚铁反应生成碳酸亚铁和硫酸钠,从而得到碳酸亚铁,因此从复分解反应的条件分析,该试剂可以是Na 2CO 3溶液。
2.某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO 2)和少量石灰石。
下图是利用该镁矿石制备七水硫酸镁(MgSO 4·7H 2O)的工艺流程。

2024年中考化学复习题型突破篇—流程图题【题型解读】化学工艺流程题是以化工生产中的真实情景为素材,把生产流程用框图形式表示出来,对生产流程中有关的化学知识进行设问。
与化工生产成本、产品提纯、环境保护等相融合,考查内容涉及:实验步骤、实验注意事项、操作名称、物质的制备、检验、分离提纯等在化工生产中的实际应用,要求考生依据流程图分析原理,紧扣信息,抓住关键、准确答题。
注重对考生综合化学思维能力的考查。
流程示意图解读明确工艺流程的目的,关注箭头及所指方框箭头:箭头进入的是投料(即反应物)、出去的是生成物(包括主产物和副产物)三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环使用。
突破方法:关注流程“三线(去线、进线、可逆线)”和“核心”流程示意图图解:1常考操作术语及目的【方法指导】(1)粉碎(研磨):增大反应物的接触面积,加快反应速率或使反应更充分。
(2)搅拌:使反应物充分接触、加快反应(或溶解)速率。
(3)浸出:使原料中的物质溶解(或与浸取液接触反应),可溶性离子进入溶液,不溶物通过过滤除去。
①水浸:使可溶物溶解,与不溶物分离。
②酸浸:溶解金属、金属氧化物(如氧化铝等)、难溶性碱或碳酸盐等。
③碱浸:溶解二氧化硅、氧化铝等。
(4)灼烧(煅烧):使固体或杂质在高温条件下分解,使反应充分进行或增大转化率。
2化学方程式的书写方法【方法指导】(1)寻找反应物和生成物:根据箭头方向判断,箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。
(2)查漏补缺;若从已知信息中找出的反应物和生成物不满足质量守恒定律;①考虑反应中是否有水参与或生成;②若通入空气,则考虑O2或CO2是否参加反应。
然后根据题意写出反应条件并配平即可。
【题型突破精练】1.(2024·江苏南通·一模)《天工开物》记载的“生铁、熟铁连续生成工艺”,处于当时世界领先地位,是现代冶金工艺的雏形。
其流程图如图所示。
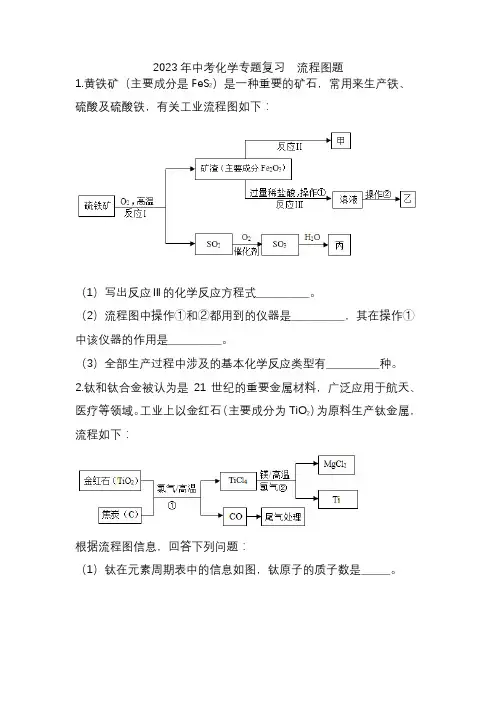
2023年中考化学专题复习流程图题1.黄铁矿(主要成分是FeS2)是一种重要的矿石,常用来生产铁、硫酸及硫酸铁,有关工业流程图如下:(1)写出反应Ⅲ的化学反应方程式___________。
(2)流程图中操作①和②都用到的仪器是___________,其在操作①中该仪器的作用是___________。
(3)全部生产过程中涉及的基本化学反应类型有___________种。
2.钛和钛合金被认为是21世纪的重要金属材料,广泛应用于航天、医疗等领域。
工业上以金红石(主要成分为TiO2)为原料生产钛金属,流程如下:根据流程图信息,回答下列问题:(1)钛在元素周期表中的信息如图,钛原子的质子数是______。
(2)反应①的化学方程式为______。
(3)反应②的基本反应类型是______。
(4)反应②是在氩气环境下进行的,氩气的作用是______。
(5)航天飞机常用到钛合金,是因为钛合金具备很多优良性能,如______(请你写出一点)。
3.以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:已知:SiO2难溶于水和酸,FeCl3·6H2O受热易分解。
回答下列问题。
高温(1)配平黄铁矿焙烧的化学方程式:_____FeS2+_____O2_____Fe2O3+_____SO2。
(2)试剂a的名称是___________。
(3)操作Ⅱ为___________(填“蒸发结晶”或“降温结晶”)。
(4)焙烧产生的SO2可用于工业制备硫酸,制备过程中产生的废气中含有SO2,废水中含有硫酸。
以下想法不妥的是___________(填字母)。
A 废气可以回收再利用B 废气可以点燃后排放C 废水用熟石灰中和后排放D 改进工艺,减少废气废水的排放4.过氧化镁(MgO2)是一种镁精细化工产品,在医疗上可用来治疗消化不良、胃酸过多等疾病。
下图是利用Mg2(OH)2CO3生产过氧化镁的工艺流程。

一、中考初中化学流程图1.高炉炼铁所需的原料有铁矿石、焦炭、石灰石等,其过程可用下图简要表示:已知气体①、气体②和固体③均属于氧化物。
(1)气体②的化学式为_____。
根据氧化物的性质推测炉渣的主要成分为_____(填化学式)。
(2)炼铁高炉底部通过不同高度的出口分离铁水与炉渣(如图2所示)。
能实现渣铁分离的原因是是因为炉渣具有_____、_____的性质。
(3)反应Ⅰ~Ⅴ中属于化合反应的有_____个,属于分解反应的有_____个,属于置换反应的有_____个。
(4)高炉气体中含有多种成分,其中含量最高(占55%~60%)的是_____(填化学式),此外还含有25~30%的可燃性气体_____(填化学式),以及9~12%左右的_____(填化学式)。
【答案】CO CaSiO3熔点高密度比铁水小 3 1 0 N2 CO CO2【解析】【分析】【详解】(1)碳和氧气在点燃的条件下生成二氧化碳,二氧化碳和碳在高温的条件下生成一氧化碳,所以气体②的化学式为CO,化学反应前后,元素种类不变,所以依据氧化物的性质推测炉渣的主要成分为:CaSiO3;(2)炉渣的出口在上方,铁水的出口在下方,所以炉渣具有熔点高、密度比铁水小的性质;(3)Ⅰ是碳和氧气反应生成二氧化碳,属于化合反应,Ⅱ是二氧化碳和碳高温生成一氧化碳,属于化合反应,Ⅲ是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,不属于基本反应类型,Ⅳ是氧化钙、二氧化硅反应生成硅酸钙,属于化合反应,Ⅴ是碳酸钙高温生成氧化钙和二氧化碳,属于分解反应,所以反应Ⅰ~Ⅴ中属于化合反应的有3个,属于分解反应的有1个,属于置换反应的有0个;(4)空气中含量最高的是氮气,所以高炉气中含有多种成分,其中含量最高(占55~60%)的是N2,此外还含有25~30%的可燃性气体CO,以及9~12%左右的CO2。
2.下图为工业利用石灰石和食盐水制作漂白粉的流程图。
(1)石灰石高温燃烧得到的两种氧化物,反应的化学方程式为______________。
中考专题复习流程题一、知识梳理1.流程路线示意图2.常考操作术语及目的(1)原料进行预处理的常用方法及其作用①粉碎(研磨):。
②灼烧(煅烧):使固体或使杂质等。
使反应或增大转化率、产率。
(2)常用的分离方法①过滤:和的分离。
所需仪器有铁架台(带铁圈)、滤纸、、烧杯、玻璃棒。
②蒸发结晶:提纯溶解度的物质,如NaCl。
③降温结晶:提纯溶解度的物质。
操作过程为蒸发浓缩→→过滤→洗涤→干燥。
浓缩:,提高溶液的浓度。
洗涤:除去。
干燥:。
二、考点透视题型1 工业制备类例1 . 金属镍可用于制造货币、不锈钢等。
粗制氧化镍中含有少量氧化钴(CoO)和氧化铁,以粗制氧化镍为原料制备纯镍的流程如下:(1)反应①中,反应物X可能是____________。
(2)石灰浆是氢氧化钙的悬浊液,反应②的化学方程式为。
(3)操作安全说明中要求反应③开始前“用氮气充分吹扫设备内部”的目的是。
(4)由下表推知:从Ni(CO)4、Fe(CO)5和Co2(CO)8的混合物中用蒸馏的方法提取Ni(CO)4应选择的温度(T)范围是__________________________。
物质Ni(CO)4Fe(CO)5Co2(CO)8沸点/℃4310352(5)在以上生产流程中循环使用CO的目的是。
例2 . 孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。
现以孔雀石为原料制取胆矾(CuSO4·5H2O)的部分工艺流程如图。
请回答:(1)滤渣b的化学式为____________。
(2)溶液c中的溶质有(写化学式):H2SO4、______________、______________。
(3)盐溶液d的颜色为__________;实验室蒸发溶液时用到的玻璃仪器有____________(写1种)(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O=== CaCO3↓+2X,X的名称为____ ________;孔雀石与稀硫酸反应生成气体a的化学方程式为。
题型三工艺流程图题基础作业1.铝是一种重要金属,从铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)中冶炼Al的工业生产流程如图所示:(1)操作Ⅰ的名称是。
(2)溶液A中含有的阳离子为Al3+、Fe3+和 (填离子符号)。
(3)电解氧化铝时还会生成一种气体,该反应的化学方程式为。
(4)溶液C中含有Na2CO3,则该生产流程中可循环使用的物质除NaOH外,还有、。
2.某化学活动小组在实验室以MnO2固体为原料制取少量MnCO3,基本流程如下:已知:MnSO4可溶于水;MnCO3难溶于水且在100 ℃时开始分解。
(1)操作a的名称为。
(2)反应①中生成物只有MnSO4,该反应的化学方程式为。
(3)产品MnCO3(Ⅱ)比MnCO3(Ⅰ)更纯净,原因是产品MnCO3(Ⅰ)经过洗涤、烘干以后,除去了表面附着的和。
(4)烘干MnCO3时需要控制的条件是。
3.某同学以金泥(含有Au、CuS、ZnS等)为原料制备Au和Cu的流程如图所示:已知:①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将Cu、Zn转化为氧化物,并完全分离出ZnO烟尘。
(1)“预处理”中会产生SO2,若SO2直接排放,会导致。
(2)“过程Ⅱ”产生的固体a中,除CuO外一定还有的物质是。
(3)“过程Ⅲ”分离Au的操作是 ,加入过量稀硫酸的目的是。
(4)“系列进程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为 ,该反应属于 (填写基本反应类型)。
(5)ZnO烟尘可用NaOH溶液吸收,该反应生成偏锌酸钠(Na2ZnO2)和H2O的化学方程式为。
4.硫酸锌可制备各种含锌材料,在防腐、医学上有很多应用。
菱锌矿的主要成分是ZnCO3,还含有少量的二氧化硅和氧化铁。
以菱锌矿为原料制备ZnSO4·7H2O的工艺流程如下图所示。
(二氧化硅难溶于水,也不与稀硫酸反应)ZnSO4·7H2O回答下列问题:(1)菱锌矿属于 (选填“纯净物”或“混合物”)。
一、中考初中化学流程图1.以下是印刷线路板的生产及废液的处理过程:请回答下列问题:(1)写出步骤②中发生的一个反应:______________________(2)滤渣的成份有________,步骤③中发生反应的化学方程式是______________________(3)该流程中可以循环、回收利用的物质是:________________。
【答案】Fe+CuCl2==Cu+FeCl2Fe、Cu Fe+2HCl==FeCl2+H2↑FeCl2【解析】(1)金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。
金属的位置越靠前,金属的活动性越强。
位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。
将铁放入氯化铜、氯化铁、氯化亚铁的溶液中,铁能与氯化铁反应生成氯化亚铁,与氯化铜反应生成氯化亚铁和铜;反应方程式为:2FeCl3 + Cu= CuCl2 +2FeCl2,Fe+CuCl2==Cu+FeCl2,(2) 步骤②反应后的固体即为滤渣,成份有生成的铜和过量的铁,步骤③中铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是Fe+2HCl==FeCl2+H2↑(3) 步骤②与步骤③生成的氯化亚铁可以在一定条件下转化成氯化铁,可循环利用。
2.通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgC12、CaCl2、Na2SO4以及泥沙等杂质。
以下是制备精盐的实验方案,各步操作流程如下:(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是_______________。
(2)第⑤步“过滤”操作中用到的仪器除烧杯、玻璃棒外还需要的玻璃仪器是_______________。
得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、_______________(填化学式)。
(3)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是_______________。
2022中考化学专题复习流程图题1. 以硫铁矿烧渣(主要成分Fe2O3、FeO、SiO2)为原料,制备高纯度氧化铁(Fe2O3)的生产流程示意图如图,回答下列问题。
(1)操作Ⅰ、操作Ⅱ的名称是;(2)写出高温时CO与硫铁矿烧渣反应生成Fe的其中一个化学方程式;(3)写出加入过量稀硫酸发生反应的化学方程式;(4)滤液Ⅰ的溶质是(填化学式)。
2. 工业上用铝土矿(含有Al2O3和SiO2,不考虑其它杂质)制取金属铝的基本流程如图所示。
(1)操作I的名称为;(2)通过该流程可得出SiO2的性质有(填序号);A.能溶于水B.不能与稀硫酸反应C.能与氢氧化钠溶液反应(3)铝土矿中氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式为;(4)电解熔融的氧化铝制取铝的化学方程式为。
3. “温室效应”是全球关注的环境问题之一,二氧化碳是目前大气中含量最高的一种温室气体,实现碳循环、促进CO2转化为有机物和控制CO2的排放量,是解决温室效应的有效途径.(1)下列措施中,不利于降低大气中CO2浓度的是(填序号)A.焚烧秸秆 B.利用太阳能、风能C.减少化石燃料的使用 D.植树造林,增大植被面积(2)某化学研究小组利用CO2催化氢化制甲烷的办法,实现了将CO2转化为有机物,实验过程如下:对反应后的物质进行检测,结果如下:在气体中检测到甲烷、氢气.在液体中检测到甲酸(HCOOH).在固体中检测到镍粉.四氧化三铁.请分析以上变化关系和检测结果,回答以下问题.①在以上反应过程中,有一种物质起到了催化作用.你认为,反应中的催化剂很可能是.②在以上变化中,CO2转化成的有机物是、.③在高温条件下,铁粉能够与水蒸气发生反应:3Fe+4H2O Fe3O4+4X,则X的化学式为,该反应的基本反应类型是.④甲酸(HCOOH)俗名蚁酸,它和醋酸具有相似的化学性质,蚁虫叮咬时能在人的皮肤内分泌出蚁酸刺激皮肤产生痛痒,当被蚁虫叮咬时,在叮咬处涂抹下列物质中的(填序号)会减轻痛痒.A.食盐水 B.食醋 C.草木灰水.4. 我国科技部制定发布了《“十二五”国家碳捕集利用与封存科技发展专项规划》,碳捕集、利用与封存(CCUS)技术可实现大规模二氧化碳减排。
中考化学流程图题专题
流程图题主要与高中的知识挂钩,且对于中考而言,算是一种新题型,也是近年中考的一个常考热点,故学生应该认真对待。
解题方法:在做实验流程题的过程中,要通过流程图及题目的信息中得到信息进行解答。
1、(2008年广州中考)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A 晶体,其主要流程如下:
(3)“降温”的目的是析出副产品“A 晶体”,A 的化学式是________________。
(4)“操作I ”中的操作是____________________,若在实验室进行该操作,需要用到的玻璃仪器除烧杯、玻璃棒外,还有______________________________。
(5)“盐水精制I ”是除去盐水中的少量氯化镁,反应的化学方程式是________________。
(6)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是__________________。
2、(2010年广州中考)硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料。
某硫酸钠粗品中含有少量CaCl 2和MgCl 2,实验室进行提纯的流程如下:
回答下列问题:
(1)用NaOH 和Na 2CO 3除杂时,反应的化学方程式分别为
________________________________、__________________________________。
(2)NaOH 和Na 2CO 3如果添加过量了,可加入适量___________溶液除去。
(3)“后续处理”的主要操作是蒸发,为了获得
纯净的硫酸钠,应蒸发至______(填序号)。
A .有大量固体析出时停止加热,过滤弃去剩余的少量溶液 B .快干时停止加热,利用余热蒸干 C .完全蒸干时停止加热 (4)已知硫酸钠的溶解度随温度变化的曲 线如右图所示。
40℃时,100g 蒸馏水 中溶解______g 硫酸钠达到饱和。
将
该饱和溶液升高温度至90℃,观察到 的现象是_____________________。
3(2011年广州中考)氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。
某工厂以石灰石为原料生产二水化钙(2CaCl O H 22 )的流程如下。
原料石灰石中含有杂质主要是3MgCO 、4MgSO 和32O Al 。
(1)石灰石粉溶解时,Al2O3发生反应的化学方程式为______________。
(2)加入BaCl2除去的杂质离子是________________;加入Ca(OH)2除去的杂质离子 是________。
⑶检验“滤液”酸碱性,如果显碱性,还需加入适量的___________________(填化学式)提高产品纯度。
4、(2011年梅州中考)海水中含氯化钠、氯化镁等物质,是一种重要的自然资源。
(1)从海水中获取淡水,常用的方法是 。
(2)通过晾晒海水可得到含有较多杂质的氯化钠晶体。
氯化钠的用途很广,请写出氯化钠的一种用途 。
(3)从海水中提取金属镁的流程如下所示:
在实际生产中,步骤①加入的试剂A 最好选用 (填“NaOH ”或“Ca(OH)2”);步骤②中反应的化学方程式为 。
5、汽车使用是人类进步的标志,但生产汽车的材料、使用的能源等是人们关注并需解决的问题。
(1)制造汽车的材料以钢铁为主,钢是铁和 的合金;写出在高温下一氧化碳与氧化铁反应的化学方程式 。
(2)钢铁的防腐是汽车制造业研究的重要课题之一。
铁生锈的原因是 。
(3)有些汽车新型排气系统中,使用抗腐蚀性能好的钛合金材料。
生产钛(Ti)的部分工艺流程图如下:
回答下列问题:
① 二氧化钛中钛元素的化合价为 价。
② 写出镁与四氯化钛(TiCl 4)发生反应的化学方程式 ;该反应类型属于 。
上述反应需在氩气环境中进行,理由是 。
(4)家用汽车和公交车相比,前者的耗油量大约是后者的1/5左右。
前者和后者在行驶时所排出的污染物的比率大致也是1/5左右。
如果后者载运乘客量平均为50人,前者平均为2人,请对比它们在燃料利用和污染环境方面因素,你的建议是 。
6、分析比较物质在组成、性质等方面的异同,可为物质的分离和鉴别提供依据。
⑴从组成上看,BaCl 2、NaCl 都含有 元素,但BaSO 4不含有;
⑵将BaSO 4、BaCl 2、NaCl 三种固体组成的混合物溶于足量的水后,充分搅拌后过滤,留在滤纸上的固体是 ;
⑶根据BaCl 2溶液和NaCl 溶液中的金属离子不同,可用稀硫酸将NaCl 溶液和BaCl 2溶液鉴别开。
请写出稀硫酸和BaCl 2反应的化学方程式 ;
⑷按如下方案分离BaCl 2和NaCl 的固体混合物时,X溶液中溶质是 。
A .K 2CO 3
B .Na 2CO 3 C. Na 2SO 4
7. 食盐是人们生活中不可缺少的调味剂,随着人们健康意识的提高,市场上出现 了“加碘盐”、“叶绿素锌钠盐”、“低钠盐”等。
某种低钠盐由NaCl 、KCl 、MgSO 4三
种物质组成,用它进行以下实验(假设每步均恰好完全反应)。
(1)写出步骤①的化学方程式:
(2)当x 是AgNO 3时,白色沉淀C 是 ,当x 是NaOH 时,白色沉淀C 是
8. (2011南京市质检,27. 10分)汽车作为一种常见交通工具,已走进千家万户。
请回答下列问题:
(1) 目前汽车使用的燃料是汽油。
将石油加热,利用各成分的沸点不同将它们分离可得
到汽油,该过程属于 变化。
我国已推广使用车用乙醇汽油,它是在汽油中加入适量的乙醇,
作为汽车的燃料。
下列叙述正确的是 。
(填字母)
A .乙醇汽油是一种新型的化合物
B .乙醇可通过粮食发酵的方法制得
C .使用乙醇汽油能减少有害气体的排放
D .乙醇和汽油都是可再生能源
(2)汽车尾气(含有CO 、NO 等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,使CO 和NO 反应,生成两种无毒气体,试写出CO 与NO 反应的化学方程式 。
(3)汽车生产过程中需要各种金属,其中用量最大的是铁和铝。
①工业上炼铁的简要流程如下:
请写出步骤Ⅰ、Ⅱ、Ⅲ的化学反应方式
、 、 。
② 早在西汉时期,我国劳动人民就利用铁与硫酸铜溶液反应制取铜,称为“湿法炼铜”,即反应③,若用该方法制得铜16千克,理论上需要溶质质量分数为10%的硫酸铜溶液多少千克?(写计算过程)。