高中化学镁铝铁知识归纳
- 格式:doc
- 大小:192.00 KB
- 文档页数:6

镁铝铁铜知识点总结高考命题方向1.从钠原子结构特征认识钠的化学性质;Na 2O 和Na 2O 2的对比,Na 2CO 3与NaHCO 3比较;碱金属元素的原子结构及物理性质比较。
2.Mg 、Al 及其化合物性质的试题在高考中不断增多,在离子共存、离子方程式书写及其正误判断、物质鉴别和推断、实验和化学计算不断出现。
3. Al 3+ 、Al(OH)3 、AlO 2-的相互转化及图像分析时,一是要明确反应原理,掌握反应规律;二是要弄清图像中的最高点、最低点、转折点及水平线的意义;三是要将定性分析和定量计算充分结合起来。
4.复习铁及其化合物性质时,要将铁的变价性质、Fe(OH)2的颜色变化、Fe 3+的检验及基本概念、基本理论和其他元素化合物知识结合起来综合分析。
第一部分:铝 一、铝(Al )1、铝的制备(了解:选修2中继续学习)铝土矿(Al 2O 3 、Fe 2O 3等)NaOH溶解:Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O过滤:除杂,得到NaAlO 2提 CO 2酸化:NaAlO 2 + CO 2 + 2H 2O = Al(OH)3↓ + NaHCO 3纯过滤:得到Al(OH)3↓灼烧:2Al(OH)3 ==========Al 2O 3+3H 2O 电解:2Al 2O 3======4Al+3O 2↑2、物理性质:高温通电 冰晶石(过量)3、化学性质: 原子结构:铝原子的最外层只有三个电子,这三个电子很容易失去变成铝离子,因此铝很活泼 (1)与非金属单质(O 2)4Al+3O 2====2Al 2O 3 (现象:产生耀眼的白光,放出大量的热) (2) 铝能与稀盐酸、氢氧化钠溶液反应放出氢气。
2Al+6HCl = 2AlCl 3+3H 2↑2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑(3)常温下,铝在冷的浓硫酸、浓硝酸中钝化 (4)与盐溶液反应2Al+3CuSO 4=3Cu+Al 2(SO 4)3 (5)铝与某些氧化物反应——铝热反应 2Al + Fe 2O 3====2Fe + Al 2O 3 4、用途易加工成各种形状,包装、装饰工艺,铝箔、铝丝、银粉涂料,铝锅、铝壶等,加热器具铝芯电线、电缆 5、铝与人体健康世界卫生组织提出人体每天的摄铝量不应超过每千克体重1毫克,一般情况下,一个人每天摄取的铝量绝不会超过这个量,但是,经常喝铝盐净化过的水,吃含铝盐的食物,如油条、粉丝、凉粉、油饼、易位罐装的软饮料等,或是经常食用铝制炊具炒出的饭莱,都会使人的摄铝量增加,从而影响脑细胞功能,导致记忆力下降,思维能力迟钝。

【一. 教学内容镁、铝、铁及化合物性质二. 重点、难点:1. 常识性介绍过渡元素的概念2. 掌握镁、铝、铁的化学性质3. 理解铁盐和亚铁盐的相互转变4. 了解铁的氧化物和氢氧化物5. 掌握铁离子的检验方法三. 知识分析:1. 镁、铝及化合物(1)Mg、Al在元素周期表中的位置及原子结构特点(3)化学性质比较①与非金属单质反应②与水反应③与酸反应④与碱反应⑤与氧化物反应⑥与盐反应(4)制法——电解法(5)氧化物性质比较(类型、物理性质、化学性质)(6)氢氧化物性质比较(类型、化学性质)(7)盐的性质2. 铁及化合物(1)位于元素周期表第四周期第Ⅷ族(2)原子结构特点:次外层电子未达饱和,不同于主族元素次外层电子数一般为8或18、32,在化学反应中易形成阳离子:具有可变价态。
(3)铁的性质:①物理性质——色、态、熔、沸点及特性②化学性质——与非金属单质的反应与水反应与酸反应 与盐溶液反应 (4)铁的氧化物及性质 (5)铁的氢氧化物及性质(6)铁盐及亚铁盐的性质及鉴别方法【典型例题】[例1] 将5.1g 镁、铝合金投入到500mL 2mol /L 的盐酸中,金属完全溶解,再加入4mol /L 的NaOH 溶液,若要生成的沉淀最多,则应加入的这种NaOH 溶液的体积是( )A. 200mlB. 250mLC. 425mLD. 560mL解析:本题考查学生对镁、铝的化学性质区别的掌握。
Mg 、Al 与盐酸和NaOH 的反应有:↑+=+222H MgCl HCl Mg 、↑+=+233262H AlCl HCl Al 产生的两种盐分别与NaOH 溶液反应:NaCl OH Mg NaOH MgCl 2)(222+↓=+、OH Al NaOH AlCl 3)(333+↓=+NaCl 3或O H NaAlO NaCl NaOH AlCl 223234++=+,若使所得沉淀最多,则所加NaOH 的物质的量应与盐酸的物质的量相等。
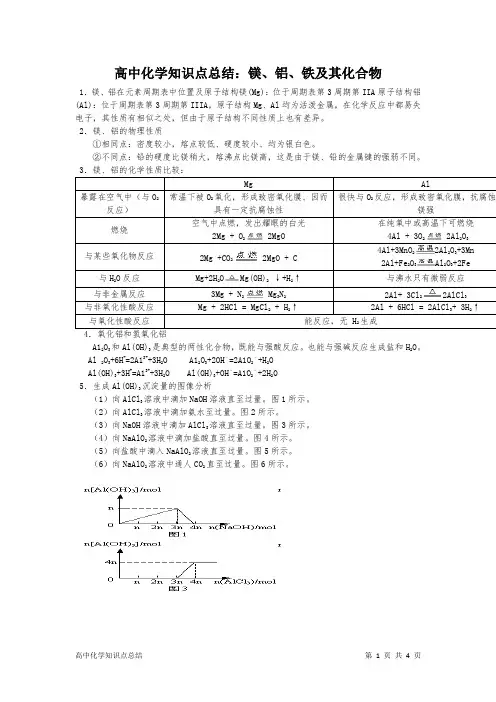
高中化学知识点总结:镁、铝、铁及其化合物1.镁、铝在元素周期表中位置及原子结构镁(Mg):位于周期表第3周期第IIA原子结构铝(Al):位于周期表第3周期第IIIA,原子结构Mg、Al均为活泼金属,在化学反应中都易失电子,其性质有相似之处,但由于原子结构不同性质上也有差异。
2.镁、铝的物理性质①相同点:密度较小,熔点较低、硬度较小、均为银白色。
②不同点:铅的硬度比镁稍大,熔沸点比镁高,这是由于镁、铅的金属键的强弱不同。
3.镁、铝的化学性质比较:2 2MgO 2223Mg(OH)2 Mg22AlCl4.氧化铝和氢氧化铝A12O3和Al(OH)3是典型的两性化合物,既能与强酸反应。
也能与强碱反应生成盐和H2O。
Al 2O3+6H+=2A13++3H2O A12O3+2OH–=2A1O2–+H2OAl(OH)3+3H+=A13++3H2O Al(OH)3+OH–=A1O2–+2H2O5.生成Al(OH)3沉淀量的图像分析(1)向AlCl3溶液中滴加NaOH溶液直至过量。
图1所示。
(2)向AlCl3溶液中滴加氨水至过量。
图2所示。
(3)向NaOH溶液中滴加AlCl3溶液直至过量。
图3所示。
(4)向NaAlO2溶液中滴加盐酸直至过量。
图4所示。
(5)向盐酸中滴入NaAlO2溶液直至过量。
图5所示。
(6)向NaAlO2溶液中通人CO2直至过量。
图6所示。
铁及其化合物(1)铁在周期表中的位置及原子结构铁位于第四周期第Ⅷ族,是过渡金属元素的代表,其原子结构示意图:铁元素是一种变价元素,通常显示+2价、+3价,其化合物及其水溶液往往带有颜色。
(2)铁的性质①与非金属反应2Fe+3Cl2=2FeCl3(棕黄色的烟)3Fe+2O2=Fe3O4Fe+S=FeSFe+I2=FeI2注:铁与弱氧化性物质反应生成低价铁的化合物②与酸反应a.非氧化性酸.Fe+2H+=Fe2++H2↑b.氧化性酸:常温下遇浓H2SO4、浓HNO3会发生钝化,而加热时会剧烈反应。

高一化学镁铝和铁化学方程式知识点总结
1、碳酸氢钙溶液受热分解 Ca(HCO3)2 =CaCO3+CO2+H2o
2、氯化镁和氨水 MgCl2 + 2NH3H2O = Mg(OH)2+2NH4Cl
3、铝和氢氧化钠溶液 2Al+2NaOH+2H2o=2NaAlO2+3H2
4、铝热反应 4Al+3MnO2=3Mn+2Al2O3(高温)
5、氧化铝和盐酸 Al2O3 + 6HCl = 2AlCl3 + 3H2O
6、氧化铝和氢氧化钠溶液 Al2O3 + 2NaOH = 2NaAlO2 + H2O
7、氢氧化铝受热分解 2Al(OH)3=Al2O3+3H2O
8、氢氧化铝和盐酸 Al(OH)3+3HCl=AlCl3+3H2O
9、氢氧化铝和氢氧化钠溶液 Al(OH)3+NaOH=NaAlO2+2H2O
10、三氯化铝和过量氨水
AlCl3+3NH3+3H2O=Al(OH)3+3NH4Cl
11、三氯化铝和过量氢氧化钠
AlCl3+4NaOH=NaAlO2+3NaCl+2H2o
12、铁和水蒸气 3Fe+4H2O=Fe3O4+4H2
13、铁和足量的稀盐酸 Fe + 2HCl = FeCl2 + H2
14、铁和足量的稀硝酸 Fe+4HNO3=Fe(NO3)3+NO+2H2o
15、铁(完全过量)和少量的稀硝酸
3Fe+8HNO3=3Fe(NO3)2+2NO+4H2o
16、氢氧化铁受热分解 2Fe(OH)3=Fe2O3+3H2o
总结:以上就是高一化学镁铝和铁化学方程式知识点总结的全部内容,希望能帮助同学们巩固学过的化学知识,祝愿同
学们都能轻松愉快的学习,取得好成绩!。

高一化学铝和铁知识点大全导言:高一化学是学生接触到化学知识的起点,其中铝和铁是常见的金属元素。
本文将全面介绍高一化学中关于铝和铁的知识点,帮助学生更好地理解这两种金属元素的性质、应用和相关实验。
一、铝的性质与应用1. 物理性质铝是一种银白色的金属,具有良好的延展性和导电性,是轻金属中的一种。
它的密度较低,比铁轻,但比水重。
铝的熔点较低,为660.32°C,烧蚀时持续生成一层阻挡铝青铜的阳极氧化膜。
2. 化学性质铝在空气中能形成一层致密的氧化铝膜,具有优良的耐腐蚀性,能防止进一步的氧化反应。
铝能够与非金属反应生成相应的化合物,如与氯气反应生成氯化铝。
3. 应用领域铝被广泛应用于各个领域,例如航空航天、汽车制造、建筑材料等。
由于其轻便且抗腐蚀性能好,因此可用于飞机、汽车等运输工具的制造。
同时,铝也是建筑材料中的重要组成部分,它的耐候性和可加工性使其成为一种理想的选材。
4. 铝制备方法铝的主要制备方法有电解法和热法两种。
电解法是通过电解氧化铝溶液得到纯铝,而热法则是通过还原铝矾土得到铝。
二、铁的性质与应用1. 物理性质铁是一种常见的金属元素,具有较高的密度和强度。
它有良好的延展性和导电性,易被锻造成各种形状。
2. 化学性质铁容易与氧气发生反应,形成氧化铁。
铁在水蒸气中易受潮并生锈,所以需要采取措施防止铁制品受潮。
此外,铁还可以与非金属元素进行反应,如与硫反应生成硫化铁。
3. 应用领域铁是人类应用最广泛的金属之一,广泛用于建筑、制造业、冶金和汽车等领域。
铁可以制成钢材,用于建筑和桥梁的建设;铸铁则用于制造机械设备和汽车发动机的零部件。
4. 铁的提取方法铁的常见提取方法是高炉法,利用高温将矿石中的铁与石灰石等物质还原得到铁铁液。
另外,还可以使用电解法、氧化还原法等方法提取铁。
三、相关实验化学实验在学习化学过程中起着重要的作用。
在学习铝和铁的化学性质时,以下是一些相关实验可以帮助理解:1. 铝锌电池实验:通过使用铝和锌制作电极,观察电池产生电流的现象。

高一化学钠铁镁铝知识点化学是一门研究物质性质、组成、构造、变化和相互关系的科学。
在高中化学中,钠(Na)、铁(Fe)、镁(Mg)和铝(Al)是常见的金属元素。
下面将分别介绍这四种金属元素的知识点。
一、钠(Na)1. 基本性质钠是一种银白色的金属,在常温下非常活泼。
它的熔点较低,约为98摄氏度,热稳定性较差,容易氧化。
2. 化合物钠与氧、氯等元素形成多种化合物。
其中最常见的是氯化钠(NaCl),即食盐。
钠还与氧形成氧化钠(Na2O)等化合物。
3. 应用钠在工业上广泛应用,主要用于金属制品的冶炼、合成橡胶和塑料的生产等。
二、铁(Fe)1. 基本性质铁是一种常见的金属元素,在自然界中广泛存在。
它具有良好的延展性和导电性,并且能够吸附磁性。
2. 基本结构铁的原子核中含有26个质子和中子,电子排布为2-8-14-2。
3. 氧化反应铁在空气中容易氧化,形成氧化铁。
常见的氧化铁有赤铁矿(Fe2O3)和磁铁矿(Fe3O4)。
4. 应用铁是制造钢铁的主要原料,广泛用于建筑、机械、交通工具等领域。
三、镁(Mg)1. 基本性质镁是一种银白色的金属,比重轻、延展性好、导电性能强,并具有良好的耐腐蚀性。
2. 化合物镁与氧、氯等元素形成多种化合物。
其中最常见的是氧化镁(MgO),常用作建筑材料。
3. 应用镁在工业上广泛应用,如制造航空器、汽车、光学仪器等。
四、铝(Al)1. 基本性质铝是轻质金属,具有良好的延展性、导电性和热传导性,同时还有一定的耐腐蚀性。
2. 氧化反应铝表面易生成一层氧化铝膜,这层膜能够防止铝继续氧化。
3. 应用铝是一种重要的工业原料,广泛用于建筑、包装、交通工具等。
综上所述,钠、铁、镁和铝是高中化学中常见的金属元素。
通过学习它们的基本性质、化合物以及应用,可以更好地理解化学元素的特点和用途。
这些知识点的掌握有助于培养学生的实践能力和科学思维,为日后深入学习化学和工程技术奠定基础。

镁、铝、铜及其化合物 (一)镁与铝化学性质的比较1.与O 2的反应:Mg 、Al 均能与空气中的O 2反应,生成一层坚固而致密的氧化物保护膜.所以,金属镁和铝都有抗腐蚀性能。
它们都可燃烧:2Mg +O 2=====点燃2MgO,4Al +3O 2=====高温2Al 2O 32.与S 、X 2等非金属的反应:Mg +S=====△MgS ,Mg +Cl 2=====点燃MgCl 2 2Al +3S=====△Al 2S 3,2Al +3Cl 2=====点燃2AlCl 3 3.与酸的反应:非氧化性酸:Mg +2H +===Mg 2++H 2↑,2Al +6H +===2Al 3++3H 2↑氧化性酸:镁可溶于氧化性酸;常温下铝在冷的浓HNO 3、浓H 2SO 4中因发生钝化而难溶,但加热时也可溶解。
4.与碱的反应:镁不反应, 2Al +6H 2O +2NaOH===2Na[Al(OH)4]+3H 2↑5.与氧化物的反应:2Mg +CO 2=====点燃2MgO +C(金属镁能在CO 2气体中燃烧),2Al +Fe 2O 3=====高温2Fe +Al 2O 3[铝热反应,铝与比铝不活泼的金属氧化物(如CuO 、MnO 2、Fe 2O 3等)都可以发生铝热反应](二)氧化铝和氢氧化铝1.氧化铝:两性氧化物,既能与酸反应生成铝盐,又能与强碱反应生成四羟基合铝酸盐 :Al 2O 3+6H+===2Al 3++3H 2O , Al 2O 3+2OH -+3H 2O===2[Al(OH)4]-2.氢氧化铝:①既能溶于强酸,又能溶于强碱中:Al(OH)3+3H +===Al 3++3H 2O ,Al(OH)3+OH-===[Al(OH)4]-②受热分解:2Al(OH)3=====△Al 2O 3+3H 2O3.氢氧化铝的制法:可溶性铝盐与氨水反应:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4 或四羟基合铝酸钠 溶液通入CO 2:CO 2过量:[Al(OH)4]-+CO 2===Al(OH)3↓+HCO -3; CO 2少量: 2[Al(OH)4]-+CO 2===2Al(OH)3↓+H 2O +CO 2-3。

专题:元素及其化合物第三讲 镁铝铁1、镁铝及其化合物(1)镁铝单质①O 2、Cl 2、S : 2Mg+O 2点燃2MgO 4Al+3O22Al 2O 3 3Mg+N 2点燃Mg3N 2 Mg+SMgS 2Al+3S Al 2S 3 Mg+Cl 2点燃MgCl 22Al+3Cl 2点燃2AlCl 3②盐酸⎪⎪⎩⎪⎪⎨⎧⎩⎨⎧↑+=+++发生钝化浓铝与冷的浓不产生强氧化性酸非氧化性酸34222,..2:HNO SO H b H a H n M nH M n③氢氧化钠溶液:2Al+2H 2O+2NaOH=2NaAlO 2+3H 2↑④与氧化物的反应:a .H 2OMg+2H 2OMg(OH)2+H 2↑(能使酚酞变红) 2Al+6H 2O沸水2Al(OH)3+3H 2↑b .Fe 3O 4 铝热反应:32y Al (S)+M x O y(S)高温3y Al 2O 3+xM (l) △H <0 说明:①反应条件:M 为Fe 、V 、Cr 、Mn 等活泼性比Al 弱的金属(FeO 、Fe 2O 3、Fe 3O 4、MnO 2、CrO 3、V 2O 5、WO 3)。
反应中Al 从氧化物中夺取氧, 表现出很强的还原性。
(MgO 不可以)②实验操作③反应放出大量的热(2)氯化镁(MgCl 2)①物理性质:易溶于水、味苦、易潮解②用途:是制取镁的重要原料(3)氧化铝(Al 2O 3)①物理性质:白色、熔点高、难溶于水的固体②化学性质:两性氧化物盐酸氢氧化钠从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取Al的两种工艺流程如下:(4)氢氧化铝[Al(OH)3]①氢氧化铝的两性:稀硫酸Al(OH)3+3H+=Al3++3H2O氢氧化钠溶液Al(OH)3+OH-=AlO2-+2H2O②氢氧化铝的生成:a.铝盐与碱反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+b.偏铝酸盐与酸反应:当CO2不足或适量时:CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-;当CO2过量时:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-。

高二化学第二册第四章镁和铝知识点
1.镁知识点
(1)物理性质:镁,化学符号Mg,相对原子质量为24,银白色金属;熔点
648.8deg;C,沸点1107deg;C,密度1.74克/厘米
sup3;.
(2)化学性质:能与卤族元素反应,例
如:Mg+Cl2---(点燃)MgCl2
能与氧气反应:Mg+O2MgO
能与稀酸反映:H2SO4+Mg==MgSO4+H2(气体)
能与沸水反映:Mg+2H2O==Mg(OH)2+H2(气体)
注:镁位于第三周期第二主族,所以你可以找和他相邻的元素,他们的结构性质都相似
2生物方面:是生物生活的必须元素,不能缺.在植物体内,以离子态存在.新叶含的镁比老叶多.
2.铝的知识点
Al(OH)3是一种两性氢氧化物,三元弱碱.也可以看作是HAlO2+H2O,这样,它也可以看成是一元弱酸.
Al(OH)3只能和强酸强碱反应,与弱酸弱碱(如
CO2+H20,NH3.H2O)都不反应
关于Al+ 和AlO-的问题也比较简单,把Al(OH)3看成是对应的酸碱就行了
第四章镁和铝知识点的全部内容就是这些,更多精彩内容请持续关注。

高考命题方向1.从钠原子结构特征认识钠的化学性质;2Na O 和22Na O 的对比,23Na CO 与3NaHCO 比较;碱金属元素的原子结构及物理性质比较。
2.Mg 、Al 及其化合物性质的试题在高考中不断增多,在离子共存、离子方程式书写及其正误判断、物质鉴别和推断、实验和化学计算不断出现。
3. Al 3+、Al(OH)3 、AlO 2-的相互转化及图像分析时,一是要明确反应原理,掌握反应规律;二是要弄清图像中的最高点、最低点、转折点及水平线的意义;三是要将定性分析和定量计算充分结合起来。
4.复习铁及其化合物性质时,要将铁的变价性质、Fe(OH)2的颜色变化、Fe 3+的检验及基本概念、基本理论和其他元素化合物知识结合起来综合分析。
知识点1: 钠、镁 1、物理性质钠:钠是银白色金属,密度小(0.97g/cm 3), 镁:镁是银白色金属,质较软,密度1.74g/cm 3, 熔点低(97℃),硬度小,质软,可用刀切 是轻金属,硬度小。
割。
钠通常保存在煤油中。
是电和热的良导体。
2、原子结构钠 镁 3、化学性质(1)与非金属单质(氧气、氯气、硫、氮气)常温:4Na + O 2 == 2Na 2O, 2Mg + O 2 == 2MgO 加热:2Na + O 2 △Na 2O 2; Mg + Cl 2点燃MgCl 2 2Na + Cl 2 △2NaCl; 2Mg+CO 2点燃2MgO+C 2Na + S △Na 2S 3Mg + N 2点燃Mg 3N 2(2)与水的反应2Na + 2H 2O == 2NaOH + H 2↑ Mg + 2H 2O(沸水)== Mg(OH)2 + H 2 ↑ 现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后 消失,在反应后的溶液中滴加酚 酞,溶液变红。
(浮、熔、游、响、红)结论:从反应条件的难易判断出 金属性/还原性:Na>Mg (3)与酸反应2Na + 2HCl == 2NaCl + H 2↑ Mg + 2HCl == MgCl 2 + H 2↑Na 放入稀盐酸中,是先与酸反应,酸不足 与非强氧化性酸反应:是酸中的H +与Mg 反应, 再与水反应。

高一化学必修二铝铁知识点一、铝的性质及应用铝是一种轻质、耐腐蚀的金属,具有良好的导电和导热性能。
它在许多领域都有广泛的应用,如航空航天、建筑材料、电力传输等。
铝的抗腐蚀性使其成为一种理想的包装材料,如铝箔用于食品包装。
此外,铝还经常用于制造汽车零部件、家居用品等。
二、铁的性质及应用铁是一种常见的金属元素,具有良好的导电性能和磁性。
它的应用非常广泛。
铁是制造钢铁的主要原料,钢铁是许多工业领域的基础材料。
此外,铁还广泛应用于建筑、制造机械和电子设备等领域。
三、铝铁合金铝和铁分别作为纯金属具有一定的性质,但它们合成的合金则具有更多的优点。
铝铁合金通常是通过电解法或混合熔炼法制备的。
铝铁合金具有较高的强度、硬度和耐腐蚀性,常被用于制造飞机、火车和汽车零部件等。
四、铝铁合金的应用1. 航空航天领域:铝铁合金在航空航天领域有着重要的应用,如制造飞机的结构件、发动机零部件等。
铝铁合金具有轻质、高强度等特点,可以减轻飞机自身的重量,提高飞行的效率和燃油利用率。
2. 电力传输领域:铝铁合金常用于高压电力导线的制造,它具有较高的导电性能和耐腐蚀性,可以减少能量的损耗,提高电力传输的效率。
3. 汽车工业:铝铁合金在汽车工业中应用广泛,如制造汽车车身和发动机零部件等。
铝铁合金的轻质特性可以降低汽车的整体重量,提高燃油效率和行驶性能。
4. 建筑行业:铝铁合金常用于制造门窗、幕墙和建筑结构等。
铝铁合金具有耐腐蚀、耐候性好等特点,可以增加建筑物的造型和美观度,同时提高建筑物的稳定性和耐久性。
综上所述,铝和铁是常见的金属元素,在各自的行业中有着重要的应用。
而铝铁合金则将两者的优点融合在一起,具有更广阔的应用领域。
铝铁合金在航空航天、电力传输、汽车工业和建筑行业等方面发挥着重要的作用,为社会进步和经济发展做出了重要贡献。
“镁、铝及其化合物”知识点总结一、Mg、Al的化学性质(一)与非金属反应1.与O2反应。
常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2.与卤素单质、硫等反应。
【特别提醒】(1)镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:(2)燃烧时都放出大量的热,发出耀眼的白光。
利用镁的这种性质来制造照明弹。
(3)集气瓶底部都要放一些细纱,以防集气瓶炸裂。
(二)与H2O反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气(三)与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓 H2SO4,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
(四)与某些氧化物反应1.镁与二氧化碳反应:[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe2O32Fe+ Al2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:(1)铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、Mn O2等。
(2)铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
(3)要使用没有氧化的铝粉,氧化铁粉末要烘干。
(4)KClO3作为引燃剂,也可以用Na2O2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
(五)与碱反应镁不与碱反应,铝与碱液反应:二、氢氧化铝(一)物理性质:A l(O H)3是几乎不溶于水的白色胶状固体,具有吸附性。
(二)化学性质1.与酸反应:Al(OH)3 +3HCl=AlCl3+3H2O离子反应方程式:Al(OH)3+3H+=Al3++3H2O2.与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O离子反应方程式:Al(OH)3+OH =NaAlO2+2H2O3.Al(OH)3的制取(1)铝盐与碱反应:实验室制取氢氧化铝时采用过量的氨水,而不用强碱与可溶性铝盐溶液反应是因为氢氧化铝是两性氢氧化物,能溶于强碱溶液,不溶于弱碱溶液。
高中化学镁铝铁知识归纳一、镁1. 镁的性质镁是一种质轻、柔软、有光泽的银白色金属,在空气中易氧化。
它容易发生燃烧反应,在氧气中燃烧时会放出很强的光和热。
镁可以和非金属反应,与卤素的反应尤其强烈。
2. 镁的用途•镁可以用于制造航天器、战斗机和轻量化汽车等重要的航空航天和交通工具。
•镁还可以用于制造人造合成纤维、防火材料和荧光粉等化工产品。
3. 镁的化合物及其性质•氧化镁(MgO):一种高熔点的白色固体,可用作耐高温材料。
•氯化镁(MgCl2):一种常见的镁化合物,可用作工业上重要的金属提取剂和干燥剂。
•硫酸镁(MgSO4):可用于制备镁盐和肥料。
•碳酸镁(MgCO3):常见的挥发性碱式镁盐,有一定的生物作用。
二、铝1. 铝的性质铝是一种具有良好的延展性、可塑性和耐腐蚀性的轻质金属。
它在空气中易生成一层氧化铝膜,能有效地保护其表面不受氧化破坏。
2. 铝的用途•铝可以用于制造轻型汽车、航空器和建筑结构材料等。
•铝还可以用于制造食品包装和家电等日用品。
3. 铝的化合物及其性质•氧化铝(Al2O3):一种无机化合物,可用于制备工业上重要的铝盐、金属铝和陶瓷等。
•氯化铝(AlCl3):一种常见的铝化合物,可用作工业上重要的催化剂和中间体。
•硫酸铝(Al2(SO4)3):可用于制备铝盐和纸张脱酸剂等。
三、铁1. 铁的性质铁是一种重要的金属元素,具有良好的导电性、延展性和磁性。
铁在空气中易氧化,形成氧化铁层,保护铁不受氧气的破坏。
2. 铁的用途•铁可以用于制造建筑结构、船舶、火车和汽车等重要的交通工具。
•铁还可以用于制造钢铁、炉具和钉子等日用品。
3. 铁的化合物及其性质•氧化铁(Fe2O3):一种常见的铁氧化物,可用作制备铁盐和陶瓷等。
•氯化铁(FeCl3):可用作催化剂、氧化剂和沥青加氢剂等。
•硫酸亚铁(FeSO4):可用作食品和饲料的补铁剂、铁盐的原料、药物等。
四、•镁、铝和铁都是非常重要的金属元素,它们在工业、交通和日常生活中都有很广泛的应用。
高中化学镁铝铁知识归纳【知识网络】一、镁及其化合物相关化学方程式2Mg+O2=2MgO3Mg+N2 Mg3N2Mg+Cl2 MgCl2Mg+2H+=Mg2++H2↑Mg+2H2O Mg(OH)2+H2↑2Mg+CO2 2MgO+CMgO+H2O=Mg(OH)2MgO+2HCl=MgCl2+H2OMgCl2(熔融) Mg+Cl2↑Mg2++CO32-=MgCO3↓MgCO3+2H+=Mg2++CO2↑+H2O MgCO3+CO2+H2O=Mg(HCO3)2 MgCO3+H2O Mg(OH)2+CO2↑Mg(OH)2+2H+=Mg2++H2OMg(OH)2 MgO+H2OMg3N2+6H2O=3Mg(OH)2↓+2NH3↑二、铝及其化合物相关化学方程式4Al+3O2=2Al2O33S+2Al Al2S32Al+3Cl2 2AlCl32Al+6HCl=2AlCl3+3H2↑2Al+6H2O 2Al(OH)3+3H2↑2Al+Fe2O3 Al2O3+2Fe2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al2O3+6HCl=2AlCl3+3H2OAl2O3+2NaOH=2NaAlO2+2H2O2Al2O3(熔融) 4Al+3O2↑Al3++3H2O=Al(OH)3+3H+Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al3++3OH-=Al(OH)3↓Al3++4OH-=AlO2-+2H2OAl2S3+6H2O=2Al(OH)3↓+3H2S↑Al(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=AlO2-+2H2OAlO2-+CO2+2H2O=Al(OH)3↓+HCO3-AlO2-+H++H2O=Al(OH)3↓AlO2-+4H+=Al3++2H2O3AlO2-+Al3++6H2O=4Al(OH)3↓三、铁及其化合物相关化学方程式3Fe+2O2(纯) Fe3O4Fe+S FeS2Fe+3Cl2 2FeCl3Fe+2H+=Fe2++H2↑3Fe+4H2O Fe3O4+4H2↑Fe+Cu2+=Cu+Fe2+FeO+2HCl=FeCl2+H2OFe(OH)2+2HCl=FeCl2+2H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2FeCl2+Cl2=2FeCl3FeS+2H+=Fe2++H2S↑2Fe3++Fe=3Fe2+4FeS2+11O2 2Fe2O3+8SO2Fe2O3+6H+=2Fe3++3H2OFe2O3+3CO 2Fe+3CO2Fe3++3H2O Fe(OH)3+3H+Fe3++SCN-=Fe(SCN)2+Fe(OH)3+3H+=Fe3++3H2O2Fe(OH)3 Fe2O3+3H2O【各部分知识回顾】一、镁1.原子结构示意图:2.单质(1)在周期表中位置:第三周期ⅡA族(碱土金属)(2)物理性质:银白色,质软,轻金属,硬度较小,熔沸点较低。
高中化学镁铝铁知识归纳
【知识网络】一、镁及其化合物
相关化学方程式2Mg+O2=2MgO
3Mg+N2Mg3N2Mg+Cl2MgCl2Mg+2H+=Mg2++H2↑Mg+2H2O Mg(OH)2+H2↑2Mg+CO22MgO+C
MgO+H2O=Mg(OH)2MgO+2HCl=MgCl2+H2O
MgCl2(熔融) Mg+Cl2↑Mg2++CO32-=MgCO3↓MgCO3+2H+=Mg2++CO2↑+H2O MgCO3+CO2+H2O=Mg(HCO3)2MgCO3+H2O Mg(OH)2+CO2↑Mg(OH)2+2H+=Mg2++H2O
Mg(OH)2MgO+H2O
Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑二、铝及其化合物
相关化学方程式4Al+3O2=2Al2O33S+2Al Al2S32Al+3Cl22AlCl32Al+6HCl=
2AlCl3+3H2↑2Al+6H2O 2Al(OH)3+3H2↑2Al+Fe2O3Al2O3+2Fe
2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+2H2O
2Al2O3(熔融) 4Al+3O2↑Al3++3H2O=Al(OH)3+3H+Al3++3NH3·H2O=Al(OH)3↓
+3NH4+Al3++3OH-=Al(OH)3↓Al3++4OH-=AlO2-+2H2O
Al2S3+6H2O=2Al(OH)3↓+3H2S↑Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=AlO2-+2H2O
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-AlO2-+H++H2O=Al(OH)3↓AlO2-+4H+=Al3++2H2O
3AlO2-+Al3++6H2O=4Al(OH)3↓三、铁及其化合物
相关化学方程式3Fe+2O2(纯) Fe3O4Fe+S FeS
2Fe+3Cl22FeCl3Fe+2H+=Fe2++H2↑3Fe+4H2O Fe3O4+4H2↑Fe+Cu2+=Cu+Fe2+FeO+2HCl =FeCl2+H2O
Fe(OH)2+2HCl=FeCl2+2H2O
4Fe(OH)2+O2+2H2O=4Fe(OH)32FeCl2+Cl2=2FeCl3FeS+2H+=Fe2++H2S↑2Fe3++Fe=
3Fe2+4FeS2+11O22Fe2O3+8SO2Fe2O3+6H+=2Fe3++3H2O
Fe2O3+3CO 2Fe+3CO2Fe3++3H2O Fe(OH)3+3H+Fe3++SCN-=Fe(SCN)2+Fe(OH)3+3H+=
Fe3++3H2O
2Fe(OH)3Fe2O3+3H2O
【各部分知识回顾】一、镁1.原子结构示意图:
2.单质(1)在周期表中位置:第三周期ⅡA族(碱土金属)(2)物理性质:银白色,质软,轻金属,硬度较小,熔沸点较低。
(3)化学性质①与非金属反应
(发出耀眼白光),常温形成致密氧化膜②
与非金属氧化物反应③与非氧化学性质酸反应
④与氧化学性质酸(如硝酸、浓硫酸)反应,不放出H2⑤与水反应
(能使酚酞变红)⑥与盐溶液反应,能置换出后面的金属(4)冶炼:(5)用途:制轻合金、飞机、汽车部件、烟火、照明弹等。
3.化合物(1)MgO①物理性质:白色粉末,密
度小,熔点高,硬度大,难溶于水。
②化学性质:碱性氧化物,
(缓慢)③制法:MgCO3MgO+CO2↑④用途:耐火材料(2)Mg(OH)2:
难溶性中强碱:(3)MgCl2:无色、味苦、易溶、易潮解的白色晶体,具有可溶性盐的通性。
(4)KCl·MgCl2·6H2O(光卤石):从中可提取MgCl2·6H2O
二、铝1.原子结构示意图:
2.在周期表中位置:第三周期ⅢA族3.单质(1)物理性质:银白色,质软,轻金属。
(2)化学性质①与金属反应常温下被O2氧化,形成致密氧化膜,在O2中或高温下点燃生成Al2O3 4Al+3O22Al2O3与Cl2、S等非金属反应 2Al+3Cl22AlCl3 2Al+3S Al2S3②与Fe3O4、WO3、MnO2等金属氧化物发生铝热反应8Al+3Fe3O44Al2O3+9Fe
③与非氧化性酸发生置换反应2Al+6H+=2Al3++3H2↑注:常温下在浓硫酸、浓硝酸中
钝化。
④与沸水发生置换反应2Al+6H2O 2Al(OH)3+3H2↑⑤与强碱液液反应:
⑥与盐溶液反应,置换后面的金属(3)冶炼:
(熔融电解)(4)用途:制轻合金、飞机、汽车、轮船部件,导线,炊具、还原剂,铝热剂。
4.化合物(1)Al2O3①物理性质:白色难溶固体,熔点高,硬度大。
②化学性质:两性氧化物Al2O3+6H+=2Al3++3H2O
Al2O3+2OH-=2AlO2-+H2O
③制法:④用途:制铝、耐火材料。
刚玉可做仪器、手表轴承、磨料等。
(2)Al(OH)3:两性氢氧化物,不溶于水的白色胶状物Al(OH)3+3H+=Al3++3H2O
Al(OH)3+OH-=AlO2-+2H2O
(3)AlCl3:具有可溶性盐的通性,能水解而呈酸性,只存在于酸性溶液中。
(4)NaAlO2:易水解而显碱性,只存在于强碱性溶液中AlO2-+ H++ H2O=Al(OH)3↓(5)KAl(SO4)2·12H2O (明矾):属复盐,易水解生成胶状Al(OH)3,可做净水剂。
三、铁1.原子结构示意图:
能失去最外层2个电子及第三层1个电子2.在周期表中位置:第四周期第Ⅷ族,属过渡元素3.存在①游离态:少量存在于陨石中。
②化合态:赤铁矿、磁铁矿、褐铁矿、黄铁矿、菱铁矿。
4.单质(1)物理性质:银白色,ρ=7.86g·cm-3,熔点1535℃;纯铁抗蚀能力较强,能被磁铁吸引和磁化。
(2)化学性质:典型金属,有金属通性。
①与非金属反应与O2:常温干燥空气中不易与O2反应,但在潮湿空气中易形成原电池等形式被腐蚀;
铁粉能在纯氧中燃烧:与卤素:
I2+Fe FeI2与硫:②与酸反应非氧化学性质酸:
与浓硝酸、浓硫酸:常温下钝化,加热时反应③与盐:
④与水:↑
(3)冶炼:5.化合物(1)氧化物:FeO、Fe2O3、Fe3O4(2)
氢氧化物:Fe(OH)2、Fe(OH)3(3)盐:①亚铁盐:FeSO4·7H2O(绿矾)②铁盐:FeCl3、Fe2(SO4)3③络盐:[Fe(SCN)n]3-n(n=1~6)
四、合金(1)概念:由两种或两种以上的金属(或金属跟非金属)熔合而成的具有金属特性的物质。
(2)特点:合金性质不是各成分金属性质的总和;硬度一般比各成分金属大;多数合金的熔点一般比各成分金属低;化学性质与成分金属不同。
(3)常见合金:镁铝合金、硬铝、合金钢、锰钢、黄铜、青铜、钛合金……。