高中化学知识点总结:镁、铝、铁及其化合物
- 格式:doc
- 大小:68.13 KB
- 文档页数:4
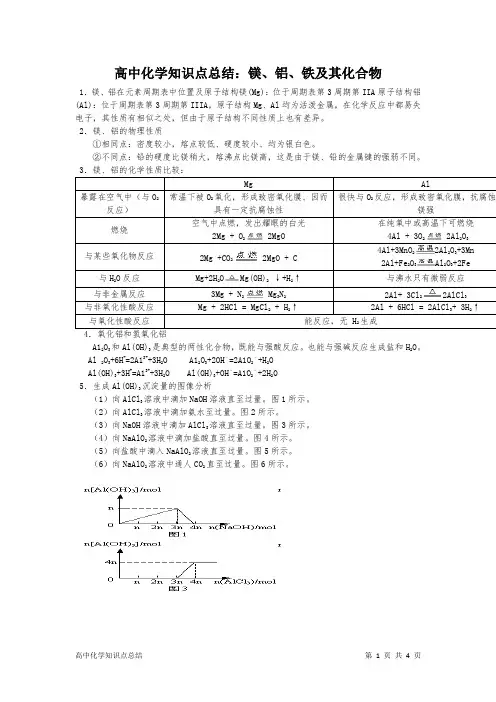
高中化学知识点总结:镁、铝、铁及其化合物1.镁、铝在元素周期表中位置及原子结构镁(Mg):位于周期表第3周期第IIA原子结构铝(Al):位于周期表第3周期第IIIA,原子结构Mg、Al均为活泼金属,在化学反应中都易失电子,其性质有相似之处,但由于原子结构不同性质上也有差异。
2.镁、铝的物理性质①相同点:密度较小,熔点较低、硬度较小、均为银白色。
②不同点:铅的硬度比镁稍大,熔沸点比镁高,这是由于镁、铅的金属键的强弱不同。
3.镁、铝的化学性质比较:2 2MgO 2223Mg(OH)2 Mg22AlCl4.氧化铝和氢氧化铝A12O3和Al(OH)3是典型的两性化合物,既能与强酸反应。
也能与强碱反应生成盐和H2O。
Al 2O3+6H+=2A13++3H2O A12O3+2OH–=2A1O2–+H2OAl(OH)3+3H+=A13++3H2O Al(OH)3+OH–=A1O2–+2H2O5.生成Al(OH)3沉淀量的图像分析(1)向AlCl3溶液中滴加NaOH溶液直至过量。
图1所示。
(2)向AlCl3溶液中滴加氨水至过量。
图2所示。
(3)向NaOH溶液中滴加AlCl3溶液直至过量。
图3所示。
(4)向NaAlO2溶液中滴加盐酸直至过量。
图4所示。
(5)向盐酸中滴入NaAlO2溶液直至过量。
图5所示。
(6)向NaAlO2溶液中通人CO2直至过量。
图6所示。
铁及其化合物(1)铁在周期表中的位置及原子结构铁位于第四周期第Ⅷ族,是过渡金属元素的代表,其原子结构示意图:铁元素是一种变价元素,通常显示+2价、+3价,其化合物及其水溶液往往带有颜色。
(2)铁的性质①与非金属反应2Fe+3Cl2=2FeCl3(棕黄色的烟)3Fe+2O2=Fe3O4Fe+S=FeSFe+I2=FeI2注:铁与弱氧化性物质反应生成低价铁的化合物②与酸反应a.非氧化性酸.Fe+2H+=Fe2++H2↑b.氧化性酸:常温下遇浓H2SO4、浓HNO3会发生钝化,而加热时会剧烈反应。

高一化学镁铝和铁化学方程式知识点总结
1、碳酸氢钙溶液受热分解 Ca(HCO3)2 =CaCO3+CO2+H2o
2、氯化镁和氨水 MgCl2 + 2NH3H2O = Mg(OH)2+2NH4Cl
3、铝和氢氧化钠溶液 2Al+2NaOH+2H2o=2NaAlO2+3H2
4、铝热反应 4Al+3MnO2=3Mn+2Al2O3(高温)
5、氧化铝和盐酸 Al2O3 + 6HCl = 2AlCl3 + 3H2O
6、氧化铝和氢氧化钠溶液 Al2O3 + 2NaOH = 2NaAlO2 + H2O
7、氢氧化铝受热分解 2Al(OH)3=Al2O3+3H2O
8、氢氧化铝和盐酸 Al(OH)3+3HCl=AlCl3+3H2O
9、氢氧化铝和氢氧化钠溶液 Al(OH)3+NaOH=NaAlO2+2H2O
10、三氯化铝和过量氨水
AlCl3+3NH3+3H2O=Al(OH)3+3NH4Cl
11、三氯化铝和过量氢氧化钠
AlCl3+4NaOH=NaAlO2+3NaCl+2H2o
12、铁和水蒸气 3Fe+4H2O=Fe3O4+4H2
13、铁和足量的稀盐酸 Fe + 2HCl = FeCl2 + H2
14、铁和足量的稀硝酸 Fe+4HNO3=Fe(NO3)3+NO+2H2o
15、铁(完全过量)和少量的稀硝酸
3Fe+8HNO3=3Fe(NO3)2+2NO+4H2o
16、氢氧化铁受热分解 2Fe(OH)3=Fe2O3+3H2o
总结:以上就是高一化学镁铝和铁化学方程式知识点总结的全部内容,希望能帮助同学们巩固学过的化学知识,祝愿同
学们都能轻松愉快的学习,取得好成绩!。

镁和铝其化合物性质知识点归纳一 Mg 的化学性质1.与非金属反应(1)与O 2反应。
常温下与空气中的O 2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2Mg+O 22MgO 。
4Al+ 3O 22Al 2O 3(2)与卤素单质、硫等反应。
Mg+ Cl 2MgCl 2 2Al+ 3Cl 22AlCl 32Al+ 3S Al 2S 3 (用于工业制备) Mg+ S MgS ③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。
2.与H 2O 反应 Mg 、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气 Mg+2H 2O Mg(OH)2+H 2↑ 2A1+6H 2O 2A1(OH)3+3H 2↑3.与酸反应置换出H 2Mg 、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H 2,其中铝在冷浓 H 2SO 4,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
4.与某些氧化物反应(1)镁与二氧化碳反应:2Mg+CO 22MgO+C[特别提醒]:“CO 2不能助燃”的说法是不全面的,CO 2对绝大多数可燃物是良好的灭火剂,而对K 、Ca 、Na 、Mg 等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe 2O 3 2Fe+ Al 2O 3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V 、Cr 、等。
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe 2O 3 、FeO 、Fe 3O 4、Cr 2O 3、V 2O 5、MnO 2等。
②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
③要使用没有氧化的铝粉,氧化铁粉末要烘干。
④KClO 3作为引燃剂,也可以用Na 2O 2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
5.与碱反应镁不与碱反应,铝与碱液反应:2Al+2NaOH+6H 2O 2NaAlO 2+4H 2O+3H 2↑1.镁的知识主线上图的1~13中的 有关化学方程式如下:二、铝的结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA 族镁原子核外有三个电子,在化学反应中,容易失去最外层的三个电子,显+3价。

元素化合物(五) 镁、铝、铁及化合物性质一. 本周教学内容元素化合物(五)镁、铝、铁及化合物性质二. 知识重点1. 镁、铝及化合物(1)Mg、Al在元素周期表中的位置及原子结构特点(2(3①与非金属单质反应②与水反应③与酸反应④与碱反应⑤与氧化物反应⑥与盐反应(4)制法——电解法(5)氧化物性质比较(类型、物理性质、化学性质)(6)氢氧化物性质比较(类型、化学性质)(7)盐的性质2. 铁及化合物(1)位于元素周期表第四周期第Ⅷ族(2)原子结构特点:次外层电子未达饱和,不同于主族元素次外层电子数一般为8或18、32,在化学反应中易形成阳离子:具有可变价态。
(3)铁的性质:①物理性质——色、态、熔、沸点及特性②化学性质——与非金属单质的反应与水反应与酸反应与盐溶液反应(4)铁的氧化物及性质(5)铁的氢氧化物及性质(6)铁盐及亚铁盐的性质及鉴别方法【典型例题】[例1] 将5.1g 镁、铝合金投入到500mL 2mol /L 的盐酸中,金属完全溶解,再加入4mol /L 的NaOH 溶液,若要生成的沉淀最多,则应加入的这种NaOH 溶液的体积是( )A. 200mlB. 250mLC. 425mLD. 560mL解析:本题考查学生对镁、铝的化学性质区别的掌握。
Mg 、Al 与盐酸和NaOH 的反应有:↑+=+222H MgCl HCl Mg 、↑+=+233262H AlCl HCl Al 产生的两种盐分别与NaOH 溶液反应:NaCl OH Mg NaOH MgCl 2)(222+↓=+、OH Al NaOH AlCl 3)(333+↓=+ NaCl OH Al 3)(3+↓或O H NaAlO NaCl NaOH AlCl 223234++=+,若使所得沉淀最多,则所加NaOH 的物质的量应与盐酸的物质的量相等。
即)()(NaOH V NaOH c ⋅)()(盐酸盐酸V c ⋅mol L L mol 15.0/2=⨯=则mL L Lmol molNaOH V ag 25025.041][1)(⇒=⋅=- 答案:B[例2] 下面是AlCl 3溶液与NaOH 溶液反应的三组数据及产生沉淀的质量:① 当AlCl 3溶液为440mL 、NaOH 溶液为120mL 时,产生沉淀15.6g ② 当AlCl 3溶液为120mL 、NaOH 溶液为440mL 时,产生沉淀15.6g ③ 当AlCl 3溶液为120mL 、NaOH 溶液为400mL 时,产生沉淀31.2g 求:二溶液的物质的量浓度分别为多少mol/L ?解析:由①、②、③可知:①是NaOH 溶液不足;而②是NaOH 溶液过量;由①可知L mol L mol g g NaOH c /512.013786.15)(1=⨯⨯⋅=-由②~③可知:mL NaOH V 40)(=∆,g g g m 6.152.316.15)(-==∆沉淀 由①~②可知:mL NaOH V 320)(=∆,根据图象可知:产生3)(OH Al 沉淀为:L mol L molg OH Al m /532.04178])([13⨯⨯⨯⋅=-g 2.31=共产生沉淀:g g g 8.462.316.15=+ 则L mol Lmol g gAlCl c /512.0788.46)(13=⨯⋅=- 答案:L mol NaOH c /5)(= L mol AlCl c /5)(3=[例3] 把含有Fe 2O 3的铁片投入到足量的稀H 2SO 4中,直到铁片全部溶解。
在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有自我抗腐蚀能力铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等易错点:(1)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
(2)铝不但能与酸(H +)反应,还能够与碱溶液反应,表现为特殊性。
2Al +2OH -+2H 2O===2AlO -2+3H 2↑。
其反应机理应为:铝先与强碱溶液中的水反应生成H 2和Al(OH)3,然后Al(OH)3再与NaOH 反应生成H 2O 和NaAlO 2,反应中铝作还原剂,水作氧化剂,NaOH 无电子得失。
(3)铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序其后的金属氧化物反应。
铝不能与MgO 反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
(4)Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
同时镁与氮气反应生成Mg 3N 2。
二、铝的重要化合物1.氧化铝(1)物理性质 色态: ;硬度: ;熔点: 。
(2)化学性质①属于两性氧化物,写出有关反应的离子方程式:,②电解 化学方程式为 2Al 2O 3(熔融)=====电解4Al +3O 2↑。
(3)用途熔点很高,是一种较好的耐火材料,天然产刚玉的成分是Al 2O 3,还可制作各种宝石。
2.氢氧化铝 (1)物理性质Al(OH)3是一种难溶于水的白色胶状物质,具有较强的吸附能力。
(2)化学性质 ①两性Al(OH)3的电离方程式为Al(OH)3既能溶于强酸又能溶于强碱,且都生成盐和水。
与强酸反应: , 与强碱溶液反应: 。
②不稳定性Al(OH)3受热分解: 。
(3)制备①向铝盐中加入氨水,离子方程式为 。
②NaAlO 2溶液中通入足量CO 2,离子方程式为 。
③NaAlO 2溶液与AlCl 3溶液混合:离子方程式为 。

高一化学钠铁镁铝知识点化学是一门研究物质性质、组成、构造、变化和相互关系的科学。
在高中化学中,钠(Na)、铁(Fe)、镁(Mg)和铝(Al)是常见的金属元素。
下面将分别介绍这四种金属元素的知识点。
一、钠(Na)1. 基本性质钠是一种银白色的金属,在常温下非常活泼。
它的熔点较低,约为98摄氏度,热稳定性较差,容易氧化。
2. 化合物钠与氧、氯等元素形成多种化合物。
其中最常见的是氯化钠(NaCl),即食盐。
钠还与氧形成氧化钠(Na2O)等化合物。
3. 应用钠在工业上广泛应用,主要用于金属制品的冶炼、合成橡胶和塑料的生产等。
二、铁(Fe)1. 基本性质铁是一种常见的金属元素,在自然界中广泛存在。
它具有良好的延展性和导电性,并且能够吸附磁性。
2. 基本结构铁的原子核中含有26个质子和中子,电子排布为2-8-14-2。
3. 氧化反应铁在空气中容易氧化,形成氧化铁。
常见的氧化铁有赤铁矿(Fe2O3)和磁铁矿(Fe3O4)。
4. 应用铁是制造钢铁的主要原料,广泛用于建筑、机械、交通工具等领域。
三、镁(Mg)1. 基本性质镁是一种银白色的金属,比重轻、延展性好、导电性能强,并具有良好的耐腐蚀性。
2. 化合物镁与氧、氯等元素形成多种化合物。
其中最常见的是氧化镁(MgO),常用作建筑材料。
3. 应用镁在工业上广泛应用,如制造航空器、汽车、光学仪器等。
四、铝(Al)1. 基本性质铝是轻质金属,具有良好的延展性、导电性和热传导性,同时还有一定的耐腐蚀性。
2. 氧化反应铝表面易生成一层氧化铝膜,这层膜能够防止铝继续氧化。
3. 应用铝是一种重要的工业原料,广泛用于建筑、包装、交通工具等。
综上所述,钠、铁、镁和铝是高中化学中常见的金属元素。
通过学习它们的基本性质、化合物以及应用,可以更好地理解化学元素的特点和用途。
这些知识点的掌握有助于培养学生的实践能力和科学思维,为日后深入学习化学和工程技术奠定基础。

镁、铝、铜及其化合物 (一)镁与铝化学性质的比较1.与O 2的反应:Mg 、Al 均能与空气中的O 2反应,生成一层坚固而致密的氧化物保护膜.所以,金属镁和铝都有抗腐蚀性能。
它们都可燃烧:2Mg +O 2=====点燃2MgO,4Al +3O 2=====高温2Al 2O 32.与S 、X 2等非金属的反应:Mg +S=====△MgS ,Mg +Cl 2=====点燃MgCl 2 2Al +3S=====△Al 2S 3,2Al +3Cl 2=====点燃2AlCl 3 3.与酸的反应:非氧化性酸:Mg +2H +===Mg 2++H 2↑,2Al +6H +===2Al 3++3H 2↑氧化性酸:镁可溶于氧化性酸;常温下铝在冷的浓HNO 3、浓H 2SO 4中因发生钝化而难溶,但加热时也可溶解。
4.与碱的反应:镁不反应, 2Al +6H 2O +2NaOH===2Na[Al(OH)4]+3H 2↑5.与氧化物的反应:2Mg +CO 2=====点燃2MgO +C(金属镁能在CO 2气体中燃烧),2Al +Fe 2O 3=====高温2Fe +Al 2O 3[铝热反应,铝与比铝不活泼的金属氧化物(如CuO 、MnO 2、Fe 2O 3等)都可以发生铝热反应](二)氧化铝和氢氧化铝1.氧化铝:两性氧化物,既能与酸反应生成铝盐,又能与强碱反应生成四羟基合铝酸盐 :Al 2O 3+6H+===2Al 3++3H 2O , Al 2O 3+2OH -+3H 2O===2[Al(OH)4]-2.氢氧化铝:①既能溶于强酸,又能溶于强碱中:Al(OH)3+3H +===Al 3++3H 2O ,Al(OH)3+OH-===[Al(OH)4]-②受热分解:2Al(OH)3=====△Al 2O 3+3H 2O3.氢氧化铝的制法:可溶性铝盐与氨水反应:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4 或四羟基合铝酸钠 溶液通入CO 2:CO 2过量:[Al(OH)4]-+CO 2===Al(OH)3↓+HCO -3; CO 2少量: 2[Al(OH)4]-+CO 2===2Al(OH)3↓+H 2O +CO 2-3。
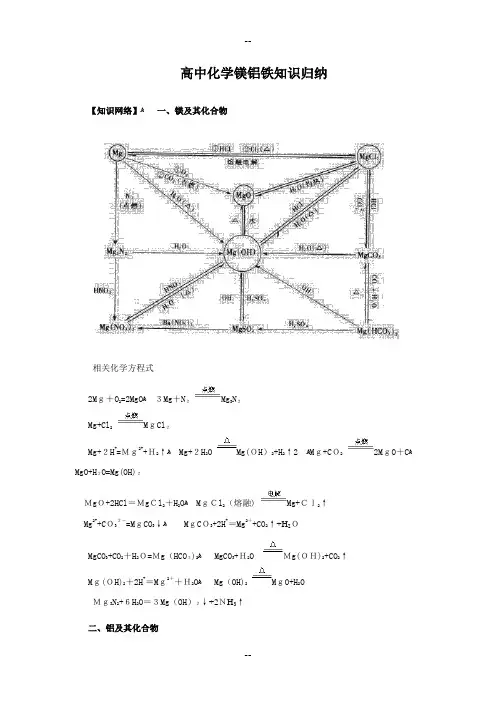
高中化学镁铝铁知识归纳【知识网络】ﻫ一、镁及其化合物相关化学方程式2Mg+O2=2MgOﻫ3Mg+N2Mg3N2Mg+Cl2MgCl2Mg+2H+=Mg2++H2↑ﻫ Mg+2H2O Mg(OH)2+H2↑2 ﻫMg+CO22MgO+CﻫMgO+H2O=Mg(OH)2MgO+2HCl=MgCl2+H2Oﻫ MgCl2(熔融) Mg+Cl2↑Mg2++CO32-=MgCO3↓ﻫMgCO3+2H+=Mg2++CO2↑+H2OMgCO3+CO2+H2O=Mg(HCO3)2ﻫ MgCO3+H2O Mg(OH)2+CO2↑Mg(OH)2+2H+=Mg2++H2OﻫMg(OH)2MgO+H2OMg3N2+6H2O=3Mg(OH)2↓+2NH3↑二、铝及其化合物相关化学方程式ﻫ4Al+3O2=2Al2O33S+2Al Al2S32Al+3Cl22AlCl32 ﻫAl+6HCl=2AlCl3+3H2↑ﻫ2Al+6H2O 2Al(OH)3+3H2↑2Al+Fe2O3Al2O3+2Fe2Al+2NaOH+2H2O=2NaAlO2+3H2↑ﻫ Al2O3+6HCl=2AlCl3+3H2OﻫAl2O3+2NaOH=2NaAlO2+2H2O2Al2O3(熔融)4Al+3O2↑Al3++3H2O=Al(OH)3+3H+Al3++3NH3·H2O=Al(OH)3↓+3NH4+Al3++3OH-=Al(OH)3↓ﻫAl3++4OH-=AlO2-+2H2OAl2S3+6H2O=2Al(OH)3↓+3H2S↑ﻫAl(OH)3+3H+=Al3++3H2Oﻫ Al(OH)3+OH-=Al O2-+2H2OﻫAlO2-+CO2+2H2O=Al(OH)3↓+HCO3-ﻫ AlO2-+H++H2O=Al(OH)3↓AlO2-+4H+=Al3++2H2Oﻫ 3AlO2-+Al3++6H2O=4Al(OH)3↓ﻫ三、铁及其化合物相关化学方程式3Fe+2O2(纯)Fe3O4Fe+SFeS2Fe+3Cl22FeCl3Fe+2H+=Fe2++H2↑3Fe+4H2O Fe3O4+4H2↑ﻫFe+Cu2+=Cu+Fe2+ﻫ FeO+2HCl=FeCl2+H2OFe(OH)2+2HCl=FeCl2+2H2Oﻫ 4Fe(OH)2+O2+2H2O=4Fe(OH)32FeCl2+Cl2=2FeCl3ﻫ FeS+2H+=Fe2++H2S↑2Fe3++Fe=3Fe2+4FeS2+11O22Fe2O3+8SO2ﻫFe2O3+6H+=2Fe3++3H2OﻫFe2O3+3CO2Fe+3CO2ﻫFe3++3H2O Fe(OH)3+3H+Fe3++SCN-=Fe(SCN)2+ﻫFe(OH)3+3H+=Fe3++3H2O2Fe(OH)3Fe2O3+3H2Oﻫ【各部分知识回顾】ﻫ一、镁ﻫ1.原子结构示意图:2.单质(1)在周期表中位置:ﻫ第三周期ⅡA族(碱土金属)(2)物理性质:银白色,质软,轻金属,硬度较小,熔沸点较低。

高二化学第二册第四章镁和铝知识点
金属镁是一种银白色的轻质碱土金属,化学性质活泼,能与酸反应生成氢气,具有一定的延展性和热消散性。
以下是查字典化学网整理的第四章镁和铝知识点,请大家认真学习。
1.镁知识点
(1)物理性质:镁,化学符号Mg,相对原子质量为24,银白色金属;熔点
648.8C,沸点1107C,密度1.74克/厘米.
(2)化学性质:能与卤族元素反应,例如:Mg+Cl2---(点
燃)MgCl2
能与氧气反应:Mg+O2MgO
能与稀酸反映:H2SO4+Mg==MgSO4+H2(气体)
能与沸水反映:Mg+2H2O==Mg(OH)2+H2(气体)
注:镁位于第三周期第二主族,所以你可以找和他相邻的元素,他们的结构性质都相似
2生物方面:是生物生活的必须元素,不能缺.在植物体内,以离子态存在.新叶含的镁比老叶多.
2.铝的知识点
Al(OH)3是一种两性氢氧化物,三元弱碱.也可以看作是HAlO2+H2O,这样,它也可以看成是一元弱酸.
Al(OH)3只能和强酸强碱反应,与弱酸弱碱(如
CO2+H20,NH3.H2O)都不反应
关于Al^3+ 和AlO^2-的问题也比较简单,把Al(OH)3看成是对应的酸碱就行了
第四章镁和铝知识点的全部内容就是这些,更多精彩内容请持续关注查字典化学网。

专题:元素及其化合物第三讲 镁铝铁1、镁铝及其化合物(1)镁铝单质①O 2、Cl 2、S : 2Mg+O 2点燃2MgO 4Al+3O22Al 2O 3 3Mg+N 2点燃Mg3N 2 Mg+SMgS 2Al+3S Al 2S 3 Mg+Cl 2点燃MgCl 22Al+3Cl 2点燃2AlCl 3②盐酸⎪⎪⎩⎪⎪⎨⎧⎩⎨⎧↑+=+++发生钝化浓铝与冷的浓不产生强氧化性酸非氧化性酸34222,..2:HNO SO H b H a H n M nH M n③氢氧化钠溶液:2Al+2H 2O+2NaOH=2NaAlO 2+3H 2↑④与氧化物的反应:a .H 2OMg+2H 2OMg(OH)2+H 2↑(能使酚酞变红) 2Al+6H 2O沸水2Al(OH)3+3H 2↑b .Fe 3O 4 铝热反应:32y Al (S)+M x O y(S)高温3y Al 2O 3+xM (l) △H <0 说明:①反应条件:M 为Fe 、V 、Cr 、Mn 等活泼性比Al 弱的金属(FeO 、Fe 2O 3、Fe 3O 4、MnO 2、CrO 3、V 2O 5、WO 3)。
反应中Al 从氧化物中夺取氧, 表现出很强的还原性。
(MgO 不可以)②实验操作③反应放出大量的热(2)氯化镁(MgCl 2)①物理性质:易溶于水、味苦、易潮解②用途:是制取镁的重要原料(3)氧化铝(Al 2O 3)①物理性质:白色、熔点高、难溶于水的固体②化学性质:两性氧化物盐酸氢氧化钠从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取Al的两种工艺流程如下:(4)氢氧化铝[Al(OH)3]①氢氧化铝的两性:稀硫酸Al(OH)3+3H+=Al3++3H2O氢氧化钠溶液Al(OH)3+OH-=AlO2-+2H2O②氢氧化铝的生成:a.铝盐与碱反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+b.偏铝酸盐与酸反应:当CO2不足或适量时:CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-;当CO2过量时:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-。

中学化学常见元素和化合物知识点总结(一)化学元素符号:正一价(+1):氢锂钠钾银亚铜H Li Na K Ag Cu负一价(-1):氟氯溴碘F Cl Br I正二价(+2):铍镁钙锶钡铜汞锌亚钴碳铅Be Mg Ca Sr Ba Cu Hg Zn Co C Pb负二价(-2):氧硫O S正三价(+3):铁钴铝硼铬镍Fe Co Al B Cr Ni正四价(+4):碳硅锡锰C Si Sn Mn正五价(+5):氮磷N P(二)酸根符号:正一价(+1):铵根NH4+负一价(-1):氯酸根硝酸根碳酸氢根醋酸根氢氧根过锰酸根ClO3-NO3-HCO3-CH3COO-OH-MnO4-负二价(-2):碳酸根硫酸根亚硫酸根铬酸根二铬酸根CO3-2SO4-2SO3-2CrO4-2Cr2O7-2负三价(-3):磷酸根PO4-3(三)化学式的规则:1.正价元素(酸根)和负价元素(酸根)相结合,形成化合物,其英文名称即为化学式。
2.酸根中除了NH4+为正价外,其余酸根皆为负价,且多为含氧的原子团。
3.化合物中,正价元素的总价数=负价元素的总价数;因此化合物的总价数为零。
4.金属为原子状态,价数=0;如:铁(Fe)﹑铝(Al)﹑铜(Cu)。
5.酸根和H结合,形成酸,即:氢+酸根=酸6.同种元素所形成的化合物,称为单质,如:H2﹑F2﹑Cl2﹑Br2﹑I2﹑O2﹑N2。
7.正价符号在前,负价符号在后。
1.氟化钠先写钠,再写氟 NaFNa为+1价F为-1价→价数总和为0所以氟化钠的化学式为NaF2.氢氧化钾先写钾,再写氢氧根→KOHK为+1价OH-为-1价→价数总和为0所以氢氧化钾的化学式为KOH3.氧化锌先写锌,再写氧→ZnOZn为+2价O为-2价→价数总和为0所以氧化锌的化学式为ZnO4.氯化钡先写钡,再写氯→BaClBa为+2价Cl为-1价→Ba需要个,Cl需要2个→+2×1=+2-1×2=-2→+2和-2的价数总和为0所以氯化钡的化学式为BaCl25.碘化铅先写铅,再写碘→PbIPb为+2价I为-1价→Pb需要1个,I需要2个→+2×1=+2-1×2=-2→+2和-2的价数总和为0所以碘化铅的化学式为PbI26.溴化铬先写铬,再写溴→CrBrCr为+3价Br为-1价→Cr需要1个,Br需要3个→+3×1=+3-1×3=-3→+3和-3的价数总和为0所以溴化铬的化学式为CrBr37.二氧化铅有数字的化学式按照所要求的个数直接书写,不需考虑价数。
高二化学第二册第四章镁和铝知识点
1.镁知识点
(1)物理性质:镁,化学符号Mg,相对原子质量为24,银白色金属;熔点
648.8deg;C,沸点1107deg;C,密度1.74克/厘米
sup3;.
(2)化学性质:能与卤族元素反应,例
如:Mg+Cl2---(点燃)MgCl2
能与氧气反应:Mg+O2MgO
能与稀酸反映:H2SO4+Mg==MgSO4+H2(气体)
能与沸水反映:Mg+2H2O==Mg(OH)2+H2(气体)
注:镁位于第三周期第二主族,所以你可以找和他相邻的元素,他们的结构性质都相似
2生物方面:是生物生活的必须元素,不能缺.在植物体内,以离子态存在.新叶含的镁比老叶多.
2.铝的知识点
Al(OH)3是一种两性氢氧化物,三元弱碱.也可以看作是HAlO2+H2O,这样,它也可以看成是一元弱酸.
Al(OH)3只能和强酸强碱反应,与弱酸弱碱(如
CO2+H20,NH3.H2O)都不反应
关于Al+ 和AlO-的问题也比较简单,把Al(OH)3看成是对应的酸碱就行了
第四章镁和铝知识点的全部内容就是这些,更多精彩内容请持续关注。
“镁、铝及其化合物”知识点总结一、Mg、Al的化学性质(一)与非金属反应1.与O2反应。
常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2.与卤素单质、硫等反应。
【特别提醒】(1)镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:(2)燃烧时都放出大量的热,发出耀眼的白光。
利用镁的这种性质来制造照明弹。
(3)集气瓶底部都要放一些细纱,以防集气瓶炸裂。
(二)与H2O反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气(三)与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓 H2SO4,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
(四)与某些氧化物反应1.镁与二氧化碳反应:[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe2O32Fe+ Al2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:(1)铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、Mn O2等。
(2)铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
(3)要使用没有氧化的铝粉,氧化铁粉末要烘干。
(4)KClO3作为引燃剂,也可以用Na2O2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
(五)与碱反应镁不与碱反应,铝与碱液反应:二、氢氧化铝(一)物理性质:A l(O H)3是几乎不溶于水的白色胶状固体,具有吸附性。
(二)化学性质1.与酸反应:Al(OH)3 +3HCl=AlCl3+3H2O离子反应方程式:Al(OH)3+3H+=Al3++3H2O2.与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O离子反应方程式:Al(OH)3+OH =NaAlO2+2H2O3.Al(OH)3的制取(1)铝盐与碱反应:实验室制取氢氧化铝时采用过量的氨水,而不用强碱与可溶性铝盐溶液反应是因为氢氧化铝是两性氢氧化物,能溶于强碱溶液,不溶于弱碱溶液。
铝及其化合物知识点总结铝及其化合物一、铝的结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA族镁原子核外有三个电子,在化学反应中,容易失去最外层的三个电子,显+3价。
二、铝单质的性质1、物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2、化学性质:(1)与非金属单质反应:A、2Al+3Cl22AlCl3B、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O2 2Al2O3思考:在金属活泼性顺序中铝排在铁的前面,那为什么铁在空气中易生锈而铝在空气中不易被腐蚀呢?铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO4=3Cu+Al2(SO4)3(3)与某些氧化物反应—铝热反应:2Al + Fe2O32Fe + Al2O3铝热剂[现象]:发出耀眼的光芒、放出大量的热、有熔融物生成。
铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、Mn O2等。
②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
③要使用没有氧化的铝粉,氧化铁粉末要烘干。
④KClO3作为引燃剂,也可以用Na2O2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
[试一试]:写出Al分别与MnO2、V2O5的反应方程式(4)与沸水微弱反应:2Al+6H2O2Al(OH)3+ 3H2↑(5)与酸反应::2Al+6HCl ====== 2AlCl3+H2↑2Al+3H2SO4====== Al2(SO4)3+ 3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
高中化学镁铝铁知识归纳一、镁1. 镁的性质镁是一种质轻、柔软、有光泽的银白色金属,在空气中易氧化。
它容易发生燃烧反应,在氧气中燃烧时会放出很强的光和热。
镁可以和非金属反应,与卤素的反应尤其强烈。
2. 镁的用途•镁可以用于制造航天器、战斗机和轻量化汽车等重要的航空航天和交通工具。
•镁还可以用于制造人造合成纤维、防火材料和荧光粉等化工产品。
3. 镁的化合物及其性质•氧化镁(MgO):一种高熔点的白色固体,可用作耐高温材料。
•氯化镁(MgCl2):一种常见的镁化合物,可用作工业上重要的金属提取剂和干燥剂。
•硫酸镁(MgSO4):可用于制备镁盐和肥料。
•碳酸镁(MgCO3):常见的挥发性碱式镁盐,有一定的生物作用。
二、铝1. 铝的性质铝是一种具有良好的延展性、可塑性和耐腐蚀性的轻质金属。
它在空气中易生成一层氧化铝膜,能有效地保护其表面不受氧化破坏。
2. 铝的用途•铝可以用于制造轻型汽车、航空器和建筑结构材料等。
•铝还可以用于制造食品包装和家电等日用品。
3. 铝的化合物及其性质•氧化铝(Al2O3):一种无机化合物,可用于制备工业上重要的铝盐、金属铝和陶瓷等。
•氯化铝(AlCl3):一种常见的铝化合物,可用作工业上重要的催化剂和中间体。
•硫酸铝(Al2(SO4)3):可用于制备铝盐和纸张脱酸剂等。
三、铁1. 铁的性质铁是一种重要的金属元素,具有良好的导电性、延展性和磁性。
铁在空气中易氧化,形成氧化铁层,保护铁不受氧气的破坏。
2. 铁的用途•铁可以用于制造建筑结构、船舶、火车和汽车等重要的交通工具。
•铁还可以用于制造钢铁、炉具和钉子等日用品。
3. 铁的化合物及其性质•氧化铁(Fe2O3):一种常见的铁氧化物,可用作制备铁盐和陶瓷等。
•氯化铁(FeCl3):可用作催化剂、氧化剂和沥青加氢剂等。
•硫酸亚铁(FeSO4):可用作食品和饲料的补铁剂、铁盐的原料、药物等。
四、•镁、铝和铁都是非常重要的金属元素,它们在工业、交通和日常生活中都有很广泛的应用。
高中化学知识点总结:镁、铝、铁及其化合物
1.镁、铝在元素周期表中位置及原子结构镁(Mg):位于周期表第3周期第IIA原子结构铝
(Al):位于周期表第3周期第IIIA,原子结构Mg、Al均为活泼金属,在化学反应中都易失
电子,其性质有相似之处,但由于原子结构不同性质上也有差异。
2.镁、铝的物理性质
①相同点:密度较小,熔点较低、硬度较小、均为银白色。
②不同点:铅的硬度比镁稍大,熔沸点比镁高,这是由于镁、铅的金属键的强弱不同。
3.镁、铝的化学性质比较:
2 2MgO 2
2
2
3
Mg(OH)
2 Mg22AlCl
4.氧化铝和氢氧化铝
A12O3和Al(OH)3是典型的两性化合物,既能与强酸反应。
也能与强碱反应生成盐和H2O。
Al 2O3+6H+=2A13++3H2O A12O3+2OH–=2A1O2–+H2O
Al(OH)3+3H+=A13++3H2O Al(OH)3+OH–=A1O2–+2H2O
5.生成Al(OH)3沉淀量的图像分析
(1)向AlCl3溶液中滴加NaOH溶液直至过量。
图1所示。
(2)向AlCl3溶液中滴加氨水至过量。
图2所示。
(3)向NaOH溶液中滴加AlCl3溶液直至过量。
图3所示。
(4)向NaAlO2溶液中滴加盐酸直至过量。
图4所示。
(5)向盐酸中滴入NaAlO2溶液直至过量。
图5所示。
(6)向NaAlO2溶液中通人CO2直至过量。
图6所示。
铁及其化合物
(1)铁在周期表中的位置及原子结构
铁位于第四周期第Ⅷ族,是过渡金属元素的代表,其原子结构示意图:
铁元素是一种变价元素,通常显示+2价、+3价,其化合物及其水溶液往
往带有颜色。
(2)铁的性质
①与非金属反应
2Fe+3Cl2=2FeCl3(棕黄色的烟)
3Fe+2O2=Fe3O4
Fe+S=FeS
Fe+I2=FeI2
注:铁与弱氧化性物质反应生成低价铁的化合物
②与酸反应
a.非氧化性酸.Fe+2H+=Fe2++H2↑
b.氧化性酸:常温下遇浓H2SO4、浓HNO3会发生钝化,而加热时会剧烈反应。
③与水反应:3Fe+4H2O(气)=Fe3O4+4H2
④与某些盐熔液反应:Fe+Cu2+=Fe2++Cu,Fe+2Fe3+=3Fe2+
(3)铁的存在铁在自然界中分布较广。
在地壳中含量约占5%,仅次于铝。
分布在地壳中的铁均以化合态存在,游离态的铁只能在陨石中得到。
铁矿石的种类较多,重要有:赤铁矿(Fe2O3)、磁铁矿(Fe3O4),褐铁矿(2Fe2O3·3H2O)和菱铁矿(FeCO3)。
(4)铁的氧化物和氢氧化物
①铁的氧化物
②铁的氢氧化物
(5)Fe 2+和Fe 3+
的性质 ①Fe 具有氧化性,主要表现还原性
4Fe 2++O 2+4H +=4Fe 3++2H 2O (Fe 2+
被氧化) ②Fe 3+具有较强的氧化性,与S 2–、I –、SO 32– 等能发生氧化还原反应2Fe 3++S 2–=2Fe 2+
+S↓ 2Fe 3++2I –=2Fe 2+
+I 2
③Fe 3+是典型的弱碱阳离子,与HCO 3–、AlO 2–。
等在溶液中发生双水解反应
232Fe
2Fe+3CO32–+3H2O=2Fe(OH)3↓+3CO2↑
④Fe3+遇苯酚溶液呈紫色;可用于检验Fe3+
⑤亚铁盐、铁盐的存放方法:亚铁盐溶液——加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液以防止Fe2+水解。
铁盐溶液——加入少量相应的酸溶液以防止Fe3+水解。