第二章 化学热力学基础
- 格式:pdf
- 大小:280.92 KB
- 文档页数:10






第二章化学热力学基础学习重点一.理解并熟悉热力学有关的概念:体系和环境状态和状态函数过程和途径常见的三个体系:敞开、封闭、孤立体系常见的三个过程:等压、等容、等温过程热和功热力学能(内能)和焓变化学反应热,等容反应热、等压反应热生成焓和标准生成焓;键能和离解能,键能和反应热的关系熵和熵变,标准摩尔熵Gibbs自由能和Gibbs自由能变,标准摩尔生成Gibbs自由能二.理解并熟练运用几个定律(包括两个判据)1.盖斯定律2.热力学第一定律:△U=Q-W3.热力学第二定律:△S(孤立)= △S(体系)+ △(环境)4.热力学第三定律:0K时,任何纯物质的完美晶体,S=05.两个判据:ⅰ.熵判据:△S(孤立)= △S(体系)+ △S(环境) ………………自发过程△S(孤立)= △S(体系)+ △S(环境) ………………不能进行ⅱ.G判据:等温等压吓,体系的G减小的方向是不能做非体积功的化学反应进行的方向.不及化学反应如此,任何等温等压虾,不做非体积功的自发过程的G都将减小.这正是热力学第二定律的另一种表述形式.△G<0 …………………自发进行△G>0 …………………不能自发进行△G=0 …………………可逆发应三.熟练掌握并运用几个热力学攻势(方程式)进行计算1.△U=Q-W2.Q v=△U3.Q p=△HH=U+PV △H=△U+△(PV)4.△r H mθ=∑υB△f H mθ(B)5.△S=Q r/T △r S mθ=∑υB△f S mθ(B)6.△G=△H-T△S 并分析自发进行的四种情况△r G mθ=∑υB△f G mθ(B)四.热力学的标准状态,尤其要注意所给定的热力学条件五.热力学化学方程式的书写六.问题:1.P△V和△(PV)2.H和Q。

第2章 化学热力学基础2-1. 估计下列过程ΔS 、ΔH 、ΔG 的符号。
(1)硫酸溶于水 (2)室温下冰融化 (3)NaNO 3(s)溶于水解:(1)ΔS >0,ΔH <0,ΔG <0;(2)ΔS >0,ΔH >0,ΔG <0;(3)ΔS >0,ΔH >0,ΔG <0。
2-2. 确定下列各组物质熵值的大小顺序。
(1)H 2O(l)、H 2O(g)、H 2O(s); (3)CH 4(g)、C 2H 6 (g);(2)H 2(g,310K )、H 2(g ,298K) (4)Fe(s)、Fe 2O 3(s)。
解:(1)S (H 2O,g)>S (H 2O,l)>S (H 2O,s) (2)S (H 2,g,80)>℃S (H 2,g,25)℃(3)S (C 2H 6,g) > S (CH 4,g) (4)S (Fe 2O 3,s)>S (Fe,s)2-3. 计算体系热力学能的变化 (1)体系从环境吸热1000J ,并对环境作功540J ;(2)体系向环境放热535J ,环境对体系作功250J 。
解: (1)ΔU =Q +W =(+1000)+(-540)=460(J)(2)ΔU =Q +W =(-250)+(+535)=285(J)2-4. 求下列反应的Δr H m θ。
[Δf H m θ ( Fe 2O 3,s)=-822.2kJ·mol -1,Δf H m θ ( Al 2O 3,s)=-1670kJ·mol -1,其余Δf H m θ值查附录一 ](1)4NH 3(g) + 5O 2(g) = 4NO(g)+ 6H 2O(g) (2)C 2H 4(g)+ H 2O(g)= C 2H 5OH(l)(3)Fe 2O 3(s)+ 2Al(s) = 2Fe(s)+ Al 2O 3(s)解: (1) Δr H m θ =4Δf H m θ(NO,g)+6Δf H m θ(H 2O,g)-[4Δf H m θ( NH 3,g)+5Δf H m θ(O 2,g)]=4×90.25+6×(-241.8)-[4×(-46.11)+5×0]=-905.36(kJ·mol -1)(2) Δr H m θ=Δf H m θ(C 2H 5OH,l)-[Δf H m θ(C 2H 4,g)+Δf H m θ(H 2O,g)]=-277.7-[(52.26+(-241.8)]=-88.16(kJ·mol -1)(3) Δr H m θ=2Δf H m θ(Fe,s)+ Δf H m θ(Al 2O 3,s)- [Δf H m θ(Fe 2O 3,s)+ 2Δf H m θ(Al,s)]=2×0+(-1670)-[(-822.2)+2×0] = -847.8 kJ·mol -12-5. 已知Δc H m θ(C 3H 8,g)=-2220.9kJ·mol -1,Δf H m θ(H 2O,l)=-285.8kJ·mol -1,Δf H m θ(CO 2,g)=-393.5kJ·mol -1,求C 3H 8(g)的Δf H m θ。



普通化学第二章化学热力学基础⏹§1.1 热力学基本概念⏹§1.2 热力学第一定律⏹§1.3 焓热力学⏹§1.4 自发过程和熵⏹§1.5 吉布斯自由能与化学反应的方向⏹总结化学热力学研究与解决的主要问题?热力学-------研究各种形式的能量相互转变过程中所遵循规律的科学。
热力学的基础:热力学第一定律和热力学第二定律化学热力学-------将热力学的原理应用于化学变化过程,就称为化学热力学。
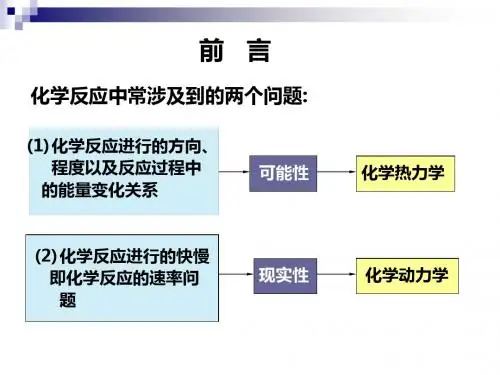
化学热力学研究与解决的主要问题:一是在指定的条件下,某一化学反应进行时,与外界交换多少能量?即计算化学反应热。
二是在指定的条件下,某一化学反应能否自发进行,即判断化学反应进行的方向。
三若可能自发进行,反应进行的温度如何?热力学方法的特点:大量质点组成的宏观体系1、热、功、状态函数△U、△H、△G和△S2、热力学第一、二、三定律3、盖斯定律4、自发过程的判定5、吉布斯—亥姆霍兹公式1、功、热、内能、焓、自由能、熵的计算2、自发过程判定AgNO 3与NaCl 的水溶液:如果只研究在水溶液中所进行的反应,则含有这两种物质的水溶液就是体系。
溶液以外的烧杯、溶液上方的空气都是环境。
如果还要研究反应时的能量变化,则水溶液和烧杯为体系,空气为环境。
例如:NaCl+AgNO 3溶液-体系分类敞开体系:体系与环境之间既有能量交换,又有物质交换。
封闭体系:体系与环境之间只有能量交换,没有物质交换。
孤立体系:体系与环境之间既没有能量交换,也没有物质交换。
敞开体系封闭体系绝热箱孤立体系NaOH+H2ONaOH+H2ONaOH+H2O热物质热二、体系的性质1、体系的性质:确定体系状态的各种宏观物理量。
如温度、压力、体积、质量、密度、浓度等2、体系的性质分为广度性质和强度性质两类:广度性质:在数值上与体系中物质的量成正比,即具有加和性。
如体积、质量、内能、焓、熵等。
强度性质:在数值上与体系中物质的量无关,即不具有加和性。
课 题第二章 化学热力学基础课次第一讲(2学时)教学目的(1)理解状态函数的概念及其特点(2)理解过程和途径的区别(3)理解热和功的概念及其符号规定.重点难点状态函数的基本特点热和功的符号规定及计算教学过程2-1 热力学的一些基本概念教学方法讲授课的类型基础课内蒙古农业大学理学院普通化学教案第二章 化学热力学基础(8学时)§2.1 热力学的一些基本概念一.系统和环境系统是被人为地划定的作为研究对象的物质(又叫体系或物系)。
除系统外的物质世界就是环境。
体系分类:孤立系统:与环境既无物质交换又无能量交换。
开放系统:与环境既有物质交换又有能量交换。
封闭系统: 与环境无物质交换而有能量交换。
二.状态和状态函数在热力学中,为了描述一个系统,必须确定它的一系列性质,即物理性质和化学性质,如温度、压力、体积、密度、组成等。
当系统的所有物理性质和化学性质都有确定的值,则称这个系统处于一定的状态。
所以系统的状态是由一系列表征系统性质的物理量所确定下来的系统的存在形式,是其物理性质和化学性质的综合表现。
系统的状态是由许多宏观的物理量来描述和确定的。
例如,气体的温度、压力、体积以及物质的量等宏观物理量确定了,则该气体系统的状态也就确定了。
只要其中一个物理量改变,则体系的状态就会发生变化,变化前的状态叫始态,变化后的状态叫终态。
系统的每一状态都具有许多物理和化学性质,状态一定,系统的性质也就一定,状态改变,系统的性质也随之变化。
在热力学中把用来说明、确定系统所处状态的系统性质叫做状态函数。
例如p、V、T及后面要介绍的非常重要的热力学能U、焓H、熵S和吉布斯自由能G等均是状态函数。
状态函数的特点:一是当系统的状态确定后,系统的宏观性质即状态函数就有确定的数值,亦即系统的宏观性质是状态的单值函数;二是状态函数的变化值只决定于系统的始态和终态,而与状态发生变化时所经历的具体途径无关。
无论经历多么复杂的变化,只要系统恢复原状,则状态函数也恢复原状。
状态函数按其性质可分为两大类:(1)广度性质:又称容量性质,当将系统分割成若干部分时,系统的某性质等于各部分该性质之和,即广度性质的值与系统中物质的量成正比,具有加和性。
体积、质量、热力学能、熵、焓、吉布斯自由能等均是广度性质。
(2)强度性质:此类性质不具有加和性,其值与系统中物质的量多少无关,仅决定于系统本身的特性。
例如,两杯298K的水混合,水温仍是298K,而不是596K。
温度、压力、密度、粘度等均是强度性质。
应当指出,两个广度性质的比值,是一个新的强度性质。
如摩尔体积、摩尔质量、密度、浓度等就是强度性质。
强度性质不必指定物质的量就可以确定。
三.过程和途径当系统与环境之间发生物质交换和能量交换时,系统的状态就会发生变化,人们把状态变化的经过称为过程,而把完成变化的具体步骤称为途径。
一个过程可以由多种不同的途径来实现,而每一途径常由几个步骤组成。
例如,在101.325kPa下,将25℃水加热到75℃的过程,可以通过多种途径达到。
如途径Ⅰ,直接加热升温到75℃;途径Ⅱ,先把水加热到90℃,然后再冷却到75℃。
热力学常见的过程有:(1)定温过程:系统的状态变化是在系统的始态温度、终态温度及环境温度均相等的条件下发生的过程。
即T始=T终=T环=T。
(2)定压过程:系统的状态变化是在系统的始态压力、终态压力及环境压力均相等的条件下发生的过程。
即p始=p终=p环=p。
(3)定容过程:系统的状态变化时系统的体积不发生变化的过程。
即V始=V终。
(4)绝热过程:在状态变化时,系统与环境之间无热量交换的过程。
(5)循环过程:系统从一状态出发经过一系列的变化又回到原始状态的过程。
热(Q):是体系与环境间温度差而引起的能量交换形式。
功(W):除热之外,系统与环境间其他形式传递的能量。
它们具有相同的量纲—采用相同的单位: J, kJ1.热和功的符号:热力学中规定:体系从环境吸热:Q为“+” 体系从环境放热:Q为“—”体系对环境做功:W为“—” 环境对体系做功:W为“+”功的种类有很多种,如体积功、电功、表面功、机械功等等。
在热力学中将功分为体积功和非体积功两大类。
体积功是系统体积变化时所做的功。
除体积功外其它各种形式的功统称为非体积功,也称有用功,常用符号W′表示。
由于W与过程和途径有关,所以不同的过程必然不同:(1)定容过程:(2)定压过程:(3)定温定压过程:(对于理想气体)作业、讨论题、思考题:P65 2.1(1) (2) (4)课后小结:本节要求掌握1、热和功的符号规定及计算2、状态函数的基本特点课 题第二章 化学热力学基础课次第二讲(2学时)教学目的(1)理解热力学第一定律和热力学能的概念(2)掌握化学反应的定容热,定压热及其相互关系,以及与反应的摩尔热力学能变,摩尔焓变的关系.重点难点热力学第一定律及定容热、定压热的含义及计算教学过程2-2 热力学第一定律及焓教学方法讲授课的类型基础课参考资料:[1] 阿娟、普通化学、北京、中国农业大学出版社、2005[2]浙江大学普通化学教研室、普通化学(第五版)、北京、高等教育出版社、2003[3]杨桂梧、普通化学、大连、辽宁民族出版社、1996[4]大连理工大学无机教研室、无机化学、北京、高等教育出版社、2002[5] 赵士铎、普通化学、北京、中国农业大学出版社、2005§2.2 热力学第一定律及焓一.热力学内能U定义:体系内部能量的总和。
因为U 是容量性质,所以其具有加合性。
二.热力学第一定律:封闭体系中,体系内部能量的变化等于体系从环境中吸收的热加上环境对体系所做的功:三.焓H1.根据热力学第一定律有: 移项整理得到:于是热力学定义一个新的状态函数称为焓,用符号H 表示: 说明:H 是容量性质,且是状态函数。
定容热: 在定容过程中体系吸收或放出的热. 定义: 在定压过程中体系吸收或放出的热.上式常用于想变中的有关计算.注: (1) 只有熔沸点想变才是定温定压过程(2) 是气体的物质的量变化,与固体和液体无关.四.热力学标准态:指温度为T,压力为=100kPa,浓度为1mol•L-1时的状态.五. 热化学研究化学反应过程中能量变化的科学.而化学反应过程中能量的变化正是反应热,因化学反应通常在定压下进行,故其反应热指的是定压热。
化学反应的标准摩尔热力学能变。
r: reaction, 表示反应的热力学能变。
m:表示反应进度变化为1mol表示化学反应与其热效应关系的化学方程式。
例如: =-285.84KJ•mol作业、讨论题、思考题:P66 2.2(1)课后小结:本节要求掌握1、热力学第一定律及定容热、定压热的含义及计算参考资料:[1] 阿娟、普通化学、北京、中国农业大学出版社、2005[2]浙江大学普通化学教研室、普通化学(第五版)、北京、高等教育出版社、2003[3]杨桂梧、普通化学、大连、辽宁民族出版社、1996[4]大连理工大学无机教研室、无机化学、北京、高等教育出版社、2002[5] 赵士铎、普通化学、北京、中国农业大学出版社、2005课题第二章化学热力学基础课次第三讲(2学时)教学目的(1)理解并熟练应用盖斯定律;(2)掌握标准摩尔生成焓的概念并熟练应用它计算反应的标准摩尔焓变;(3)了解自发过程的两个趋势.重点难点(1)重点掌握并熟练应用盖斯定律。
(2)掌握化学反应自发性的特点及熵的概念。
教学过程 2.3盖斯定律及反应热的计算;2.4化学反应的自发性及熵教学方法讲授课的类型基础课§2.3盖斯定律及反应热的计算一.盖斯定律内容:在定容或定压条件下,一个化学反应, 不管是一步完成或分几步完成,总反应的热效应等于各步反应的热效应之和。
借助盖斯定律可以计算难于测定和不能直接测定的一些化学反应热效应。
通过某些已知准确测定的反应热数据,就可以得到实际上难以测定的反应热.例如:已知(1)C(s) +O2(g)→ CO2(g) =-393.5 kJ·mol-1(2) =-283 kJ·mol-1求:(3) C(s) + ½ O2(g) == CO(g) =?由盖斯定律:反应(3)=反应(1)—反应(2)所以=—=-393.5 kJ·mol-1-(-283 kJ·mol-1)=676.5 kJ·mol-1二. 标准摩尔生成焓定义: 在标准状态下,由最稳定的单质生成1mol纯物质B时的焓变.= ΣνB(B,相态)§2.4 化学反应的自发性及熵一.自发过程的趋势3.自发反应的特点:)有一定方向;2)有对外作的能力;3)有一定限度;4)是不可逆的.G=H-TS1. G是体系的状态函数ΔG < 0, 正向反应自发ΔG=0, 处于平衡状态ΔG > 0, 正向反应非自发在等温定压下,任何自发反应的自由能G总是在减少.三.熵及熵变1.熵的定义: 熵是反映体系内部质点运动的混乱程度的物理量.用S表示.1)有序无序 ,其2)在等温定压下,一个导致气体分数增加的过程是熵增加的过程。
热力学第三定律在绝对零度时,任何纯物质的完美晶体的熵等于0,即作业、讨论题、思考题:P65 2.2(2),2.6,课后小结:本节要求掌握(1)重点掌握并熟练应用盖斯定律。
(2)掌握化学反应自发性的特点及熵的概念。
参考资料:[1] 阿娟、普通化学、北京、中国农业大学出版社、2005[2]浙江大学普通化学教研室、普通化学(第五版)、北京、高等教育出版社、2003[3]杨桂梧、普通化学、大连、辽宁民族出版社、1996课 题第二章 化学热力学基础课次第四讲(2学时)教学目的(1)会用标准摩尔生成吉布斯自由能计算反应的标准摩尔吉布斯自由能变;(2)掌握吉布斯–亥姆霍兹(Gibb s -HelmholTz )方程及简单应用;(3)会判断化学反应的自发方向.重点难点(1)重点掌握并熟练应用吉布斯–亥姆霍兹(Gibb s -HelmholTz )方程(2)会判断化学反应的自发方向.教学过程 2.5吉布斯自由能及反应方向的判据教学方法讲授课的类型基础课[4]大连理工大学无机教研室、无机化学、北京、高等教育出版社、2002[5] 赵士铎、普通化学、北京、中国农业大学出版社、2005§2.5 吉布斯自由能及反应方向的判据1.标准摩尔吉布斯自由能判据(等温等压)吉布斯自由能的重要作用是作为反应自发性的判据,判断反应进行的方向和限度。
可用于判断标准态时反应的方向。
<0 反应能自发进行; <0 =0 反应处于平衡状态; =0>0 反应不能自发进行。
>0注:标准态时的判据;是任意态时的判据二.标准摩尔生成吉布斯自由能与焓相似,物质的吉布斯自由能的绝对值难以确定。