高中化学专题3溶液中的离子反应第三单元盐类的水解3溶液中的三个守恒学案苏教版选修40818451.doc
- 格式:doc
- 大小:78.43 KB
- 文档页数:5

《盐类的水解》教学设计无锡市惠山区教育局教研室薛青峰教材依据:普通高中课程标准实验教科书·化学――《化学反应原理》(苏教版主编:王祖浩)专题3 溶液中的离子反应第三单元盐类的水解本单元主要包括三部分内容,它们分别是第一部分:盐类的水解规律;第二部分:影响盐类水解的因素;第三部分:盐水水解的应用;本教学设计为第一部分内容。
设计思想:1.随着《高中化学课程标准》将科学探究纳入了化学教学的内容,科学探究作为一种独特的学习方式,一方面为实现学生学习方式的多样化提供了有效的途径,另一方面也为落实“过程与方法”目标找到了可靠的载体,同时使得化学教学在培养学生的创新精神、实践能力和实事求是的科学态度有了可操作的内容。
正因为如此,科学探究正越来越被广大教师接受和运用。
然而,仔细分析频繁出现的科学探究,不难发现,一些科学探究的设计还存在着诸多不足,其中最为突出的问题是对“猜想与假设”的处理,基于此,本设计力求通过《盐类水解》中对“猜想与假设”的处理,让学生感悟如何利用已有化学知识和经验的进行“猜想和假设”,并学会对“猜想和假设”进行合理性剖析,进而培养学生“猜想与假设”的能力,发展学生对科学探究活动的预见能力。
2.建构主义教学观认为:教学的核心任务不是如何把现成的知识传授给学生,而是如何激发出学生原来的相关知识经验,促进知识经验的生长,促进学生的知识建构活动。
《盐类水解》一课的教学,一般老师采用的教学方式是:呈现现象,归纳共性。
而本设计采用的教学方式是科学探究方式,通过从已有知识中寻找新知识的生长点,激发学生探究欲望,并通过层层递进的问题,不断激发学生猜想与假设,并通过实验与小组讨论,探究盐类水解的本质。
这种从已有知识中寻找问题,并进行科学探究的学习方式对学生今后的学习意义重大。
教学目标:1、理解盐类水解的本质,初步掌握盐类水解方程式的书写方法2、学会根据已有的知识和经验进行合理猜想并能设计方案验证自己的猜想3、体会假设和推理在学习化学过程中的重要作用教学方法:探究教学、小组合作学习教学重点:探究盐类水解的规律教学难点:解释盐溶液酸碱性的成因及盐类水解离子方程式的书写教学用品:CH3COONa溶液、Na2SO3溶液、NaCl溶液、K2SO4溶液、NH4Cl溶液、AlCl3溶液、蒸馏水、pH 试纸、表面皿、玻璃棒、剪刀、镊子、烧杯、滤纸教学过程:〖第一环节〗温故激疑引出课题问题1:你知道醋酸溶液为什么呈酸性吗?氨水为什么又呈碱性呢?【设计意图】唤起学生对酸溶液呈酸性、碱溶液呈碱性原因的回忆;同时以醋酸和氨水为例,使学生进一步加深弱酸、弱碱在溶液中的电离是一个可逆过程,即弱酸溶液中弱酸分子、弱酸根离子和H+必定是同时存在,同样弱碱溶液中弱碱分子、弱碱阳离子和OH_也必定是同时存在,为后面的猜想做好铺垫。

第2课时影响盐类水解的因素[学习目标定位] 1.会分析外界条件对盐类水解平衡的影响。
2.了解盐类水解在生产生活、化学实验、科学研究中的应用。
一、影响盐类水解平衡的因素1.盐类水解的特点(1)根据盐类水解的实质和规律判断正误(正确的打“√”,错误的打“×”)①盐类的水解过程促进了水的电离( )②盐水解后,溶液不是显酸性就是显碱性( )③盐的水解反应都是吸热反应( )④CH3COONa溶液中含有CH3COO-,不含有CH3COOH分子( )⑤FeCl3水解的离子方程式为Fe3++3H2O===Fe(OH)3↓+3H+( )答案①√②×③√④×⑤×(2)0.1 mol·L-1的NaClO、CH3COONa、NaNO2溶液的水解及pH的大小ClO-+H2O HClO+OH-CH3COO-+H2O CH3COOH+OH-NO-2+H2O HNO2+OH-(1)水解反应可看作中和反应的逆反应,是吸热反应。
(2)盐水解的程度很小。
相同条件下:2.实验探究盐类水解平衡的影响因素已知:Fe3++3H2O Fe(OH)3+3H+,根据实验操作填写下表影响盐类水解平衡的外界因素(1)温度:盐的水解是吸热反应,因此升高温度,水解程度增大。
(2)浓度:盐的浓度越小,水解程度越大。
(3)酸碱性:向盐溶液中加入H+,可抑制阳离子水解,促进阴离子水解;向盐溶液中加入OH-,能抑制阴离子水解,促进阳离子水解。
例1(2017·江阴南菁中学高二期中)0.1 mol·L-1 K2CO3溶液中,由于CO2-3的水解,使得c(CO2-3)<0.1 mol·L-1。
如果要使c(CO2-3)更接近0.1 mol·L-1,可以采取的措施是( ) A.加入适量水B.加入少量盐酸C.加入适量KOH固体D.加热答案 C解析如果要使c(CO2-3)更接近于0.1 mol·L-1,抑制CO2-3的水解即可。

第三单元盐类的水解第一课时盐类的水解反应——————————————————————————————————————[课标要求]1.了解不同盐溶液的酸碱性。
2.理解盐溶液的水解规律。
3.掌握盐类水解方程式的书写方法。
1.盐类水解的实质是盐电离出来的离子与水电离的H+或OH-结合生成弱电解质,打破了水的电离平衡,导致c(H+)≠c(OH-),而引起溶液酸碱性的变化。
2.盐类水解的规律:有弱才水解,越弱越水解,谁强显谁性,同强显中性。
而强酸弱碱盐溶液呈酸性,强碱弱酸盐溶液呈碱性。
3.水解离子方程式书写“两规那么〞:(1)多元弱酸阴离子是分步水解的,以第一步水解为主。
(2)多元弱碱阳离子水解复杂,可一步写出。
盐类的水解1.盐溶液呈酸碱性的原因(1)盐的类型和溶液的酸碱性探究①实例:盐溶液NaCl Na2CO3NH4Cl CH3COONa AlCl3溶液的酸碱性中性碱性酸性碱性酸性盐的类型 强酸强碱盐弱酸强碱盐强酸弱碱盐弱酸强碱盐强酸弱碱盐②一般规律:并不是所有的盐溶液都呈中性,通常强酸强碱盐的溶液呈中性,强酸弱碱盐的溶液呈酸性,弱酸强碱盐的溶液呈碱性。
(2)盐溶液酸碱性的理论分析 ①NH 4Cl 溶液: 图示解释NH +4结合H 2O 电离产生的OH -生成弱电解质NH 3·H 2O ,使水的电离平衡正向移动,使c (H +)>c (OH -),溶液呈酸性表示 NH +4+H 2ONH 3·H 2O +H +②CH 3COONa 溶液: 图示解释CH 3COO -结合H 2O 电离产生H +生成弱电解质CH 3COOH ,使水的电离平衡正向移动,使c (H +)<c (OH -),溶液呈碱性表示 CH 3COO -+H 2OCH 3COOH +OH -③NaCl 溶液:⎭⎪⎬⎪⎫NaCl===Na ++Cl -H 2OOH -+H +溶液中无弱电解质生成,水的电离平衡未被破坏,溶液中c (H +)=c (OH -),呈中性2.盐类水解的概念和本质(1)概念: 在水溶液中盐电离产生的离子与水电离产生的H +或OH -结合生成弱电解质的反应,叫做盐类的水解。
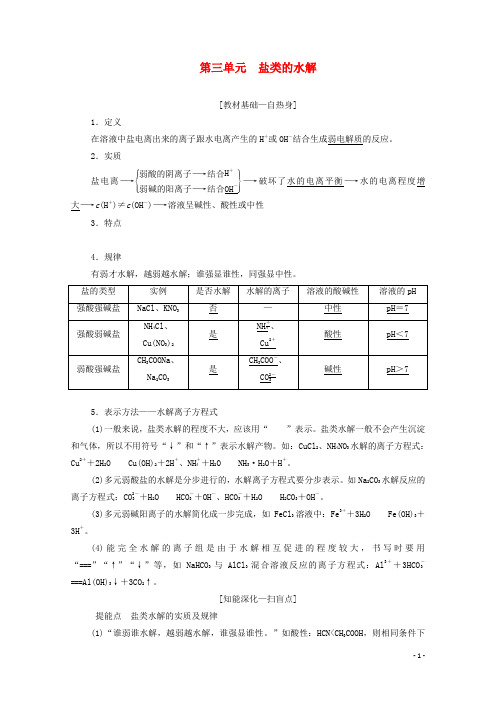
第三单元 盐类的水解[教材基础—自热身]1.定义在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反应。
2.实质盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子―→结合H +弱碱的阳离子―→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→c (H +)≠c (OH -)―→溶液呈碱性、酸性或中性3.特点 4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
5.表示方法——水解离子方程式(1)一般来说,盐类水解的程度不大,应该用“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如:CuCl 2、NH 4NO 3水解的离子方程式:Cu 2++2H 2OCu(OH)2+2H +、NH +4+H 2ONH 3·H 2O +H +。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
如Na 2CO 3水解反应的离子方程式:CO 2-3+H 2OHCO -3+OH -、HCO -3+H 2OH 2CO 3+OH -。
(3)多元弱碱阳离子的水解简化成一步完成,如FeCl 3溶液中:Fe 3++3H 2O Fe(OH)3+3H +。
(4)能完全水解的离子组是由于水解相互促进的程度较大,书写时要用“===”“↑”“↓”等,如NaHCO 3与AlCl 3混合溶液反应的离子方程式:Al 3++3HCO -3===Al(OH)3↓+3CO 2↑。
[知能深化—扫盲点]提能点 盐类水解的实质及规律(1)“谁弱谁水解,越弱越水解,谁强显谁性。
”如酸性:HCN<CH 3COOH ,则相同条件下碱性:NaCN>CH3COONa。
(2)强酸的酸式盐只电离,不水解,溶液显酸性。
如NaHSO4在水溶液中:NaHSO4===Na++H++SO2-4。
(3)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子电离程度和水解程度的相对大小。
①若电离程度小于水解程度,溶液显碱性。

江苏省大丰市高中化学专题3 溶液中的离子反应第三单元盐类的水解学案苏教版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(江苏省大丰市高中化学专题3 溶液中的离子反应第三单元盐类的水解学案苏教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为江苏省大丰市高中化学专题3 溶液中的离子反应第三单元盐类的水解学案苏教版选修4的全部内容。
第三单元 盐类的水解第1节 盐类的水解规律及其主要影响因素1.A 下列有关盐类水解的说法不正确的是( )A .盐类水解过程破坏了纯水的电离平衡B .盐类水解反应是酸碱中和反应的逆反应C .盐类水解的结果使溶液不一定呈中性D .Na 2S 溶液中c (Na +)是c (S 2)的2倍2.A 下列溶液能使酚酞指示剂显红色的是( )A .碳酸钾B .硫酸氢钠C .碳酸氢钠D .氯化铁3.A 下列离子在水溶液中不会发生水解的是( )A .NH 4+B .SO 24-C .Al 3+D .F4.A 氯化铵溶液中离子浓度从大到小排列正确的是( )A .NH 4+、H +、OH 、Cl B .Cl 、NH 4+ 、H +、OH C .H +、Cl 、NH 4+ 、OH D .Cl 、NH 4+、OH 、H +5.A下列离子方程式中,属于水解反应的是() A.HCOOH + H 2O HCOO–+ H3O+B.CO 2 + H2O HCO3-+ H+C.CO23-+ H2O HCO3-+OH–D.HS– + H 2O S2–+ H3O+6.A下列关于酸性溶液的叙述中正确的是()A.可能是盐的水溶液B.一定是酸的水溶液C.溶液中c( H+)<c(OH–)D.不含有OH–的溶液7.B已知一种c(H+) = 1×103mol•L1的酸溶液和一种c(OH) = 1×103mol•L1的碱溶液等体积混合后,溶液呈酸性,其原因可能是( )A.浓的强酸和稀的强碱溶液反应B.浓的弱酸和稀的强碱溶液反应C.等浓度的强酸和弱碱溶液反应D.生成了一种强酸弱碱盐8.B常温下,下列溶液的pH大于7的是()A.NH4Cl B.H3PO4C.NaHCO3 D.Na2SO49.B完成水解反应的离子方程式:氯化铵溶液:;醋酸钠溶液: ;氯化铁溶液:;硫酸铝溶液:;碳酸钠溶液: ;硫酸铜溶液: .10.B在水中加入下列物质,可使水的电离平衡正向移动,且所得溶液呈酸性的是()A.NaCl B.H2SO4C.Na2CO3 D.NH4Cl11.B下列物质能跟镁反应并生成氢气的是()A.甲酸溶液 B.氢氧化钠溶液C.氯化铵溶液 D.碳酸钠溶液12.B等物质的量浓度的下列各溶液中,NH4+离子的浓度最大的是()A.NH4HCO3 B.NH4HSO4C.NH4Cl D.NH3·H2O13.B相同温度,相同物质的量浓度的四种溶液:①CH3COONa,②NaHSO4,③NaCl,④Na2CO3,按pH值由大到小的顺序排列,正确的是()A.④①③② B.①④③②C.①②③④ D.④③①②14.B常温下某溶液中由水电离的c(H+) =1010mol·L1,该溶液中溶质不可能是()A.NaHSO4 B.Al2(SO4)3C.NaOH D.HCl15.C在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH离子浓度分别为A mol/L与B mol/L,则A和B关系为( )A.A〉B B.A=104 BC.B=104 A D.A=B16.B下列关于0。

导学案:专题3第三单元 盐类的水解课前预习问题导入我们所用自来水,都是自来水公司进行净化、消毒后获得的。
自来水公司用于净水的试剂最常用的是明矾,其净水的原理是什么?答案:明矾净水的原理是自身电离出来的Al 3+在水中发生水解,生成Al(OH)3胶体,吸附水中的杂质、色素使其沉降下来。
基础知识1.实验表明,并不是所有的盐溶液都是中性的。
通常____________盐呈中性,____________盐的溶液呈酸性,____________盐的溶液呈碱性。
答案:强酸强碱 强酸弱碱 弱酸强碱2.盐溶液之所以可能显示出酸性或碱性,主要是由于盐电离产生的阳离子或阴离子能结合水电离产生的____________或____________生成____________,从而促进水的电离平衡朝着____________方向移动。
这样的反应称为盐类水解。
盐类的水解可用如下式子表示: 盐+水____________+____________因此水解反应可以看作____________反应的逆反应。
并且可以根据生成酸和碱的____________来判断溶液酸碱性。
答案:氢氧根离子 氢离子 弱电解质 电离 酸 碱酸碱中和 相对强弱3.盐类水解的本质是在水溶液中,盐电离出的____________或____________与水电离产生的____________或____________作用生成____________电解质。
如果生成的弱电解质越____________电离,则生成弱电解质的倾向越____________,盐水解的程度就越____________,溶液中c(H +)和c (OH -)的差别就越____________。
答案:阴离子 阳离子 H + OH - 弱 难 大 大 大课堂互动三点剖析重点1 水解方程式书写1.书写盐类水解的离子方程式时应注意(1)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,因此盐类水解的离子方程式中不标“↑”或“↓”,也不把生成物(如NH 3·H 2O 、H 2CO 3等)写成其分解产物的形式。
第1课时盐类的水解反应教学设计教学过程[提问引入]1.酸和碱反应生成盐和水,生活中常用的盐有哪些?生活中常用的盐除了NaCl外,还有和Na2CO3、NaHCO3 等。
NaCl,C5H8NO4Na(谷氨酸一钠,味精)主要用于食品调味,而Na2CO3、NaHCO3被视作“碱”用于油污清洗和面食制作,特别是NaHCO3俗称纯碱。
2.Na2CO3、NaHCO3明明是盐,为什么叫“碱”呢?盐溶液是否都显中性?一.发现问题[实验演示]1.用pH试纸检验CH3COONa、 Na2CO3等溶液的酸碱性。
(通过示范说明操作要领,并强调注意事项)[图表展示] 分类展示实验的图表[讨论]由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系。
[学生小结]盐的组成与盐溶液酸碱性的关系:[结论] 谁强显谁性,同强显中性二.探究原因1. CH3COONa的水溶液显碱性的原因:[讨论](1)写出醋酸钠在水溶液中电离的方程式?(2)写出水电离的方程式?(3)CH3COONa溶液中存在着几种离子?(4)溶液中哪些离子可以结合成弱电解质?(5)生成弱电解质时对水的电离平衡有何影响?[播放实验]结合学生的讨论,利用电脑动画模拟CH3COONa的水解过程,生动形象地说明CH3COONa的水解原理。
[讲解]CH3COONa溶于水时,CH3COONa电离出的CH3COO-和水电离出的H+结合生成难电离的CH3COOH,消耗了溶液中的H+,使水的电离平衡向右移动,产生更多的OH-,建立新平衡时,c(OH-)>c(H+),从而使溶液显碱性。
2.学生填写表格(书本79面的表格)3. NH4Cl的水溶液显酸性的原因:[讨论]试从CH3COONa的水溶液显碱性的原因分析:为什么NH4Cl的水溶液显酸性?而NaCl溶液为什么显中性?[学生小结]NH4Cl溶于水时电离出的NH4+与水电离出的OH-结合成弱电解质NH3·H2O,消耗了溶液中的OH-,使水的电离平衡向右移动,产生更多的H+,建立新平衡时,c(H+)>c(OH -),从而使溶液显酸性。
尽管电解质在水溶液中可能发生电离、水解等多种变化,使各种分子、离子浓度的运算和比较变得错综复杂,但只要抓住“电荷守恒”“元素(物料)守恒”“质子守恒”这三个守恒关系,进行准确分析,这些问题就会迎刃而解。
一、电荷守恒是指溶液中所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数相等。
即溶液永久是电中性的,因此阳离子带的正电荷总量=阴离子带的负电荷总量1. 溶液必须保持电中性,即溶液中所有阳离子所带的电荷数等于所有阴离子所带的电荷数。
2. 除六大强酸、四大强碱外都水解,多元弱酸部分水解。
产物中有分步水解产物。
3. 那个离子所带的电荷数是多少,离子前就写几。
例如:Na2CO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c (CO3 2-)写那个等式要注意两点:1. 要准确判定溶液中存在的所有离子,不能漏掉。
2. 注意离子自身带的电荷数目。
例如:NaHCO3溶液:c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH-)NaOH溶液:c(Na+)+ c(H+)= c(OH-)Na3PO4溶液:c(Na+)+ c(H+)= 3c(PO43-)+ 2c(HPO42-)+ c(H2PO4-)+ c(OH-)注意:(1)正确分析溶液中存在的阴、阳离子是书写电荷守恒式的关键,需要结合电解质电离及盐类的水解知识,专门是对多级电离或多级水解,不能有所遗漏。
如Na2CO3溶液中存在如下电离和水解平稳:Na2CO3= 2 Na+ +CO32-;CO32-+ H2O HCO3-+OH-;HCO3-+H2O H2 CO3 +OH-;H2O H++OH-。
因此溶液中阳离子有:Na+、H+,阴离子有:CO32-、HCO3-、O H-。
(2)结合阴、阳离子的数目及其所带的电荷能够写出:N(Na+)+N(H+)= 2N(CO32-)+ N(HCO3-)+ N(O H-)(3)将上式两边同时除以NA得:n(Na+)+n(H+)=2n(CO32-)+ n(HCO3-)+ n(OH-);再同时除以溶液体积V得:C(Na+)+C(H+)= 2C(CO32-)+ C(HCO3-)+ C(OH-),这确实是Na2 CO3溶液的电荷守恒式。
第三单元盐类的水解 3 溶液中的三个守恒(答题时间:15分钟)一、选择题1. 35℃时,在0.1mol·L-1的Na2S和0.1mol·L-1的NaHS溶液中均存在的关系是()A. c(OH-)×c(H+)=1×10-14B. c(Na+)=c(S2-)+c(HS-)+c(H2S)C. c(OH-)=c(H+)+c(HS-)+2c(H2S)D. c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)2. 在0.1 mo l · L-1的Na2CO3溶液中,下列关系式正确的是()A. c(Na+)=2c(CO32-)B. c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)C. c(HCO3-)>c(H2CO3)D. c(Na+)<c(CO32-)+c(HCO3-)3. 在0.1mol/L的H2S溶液中,下列关系式错误的是()A. c(H+)=c(HS-)+c(S2-)+c(OH-)B. c(H+)=c(HS-)+2c(S2-)+c(OH-)C. c(H+)>[c(HS-)+c(S2-)+c(OH-)]D. c(H2S)+c(HS-)+c(S2-)=0.1mol/L4. (多选)在Na2S溶液中,下列关系式不正确的是()A. c(Na+)=2c(HS-)+2c(S2-)+c(H2S)B. c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)C. c(Na+)>c(S2-)>c(OH-)>c(HS-)D. c(OH-)=c(HS-)+c(H+)+c(H2S)二、填空题5. 写出NaHCO3在水溶液中所发生的电离与水解反应的离子方程式:并写出溶液中的电荷守恒的表达式:,溶液中的物料守恒(表达式为:原子守恒)的表达式:。
6. 0.1mol/L的HCN溶液与0.1mol/L的NaCN溶液等体积混合,混合后溶液的pH>7,说明:HCN的电离程度CN-的水解程度(填“大于”、“小于”或“等于”);电荷守恒表达式为:;物料守恒表达式为:。
溶液中的三个守恒【考点精讲】虽然电解质在水溶液中可能发生电离、水解等多种变化,使各种分子、离子浓度的计算和比较变得错综复杂,但只要抓住“电荷守恒”“元素(物料)守恒”“质子守恒”这三个守恒关系,进行准确分析,这些问题就会迎刃而解。
一、电荷守恒是指溶液中所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数相等。
即溶液永远是电中性的,所以阳离子带的正电荷总量=阴离子带的负电荷总量1. 溶液必须保持电中性,即溶液中所有阳离子所带的电荷数等于所有阴离子所带的电荷数。
2. 除六大强酸、四大强碱外都水解,多元弱酸部分水解。
产物中有分步水解产物。
3. 这个离子所带的电荷数是多少,离子前就写几。
例如:Na2CO3:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO3 2-)写这个等式要注意两点:1. 要准确判断溶液中存在的所有离子,不能漏掉。
2. 注意离子自身带的电荷数目。
例如:NaHCO3溶液:c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH-)NaOH溶液:c(Na+)+ c(H+)= c(OH-)Na3PO4溶液:c(Na+)+ c(H+)= 3c(PO43-)+ 2c(HPO42-)+ c(H2PO4-)+ c(OH-)注意:(1)正确分析溶液中存在的阴、阳离子是书写电荷守恒式的关键,需要结合电解质电离及盐类的水解知识,尤其是对多级电离或多级水解,不能有所遗漏。
如Na2CO3溶液中存在如下电离和水解平衡:Na2CO3= 2 Na+ +CO32-;CO32-+ H2O HCO3-+OH-;HCO3-+H2O H2CO3 +OH-;H2O H++OH-。
所以溶液中阳离子有:Na+、H+,阴离子有:CO32-、HCO3-、OH-。
(2)结合阴、阳离子的数目及其所带的电荷可以写出:N(Na+)+N(H+)= 2N(CO32-)+ N( HCO3-)+ N(OH-)(3)将上式两边同时除以N A得:n(Na+)+n(H+)=2n(CO32-)+ n(HCO3-)+ n(OH-);再同时除以溶液体积V得:C(Na+)+C(H+)= 2C(CO32-)+ C(HCO3-)+ C(OH-),这就是Na2CO3溶液的电荷守恒式。
电荷守恒式即溶液中所有阳离子的物质的量浓度与其所带电荷乘积之和等于所有阴离子的物质的量浓度与其所带电荷的绝对值乘积之和。
二、物料守恒即加入的溶质组成中存在的某些元素之间的特定比例关系,由于水溶液中一定存在水的H、O元素,所以物料守恒中的等式一定是非H、O元素的关系。
例如:NH4Cl溶液:化学式中N:Cl=1:1,即得到c(NH4+)+ c(NH3•H2O)= c(Cl-)Na2CO3溶液:Na:C=2:1,即得到c(Na+)= 2c(CO32-+HCO3-+H2CO3)NaHCO3溶液:Na:C=1:1,即得到c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3)写这个等式要注意,把所有含这种元素的粒子都要考虑在内,可以是离子,也可以是分子。
物料守恒可以理解为原子守恒的另一种说法。
“任一化学反应前后原子种类和数量分别保持不变”,可以微观地应用到具体反应方程式,也就是反应物元素原子(核)种类与总数相等于生成物。
1. 含特定元素的微粒(离子或分子)守恒;2. 不同元素间形成的特定微粒比守恒;3. 特定微粒的来源关系守恒。
示例:NaHCO3溶液n(Na):n(C)=1:1,如果HCO3-没有电离和水解,那么Na+和HCO3-浓度相等。
HCO3-会水解成为H2CO3,电离为CO32-(都是1:1反应,也就是消耗一个HCO3-,就产生一个H2CO3或者CO32-),那么守恒式中把Na+浓度和HCO3-及其产物的浓度和画等号(或直接看作钠与碳的守恒):即c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)这个式子叫物料守恒三、质子守恒这是“追踪”溶液中H+(质子)的“来龙去脉”而得到的关系式。
即质子守恒就是酸失去的质子和碱得到的质子数目相同。
方法一:可以由电荷守恒和物料守恒关系联立得到。
NaHCO3溶液中存在下列等式c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-){电荷守恒}c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3){物料守恒}两式相减得c(H+)+c(H2CO3)=c(CO32-)+c(OH-),这个式子叫质子守恒。
方法二:酸碱质子理论示例1:NaHCO3溶液原始物种类:HCO3-、H2O消耗质子产物H2CO3,产生质子产物CO32-、OH-c(H+)=c(CO32-)+c(OH-)-c(H2CO3)即c(H+)+c(H2CO3)=c(CO32-)+c(OH-)关系:剩余的质子数目等于产生质子的产物数目-消耗质子的产物数目直接用酸碱质子理论求质子平衡关系比较简单,但要细心;如果用电荷守恒和物料守恒关系联立得到则比较麻烦,但比较保险。
示例2:NaH2PO4溶液原始物种类:H2PO4-,H2O消耗质子产物:H3PO4,产生质子产物:HPO42-(产生一个质子),PO43-(产生两个质子),OH-所以:c(H+)=c(HPO42-)+2c(PO43-)+c(OH-)-c(H3PO4)【典例精析】例题1 写出K3PO4溶液中存在的物料守恒关系式___________________。
思路导航:在K3PO4溶液中,PO43-部分水解成HPO42-、H2PO4-、H3PO4,其物料守恒关系式为:c(K+)=3[c(PO43-)+ c(HPO42-)+ c(H2PO4-)+ c(H3PO4)]=3c(PO43-)+ 3c(HPO42-)+ 3c(H2PO4-)+ 3c(H3PO4)答案:c(K+)=3c(PO43-)+ 3c(HPO42-)+ 3c(H2PO4-)+ 3c(H3PO4)例题2 写出K3PO4 溶液中存在的质子守恒关系式___________________。
思路导航:在K3PO4溶液中,PO43-结合一个质子成为HPO42-、结合两个质子成为H2PO4-、结合三个质子成为H3PO4,而水失去一个质子成为OH-,因此质子守恒的关系式是:c(OH-)= c(H+)+ c(HPO42-)+ 2c(H2PO-)+ 3c(H3PO4)答案:c(OH-)= c(H+)+ c(HPO42-)+ 2c(H2PO-)+ 3c(H3PO4)例题3 在0.1 mol/L Na2CO3溶液中,下列等量关系正确的是()A. c(OH-)= c(H+)+ c(HCO3-)+ c(H2CO3)B. 2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3)C. c(Na+)+ c(OH-)= c(H+)+ 2c(CO32-)+ 3c(HCO3-)+ 4c(H2CO3)D. c(Na+)+ c(H+)=c(HCO3-)+ c(CO32-)+ c(OH-)思路导航:由质子守恒知:A项正确的是c(OH-)= c(H+)+ c(HCO3-)+ 2c(H2CO3),由物料守恒知:B项正确的是c(Na+)= 2c(CO32-)+ 2c(HCO3-)+ 2c(H2CO3),由质子守恒和物料守恒联合推出C项正确,由电荷守恒知:D项正确的是c(Na+)+ c(H+)=c(HCO3-)+ 2c(CO32-)+ c(OH-)。
答案:C【总结提升】快速书写质子守恒的方法:第一步:确定溶液的酸碱性,溶液显酸性,把氢离子浓度写在左边,反之则把氢氧根离子浓度写在左边。
第二步:根据溶液能电离出的离子和溶液中存在的离子,来补全等式右边。
具体方法是,判断溶液能直接电离出的离子是什么。
然后选择能电离产生氢离子或者水解结合氢离子的离子为基准,用它和它电离或者水解之后的离子(这里称为对比离子)做比较,是多氢还是少氢,多N个氢,就减去N倍的该离子(对比离子)浓度。
少N个氢离子,就加上N倍的该离子(对比离子)。
如碳酸氢钠溶液(NaHCO3)显碱性,所以把氢氧根离子浓度写在左边。
首先,判断出该溶液直接电离出的离子是钠离子和碳酸氢根,而能结合氢离子或电离氢离子的是碳酸氢根。
其次,以碳酸氢根为基准离子(因为碳酸氢钠直接电离产生碳酸氢根和钠离子,而钠离子不电离也不水解。
)减去它电离之后的离子浓度,加上它水解生成的离子浓度。
便是:c(OH-)=c(H2CO3)-c(CO32-)+c(H+)例题1(广东理综)对于0.1 mol·L-1的Na2SO3溶液,下列选项正确的是()A. 升高温度,溶液pH降低B. c(Na+)=2c(SO2-3)+c(HSO-3)+c(H2SO3)C. c(Na+)+c(H+)=2c(SO2-3)+2c(HSO-3)+c(OH-)D. 加入少量NaOH固体,c(SO2-3)与c(Na+)均增大思路导航:溶液中存在亚硫酸根离子的水解平衡和水的电离平衡,温度升高,盐的水解程度增大,pH增大,A错误;B项是物料守恒,但钠离子的浓度是后面三种离子浓度和的2倍,故错误;C项是电荷守恒,亚硫酸氢根离子浓度不能乘以2;D项加入氢氧化钠,钠离子浓度增大,氢氧根离子的浓度增大,亚硫酸根离子的水解平衡左移,亚硫酸根离子的浓度也增大。
答案:D例题2(全国卷)用0.10 mol·L-1的盐酸滴定0.10 mol·L-1 的氨水,滴定过程中不可能出现的结果是()A. c(NH4+)>c(Cl-),c(OH-)>c(H+)B. c(NH4+)=c(Cl-),c(OH-)=c(H+)C. c(Cl-)>c(NH4+),c(OH-)>c(H+)D. c(Cl-)>c(NH4+),c(H+)>c(OH-)思路导航:溶液中不可能出现阴离子均大于阳离子的情况,不遵循电荷守恒,故C项错。
答案:C精美句子1、善思则能“从无字句处读书”。
读沙漠,读出了它坦荡豪放的胸怀;读太阳,读出了它普照万物的无私;读春雨,读出了它润物无声的柔情。
读大海,读出了它气势磅礴的豪情。
读石灰,读出了它粉身碎骨不变色的清白。
2、幸福幸福是“临行密密缝,意恐迟迟归”的牵挂;幸福是“春种一粒粟,秋收千颗子”的收获. 幸福是“采菊东篱下,悠然见南山”的闲适;幸福是“奇闻共欣赏,疑义相与析”的愉悦。
幸福是“随风潜入夜,润物细无声”的奉献;幸福是“夜来风雨声,花落知多少”的恬淡。
幸福是“零落成泥碾作尘,只有香如故”的圣洁。
幸福是“壮志饥餐胡虏肉,笑谈渴饮匈奴血”的豪壮。
幸福是“先天下之忧而忧,后天下之乐而乐”的胸怀。
幸福是“人生自古谁无死,留取丹心照汗青”的气节。
3、大自然的语言丰富多彩:从秋叶的飘零中,我们读出了季节的变换;从归雁的行列中,我读出了集体的力量;从冰雪的消融中,我们读出了春天的脚步;从穿石的滴水中,我们读出了坚持的可贵;从蜂蜜的浓香中,我们读出了勤劳的甜美。