蔗糖酶的分离提纯及酶促(精)
- 格式:ppt
- 大小:498.50 KB
- 文档页数:55

蔗糖酶的分离提纯【实验目的】1.了解蔗糖酶分离提纯的方法。
2.掌握离心技术、电泳技术、层析技术、膜分离技术和分光光度法。
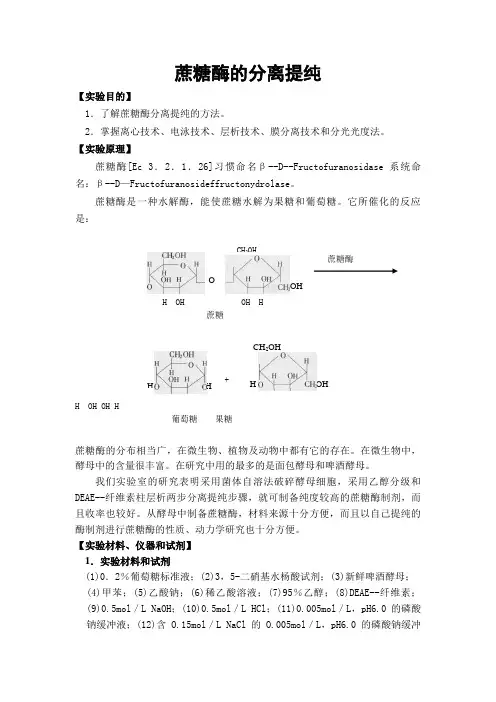
【实验原理】蔗糖酶[Ec 3.2.1.26]习惯命名β--D--Fructofuranosidase 系统命名:β--D —Fructofuranosideffructonydrolase 。
蔗糖酶是一种水解酶,能使蔗糖水解为果糖和葡萄糖。
它所催化的反应是:H OH OH H蔗糖+H OH OH H葡萄糖 果糖蔗糖酶的分布相当广,在微生物、植物及动物中都有它的存在。
在微生物中,酵母中的含量很丰富。
在研究中用的最多的是面包酵母和啤酒酵母。
我们实验室的研究表明采用菌体自溶法破碎酵母细胞,采用乙醇分级和DEAE--纤维素柱层析两步分离提纯步骤,就可制备纯度较高的蔗糖酶制剂,而且收率也较好。
从酵母中制备蔗糖酶,材料来源十分方便,而且以自己提纯的酶制剂进行蔗糖酶的性质、动力学研究也十分方便。
【实验材料、仪器和试剂】 1.实验材料和试剂(1)0.2%葡萄糖标准液;(2)3,5-二硝基水杨酸试剂;(3)新鲜啤酒酵母; (4)甲苯;(5)乙酸钠;(6)稀乙酸溶液;(7)95%乙醇;(8)DEAE--纤维素;(9)0.5mol /L NaOH ;(10)0.5mol /L HCl ;(11)0.005mol /L ,pH6.0的磷酸钠缓冲液;(12)含O.15mol /L NaCl 的O.005mol /L ,pH6.0的磷酸钠缓冲CH 2OHH OHHHOHCH 20H液;(13)5%蔗糖;(14)测定蛋白质浓度试剂;(15)聚丙烯酰胺凝胶电泳试剂2.仪器(1)恒温水浴;(2)烧杯、量筒、移液管、容量瓶、玻棒;(3)冰盐浴;(4)离心机;(5)721型分光光度计;(6)柱层析装置;(7)天平;(8)pH计; (9)滴管、试管和血糖管;(10)秒表【实验操作】一、葡萄糖浓度标准曲线的制作1.取10支血糖管,按下表加入0.2%葡萄糖溶液、水及3,5一二硝基水上述试剂混匀后,在沸水浴中加热5min,取出立即冷却,以蒸馏水稀释至25mL,摇匀,于540nm测光密度。



实验一、蔗糖酶的提取及粗分离
1. 蔗糖酶的用途,研究蔗糖酶的意义?蔗糖酶(Sucrase , EC 3.
2. 1. 26)叉称转化酶(Invertase)。
可作用于B-1 , 2糖苷键,将蔗糖水解为n葡萄糖和n果糖。
由于果糖甜度高,约为蔗糖的1. 36〜1. 60 倍,在工业上具有较高的经济价值‘“。
可用以转化蔗糖,增加甜味,制造人造蜂蜜,防止高浓度糖浆中的蔗糖析出,
制造含果糖和巧克力的软心糖,还可为果葡糖浆的工业化生产提供新的方法。
10分
2. 蔗糖酶有哪些性质?包括酶的适用pH和温度、等电点等。
蔗糖酶的最适温度为45 °C
~50 C,最适ph为4.0~4.5。
CuCl:对蔗糖酶有激活作用,而AgC]对蔗糖酶则其抑制作用,NaCI,KCI,FeSQ对蔗糖酶活性无明显作用,但相对活力都保持在70 %以上。
等电点5.6
10分
3. 蔗糖酶存在于什么材料中?你选择哪种材料来提取?为什
么?10分
4 .蔗糖酶属于胞内酶,提取前需要破壁,破壁方法有哪些?15分
5 .蔗糖酶提取溶剂如何选择?为什么?10分
7.蛋白质的粗分离方法有哪些?各有什么优缺点?如何选择?25
分
实验二、蔗糖酶的层析分离(一)
一、实验目标
根据初步纯化以后的样品性质选择一种柱层析方法进行纯化,目
标是纯化效果好,回收率高。
二、导学问题
1蛋白质层析分离方法有哪些?10分
1蛋白质层析分离方法有哪些?10分
2 .各测定方法的原理?20分。

(一)蔗糖酶的提取与部分纯化一、实验目的:学习酶的纯化方法,并为动力学实验提供一定量的蔗糖酶。
二、试剂:1. 啤酒酵母2. 二氧化硅3. 甲苯(使用前预冷到0℃以下)4. 去离子水(使用前冷至4℃左右)5. 冰块、食盐6. 1N乙酸7. 95%乙醇三、仪器:1. 研钵1个2. 离心管3个3. 滴管3个4. 量筒50ml 1个5. 水浴锅1个6. 恒温水浴7. 烧杯100ml 2个8. 广泛pH试纸9. 高速冷冻离心机四、操作步骤:1. 提取(1)准备一个冰浴,将研钵稳妥放入冰浴中。
(2)称取5g干啤酒酵母和20g湿啤酒酵母,称20mg蜗牛酶及适量(约10g)二氧化硅,放入研钵中。
二氧化硅要予先研细。
(3)量取预冷的甲苯30ml缓慢加入酵母中,边加边研磨成糊状,约需60分钟。
研磨时用显微镜检查研磨的效果,至酵母细胞大部分研碎。
(4)缓慢加入预冷的40ml去离子水,每次加2ml左右,边加边研磨,至少用30分钟。
以便将蔗糖酶充分转入水相。
(5)将混合物转入两个离心管中,平衡后,用高速冷离心机离心,4℃,10000rpm,10min。
如果中间白色的脂肪层厚,说明研磨效果良好。
用滴管吸出上层有机相。
(6)用滴管小心地取出脂肪层下面的水相,转入另一个清洁的离心管中,4℃,10000rpm,离心10min。
(7)将清液转入量筒,量出体积,留出1.5ml测定酶活力及蛋白含量。
剩余部分转入清洁离心管中。
(8)用广泛pH试纸检查清液pH,用1N乙酸将pH调至5.0,称为“粗级分I”。
2. 热处理(1)予先将恒温水浴调到50℃,将盛有粗级分I的离心管稳妥地放入水浴中,50℃下保温30分钟,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,用4℃,10000rpm,离心10min。
(3)将上清液转入量筒,量出体积,留出1.5ml测定酶活力及蛋白质含量(称为“热级分II”)。
3. 乙醇沉淀将热级分II转入小烧杯中,放入冰盐浴(没有水的碎冰撒入少量食盐),逐滴加入等体积预冷至-20℃的95%乙醇,同时轻轻搅拌,共需30分钟,再在冰盐浴中放置10分钟,以沉淀完全。


蔗糖酶的提取、分离、纯化及活性检测摘要随着分子生物学的发展,不论对酶分子本身作用机制的研究还是其他研究,越来越需要纯度更高的酶制剂,这就要求我们熟悉酶提纯的一般操作步骤及酶的提纯及活力测定等重要的生物实验技术。
本次实验主要通过提取啤酒酵母中的蔗糖酶并经过两次纯化测定其活力与Km。
在实验过程中用乙醇分级分离法,DEAE-Cellulose柱层析,分子筛(凝胶过滤)层析提取纯化蔗糖酶。
在实验过程中,虽然我们很努力,但由于我们对实验的程序不熟悉,因此在实验的一些过程中有一些明显的操作失误,使得实验的最后测定结果与理论值有一定出入。
关键词啤酒酵母蔗糖酶乙醇分级分离 DEAE-Cellulose柱层析分子筛层析Km前言生物体内所发生的一切化学反应,几乎都是在专一性酶的催化下进行的,因此酶的研究对了解生命活动的规律以及生命本质的阐述具有十分重要的意义。
随着分子生物学的发展,不论对酶分子本身作用机制的研究以及分子生物学其他重要课题的研究都越来越多地需要使用作用专一,纯度高的酶制剂。
这就要求人们建立各种方法,以便从各种生物来源的材料中分离提纯酶。
由于酶本身也是蛋白质,因此酶分离提存的方法大体上与蛋白质纯化方法相同,一般来说,没有一种固定的方法,而往往根据实验者所要分离提纯酶的取材以及酶本身的物理﹑化学及生物学性质来确定分离提纯方法。
各种酶的纯化通常有五个阶段:①材料的选择与预处理;②细胞破碎;③抽提;④纯化;⑤浓缩﹑干燥及保存。
酶分离纯化成功与否的重要标志:一是要有较高的收率;二是达到所要求的纯度,这两个指标通常是矛盾的,可根据需要来有所侧重,一般来说,好的方法与步骤应该是简单易行,最终的酶制剂有较高的收率和纯度。
就单独的每种分离提纯的方法而言,有盐析法、有机溶剂分级法、调PH分级沉淀法、选择变性法、吸附法、层析法(纸层析、薄板层析、柱层析等)。
其中盐析法是用于蛋白质和酶分离提纯的最早而且最广泛的一种方法,该方法是根据蛋白质和酶在一定浓度的溶液中溶解度的降低程度的不同而达到彼此分离的方法盐析法常用的中性盐有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等,其中用得最多的是硫酸铵,因为它具有温度系数小而溶解度大的优点。

生物化学实验示范报告:实验名称:蔗糖酶的分离提取与纯化实验目的:1.掌握蔗糖酶分离提纯的原理与实验操作方法;2.掌握有机溶剂分级纯化蔗糖酶的原理和操作方法,了解蔗糖酶的离子交换层析法纯化原理;3.掌握酶活、酶比活等基本概念及测定原理、计算和操作方法;4.巩固并熟练掌握Folin法测定牛血清蛋白和3、5 -二硝基水杨酸法测定葡萄糖标准曲线制作方法,并能通过回归方程测定还原糖及蛋白质的含量。
实验原理:蔗糖酶分离提纯原理:酵母中的蔗糖酶含量很丰富,实验以安琪酵母粉为原料,首先采用自溶法破碎细胞壁、再用乙醇分级和DEAE—纤维素柱层析两步分离提纯,制备纯度较高的蔗糖酶制剂。
酶分离提纯的原理与蛋白质的相同。
但酶是有催化活性的蛋白质,在分离提纯过程中必须注意:防止酶变性失活;随时测定酶的比活力,并跟踪酶的去向、衡量酶提纯的程度及得率。
有机溶剂分级纯化蔗糖酶原理:利用不同蛋白质在不同浓度的有机溶剂—乙醇中溶解度的差异将蔗糖酶蛋白与其它蛋白质杂质进行有机溶剂分级沉淀,而使提取的蔗糖酶得以纯化(32%的乙醇饱和度沉淀分离杂蛋白,47.5%的乙醇饱和度沉淀分离酶蛋白)。
操作必须在低温下进行且避免有机溶剂局部过浓;分离后应立刻除去有机溶剂并用水或缓冲溶液溶解沉淀的酶蛋白(复溶),确保酶的活性;pH多选在酶蛋白的等电点附近;有机溶剂在中性盐存在时能增加蛋白质的溶解度减少变性,提高分离效果。
蔗糖酶的离子交换层析法纯化原理:本实验采用DEAE-纤维素(DEAE-C11)微粒状的、弱碱性的阴离子纤维素为柱料,进行蔗糖酶的进一步纯化。
它具有分辨率高、化学性质稳定、有开放性的长链结构、有较大的表面积、对蛋白质的吸附容量大等优点;纤维素上离子基团的数量不多,排列疏散,对蛋白质的吸附不是太牢固,用缓和的洗脱条件即可达到分离的目的,不致引起蛋白质的变性。
蔗糖酶活力与比活的测定:在蔗糖酶的纯化过程中,通过3、5-二硝基水杨酸法测定蔗糖酶催化蔗糖生成还原糖的量,测定酶活力大小,跟踪酶的活力。
蔗糖酶的分离提纯【实验目的】1.了解蔗糖酶分离提纯的方法。
2.掌握离心技术、电泳技术、层析技术、膜分离技术和分光光度法。
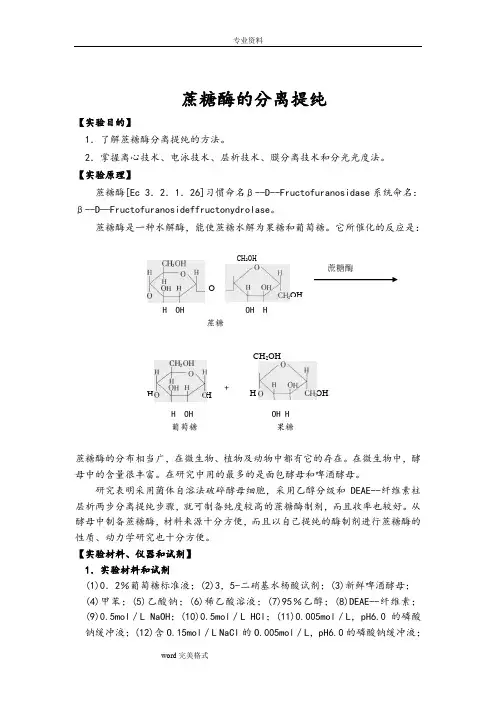
【实验原理】蔗糖酶[Ec 3.2.1.26]习惯命名β--D--Fructofuranosidase 系统命名:β--D —Fructofuranosideffructonydrolase 。
蔗糖酶是一种水解酶,能使蔗糖水解为果糖和葡萄糖。
它所催化的反应是:H OH OH H蔗糖+H OH OH H 葡萄糖 果糖蔗糖酶的分布相当广,在微生物、植物及动物中都有它的存在。
在微生物中,酵母中的含量很丰富。
在研究中用的最多的是面包酵母和啤酒酵母。
研究表明采用菌体自溶法破碎酵母细胞,采用乙醇分级和DEAE--纤维素柱层析两步分离提纯步骤,就可制备纯度较高的蔗糖酶制剂,而且收率也较好。
从酵母中制备蔗糖酶,材料来源十分方便,而且以自己提纯的酶制剂进行蔗糖酶的性质、动力学研究也十分方便。
【实验材料、仪器和试剂】 1.实验材料和试剂(1)0.2%葡萄糖标准液;(2)3,5-二硝基水杨酸试剂;(3)新鲜啤酒酵母; (4)甲苯;(5)乙酸钠;(6)稀乙酸溶液;(7)95%乙醇;(8)DEAE--纤维素;(9)0.5mol /L NaOH ;(10)0.5mol /L HCl ;(11)0.005mol /L ,pH6.0的磷酸钠缓冲液;(12)含O.15mol /L NaCl 的O.005mol /L ,pH6.0的磷酸钠缓冲液;CH 2OHH OHHHOHCH 20H(13)5%蔗糖;(14)测定蛋白质浓度试剂;(15)聚丙烯酰胺凝胶电泳试剂2.仪器(1)恒温水浴;(2)烧杯、量筒、移液管、容量瓶、玻棒;(3)冰盐浴;(4)离心机;(5)721型分光光度计;(6)柱层析装置;(7)天平;(8)pH计;(9)滴管、试管和血糖管;(10)秒表【方法】一、葡萄糖浓度标准曲线的制作1.取10支血糖管,按下表加入0.2%葡萄糖溶液、水及3,5一二硝基水杨上述试剂混匀后,在沸水浴中加热5min,取出立即冷却,以蒸馏水稀释至25mL,摇匀,于540nm测光密度。

蔗糖酶的提取、分离、纯化及活性检测蔗糖酶是一种能够催化蔗糖水解反应的酶,广泛存在于生命体内,具有重要的应用价值。
本文主要介绍了蔗糖酶的提取、分离、纯化及活性检测方法。
一、蔗糖酶的提取1、选择合适的菌株:蔗糖酶广泛存在于细菌、真菌、植物和动物等生物体中,但不同菌株对蔗糖酶的产生能力存在差异,因此需要根据实际需求选择产酶能力较高的菌株。
2、液态培养:选用适宜的培养基和培养条件,促进菌株生长和蔗糖酶的合成。
一般情况下,最佳培养条件为温度在35℃左右,pH值为7.0左右,培养时间为24-48小时。
3、离心沉淀:将菌液离心,取上清液即为蔗糖酶提取液。
1、离子交换层析:通过调节液相pH值,利用离子交换材料对蔗糖酶进行吸附、洗脱和分离。
2、凝胶过滤层析:利用凝胶材料对蔗糖酶进行筛分,分离出不同分子量的蔗糖酶。
3、亲和层析:在固相材料上引入亲和基团,用于特异性地吸附蔗糖酶,洗脱和分离目标蛋白。
1、透析:通过半透膜对蔗糖酶真空透析,去除杂质。
2、浓缩:利用超滤膜对蔗糖酶进行浓缩。
3、电泳:运用电泳等方法对混合蛋白进行分离和分析,以实现蔗糖酶的纯化。
蔗糖酶的活性检测方法多种多样,以下介绍其中几种常见的方法。
1、邻苯二甲酸法:通过对邻苯二甲酸恒量反应条件下,测量比色产物的吸光度来检测蔗糖酶的活性。
2、甲酚磺酸法:测量甲酚磺酸转化为带电离子的速率,来判断蔗糖酶活性的多少。
3、蔗糖酶显色法:在蔗糖酶的作用下,蔗糖水解生成葡萄糖和果糖,再利用淀粉-碘酒作为指示剂,显色程度来反映蔗糖酶的活性。
总结:蔗糖酶是一种重要的酶类,在生命科学和工业生产等领域具有广泛应用。
其提取、分离、纯化及活性检测方法多种多样,需要根据不同的实验条件和需求来选择合适的方法。