- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 三.
相变过程:
• 1. 平衡相变:
S=∫0T(熔) (Cp(s)/T)dT+H熔/T熔+ ∫T(熔)T(沸)(Cp(l)/T)dT+H沸/T沸+ ∫T(沸)T (Cp(g)/T)dT
• G=0 • S=H/T • 2. 非平衡相变: 需设计一可逆过程 • • 求G时尽可能设计等温变压可逆过程.
• 熵判据从原理上虽然可以解决一切自然过程 的方向和限度问题, 但使用起来殊不方便, 为 了热力学判据使用的方便, 人们由熵函数发展 出吉布斯自由能(Gibbs free energy,用于等 压过程方向的判断).
• W:宏观状态拥有的微观运动状态的数量
• k:Boltzmann常数
• W的值愈大,体系混乱程度愈高。 • 熵是体系混乱度的量度。 • 孤立体系的熵只增不减意味着体系 的混乱度只增不减。
3
2014/7/8
• 对于恒温恒压过程: • dS-Q/T≧0 (熵判据) • dU= Q+W Q= dU+pdV-Wf • dS-dU/T-pdV/T+Wf/T≧0 两边同乘以T • TdS-dU-pdV≧-Wf • d(TS)-dU-d(pV) ≧ -Wf ∵dT=0 dp=0 • •
理想气体,等容过程 理想气体,等压过程
• 对于只涉及处于内部平衡态之纯物质的等温 过程, 其熵变随温度同趋于零.
• 物质在绝对零度附近时, 许多性质将发生根本性的变化:
• 热胀系数趋于零 • 等压热容与等容热容将相同 • 物质的热容在绝对零度时将趋于零
等压变温
• 由热力学第三定律所求得的物质的熵称为规定熵. • 以前曾将规定熵称为绝对熵, 对考虑到人们对自然的认识是有 限的, 随着科学的发展, 人类可能对熵有更深刻地认识, 故改称 为规定熵. • 规定熵可用热化学方法测定得到, 也可由统计热力学理论直接 计算得到. 规定熵的求算方法为: • S=∫0T Q/T • =∫0T (Cp/T)dT (2) • 上式表明 , 只要获得物质从 0K开始的等压热容的数据即可得 到物质的熵. 若物质在0~T温度区间有相的变化, 则需要将相 变的熵变加和进去. 如气体的熵可由下式求得: •
吉布斯自由能变化与化学反应
化学反应均在恒温恒压下进行 , 因而只要 求算某化学反应的吉布斯自由能的变化。 吉布斯自由能在化学领域中具有极其广泛 的应用,即可由其数值的符号来判断反应的方 向和限度。 对于恒温恒压的可逆过程: (dT=0, dp=0) G=Wf 对于电化学反应过程, 可由G求出电池电动势: G=-nFEr
多组分体系热力学
H2O(g), 298K 760mmHg
G
H2O(l), 298K 760mmHg
一. 偏摩尔量(partial molar quantity): 物质的纯组分的性质与当其与其它物质形 成溶液等多组分体系时, 有许多性质会发生变 化. 如体积等. 例如:50ml的水和50ml的乙醇混 合, 溶液的体积不是简单的加和, 而只有约96ml.
• 实际体系不可能为真正的绝热体系或孤 立体系, 但若将环境的熵变也一起考虑, 体系加环境可视为孤立体系, 所以有: •
理想溶液的混合过程
返回
(dS)体系+(dS)环境≧0 (S)环境=-Q实/T环
返回
• 环境熵变的计算公式: •
• 熵的微观意义(Boltzmann 熵定理 ): •
S=klnW
吉布斯自由能
• 在相同高温热源(T2)和低温热源(T1)间工作的热 机,其效率不可能超过卡诺热机,且所有可逆热机 的效率()均相等,为:
大脑的功率
• The total energy consumption of the brain is about 25 watts *.
* Principles of Neural Science, by Eric R. Kandel and James H. Schwartz, 2nd edition, Elsevier, 1985.
18-25岁基础代谢率最高 25岁以后,基础代谢率每十年约下降5-10% 五十岁时,基础代谢率降低了15-30%(身材逐渐走样的原因)
心脏的功率估算
假设心脏1分钟使6 L血液在体内循环一次,血压平均值 1.5×104帕(112mmHg),心跳每分70次,人心脏工作的 平均功率为多少? 压力:F=pA A为血管截面积,p为血压。 此压力由心脏提供,所以心脏一分钟内收缩做功为: W=Fh=pAh=pV 则心脏的功率 P=W/t=pV/t=pV/t = 1.5×104 ×6×10-3 m3/60 = 1.5W
克劳修斯不等式: dS≧Q/T “=”时为可逆过程; “>”为不可逆(自发)过程; “<”为不可能过程。
2
2014/7/8
• 对于绝热体系: Q=0 • • • 或: ∴ dS≧Q/T=0
dS≧0 (绝热体系)
(dS)孤立≧0
• 上式为熵判别式, 是热力学上第一个判 别式, 也是最重要的判别式. • 上式也称为熵增原理
G1 G2
G3
H2O(l), 298K 23.76mmHg
H2O(g), 298K 23.76mmHg
• • • •
G= G1+ G2+ G3 =RTln(p2/p1) + 0 + Vm(H2O)(p2-p1) =-8585.6+1.766=-8583.8 J<0 ∵ G<0, 此过程是一自发过程.
• • • •
功可以无条件地全变为热; 热不能无条件地全变为功。 热量自发地从高温物体传给低温物体; 不可能自发由低温物体流向高温物体。
• 能满足以上要求的热力学函数就是:
熵 (entropy) • • 熵函数可以定量的确定化学反应及其 它任何过程进行的方向与限度。
1
2014/7/8
• 熵: 体系熵变等于可逆过程的热温商之和. • S= Qr/T • 卡诺定理:
• 一 自然界的自发过程:
• 我们周围的自然界所发生的过程都是自发进行的, 如:
• 化学过程: • • • • H2+0.5O2=H2O C+O2=CO2 2Fe+1.5O2=Fe2O3 N2+3H2=2NH3
• • • •
水 电 热 风
流 流 流 流
高处 → 低处 高压 → 低压 热处 → 冷处 高压 → 低压
=1-T1/T2
各年龄基础代谢值(BMR)
• 人若是以热机方式工作,体温37oC,环 境温度以20oC计,最大效率为: • =1-T1/T2 • =1–293.15/310.15 • =5.48% • 以每天食物摄入量为2000千卡计,人的 功率为 • 2000 1034.184 5.48%/(24 60 60)=5.3 瓦
年龄 7-9 10-12 13-15 16-19 20-24 25-34 35-54 55-69 70~
男性(Kcal/kg/min) 0.0295 0.0244 0.0205 0.0183 0.0167 0.0159 0.0154 0.0151 0.0145
女性(Kcal/kg/min) 0.0279 0.0231 0.0194 0.0168 0.0162 0.0153 0.0147 0.0144 0.0144
dG= -SdT+Vdp G=∫Vdp =V(p2-p1)
(假设密度与压力无关)
•
热力学第三定律
limT→0KS=0
二. 变温过程: U=CV T H=CpT dG= -SdT+Vdp G=∫-SdT =(H-TS)= H- (TS)
理想气体熵变
• 普朗克于1912年提出物质在绝对零度时的熵等于零. • • 热力学第三定律的表述为:
• Gibbs关系式(了解) :
• • • •
dU=TdS-pdV dH=TdS+Vdp dF=-SdT-pdV dG=-SdT+Vdp
H=U+pV F=U-TS G=H-TS
4
2014/7/8
• 热力学主要关系式(了解) :
•
热力学函数值的计算
一. 等温过程: 理想气体: U=0 , H=0 凝聚体系: G=(H-TS) =(U+pV-TS)
2014/7/8
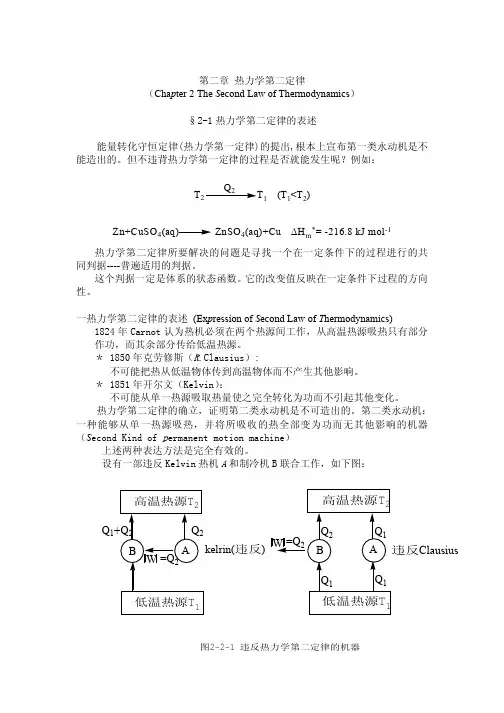
• 热力学第二定律是决定自然界一切过 程方向与限度的基本规律.
• Clauxius表述:
物理化学 热力学第二定律
(变化)
• 不可能使热量从低温物体流向高温 物体而无其它变化.
• Kelvin表述:
• 不可能从单一热源取出热使之完全 变为功而无其它变化. • 第二类永动机不可能.
热力学第二定律
(3)
5
2014/7/8
• 例: 已知298K下水的p*=23.76mmHg, 试计算298K, 1atm下的水蒸汽变为同温同压下的液态水的G? • 解: 此为一非平衡相变, 特设计下列可逆过程:
H2O(g), 298K 760mmHg
C6H6(l) 268.15K S1 C6H6(l) 278.65K
V总n1V*m,1 + n2V*m,2
V*m,1为纯i的摩尔体积。
例: 求-5℃下, 液态苯凝结的S?
已知: T平衡相变=5.5℃; Hm(熔)=9916J.mol-1; -5℃下的相变热为9847 J.mol-1; Cp,m(l)=126.8 J.K-1.mol-1; Cp,m(s)=122.6 J.K-1.mol-1.
• 热力学三大判别式:
• • • • • • • • • • • (S)孤≧0 >0: 为自发过程 =0: 可逆过程 <0: 不可能过程
(dT=0, dp=0, Wf=0) 自发过程 (G)T,p<0 =0 (dT=0, dp=0, Wf=0) 平衡,可逆 >0 (dT=0, dp=0) 不自发不可逆过程 >Wf,R (dT=0, dp=0) 不可能过程 (dT=0, dV=0, Wf=0) 自发过程 (F)T,V <0 =0 (dT=0, dV=0, Wf=0) 平衡,可逆 >0 (dT=0, dV=0) 不自发不可逆过程 >Wf,R (dT=0, dV=0) 不可能过程