高一化学电子式_结构式的书写方法
- 格式:ppt
- 大小:632.50 KB
- 文档页数:32
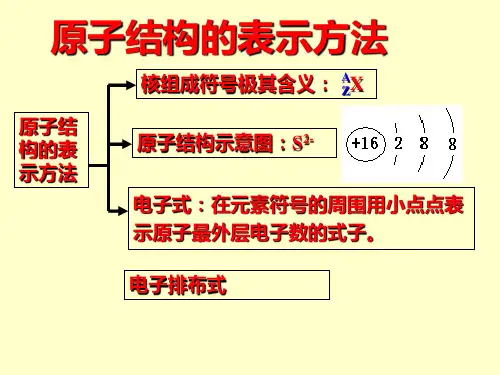

高一电子式及化学方程式、离子方程式书写一、如何正确书写电子式对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下: 1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的 最外层电子②例子:钠原子 ;镁原子 ;氟原子 2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+ (2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成, 但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出F N H H HH F S 2– Cl Na + Na Mg H H O O K + S 2– K + K 2+ S 2–O – H两原子之间的共用电子对情况②例子:HCl的电子式为;CO2的电子式:③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H2的形成过程+NaCl的形成过程+K2S的形成过程 2 +注意:①用“→”表示形成过程,不用“=”;②“→”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“→”右边是该物质的电子式, 相同的原子不可以合并用电子式表示物质的形成过程①离子化合物的形成过程形成用“→”表示,形成之前为原子的电子式并用弯箭头表示电子得失,形成之后为离子化合物的电子式。

中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程常见的20种电子式N 2N N O 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2H O O HCO 2 O C O HclO H O Cl NH 3H N H H PCl 3 Cl P Cl Cl CH 4H H C H H CCl 4 Cl C Cl Cl Cl NaOH O H 〔 〕-Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -NH 4Cl+ - CaC 2 Ca 2+ 2- ClCl H H N H H Cl C C-CH 3 —OH如何正确书写电子式(李运强 湖北省大悟县第一中学高一化学组 432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式 ①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 ) (2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况②例子:HCl 的电子式为;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 +NaCl 的形成过程 + HH C H HO F N H HH H F S2– Cl Na + Na Mg H H O OK + S 2– K + Cl H C O O K 2+ S2– O – H H HH H Na Cl Cl Na +K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
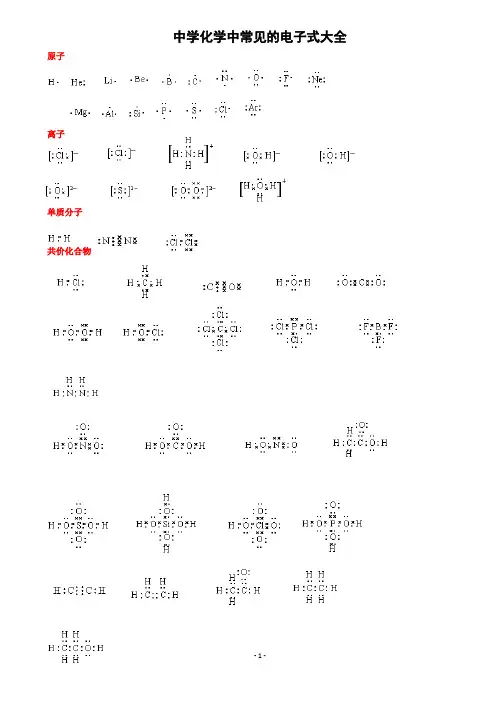
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程常见的20种电子式N 2N NO 2 O O Cl 2 Cl Cl H 2O H O H H 2O 2H O O H CO 2 O C O HclO H O ClNH 3 H N H H PCl 3 Cl P Cl Cl CH 4H H C H H CCl 4 Cl C Cl Cl ClNaOH O H 〔 〕-Na + Na 2O 2 O O Na + 2-Na + MgCl 2 -Mg 2+ -Cl H N HHNH 4Cl+ - CaC 2 Ca 2+ 2- -CH 3 —OH如何正确书写电子式(李运强 湖北省大悟县第一中学高一化学组 432800)对于电子式的书写和判断正误是高考试题中常涉及到的一个知识点,现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“· ”或“×”标出它的最外层电子②例子:钠原子 ;镁原子 ;氟原子2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示②例子:钠离子 Na + ;镁离子 Mg 2+ ;钡离子 Ba 2+(2)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷 ②例子:硫离子 ;氟离子 (3)原子团的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子 ;氢氧根离子 3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:氢气分子 ;氧气分子③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He 除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:NaCl 的电子式为 ;K 2S 的电子式为 ,(不能写成 )(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况ClCl C C HH C H HO F N H H H H FS 2– Cl Na + Na Mg H H O OK + S 2– K + K 2+ S 2– O – H②例子:HCl 的电子式为 ;CO 2的电子式: ③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H 2的形成过程 + NaCl 的形成过程 + K 2S 的形成过程 2 +注意:①用“ → ”表示形成过程,不用“=”;②“ → ”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“ → ”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。

物质结构元素周期律1、4Li + O 2--------- 2Li2 O 4Na+O= 2Nc fe O 2Na+O 2------------- N aQ22Na+2H 2O===2NaOH+H 2 f 2K+2H 2O===2KOH+H 2 f 2、卤素单质与氢气反响(条件、现象不同)F2 + H 2 === 2HF C12 + H 2 === 2HCl B Q + H 2 === 2HBr I2 + H 2 === 2HI 3、卤素单质间的置换反响:(1)CI2可以从溴化物(或碘化物)中置换出B「2 (或12):①Cl2+2NaBr=Br 2+2NaCI ② Cb+2KI=I 2+2KCI(2) Br2可以从碘化物中置换出I2 :Br2+2KI=I 2+2KBr 4、Mg+2H 2O === Mg(OH) 2+H 2f(沸水)2AI+6HCI===2AICI 3+3H 2 f Mg+2HCI :===MgCI 2+ H 2 f 5Cl£+£Ma gUad第二章化学反响与能量1、Ba(0H)2 • 8H2O+2NH 4CI==BaCl2+2NH 3 f +10H2O NaOH+HCI==NaCI+H 2O2、原电池原理(1)概念:原电池是把化学能转变成电能的装置(2)典型的原电池(Zn-Cu原电池)负极(锌):Zn-2e=Zn 2+(氧化反响) 正极(铜):2H++2e =H 2 f (复原反响) 电子流动方向:由锌经过外电路流向铜。
总反响离子方程式:Zn+2H +=Zn 2++H 2 f 催化剂3、2HQ= △ 2HzO+Q f4、2C + 0 2空2CO Fe2O3 + 3C0 局丘2Fe + 3CO2第三章有机化合物1、甲烷的主要化学性质(1)氧化反响占燃CH 4(g)+2O 2(g)占燃CO2(g)+2H 2O(I) (2)取代反响n—C—村亠LAjY:厶H—c—Cl + H^ C| (I)r【H CJ14 + Cl£—亠cn3ci + nciI t…光"CH^C1£斗Cl2——> CHC13-1- MCI CRjCl 4- 4- HC1I , 光亠小卄+ Cl2—-* CCI4 十HC1⑶聚合反响::;-r/・::.|(1)氧化反响(2)取代反响①②苯与硝酸(用状液体硝基苯。

高一化学必修一第四章第三节化学键【考纲要求】1.了解化学键、离子键、共价键的定义。
2.了解离子键、共价键的形成;理解化学反应的本质。
3.了解分子间作用力与氢键。
4.学会用电子式表示常见的物质及形成过程。
【考点梳理】考点一:化学键1.定义:使离子或原子相结合的强烈的相互作用力称为化学键。
化学键包括离子键、共价键等。
2.离子键与共价键的比较键型离子键共价键概念带相反电荷离子之间的相互作用原子之间通过共用电子对所形成的相互作用成键方式通过得失电子达到稳定结构通过形成共用电子对达到稳定结构成键粒子阴、阳离子原子成键性质静电作用静电作用形成条件大多数活泼金属与活泼非金属化合时形成离子键同种或不同种非金属元素化合时形成共价键(稀有气体元素除外)表示方法①电子式如②离子键的形成过程:①电子式,如②结构式,如H—Cl③共价键的形成过程:存在离子化合物绝大多数非金属单质、共价化合物、某些离子化合物考点二:极性共价键与非极性共价键的比较共价键极性共价键非极性共价键定义不同元素的原子形成的共价键,共用电子对偏向吸引电子能力强的原子一方。
同种元素的原子形成共价键,共用电子对不发生偏移。
原子吸引电子能力不相同相同成键条件不同种非金属元素的原子同种非金属元素的原子存在共价化合物,某些离子化合物中非金属单质,某些化合物中实例H—Cl H—H、Cl—Cl共价键一般是在非金属元素的原子之间,但某些金属元素和非金属元素间也可能存在共价键,如AlCl3等。
考点三:离子化合物与共价化合物的比较离子化合物共价化合物概念以离子键形成的化合物以共用电子对形成的化合物粒子间的作用阴离子与阳离子间存在离子键原子之间存在共价键导电性熔融态或水溶液导电熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)熔化时破坏的作用力一定破坏离子键,可能破坏共价键(如NaHCO3)一般不破坏共价键实例强碱、大多数盐、活泼金属的氧化物中酸、非金属的氢化物、非金属的氧化物中要点诠释:离子化合物和共价化合物的判断方法(1)根据化学键的类型判断凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,是共价化合物。

中学化学中常见的电子式大全原子 离子 单质分子 共价化合物 离子化合物 形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为OO H O ClH Cl OMg 2+ Cl 2Mg 2+NMg 2+NMg 2+3–3–+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。

中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O带部分负电荷,因此的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 价,的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。



电子式的书写及分子间作用力【学习目标】1、掌握离子化合物、共价分子电子式的书写2、掌握范德华力及氢键对物质性质的影响【主干知识梳理】一、电子式的概念及书写技巧1、电子式的概念:在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子【微点拨】元素符号周围标明元素原子的最外层电子,每个方向不能超过2个电子。
当最外层电子数小于或等于4时以单电子分布,多于4时多出部分以电子对分布2、电子式的书写(1)原子的电子式:书写主族元素原子的电子式,直接用“·”或“×”把最外层电子一一表示出来即可氢原子氯原子氮原子钠原子氧原子钙原子(2)简单阳离子(单核)的电子式:简单阳离子的电子式就是离子符号本身,不需标示最外层电子钠离子锂离子镁离子铝离子Na+Li+Mg2+Al3+(3)简单阴离子(单核)的电子式:在书写电子式时,不但要表达出最外层所有电子数(包括得到的电子),而且还应用“[]”括起来,并在“[]”右上角标出“n-”以表示其所带的电荷Cl—O2—S2—N3—(4)原子团的电子式:作为离子的原子团,无论是阴离子,还是阳离子,不仅要画出各原子最外层的电子,而且都应用“[]”括起来,并在“[]”右上角标明电性和电量NH4+H3O+OH—O22—S22—C22—(5)离子化合物的电子式:离子化合物的电子式由阳离子的电子式和阴离子的电子式组成的,对于化合物是由多种离子组成的物质,相同离子间要隔开排列,注意相同的离子不能合并CaO K2S CaF2NaOH NaHCaC2Na2O2FeS2NH4Cl NH5Mg3N2Na3N Al2S3(6)离子键的形成(离子化合物的形成过程):离子键的形成用电子式表示式时,前面写出成键原子的电子式,后面写出离子化合物的电子式,中间用一箭头“→”连起来即可,如:(7)共价化合物的电子式(共价分子):共价化合物分子是由原子通过共用电子对结合而形成的,书写电子式时,应把共用电子对写在两成键原子之间,然后不要忘记写上未成键电子结构式:用一根短线表示一对共用电子对的式子叫做结构式。
中学化学中常见的电子式大全原子离子单质分子共价化合物子的 Cl离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质; 对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查 热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电 排布,而只能靠O记忆、知识积累来处理这一类问题,错 误率较高,Mg 2+ 如将氧原子的电子式写成(正确应为 )。
典型错误归纳有以下两类: 一、无法正确排列微粒中原子或离子的顺序。
例如 HClO 的电子式写成:; MgCl 2 的电子式写成:。
二、不能正确表达共价键的数目。
例如混淆O2和H 2O2中氧原子间的共用电子对数目。
针对以上问题,笔差很小的非 或 性 氧 , 出式中 Mg 为+2 价,N 为-3 价,根 化 者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原) 子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为 HClO ,但 根据 H 、Cl 、O 个三原子的 ( 电负性)差异可知该分子中 H 、Cl 带部分正电荷,O 带部分负电荷,因此 HClO 的电子式应为:。
对于离子化合物Mg 3N 2,先可判断 Mg 2+Mg 2+Mg 2+据“异性相吸、电荷交叉”的规律其电子式为。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如 MgCl 2 由 Mg 2+和 Cl -以 1:2 的比例构成,Na 2O 2 由 Na +和 O 22-以 2:1 的比例构成。
而对于共价微粒、只有少数氧化性(电 负性)相 H C N 金属原子形成的共价体有例外,例如 HCN (其中 C 为+4 价、N为-3 价,电子式为 )。
化学高一电子式知识点总结归纳高一化学电子式知识点总结归纳化学是一门重要的科学学科,而其中的电子式知识点更是我们在学习化学的过程中必不可少的部分。
掌握好电子式的相关概念和应用,对于我们理解化学反应、化学键以及化学分子结构等方面都具有重要的意义。
本文将对高一化学中的电子式知识点进行总结归纳,以帮助大家更好地掌握这一部分内容。
一、电子式的基本概念电子式是描述化学物质中电子分布的符号表示方式。
它由化学符号组成,可显示原子核、电子轨道及轨道中的电子数目。
常用的电子式包括电子层式、电子构型式和点阵式等。
下面我们分别对这几种常见的电子式进行介绍。
1.1 电子层式电子层式是以主、次、轨道的形式表示原子电子层的分布情况。
例如,氧元素的电子层式可以表示为1s²2s²2p⁴,其中1s²表示1s轨道上有两个电子,2s²表示2s轨道上有两个电子,2p⁴表示2p轨道上有四个电子。
1.2 电子构型式电子构型式是用元素的周期表位置和填充原理来表示电子层的分布情况。
例如,氧元素的电子构型式可以表示为1s²2s²2p⁴,与电子层式是相同的。
1.3 点阵式点阵式是用方格或圆点等图形来表示原子中的电子分布情况,通常用于辅助理解电子层的排布。
例如,氧元素可以用点阵式表示为下图所示:(图省略)二、电子式在化学反应中的应用电子式不仅可以描述原子、离子和分子的电子分布情况,还可以在化学反应中帮助我们理解反应过程和反应产物的生成。
下面我们来看几个例子。
2.1 化学键的形成在化学键的形成过程中,电子式可以显示出相关原子之间电子的转移或共享情况。
例如,氯化钠的生成可以用电子式Na + Cl → NaCl来表示,这个电子式告诉我们,钠原子失去一个电子,氯原子获得一个电子,最终形成了钠离子和氯离子之间的离子键。
2.2 化学反应的平衡电子式还可以帮助我们理解化学反应中物质的转化与平衡。
例如,在氮氧化合物的反应中,可以通过电子式来描述反应物和产物之间的电子转移和重新分布。
中学化学中常见的电子式大全原子 离子 单质分子 共价化合物 离子化合物 形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成:; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电O O H O ClH Cl OCl 2荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
高中化学结构的写法教案教学目标:学生能够熟练使用正确的化学结构写法表示化学物质的结构。
教学重点:了解化学结构的基本概念和表示法;掌握常用的结构表示方法,如Lewis结构、分子式等。
教学难点:能够正确表示含有多个原子的复杂分子的结构;理解分子中原子的排列和键的形成。
教学准备:1. 教师准备课件、实验器材、化学结构模型等教学工具。
2. 学生准备笔记本、笔、书本等学习用具。
3. 教师复习相关基本知识,做好备课工作。
教学过程:一、导入:通过导入一个实际的例子引起学生的兴趣,例如让学生观察身边的化学物质,并思考它们是如何组成的。
二、讲解:首先介绍化学结构的基本概念,如原子、分子、化合物等;然后讲解常用的化学结构表示方法,如Lewis结构、分子式等;最后展示一些复杂分子的结构表示方式,并解释每个原子之间的连接关系。
三、实践:让学生根据所学知识,自己尝试绘制一些简单的化学结构,如水分子、二氧化碳分子等,并找出其中的原子及键的类型;然后让学生互相交流,分享自己的绘制经验和技巧。
四、巩固:通过小组讨论或思考题,加强学生对化学结构表示法的理解,引导学生归纳总结。
五、拓展:引导学生拓展思维,让他们尝试绘制一些更复杂的分子结构,如有机分子、聚合物等,并鼓励他们进行深入探究和学习。
六、实验:在课堂上进行一些简单的化学实验,让学生亲自实践绘制化学结构,加深他们对结构表示法的理解。
七、总结:对本节课的内容进行总结,强调化学结构的重要性和应用价值,激发学生对化学学习的兴趣和热情。
教学反馈:通过课堂练习、小组讨论、实验操作等方式,及时对学生学习情况进行反馈,帮助他们发现问题、解决问题,及时调整教学方法和策略。
教学延伸:引导学生进行更深入的学习和研究,鼓励他们继续探索化学结构的奥秘,拓展自己的学习范围和深度。
教学评估:通过课堂表现、作业考核等方式,对学生的学习成绩和能力提升进行评估,帮助他们形成正确的学习态度和方法。
教学反思:教师对本节课的教学效果进行反思,总结经验教训,不断改进教学方法和策略,提高教学质量和效果。