2019最新单自由度计算例题化学
- 格式:ppt
- 大小:1.18 MB
- 文档页数:52



2018高考化学最有效的解题方法难点33 列方程法求结构单元列方程法是已知化学式求有机物结构的常用方法,但不是惟一方法。
●难点磁场 请试做下列题目,然后自我界定学习本篇是否需要。
A 分子中只具有以下a 、b 、c 三种结构单元,A 的化学式为:C 1134H 1146(三价基团) …C ≡C … (二价基团) …C(CH 3)3 (一价基团)[: (a) (b) (c)试通过计算确定A 分子中的上述结构单元数。
●案例探究[例题]某烃B 分子式是C 1398H 1278。
它是由4种基团组成,这四种基团分别是:[:a. (3价);b. … …(2价);c. …C ≡C …(2价);d.(CH 3)3C ……(1价) 已知该分子结构式中没有芳环连接芳环,脂基连接脂基的情况,试求B 分子中含有这4种基团各几个。
错解分析:不清楚所给结构单元化学式的代数和即为有机物的分子式,不清楚结构单元彼此相连时的数量关系而无解。
解题思路:设B 分子中,四种基团数目按所列次序分别为x 、y 、z 、w 个。
则:解得:x=94,y=33,z=126,w=96答案:4种基团个数按题中所列顺序分别是:94,33,126,96●锦囊妙计列方程的依据主要有:1.根据C 、H 、O 等原子个数守恒。
2.不饱和度。
3.结构余价的相等关系。
[: ●歼灭难点训练1.(★★★)合成相对分子质量在2000~50000范围内具有确定结构的有机化合物是一个新的研究领域。
1993年报导合成了两种烃A 和B ,其分子式分别是C 1134H 1146和C 1398H 1278。
B 结构跟A 相似,但分子中多了一些结构为的结构单元。
B 分子比A 分子多了____________个这样的结构单元(填数字)。
2.(★★★★)将例题中的“B分子式为C1398H1278”改为“C分子式为:C1318H1238”,其余同例题,试求之。
3.(★★★★)下面是一个四肽,它可以看作是4个氨基酸缩合掉3个水分子而得。


2018高考化学最有效的解题方法难点19 平衡结果求取值通常是由起始数据求平衡结果,反其道则难度增加,若由平衡结果求取值范围,则更难。
●难点磁场请试做下列题目,然后自我界定学习本篇是否需要。
若273 K下,某容器容积为10.0 L,容器内存在如下平衡:2NO2+4SO24SO3+N2各物质起始量分别是:NO2:2.0 mol、SO2:a mol、SO3:4.0 mol、N2:1.2 mol;平衡时容器内气体的总物质的量8.0 mol。
只要a的取值合理,按上列数值投料平衡就不会发生移动,此时a为。
●案例探究[例题]在一个容积固定的反应器(如图19—1)中,有一可左右滑动的密封隔板,两侧分别进行如图19—1所示的可逆反应。
各物质的起始加入量如下:A、B和C均为4.0 mol、D为6.5 mol、F为2.0 mol,设E为x mol 。
当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。
请填写以下空白:图19—1(1)若x=4.5,则右侧反应在起始时向 (填“正反应”或“逆反应”)方向进行。
欲使起始反应维持向该方向进行,则x的最大取值应小于___________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达到平衡时,A的物质的量是否相等?___________(填“相等”“不相等”或“不能确定”)。
其理由是。
知识依托:勒夏特列原理。
错解分析:通常平衡计算题是已知起始量求平衡结果,本题反其道而行之,已知平衡结果,求起始量的取值范围,增大了试题难度,结果:(1)不少学生不会解。
(2)问答错的主要原因是忽视了左右两容器内温度相同这一客观条件。
解题思路:(1)由于左侧反应为气体物质的量不变的反应,无论平衡如何移动,左侧气体总物质的量总是:4.0 mol+4.0 mol+4.0 mol=12.0 mol。
当x=4.5时,反应起始时右侧气体总物质的量为:6.5 mol+4.5 mol+2.0 mol=13.0 mol。

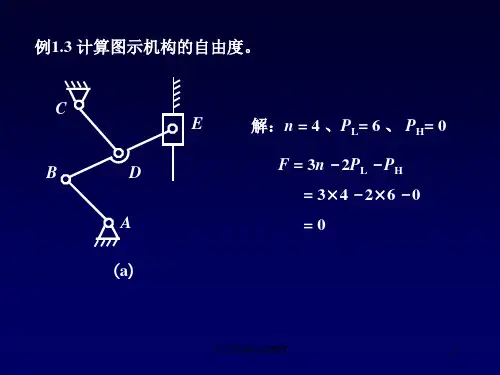
1. 计算齿轮机构的自由度.
解:由于B. C 副中之一为虚约束,计算机构自由度时,应将 C 副去除。
即如下图所示:
该机构的自由度1213233231=⨯-⨯-⨯=--=h p p n F
2. .机构具有确定运动的条件是什么?如果不能满足这一条件,将会产生什么结果?
机构在滚子B 处有一个局部自由度,应去除。
该机构的自由度017253231=-⨯-⨯=--=h p p n F
定轴轮系
A
B C
1 2
3 4 图2-22
A B
C
D
G
E
H F
当自由度F=1时,该机构才能运动, 如果不能满足这一条件,该机构无法运动。
该机构当修改为下图机构,则机构可动:
N=4, PL=5, Ph=1;
F=⨯-⨯-=
自由度342511
3. 计算机构的自由度.
1)由于机构具有虚约束, 机构可转化为下图机构。
F=⨯-⨯-=
自由度342511
2)由于机构具有虚约束, 机构可转化为下图机构。
F=⨯-⨯=
自由度31211
3)由于机构具有虚约束, 机构可转化为下图机构。
F=⨯-⨯=
自由度33241。

全国历年计算真题精选训练1.现有一瓶敞口放置在空气中的 NaOH 固体,欲知其组成成分,取样品 9.3 克向其中逐渐加入一定质量分数的稀盐酸,产生气体的质量与加入稀盐酸质量关系如图所示,试回答:(1)产生二氧化碳气体的质量为克。
(2)所用稀盐酸溶质质量分数为。
(3)求样品中氢氧化钠的质量分数为。
(精确到0.1%)【答案】2.2 7.3% 43.0%2.为了测定一瓶硫酸铜溶液的溶质质量分数,取出 50 克该溶液,向其中逐滴加入溶质质量分数为 16%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系如图所示:请你仔细分析此关系图,并进行计算。
(1)当滴入氢氧化钠溶液克时,硫酸铜与氢氧化钠恰好完全反应。
(2)计算此硫酸铜溶液中溶质的质量分数为(写出计算过程)。
【答案】25 16%3.取硫酸钠和氯化钠的混合物15g,加入180g水使其完全溶解,再加入100g氯化钡溶液恰好完全反应,过滤,得271.7滤液(不考虑实验过程中质量的损失)。
计算:(1)该混合物中硫酸钠的质量分数(计算结果精确到0.1%);(2)反应后所得滤液中溶质的质量分数(计算结果精确到0.1%)。
【答案】94.7%;4.6%。
4.某同学欲测定某石灰石样品中碳酸钙的质量分数.取12.5g石灰石样品于烧杯中,再向其中加入100g稀盐酸,恰好完全反应后,测得烧杯内物质的总质量变为108.1g(已知:石灰石中的杂质既不溶于水,也不与其他物质反应,生成的二氧化碳全部逸出).试计算:(1)生成的二氧化碳质量;(2)该样品中碳酸钙的质量分数;(3)所用稀盐酸的溶质质量分数.【答案】4.4g;80%;7.3%.5.某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。
请计算:(l)反应至A点时加入氢氧化钠溶液的质量为__________;(2)计算反应至B点时锥形瓶内所得溶液的溶质质量分数为多少?(计算结果保留至0.1%)【答案】(1)40g(1分);(2)10.4%6.铁的氧化物有三种,分别是FeO、Fe2O3和Fe3O4。

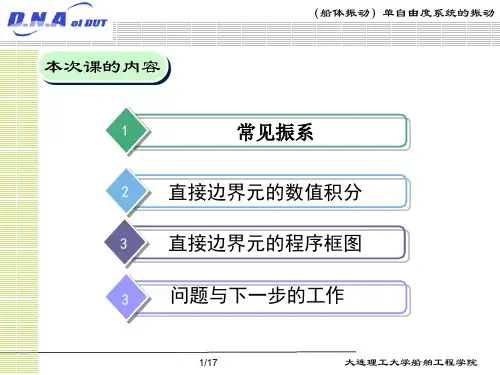
机械原理空间机构自由度的计算:F = 6n-mr-i2.2基木要求1. 掌握构件、运动副、运动链及机构等基本概念。
2. 能够将比较简单的实际机构绘制成机构运动简图。
3 •能正确讣算平而机构的自由度并能判断实是否具有确立的运动。
第2章 机构的组成原理及结构分析2. 1知识结构厂构件与零件J 零件:加工制造的单元体 I 构件:运动的单元体,r ... r 转动副 r r 低副彳“斗制 机构的组成< -X 列J 平而运动副彳 1務动副 运动副[ I 平而高副 匚空而运动副J 运动链与机构机构的组成原理及结构分析 r 定义 机构运动简图V 常用构件与运动副的表达方法 I 机构运动简图的绘制 平而机构的自由度 「平面机构自由度的计算:F = 3n-2p 「g汁算自由度时应注意的问题 r 基本杆组平而机构的组成原理与结构分析 < 组成原理I 结构分析(拆分杆组)平面机构中的髙副低代q「髙副低代应满足的条件 髙副低代的方法复合狡链 局部自由度虚约束4.掌握机构的组成原理和结构分析的方法;了解高副低代的方法。
5.了解空间机构自由度的计算。
2. 3重点及难点本章的重点是有关机构组成中的构件、运动副、运动链及机构等基本概念,机构运动简图的绘制、平而机构自由度的计算、机构具有确泄运动的条件以及机构的结构分析。
本章难点是机构中虚约朿的判别问题。
2.3. 1基本概念1.构件机构运动的单元体,而零件是制造的单元体;构件既可以是一个零件,也可以由几个零件刚性联接而成。
2.运动副凡两构件直接接触而又能做一左相对运动的可动连接。
运动副按接触形式分为高副(即点或线接触的运动副)和低副(即而接触的运动副)。
又可按两构件相对运动的形式将平而运动副中的低副分为转动副、移动副。
此外还可以按接触部分的几何形状将空间运动副分为球面高副、柱而副、圆柱副、螺旋副、球而副及球销副等。
3.运动链两个以上的构件通过运动副连接而成的相对可动的系统。
2019年高考化学试题分类解析汇编:化学计算注意事项:认真阅读理解,结合历年的真题,总结经验,查找不足!重在审题,多思考,多理解!无论是单选、多选还是论述题,最重要的就是看清题意。
在论述题中,问题大多具有委婉性,尤其是历年真题部分,在给考生较大发挥空间的同时也大大增加了考试难度。
考生要认真阅读题目中提供的有限材料,明确考察要点,最大限度的挖掘材料中的有效信息,建议考生答题时用笔将重点勾画出来,方便反复细读。
只有经过仔细推敲,揣摩命题老师的意图,积极联想知识点,分析答题角度,才能够将考点锁定,明确题意。
1.[2018·江苏化学卷8]设NA为阿伏伽德罗常数的值。
以下说法正确的选项是A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NAB.常温常压下,18gH2O含有的原子总数为3NAC.标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5NAD.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NAB解析:此题考查阿伏加德罗常数计算中一些常见问题和考前须知。
A.标准状况下,0.1molCl2溶于水,转移的电子数目小于0.1NA,因为Cl2溶于水不可实现完全与水反应。
C.标准状况下CH3CH2OH为液态,无法计算。
D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目不好计算,非标准状况。
解决此类问题的关键是:灵活应用各种知识,尤其基本概念与理论中元素守恒、化学键问题、晶体结构问题、氧化还原中电子转移问题、可逆反应问题及物质的量计算中一些特殊物质的状态等。
2.[2018·江苏化学卷14]温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)PCl3(g)+Cl2(g)经一段时间后达到平衡。
反应过程中测定的部分数据见下表:t/s 0 50 150 250 350n(PCl3)/mo l 0 0.160.190.20.2以下说法正确的选项是A.反应在前50s的平均速率为v(PCl3)=0.0032mol·L-1·s-1B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol·L-1,那么反应的△H<0C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%C解析:此题素材似乎来源于《选修四》课本第32页习题的第8题,属于基本理论中化学平衡问题,主要考查学生对速率概念理解与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。
物理化学练习题一、填空题1.理想气体恒温可逆压缩,ΔU0,ΔH0。
2.根据国际标准规定,系统对环境做功,功为值,环境对系统做功,功为值。
3.热力学第二定律的经典表述之一为:,数学表达式为。
4.在所有的偏摩尔量中,以偏摩尔吉布斯自由能i G 最为重要。
它有个专门名称叫______。
5.在水的相图中,三相点的在自由度f =______。
6.某理想气体,等温(25℃)可逆地从1.5dm 3膨胀到10dm 3时,吸热9414.5J ,则此气体的物质的量为摩尔。
7.在石灰窑中,分解反应CaCO 3(s)=CaO(s)+CO 2(g)已达平衡,则该系统的组分数K=,自由度f =。
8.主要决定于溶解在溶液中粒子的数目,而不决定于这些粒子的性质的特性叫________。
9.在孤立系统中进行的可逆过程S∆,进行不可逆过程S∆(填>0,=0,<0)。
10.在理想气体的p-V 图上,当等温线和绝热线相交时,等温线的斜率的绝对值________绝热线的绝对值。
11.实际气体经节流膨胀后的_______=∆U ,_______=∆H ,若想利用节流膨胀达到制冷的目的,要求节流膨胀系数0____T J -μ。
12.在101325Pa 下,将一小块冰投入大量的水中(水温略高于0°C ),冰会融化,问0___冰S ∆,0___水S ∆,0___总S ∆。
13.在理想稀溶液中,服从拉乌尔定律,在同一浓度范围内,服从亨利定律。
14.纯物质完美晶体在时熵值为零。
15.某反应B A −→−,如果反应物A 的浓度A ln c —t 作图成一直线,则反应级数n =,其半衰期=2/1t 。
16.在化学电源中,负极也叫极,正极也叫极;作为电解池时,阳极也称极,阴极也称极。
10.在热力学研究中,根据系统的性质是否与物质的量有关,将系统的性质分为、。
17.在电解池中,电解质正离子通过溶液向极迁移,负离子向极迁移,与此同时,极总是发生氧化反应,极上总是发生还原反应。
化学计算题专练(22道题)1.(9分)小明为了测定某钙片中碳酸钙的质量分数,用如图装置进行如下实验:①取研碎后的钙片4克,导入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐酸,置于电子天平上测出装置总质量。
②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量。
③整理相关数据如表所示,计算出钙片中碳酸钙的质量分数。
(1)该实验中,对装置中的固态干燥剂的性质有何要求?。
(2)反应前容器内是空气(密度为ρ1),反应后全部是二氧化碳(密度为ρ2),则反应前后容器(容积为V)内的气体质量差为m为。
(用字母表示,反应物的体积忽略不计)(3)小明查阅有关数据后,计算出反应前后容器内的气体质量差m为0.22克,结合表中数据,计算该钙片中碳酸钙的质量分数。
(钙片中的其它成分不与盐酸反应)2.某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验。
取废水500g,向其中加入溶质质量分数为20%的氢氧化钠溶液。
测得沉淀质量与所加入的氢氧化钠溶液的质量关系如下图:根据所得数据计算:(1)500g该废水中硫酸铜的质量。
(2)该废水中硫酸的溶质质量分数。
3.某化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用10.0 g石灰石样品,将40.0g稀盐酸分为4次加入样品中(石灰石样品中所含的杂质不溶于水和盐酸),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:请计算:Array(1)从以上数据可知,这四次实验中,第次石灰石样品中碳酸钙完全反应;第 1 页(2)该石灰石样品碳酸钙的质量分数是;(3)10.0 g稀盐酸与10.0 g石灰石样品作用,得到溶质的质量分数是多少?(写出计算过程)4.实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g 10%的NaOH溶液.然后往烧杯中滴加该盐酸.反应过程中溶液的pH与滴入盐酸的质量关系如图所示.请回答下列问题:(1)配制了8g 10%的NaOH溶液,需要水的质量为;(2)计算该盐酸的溶质质量分数;(写出计算过程)(3)当滴入4g盐酸时,烧杯内溶液中钠元素的质量为g.5.科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。