精选高考化学平衡图像专题
- 格式:doc
- 大小:785.00 KB
- 文档页数:4

化学平衡图像一、选择题1.一定温度下,在2L 的密闭容器中,X 、Y 、Z 三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( )A .反应开始到10s ,用Z 表示的反应速率为0.158mol/(L·s )B .反应开始时10s ,X 的物质的量浓度减少了0.79mol/LC .反应开始时10s ,Y 的转化率为79.0%D .反应的化学方程式为:X(g)+ Y(g)Z(g)2.( 广东19)合成氨工业对国民经济和社会发展具有重要的 意义。
对于密闭容器中的反应:N 2(g)+3H 2(g)2NH 3(g),673K ,30MPa 下n(NH 3)和n(H 2)随时间变化的关系如下图所示。
下列叙述正确的是A .点a 的正反应速率比点b 的大B .点 c 处反应达到平衡C .点d (t 1时刻) 和点 e (t 2时刻) 处n(N 2)不一样D .其他条件不变,773K 下反应至t 1时刻,n(H 2)比上图中d 点的值大3.下图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )A .正反应是放热反应B .若A 、B 是气体,则D 是液体或固体C .逆反应是放热反应.D .A 、B 、C 、D 均为气体4.同压、不同温度下的反应:A (g )+B (g )C (g );△HA 的含量和温度的关系如图3所示,下列结论正确的是 ( )A .T 1>T 2,△H>0B .T 1<T 2,△H>0C .T 1>T 2,△H<0D .T 1<T 2,△H<05.现有可逆反应A (g )+2B (g )nC (g );△H<0,在相同温度、不同压强时,A 的转化率跟反应时间(t )的关系如图4,其中结论正确的是()A .p 1>p 2,n >3B .p 1<p 2,n >3C .p 1<p 2,n <3D .p 1>p 2,n=36.对于反应2A (g )+B (g )2C (g );△H<0,下列图象正确的是 ( )7.T ℃时,A 气体与B 气体反应生成C 气体。



or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。


专题34 化学平衡图像(满分42分时间20分钟)姓名:班级:得分:1.在密闭容器中,反应2X(g)+ Y 2(g) 2XY(g)△H<0,达到甲平衡。
在仅改变某一条件后,达到乙平衡,下列分析正确的是A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低C.图Ⅱ中,t时间是增大了压强D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲【答案】D考点:考查化学平衡图像分析。
2.如图是关于反应A2(g)+B2(g) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是A .温度、压强不变,充入一些A 2(g)B .压强不变,降低温度C .压强、温度不变,充入一些与之不反应的惰性气体D .升高温度,同时加压 【答案】A【考点定位】考查化学反应速率与化学平衡【名师点晴】该题的难点是压强对平衡状态的影响,特别是“惰性气体”对化学平衡的影响:①恒温、恒容条件:原平衡体系−−−−→−充入惰性气体体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件:原平衡体系−−−−→−充入惰性气体容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
3.在某容积一定的密闭容器中,有下列的可逆反应:A (g)+B (g)xC (g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数)A .P 3>P 4,y 轴表示B 的转化率 B .P 3<P 4,y 轴表示B 的体积分数C .P 3<P 4,y 轴表示混合气体的密度D .P 3<P 4,y 轴表示混合气体的平均摩尔质量 【答案】A【考点定位】考查化学平衡图象【名师点晴】本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义。

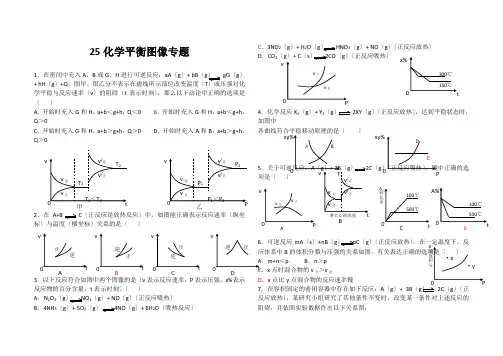
25化学平衡图像专题1.在密闭中充入A 、B 或G 、H 进行可逆反应:aA 〔g 〕+ bB 〔g 〕 gG 〔g 〕+ hH 〔g 〕+Q ,图甲、图乙分不表示在虚线所示部位改变温度〔T 学平稳与反应速率〔v 〕的阻碍〔t 表示时刻〕,那么以下结论中正确的选项是〔 〕 A .开始时充入G和H ,a+b <g+h ,Q <0 B .开始时充入G 和H ,a+b <g+h ,Q >0 C .开始时充入G 和H,a+b >g+h ,Q >0 D.开始时充入A 和B ,a+b >g+h,Q >02.在A+B C 〔正反应是放热反应〕中,如图能正确表示反应速率〔纵坐标〕与温度〔横坐标〕关系的是〔 〕3.以下反应符合如图中两个图像的是〔v 表示反应速率,P 表示压强,x%表示反应物的百分含量,t 表示时刻〕〔 〕 A .N 2O 3〔g 〕 NO 2〔g 〕+ NO 〔g 〕〔正反应吸热〕B .4NH 3〔g 〕+ 5O 2〔g〕 4NO 〔g 〕+ 6H 2O 〔吸热反应〕C .3NO 2〔g 〕+ H 2O 〔g 〕 HNO 3〔g 〕+ NO 〔g 〕〔正反应放热〕 D.CO 2〔g 〕+ C 〔s 〕2CO 〔g 〕〔正反应吸热〕4.化学反应X 2〔g 〕+ Y 2〔g 〕 2XY 〔g〕〔正反应放热〕,达到平稳状态时,如图中5〔g.可逆反应mA 〔s 〕+nB 〔g 〕 pC 〔g 〕〔正反应放热〕B .m+n <p B .n >p.x 点时混合物的v 正>v 逆D .x 点比y 点混合物的反应速率慢 7.在容积固定的密闭容器中存在如下反应:A 〔g 〕+ 3B 〔g 〕 2C 〔g 〕〔正反应放热〕,某研究小组研究了其他条件不变时,改变某一条件对上述反应的阻碍,并依照实验数据作出以下关系图:甲 乙B C DA D A CA以下判定正确的选项是〔 〕 A .图I 研究的是不同催化剂对反应的阻碍,且乙使用的催化剂效率较高B .图Ⅱ研究的是压强对反应的阻碍,且甲的压强较大C .图Ⅱ研究的是温度对反应的阻碍,且甲的温度较高D .图Ⅲ研究的是不同催化剂对反应的阻碍,且甲使用的催化剂效率较高 8.可逆反应:2X+Y 2Z 〔g 〕+Q ,气体的平均摩尔质量〔M 〕随温度变化如下图,那么以下讲法正确的选项是〔 〕 A .X 和Y 可能差不多上固体 B .X 和Y 一定差不多上气体 C .假设Y 为固体,X 一定是气体 D .X 和Y 不可能差不多上气体 【化学平稳图像专题】 1.B 、2.B 、3. C 、4. A 、5.D 、6.C D 、7. AB 、8.C 练习: 1.在恒温时,一固定容积的容器内发生如下反应:2NO 2〔g 〕N 2O 4(g),达到平稳时,再向容器内通入一定量的NO 2〔g 〕,重新达到平稳后,与第一次平稳时相比,NO 2的体积分数 〔 〕 A .不变 B .增大 C .减小 D .无法判定 2.在一密闭容器中,反应 a A 〔g 〕b B 〔g 〕达平稳后,保持温度不变,将容器体积增加一倍,当达到新的平稳时,A 的浓度变为原先的60%,那么〔 〕A .平稳向正反应方向移动了B .平稳向逆反应方向移动了C .物质B 的质量分数增加了D .a <b 3.甲为恒温恒压容器,乙为恒温恒容容器。

高(Gao)考化学专题复习:化学平衡图像专题1.对反(Fan)应2A(g)+2B(g)3C(g)+D(?),下列图象的描述(Shu)正确的是A. 依(Yi)据图①,若(Ruo)t1时升高温度,则ΔH<0B. 依据图①,若t1时增大压强,则D是固体或液体C. 依据图②,P1>P2D. 依据图②,物质D是固体或液体【答案】B2.下列图示与对应的叙述相符的是A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOHD. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大【答案】B3.—定条(Tiao)件下,CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往(Wang) 2L 恒容密(Mi)闭容器中充入 1 mol CO2和(He)3 mol H2,在不同催化剂作(Zuo)用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是A. a 点 v(正)>v(逆)B. b点反应放热53.7 kJC. 催化剂效果最佳的反应是③D. c点时该反应的平衡常数K=4/3(mol-2.L-2)【答案】A4.如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A. 正反应是放热反应B. A、B一定都是气体C. D一定不是气体D. C可能是气体【答案】B5.下图是恒温下H2(g)+I2(g)2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是A. 升高温(Wen)度B. 增大(Da)压强C. 增大反应(Ying)物浓度D. 加入(Ru)催化剂【答(Da)案】C6.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。

化学平衡图像高考真题化学平衡作为高考化学中的一个重要内容,一直是考试中的难点之一。
其中,常常会涉及到化学平衡的图像表达。
通过图像,我们可以更直观地理解化学反应中各种物质的含量变化,从而更好地解决相关问题。
下面就以高考真题为例,来分析化学平衡图像的相关知识。
在一道高考真题中,题目描述了如下化学反应:\[2A + B \rightleftharpoons 3C + D\]并要求根据该反应写出平衡常数表达式,并利用图像表示该反应的化学平衡。
首先,我们知道平衡常数(Kc)的表达式为:\[Kc = \frac{{[C]^3 [D]}}{{[A]^2 [B]}}\]根据上述反应式,我们可以得知,在达到化学平衡时,反应物A和B与生成物C和D的摩尔比为2:1:3:1。
因此,在图像中我们可以通过不同长度的线段,分别表示反应物A和B的浓度,以及生成物C和D 的浓度。
接着,我们可以将该反应表示成图像形式。
在横轴上,我们表示出反应物A和B的初始浓度以及生成物C和D的初始浓度。
在纵轴上,表示各物质的浓度变化。
通过画出不同颜色的线段,分别代表不同物质的浓度变化,并在适当的位置标出各种物质的浓度比例。
通过这样的图像表达,我们可以清晰地看到在达到化学平衡时,反应物和生成物的浓度变化情况,以及它们之间的比例关系。
这样不仅有助于我们更直观地理解化学平衡的概念,也能帮助我们更好地解答相关问题。
综上所述,化学平衡的图像表达在高考化学中起着重要作用。
通过图像,我们可以更直观地理解化学反应中各物质的浓度变化,从而更好地掌握相关知识,并更好地应对考试中的问题。
希望同学们在备战高考时能够充分利用图像表达,提升化学学科的学习效果。

化学平衡图像专题(超详细版)化学平衡是化学反应中一个非常重要的概念,它描述了在封闭系统中,反应物和物之间的动态平衡状态。
在化学平衡状态下,反应物和物的浓度保持不变,尽管反应仍在进行。
为了更好地理解和应用化学平衡原理,我们可以通过图像来直观地展示和解释这一概念。
一、化学平衡图像概述1. 反应物和物浓度随时间变化的曲线图2. 反应速率随时间变化的曲线图3. 平衡常数与温度、压力等条件的关系图二、反应物和物浓度随时间变化的曲线图在化学平衡图像中,反应物和物浓度随时间变化的曲线图是最常见的一种。
这种图像可以清晰地展示出反应物和物在反应过程中的浓度变化趋势,以及它们何时达到平衡状态。
1. 反应物浓度随时间变化的曲线图:在反应初期,反应物浓度较高,随着反应的进行,反应物浓度逐渐降低。
当反应达到平衡状态时,反应物浓度不再变化,形成一条水平直线。
2. 物浓度随时间变化的曲线图:在反应初期,物浓度较低,随着反应的进行,物浓度逐渐升高。
当反应达到平衡状态时,物浓度不再变化,形成一条水平直线。
3. 反应物和物浓度随时间变化的曲线图:将反应物和物浓度随时间变化的曲线图叠加在一起,可以更直观地展示它们之间的浓度关系。
在平衡状态下,两条曲线会相交,形成一个平衡点。
三、反应速率随时间变化的曲线图反应速率随时间变化的曲线图可以展示出反应速率在反应过程中的变化趋势,以及它如何受到反应物浓度、温度、压力等条件的影响。
1. 反应速率随时间变化的曲线图:在反应初期,反应速率较快,随着反应的进行,反应速率逐渐降低。
当反应达到平衡状态时,反应速率不再变化,形成一条水平直线。
2. 反应速率与反应物浓度的关系图:反应速率通常与反应物浓度成正比,即反应物浓度越高,反应速率越快。
当反应物浓度达到一定值时,反应速率达到最大值,不再随反应物浓度变化。
3. 反应速率与温度的关系图:反应速率通常与温度成正比,即温度越高,反应速率越快。
这是因为温度升高,反应物分子运动加快,碰撞频率增加,从而提高反应速率。
易错专题13化学平衡图像和计算聚焦易错点:►易错点一化学平衡图像►易错点二化学平衡计算典例精讲易错点一化学平衡图像【易错典例】例1(1)用O 2将HCl 转化为Cl 2,可提高效益,减少污染。
新型RuO 2催化剂对上述HCl 转化为Cl 2的总反应[2HCl(g)+12O 2H 2O(g)+Cl 2(g)ΔH ]具有更好的催化活性,①实验测得在一定压强下,总反应的HCl 平衡转化率随温度变化的αHCl ~T 曲线如下图:则总反应的ΔH ________0(填“>”、“=”或“<”);A、B 两点的平衡常数K (A)与K (B)中较大的是________。
②在上述实验中若压缩体积使压强增大,画出相应αHCl ~T 曲线的示意图,并简要说明理由_________。
③下列措施中,有利于提高αHCl 的有________。
A.增大n (HCl)B.增大n (O 2)C.使用更好的催化剂D.移去H 2O(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO 2和H 2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H 2(g)CH 3OH(g)ΔH 1②CO 2(g)+3H 2(g)CH 3OH(g)+H 2O(g)ΔH 2③CO 2(g)+H 2(g)CO(g)+H 2O(g)ΔH 3,回答下列问题:①反应①的化学平衡常数K 表达式为________;图中能正确反映平衡常数K 随温度变化关系的曲线为________(填曲线标记字母),其判断理由是________。
②合成气组成n (H 2)/n (CO+CO 2)=2.60时,体系中的CO 平衡转化率(α)与温度和压强的关系如图所示。
α(CO)值随温度升高而_____(填“增大”或“减小”),其原因是____________;图中的压强由大到小为________,其判断理由是________________。
【答案】(1)①<K (A)②见下图增大压强,平衡右移,αHCl 增大,相同温度下,HCl 的平衡转化率比之前的大③BD(2)①K =a 反应①为放热反应,升高温度使其平衡向逆反应方向移动,平衡常数K 应减小②减小由图可知,压强恒定时,随着温度的升高,α(CO)减小p 3>p 2>p 1温度恒定时,反应①为气体分子数减小的反应,加压使平衡向正反应方向移动,α(CO)增大,而反应③为气体分子数不变的反应,加压对其平衡无影响,故增大压强时,有利于α(CO)增大【解析】(1)①结合题中αHCl ~T 图像可知,随着温度升高,αHCl 降低,说明升高温度平衡逆向移动,得出正反应方向为放热反应,即ΔH <0;A、B 两点A 点温度低,平衡常数K (A)大。
化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变更趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作帮助线(等温线、等压线、平衡线),五看量的变更(如浓度变更、温度变更等),六想规律(外界条件对反响速率的影响规律和化学平衡移动规律) 1. 速率时间图1. 对达平衡的可逆反响X +Y W +Z ,增年夜压强则正、逆反响速度(v )的变更如上图,阐发可知X ,Y ,Z ,W 的聚集状态可能是( )。
(A)Z ,W 为气体,X ,Y 中之一为气体 (B)Z ,W 中之一为气体,X ,Y 为非气体 (C)X ,Y,Z 皆为气体,W 为非气体 (D)X ,Y 为气体,Z ,W 中之一为气体 2. 在一定条件下,反响A(g)+B(g)C(g)(正反响为放热反响)达到平衡后,根据下列图象判断A .B .C .D .E . (1)升温,达到新的平衡的是( ) (2)降压,达到新的平衡的是( )(3)减少C 的量,移向新平衡的是( )(4)增加A 的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)时间图3. 在一定温度下,容器内某一反响中M 、N 的物质的量随反响时间变更的曲线如右图,下列表述中正确的是( ) A .反响的化学方程式为:2 MNB .t2时,正逆反响速率相等,达到平衡C .t3时,正反响速率年夜于逆反响速率 D.t1时,N 的是M 浓度的2倍3. 含量时间温度(压强)图4. 可逆反响mA(s)+nB(g )eC(g)+fD(g),反响过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增年夜(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反响:M(g)+N(g )R(g)+2L此反响合适下面图像,下列叙述是正确的是()(A) 正反响吸热,L是气体(B) 正反响吸热,L是固体(C) 正反响放热,L是气体(D) 正反响放热,L是固体或液体6. 可逆反响mA(s)+nB(g)pC(g)+qD(g)反响过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线阐发,判断下列叙述中正确的是()(A)达到平衡后,若使用催化剂,C的质量分数增年夜(B)平衡后,若升高温度,平衡则向逆反响标的目的移动(C)平衡后,增年夜A的量,有利于平衡向正反响标的目的移动(D)化学方程式中一定n>p+q7. 现有可逆反响A(气)+B(气)3C(气),下图中甲、乙、丙辨别暗示在不合的条件下,生成物C在反响混和物中的百分含量(C%)和反响时间的关系:(1)若甲图中两条曲线辨别暗示有催化剂和无催化剂时的情况,则___曲线是暗示有催化剂时的情况。
精选高考化学平衡图像专题
1.对于反应A(气)+2B(气) 2C(气) △H<0,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是()
A B C D
2、反应2X(气)+Y(气)2Z(气) △H< 0,在不同温度
(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n Z)与反应
时间(t)的关系如图所示。
下列判断正确的是()
A、T1<T2P1<P2
B、T1<T2P1>P2
C、T1>T2P1>P2
D、T1>T2P1<P2
3.图中C%表示某反应物在体系中的百分含量,v表示反应速度,P表示压强,t表示反应时间。
图
(A)为温度一定时压强与反应速度的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。
同时符合以下两个图像的反应是()
A.4NH3(g)+5O2(g)4NO(g)+6H2O(g)
(正反应为放热反应)
B.N2O3(g)NO2(g)+NO(g)(正反应为吸热
反应)
C.3NO2(g)+H2O(l)2HNO3(l)+NO(g)
(正反应为放热反应)
D.CO2(g)+C(s)2CO(g)(正反应为吸热反应)
4.下图表示反应A(气)+B(气)nC(气)(正反应放热)
在不同条件下反应混合物中C的百分含量和反应过程所需时间的
关系曲线。
下列有关叙述正确的是()
A.若其它条件相同,a比b的温度高
B.a表示有催化剂,b表示无催化剂
C.若n=2,其它条件相同,a比b的压强大
D.反应由逆反应开始
5.在A(g)+B(g)=C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,则正反应是放热反应的图为()
A B C D
6.在一定条件下,固定容积的密闭容器中反应:
C%
t t t
500 C
200 C
500 C o
200 C o
C%
o
C%
o
200 C o
500 C o C%
t
200 C o
500 C o
T2 P1
n z
T2 P2
T1 P2
t
2NO 2(g)2NO(g)+O2(g);△H>0,达到平衡。
当改变其中一个条件X,Y随X的变化符合图中曲线的是()
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
7.某可逆反应L(s)+G(g)3R(g) (正反应为吸热反应),本图表示外界条件温度、压强的变化对上述反应的影响。
试判断图中y轴可以表示()
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
8.已知:4NH3(g)+5O2(g)===4NO(g)+6H2O(g)ΔH=-1025 kJ/mol,该反应是一个可逆反应.若反应物起始物质的量相同,下列关于该反应的示意图不正确的是()
9.图7表示mA(g)+nB(g)pC(g)+qD(g)△H=Q,在不同温度下经过
一定时间混合体系中C的质量分数与温度T的关系;图8表示一定条件下达到平衡(v正=v逆)后t时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是()。
A.m+n>p+qQ>0
B.m+n>p+qQ<0
C.m+n<p+qQ>0
D.m+n<p+qQ<0
10.用来表示可逆反应:2A(g)+B(g)2C(g)(正反应放热)的正确图象是下图中的()
A B C D
11.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)()
A.P3>P4,y轴表示B的转化率
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
12.在容积不变的密闭容器中存在如下反应:2SO 2(g)+O2(g)2SO3(g)△H =-196.6kJ·mol-1某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是()
I II III
A.图I研究的是t0时刻增大O2的浓度对反应速率的影响
B.图II研究的是t0时刻加入催化剂后对反应速率的影响
C.图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图III研究的是温度对化学平衡的影响,且乙的温度较低
13.在一定条件下,可逆反应2X(g)2y(g)+z(g)(正反应放热),在t1时达到平衡,然后在t2时开始加热至一定温度后停止加热并保温,到t3时又建立平衡,下图中能表示这一变化情况的是()
A. B C D
14.密闭容器中,有反应:A 2+B22AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃时从时间t3开始向容器中加压的情况,下列叙述
正确的是()
A.A2、B2、AB均为气体,正反应放热
B.AB为气体,A2、B2中最少有一种为非气体,正反应吸热
C.AB为气体,A2、B2中最少有一种为非气体,正反应放热
D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热
15.反应mA(固)+nB(气)pC(气)+Q在一定温
度下B的体积分数(B%)与压强变化的关系如图2-11所
示,下列叙述中正确的是()
①m+n>P;②x点表示该反应的正反应速率大于逆反应速
率;③n>p;④x点比y点时的反应速率慢。
A只有①B只有②④C只有①②④D只有①和③
16.600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO 2(g)+O2(g)2SO3(g);△H<0。
反应过程中SO2、O2、SO3物质的量变化如图,下列说法不正确的是()A.反应从0 min开始,到第一次平衡时,二氧化硫的转化率为40%
B.反应进行到10min至15min的曲线变化可能升高了温度
C.反应进行至20min时,曲线发生变化是因为通入了氧气
D.在15-20min;25-30min内时反应处于平衡状态
17.在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断
A.B.C.D.E.
(1)升温,达到新的平衡的是() (2)降压,达到新的平衡的是()
(3)减少C的量,移向新平衡的是() (4)增加A的量,移向新平衡的是() (5)使用催化剂,达到平衡的是()
18.对于吸热反应A(g)+B(g) C(g)+D(g)
A的转化率与压强(P)和温度(T)的关系如
图所示则T1、T2、T3的关系是___________.
19.在一定条件下,可逆反应A+B mC的变化如右图所示,已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2的温度时达到平衡后向容器加压的变化情况,问:
(1)温度T1_________T2(填<、>或==.)
(2)正反应是_______反应(填吸热或和热).
(3)如果A、B、C均为气体,则m_______2(填<、>或=)
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有
气体,则体系的压强_________,平衡______移动.
20. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是____ _热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则___ _曲线是表示压强较大的情况。