水环境化学作业(1)
- 格式:doc
- 大小:28.50 KB
- 文档页数:2

一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占______。
2、污染物的性质和环境化学行为取决于它们的和在环境中的。
3、环境中污染物的迁移主要有、和三种方式。
4、人为污染源可分为___________、___________、___________、和____________。
二、选择题1、属于环境化学效应的是。
A热岛效应B温室效应C土壤的盐碱化D噪声2、五十年代日本出现的痛痛病是由______污染水体后引起的。
A CdB HgC PbD As3、五十年代日本出现的水俣病是由______污染水体后引起的。
A CdB HgC PbD As三、名词解释环境污染、环境化学、环境效应、环境污染物环境污染:由于人为因素使环境的构成或状态发生变化,导致环境素质下降,从而扰乱或破坏生态系统和人们正常的生活与生产条件的现象。
环境化学:环境化学是在化学科学的传统理论和方法基础上发展起来的,以化学物质在环境中出现而引起的环境问题为研究对象,以解决环境问题为目标的一门新兴学科。
环境化学主要研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法。
环境效应:自然过程或人类的生产和生活活动会对环境造成污染和破坏,从而导致环境系统的结构和功能发生变化,称为环境效应。
环境污染物:指进入环境后使环境的正常组分和性质发生直接或间接的有害于人类的变化的物质。
四、举例简述污染物在环境各圈层间的迁移转化过程。
汞在环境中的迁移转化过程环境化学第二章练习题参考答案一、填空题1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占80%-90%。
2、污染物在环境中的迁移主要有机械迁移、物理-化学迁移和生物迁移三种方式。
3、污染物的性质和环境化学行为取决于它们的化学结构和在环境中的存在状态。
4、当今世界上最引人瞩目的几个环境问题臭氧空洞、温室效应、酸雨等是由大气污染所引起的。


作业一一、填空题1.污染物在环境中所发生的空间位移称为(1 )过程。
2.污染物在环境中通过物理、化学或生物作用改变存在形态的过程称为(2 )的过程。
3.醛类光解是大气中(3 )自由基的重要来源。
4.自由基在其电子壳层的外层有一个不成对电子,所以具有很高的(4 )和(5 )作用,其中以(6 )和(7 )自山基最为重要。
5.大气污染化学中所说的氮氧化物主要是指(8 )和(9 )。
6.大气中主要温室气体有(10 )、(11 )等。
7.污染物在大气中扩散取决于(12 )、(13 )和(14 )等因素。
8.大气按垂直结构分为(15 )层、(16 )层、(17 )层、(18 )层及(19 )层。
9.HNO2的光解是污染大气中(20 )自由基的重要来源之一。
10.清洁大气中HO的重要来源是(21 )。
11.烷基和空气中。
2结合形成(22 )。
12.大气中CH3自由基的主要来源是(23 )和(24 )的光解。
参考答案:1迁移2转化3HO24活性5强氧化6 HO7HO28 NO9NO210 CO2 11甲烷12风和湍流13天气形势14下垫面15对流层16平流层17中间层18热层19逸散层20 HO 21。
3的光解离22 RO223乙醛24丙酮、环境污染物有哪些类别?主要的化学污染物有哪些?作业二一、大气中有哪些重要自由基?HO来源如何?答:大气中主要自由基有:HO、HO2、R、RO2HO的来源:①。
3的光解:Os+ h V---------------- a-0 +。
20+ H2o ------------- a 2HO②HNO2的光解: HNO2 + h v ------- > HO+N0③玦。
2的光解:H2O2 + h v ------- _> 2H0二、影响酸雨形成的因素主要有哪些?作业三一、判断题(对的7,错的X)1.H0自由基的光化学生成产率白天低于夜间。
()2.大气中存在量最多的烷基是甲基。

0128 20222单项选择题1、水的硬度主要是衡量水体中()的浓度。
.三价铁离子和铝离子.三价铁离子和钠离子.钾离子和钠离子.钙离子和镁离子2、下列哪项不属于土壤退化过程()?.干旱和水涝.种植了过多的植物.土壤的流失和酸化.土壤盐碱化3、下列哪种物质不能同血红蛋白结合,减弱血液的输氧能力?( ).亚硝酸根.一氧化氮.一氧化碳.一氧化二氮4、进人生物机体的有毒有机污染物质,在人及动物中主要转化部位是()。
.肺.肾.血浆.肝脏5、LD50表示的是( )。
.半数有效浓度.半数致死剂量.半数有效剂量.半数致死浓度6、下面哪一项不属于环境化学效应?().光化学烟雾.水土流失.地下水硬度升高.酸雨7、生物膜的结构不包括()。
.蛋白.膜孔.线粒体.磷脂双分子层8、同型碱基之间的置换,是属于碱基对的()。
.插入.缺失.转换.颠换9、生物浓缩系数的缩写是()。
.COD.BOD.BCF.BCC10、降低pH, 水中沉积物重金属的吸附量将()。
.减少.不变.增大.无法判断11、大气中二氧化碳含量与日俱增的原因是()?.大量燃烧石油、煤等.湖泊减少.海平面上升.臭氧层遭到破坏12、关于水体污染下列说法不正确的是()。
.油污染也是一种水体污染。
.水体发臭只是味道不好闻,不属于水体污染。
.病原微生物污染特点是,数量大,分布广,存活时间长,繁殖速度快,易产生抗药性而很难灭绝。
.酸、碱的污染必然伴随着无机盐类的污染。
13、引起光化学烟雾的初生污染物主要有。
.O3和反应性烃.反应性烃和硝酸.NO和反应性烃.NO2和O314、下列气体中, ____ 在对流层大气中浓度变化最大。
.O2.N2.He.SO215、可吸入颗粒物(PM10)是指悬浮在空气中,空气动力学当量直径---------的颗粒物。
.≤10 nm.≤10 μm.≤10 mm16、硫酸烟雾属于()。
.还原型烟雾.氧化型烟雾.煤炭型烟雾.光化学烟雾17、什么状态的镉易被植物所吸收?(). A. 难溶性螯合物存在的镉.可给态镉.沉淀态镉.代换态镉18、土壤的化学风化作用不包括()?.溶解和水解.水化和二氧化碳侵蚀.氧化还原.外力使岩石崩裂19、毒物的剂量-反应关系是()。


养殖水化学答案养殖水化学答案【篇一:养殖水化学知识点】xt>1. 天然水中的主要阳离子和主要阴离子2. 养殖水环境中重要的水质指标、意义及分类3. 表示水中含盐量的水质指标,表示方法间的关系,对养殖的影响4. 表示水中有机物的污染程度的水质指标5. 水中氮元素的存在形式、循环、及其相关的作用6. 养殖池塘中溶解氧的分布变化规律7. 温跃层及危害8. 水中有毒物质及影响因素9. 电子活度与pe、氧化还原电位10. 增氧作用和耗氧作用11.水中气体溶解度与饱和度,影响因素12.水体碱度、硬度,变化规律及与养殖的关系13.水体二氧化碳系统、分布系数与碳酸平衡14.水体ph变化规律及影响因素15.离子强度、活度与活度系数16.天然水的化学分类法17.水体透明度与补偿深度18.日较差及养殖水体溶解氧的管理19.植物对营养元素吸收的一般规律20.水中磷元素的存在形式、循环、及分布变化规律21.天然水有机物的分类22.腐殖质其对水中污染物迁移转化的影响23.水中胶体的种类、带电性与电动电位24.胶体的稳定性与脱稳25.胶体的吸附与吸附等温式26.溶解度与溶积度27.同离子效应与盐效应28.水中常见难容物质溶解性与ph的关系29.络合物与络合常数30.水中常见配位体的种类及对金属的配合作用31.水体缓冲体系32.水中毒物种类及特征33.水中调控1【篇二:养殖水化学】txt>一、考试说明1. 参考教材养殖水环境化学,雷衍之主编,中国农业出版社,2004年第1版2. 试卷结构(题型)及比例(总计100分)1)填空(30%)2)问答题(50%)3)计算题(20%)二、考试大纲1. 考试大纲的性质养殖水化学是水产养殖、水族科学与技术等专业的专业基础课程,是报考水产养殖、水产动物营养与饲料科学、渔业专业硕士研究生的考试科目之一。
为硕士学位考生参加养殖水化学课程考试,明确复习的主要内容和范围,特制定本考试大纲。

第三章水环境化学1、请推导出封闭和开放体系碳酸平衡中[H 2CO 3*]、[HCO 3-]和[CO 32-]的表达式,并讨论这两个体系之间的区别。
解: 开放体系,考虑到CO 2在气液相之间的平衡,[H 2CO 3*] 不变根据亨利定律: [CO 2(aq)] = K H Pco 2 lg[H 2CO 3*] ≈ lg[CO 2(aq)] = lg K H + lg Pco 2 = - 4.9lg[HCO 3-] = lg K 1 + lg [H 2CO 3*] + pH= -11.3 + pHlg[CO 32-] = lgK 1 + lgK 2 + lg[H 2CO 3*] + 2pH= -21.6 + 2pH*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H KK CO CO H CO H K K +--+⋅==⋅][][][233*32--++=CO HCO CO H C T 是常数。
的总和为各种碳酸化合态浓度假设,T C TC HCO ⎥⎦⎤⎢⎣⎡-=31αTC CO ⎥⎦⎤⎢⎣⎡-=232αTC CO H ⎥⎦⎤⎢⎣⎡*=320α122122][][1(-+++=K H K K H α1211)][][1(-++++=H K K H α122110][][1(-++++=H K K H K α*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H K K CO CO H CO H K K +--+⋅==⋅][][][][21233*32+--H K K CO HCO C CO H T 和含有的表示式,,为变量表示以:,][],[*],[21023332得到,,代入把αααT C CO HCO CO H --eg oo d 2、请导出总酸度、CO 2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总碳酸量和分布系数(α)的函数。

养殖⽔环境化学习题各章复习思考题及综合性模拟题参考答案第⼀章⼀、名词解释1、⽔质:⽔及其中杂质所共同表现出来的特征。
2、⽔质系:⽔和其中杂质所组成的⼀切复杂体系。
⼆、问答题(答题要点)1、为什么说天然⽔是包含各种杂质的溶液或浊液?答:天然⽔中溶解了多种盐类、⽓体和有机物,⽽且还含有泥沙、粘⼟颗粒、浮游⽣物、有机碎⽚等悬浮物质,所以说天然⽔是包括各种杂质的溶液和浊液。
2、⽔⽣⽣物与⽔、⽔质有何密切关系?(可问⽼师)答:主要从⽔⽣⽣物⽣长、繁殖等与⽔、⽔质的关系及养殖⽣产的产量、质量与⽔、⽔质的关系这两个⽅⾯另以阐述。
第⼆章⼀、名词解释1、硬度:单位⽔体中所含⼆价和⼆价以⾦属离⼦的总量为⽔的硬度。
2、暂时硬度:⽔中的钙、镁的碳酸氢盐在煮沸后即分解成碳酸盐沉淀析出,故相应的硬度⼜称暂时硬度。
3、永久硬度:钙、镁的硫酸盐、氯化物等,⽤⼀般的煮沸⽅法不能把它们从⽔中除去,所以⼜称永久硬度。
4、电导率:在相距1cm⽤惰性⾦属制成的平⾏电极间,电解质溶液有1cm2⾯上所具有的电导,称为电导率。
P325、离⼦活度:离⼦的有效浓度。
P306、⽔的透明度:把透明度板沉⼊⽔中,⾄恰好看不见板⾯上的⽩⾊,此时⽔的深度即为⽔的透明度。
7、温跃层:温度随深度增加⽽迅速降低的⽔层。
8、⽔温的正分层:指夏季的上层温度⾼,下层温度低的分层情况。
9、⽔温的逆分层:指冬季的上层温度低,下层温度⾼的分层情况。
10、⽔温的全同温:指春秋季的上下层温度⼏乎相同的情况。
⼆、问答题(答题要点)1、⽔的硬度如何分类?答:单位⽔体中所含Ca2+、Mg2+的总量称为⽔的总硬度,按照造成硬度的阳离⼦的不同,硬度⼜可分为钙硬度和镁硬度。
考虑阴离⼦组成,硬度可分为碳酸盐硬度(其中钙、镁的碳酸氢盐标定的硬度⼜称暂时硬度)和⾮碳酸盐硬度(⼜称永久硬度)。
2、硬度的常⽤单位有哪三种?这些单位之间如何相互换算?答:常⽤单位有:mmol(1/2 Ca2+,1/2 Mg2+)·L-1;德国度(0H G)和mg(CaCO3)·L-1三种。


2024年春江苏开放大学环境化学形考作业1 注意:学习平台题目可能是随机,题目顺序与本答案未必一致,同学们在本页按“Ctrl+F”快捷搜索题目中“关键字”就可以快速定位题目,一定注意答案对应的选项,如果答案有疑问或遗漏,请在下载网站联系上传者进行售后。
题型:单选题客观题分值2分难度:一般得分:21有机物累积的厌氧水环境,其“决定电位”物质是()。
A:有机物B:甲烷C:溶解氧D:二氧化碳学生答案:A:老师点评:题型:单选题客观题分值2分难度:简单得分:22下列大气污染物不属于二次污染物的是()?A:O2B:PANC:H2O2D:O3学生答案:A:老师点评:题型:单选题客观题分值2分难度:较难得分:23海水中Hg2+主要以()的形式存在。
A:HgCl2, HgCl3-B:HgCl3-, HgCl42-C:Hg(OH)2, HgCl2D:HgCl42-学生答案:D:老师点评:题型:单选题客观题分值2分难度:简单得分:24有机物的辛醇-水分配系数常用( )表示。
A:KoC:B:KowC:KD:D:Kom学生答案:B:老师点评:题型:单选题客观题分值2分难度:中等得分:25有机物通过()可能改变原化合物的化学结构、毒性、挥发性、生物降解的难易程度。
A:挥发作用B:生物降解作用C:水解反应D:分配作用学生答案:C:老师点评:题型:单选题客观题分值2分难度:中等得分:26硫酸型(伦敦)烟雾污染多发生于()季节。
A:冬季B:春季C:夏季D:秋季学生答案:A:老师点评:题型:单选题客观题分值2分难度:中等得分:27一般情况下,当水体DO()时,鱼类会死亡。
A:>0B:>4.0 mg/LC:>8.0mg/LD:<4.0 mg/L学生答案:D:老师点评:题型:单选题客观题分值2分难度:简单得分:28在水体中,颗粒物对重金属的吸附量随pH值升高而()?A:增加B:无法判断C:无影响D:减少学生答案:A:老师点评:题型:单选题客观题分值2分难度:中等得分:29洛杉矶烟雾属于()A:煤炭型烟雾B:还原型烟雾C:硫酸型烟雾D:氧化型烟雾学生答案:D:老师点评:题型:单选题客观题分值2分难度:一般得分:210保护地球生命屏障的臭氧层位于大气圈的( )层中。


水环境化学资料绪论:一、我们生活的环境:大气圈、水圈、岩石圈水圈的定义:狭义“水圈”是指海洋与陆地各种贮水水体,包括海洋、江河、湖泊、冰盖、沉积物中的间隙水等。
广义“水圈”则还包括其他圈层中存在的水。
世界水资源分布情况我国的水资源状况:我国水资源总量约为2.8124 万亿立方米,约占全球径流总量的5.8%,居世界第四位。
由于人口众多,目前我国人均水资源占有量仅为2220 m3,约为世界人均占有量的1/4,在世界上名列121位,是全球13 个人均水资源最贫乏的国家之一。
中国属于季风气候,水资源时空分布不均匀,南北自然环境差异大,其中北方9 省区,人均水资源不到500 m3,实属水少地区。
特别是近年来,城市人口剧增,生态环境恶化,工农业用水技术落后,浪费严重,水源污染,更使原本贫乏的水“雪上加霜”,而成为国家经济建设发展的瓶颈。
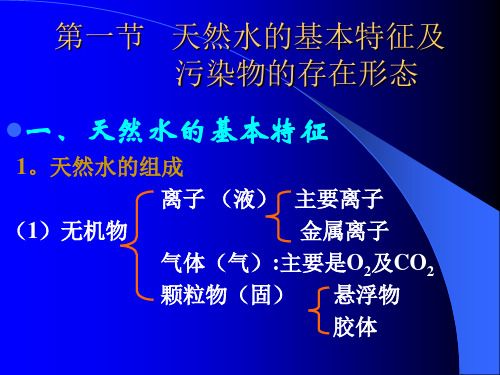
天然水质系的构成:水质系、天然水的概念及天然水质系的构成图天然水系的复杂性:水中含有的物质种类繁多,含量相差悬殊水中溶存物质的分散程度复杂:< 1 nm 真溶液状态存在的各种分子、离子1~1,000 nm 胶体分散态>1,000 nm 静置时易沉淀的粗分散态物质(如泥沙颗粒、浮游细菌、微藻等)水中存在的生物种类繁多天然水中化学成分的来源:大气淋溶从岩石、土壤中淋溶(地面径流、地下径流)生物作用(光合作用、呼吸作用、代谢、尸体腐解)次级反应与交换吸收作用工业废水、生活污水与农业退水二、环境化学与养殖水环境化学环境化学是环境科学的一个分支。
环境科学是研究人类环境质量及其控制、改善的原理、技术和方法的综合性科学。
环境化学是研究有害化学物质在环境介质中的来源、存在形态、化学特性、行为和效应、控制和治理的化学原理和方法的科学。
它又是化学科学的一个重要分支。
环境化学的研究内容:环境化学是从微观的原子水平上研究宏观的环境现象及防治方法,研究其中的化学机制。
研究对象:大气、天然水体及土壤分支学科:环境分析化学、各圈层环境化学(大气环境化学、水环境化学、土壤环境化学)、环境工程化学水环境化学与水产养殖:水环境化学讲授天然水中存在的物质的种类、形态、迁移转化的规律。



水环境化学实验指导一、银量法测定水体中的氯度实验目的:1、学习和掌握水体中氯离子含量的测定方法2、滴定指示剂的作用原理原理:在中性或弱碱性条件下用AgNO3滴定海水水样,以荧光黄钠盐-淀粉吸附指示剂指示滴定终点,终点时溶液由黄绿色转变为浅玫瑰红,用相同的方法滴定氯度标准液(NaCI或标准海水),从而计算水体的氯度。
二、实验用品:AgNO3标准溶液、荧光黄—淀粉指示剂、氯度标准溶液、250ml三角锥瓶、棕色酸式滴定管等。
三、配制:AgNO3标准溶液:取4.92克AgNO3 固体溶解于100 ml dd H2O中,棕色瓶保存;荧光黄—淀粉指示剂:(1)取50 ml dd H2O, 溶解NaOH 块0.2 g, 从中取10 ml 该溶液,加0.1 g 荧光黄,搅拌溶解,并逐步加稀HNO3 进行中和,当pH值为7.0时,最终溶液到100 ml.(2)淀粉溶液(10%), 将250 ml ddH2O中,加入25 g 可溶性淀粉,搅拌,加水后煮沸,冷却后即可。
(3)取(1)溶液12.5 ml + 250 ml 溶液(2)氯度的标准溶液:NaCl 16.37 g 溶解于500 ml dd H2O中,定容至500 ml , 即此溶液氯度值19.375实验步骤:一、AgNO3标准溶液的标定1、取氯度的标准溶液10 ml 于烧杯中,加几滴荧光黄—淀粉指示剂2、将AgNO3标准溶液加入到酸式滴定管中3、对烧杯中的氯度标准溶液进行滴定,记录开始,终止时的刻度读数,二者的差值为Vn(单位ml);注意烧杯中的颜色变化由黄绿色变为玫瑰红,即可。
校准因子f = 19.375/ Vn二、水样的测定准确移取水样10.00mL于三角锥瓶中,按步骤一)操作,其消耗AgNO3标准溶液的体积记为Vw。
3. 结果计算按下式计算海水氯度值CI‰=Vw· f +k =Vs+k氯度标准溶液的氯度值(本次实验为19.375),k—计算氯度的校正值(Vs为17‰左右时,k=0.05)。

水环境化学模拟试卷一、名词解释腐殖质、分配作用、优先污染物、酸度、碱度、硬度、水体自净、BOD、COD生物累积、生物浓缩、生物放大、光化学反应、光化学平衡、水污染、生物降解共代谢、水质指标、水环境二、填空 1. 有机物大量进入天然水体后,水体的溶解氧会发生阶段性的变化,一条受有机耗氧物污染的河流按其流向可分成三个区域:_________、___________和______________。
2. 天然水体中溶解氧的主要来源:______、_____和______。
3. 胶体的凝聚有两种基本形式:______和______4. 微生物分解利用氨基酸的主要3种方式:__________、_____________和______________。
5. 天然淡水中的主要阴离子成分有____________、___________、_______和____________。
6. 根据吸附过程的内在机理,吸附作用大体可分为________、_______和_________7. 用于阐明水体中吸附等温线方程有三种基本类型,简称为H型________和_________。
8. 微生物对有机物的降解能力大小,可将有机物分为:。
9. 天然水体中常见的配位化合物分和两类。
10. 影响腐殖质光化学反应的因素有:、、和曝气条件。
11. 天然淡水中的主要阳离子成分有、、和。
12. 按照吸附过程的内在机理,吸附可分为、和。
13湖泊主要的污染问题有和三、判断改错题1. 与生活在水体中微生物相比,鱼类对水质影响较大。
()2. 垂直湖水中,pE随湖的深度增加而增加。
()3. 有些重金属经过配合后生物毒性显著降低,有些金属配合物则对生物有更大毒性。
()4. 雨水和河水相比,雨水与海水的性质更接近。
()5. 专属吸附可以发生在带相同电荷符号的表面和吸附离子之间()6 鱼池水中溶氧主要为养殖鱼类所消耗7. 垂直湖水中,溶解氧随湖的深度增加而增加。

第3章水环境化学1、什么是表面吸附作用,离子交换吸附作用和专属吸附作用并说明水合氧化物对金属离子的专属吸附和非专属吸附的区别.(1)表面吸附:由于胶体表面具有巨大的比表面和表面能,因此固液界面存在表面吸附作用.胶体表面积越大,吸附作用越强.(2)离子交换吸附:环境中大部分胶体带负电荷,容易吸附各种阳离子.胶体每吸附一部分阳离子,同时也放出等量的其他阳离子,这种作用称为离子交换吸附作用,属于物理化学吸附.该反应是可逆反应,不受温度影响,交换能力与溶质的性质,浓度和吸附剂的性质有关.(3)专属吸附:指在吸附过程中,除了化学键作用外,尚有加强的憎水键和范德化力或氢键作用.该作用不但可以使表面点荷改变符号,还可以使离子化合物吸附在同号电荷的表面上.(4)水合氧化物对金属离子的专属吸附与非金属吸附的区别如下表所示.快速可逆请叙述氧化物表面吸附配合模型的基本原理以及与溶液中配合反应的区别。
2、已知Fe3+与水反应生成的主要配合物及平衡常数如下:Fe3+ + H2OFe(OH)2+ + H+ lgK1= - 2.16Fe3+ + 2H2OFe(OH)2+ + 2H+ lgK2= - 6.74Fe(OH)3(s) Fe3+ + 3OH- lgKso= - 38Fe3+ + 4H2OFe(OH)4- + 4H+ lgK4= - 232Fe3+ + 2H2OFe2(OH)24+ + 2H+ lgK= - 2.91请用pc-pH图表示Fe(OH)3(s)在纯水中的溶解度与pH的关系.解:(1)K1=[Fe(OH)2+][H+]/ [Fe3+]=[Fe(OH)2+]KW3/Kso[H+]2p[Fe(OH)2+]=3 lgKW - lgKso + 2 pH - lgK1=2 pH - 1.84(2)K2=[Fe(OH)2+][H+]2/ [Fe3+]=[Fe(OH)2+]KW3/Kso[H+]p[Fe(OH)2+]=3 lgKW - lgKso + pH - lgK2=pH + 2.74(3)Kso=[Fe3+][OH-]3=[Fe3+]KW3/[H+]3p[Fe3+]=3 lgKW - lgKso + 3 pH=3 pH - 4(4)K4=[Fe(OH)4-][H+]4/ [Fe3+]=[Fe(OH)4-][H+]KW3/ Ksop[Fe(OH)4-]=3 lg KW - lgK4 - lgKso - pH=19 - pH(5)K=[Fe2(OH)24+][H+]2/ [Fe3+]2=[Fe2(OH)24+]KW6/ Kso2[H+]4p[Fe2(OH)24+]=6 lg KW - lgK - 2 lgKso + 4 pH=4 pH - 5.09用pc-pH图表示Fe(OH)3(s)在纯水中的溶解度与pH的关系如下4解释下列名词:分配系数;标化分配系数;辛醇-水分配系数;生物浓缩因子;亨利定律常数;水解速率;直接光解;光量子产率;生长物质代谢和共代谢.(1)分配系数:在土壤-水体系中,土壤对非离子性有机化合物的吸着主要是溶质的分配过程(溶解),即非离子性有机化合物可通过溶解作用分配到土壤有机质中,并经过一定时间达到分配平衡,此时有机化合物在土壤有机质和水中含量的比值称为分配系数.(2)标化分配系数:有机化合物在颗粒物-水中的分配系数与颗粒物中有机碳呈正相关,以固相有机碳为基础的分配系数即标化分配系数.(3)辛醇-水分配系数:有机化合物的正辛醇-水分配系数(KOW)是指平衡状态下化合物在正辛醇和水相中浓度的比值.它反映了化合物在水相和有机相之间的迁移能力,是描述有机化合物在环境中行为的重要物理化学参数.KOW与化合物的水溶性,土壤吸附常数和生物浓缩因子等密切相关.(4)生物浓缩因子:有机毒物在生物体内浓度与水中该有机物浓度之比.(5)亨利定律常数:通常可理解为非电解质稀溶液的气-水分配系数.(6)水解速率:反映某一物质在水中发生水解快慢程度的一个参数.(7)直接光解:化合物本身直接吸收太阳能而进行分解反应.(8)光量子产率:分子被活化后,它可能进行光反应,也可能通过光辐射的形式进行"去活化"再回到基态,进行光化学反应的光子数占吸收光子数之比称为光量子产率.(9)生长物质代谢和共代谢:生物降解过程中,一些有机污染物作为食物源提供能量和提供酶催化反应分解有机物,这称为生长物质代谢.某些有机污染物不能作为微生物的唯一碳源与能源,必须有另外的化合物存在提供微生物碳源或能源时,该有机物才能被降解,这种现象称为共代谢.5请叙述有机物在水环境中的迁移,转化存在哪些重要过程.(1)负载过程:污水排放速率,大气沉降以及地表径流引入有机毒物至天然水体均将直接影响污染物在水中的浓度.(2)形态过程:①酸碱平衡:天然水中pH决定着有机酸或碱以中性态存在的分数,因而影响挥发及其他作用.②吸着作用:疏水有机化合物吸着至悬浮物上,由于悬浮物质的迁移而影响它们以后的归趋.(3)迁移过程:①沉淀-溶解作用:污染物的溶解度范围可限制污染物在迁移,转化过程中的可利用性或者实质上改变其迁移速率.②对流作用:水力流动可迁移溶解的或者被悬浮物吸附的污染物进入或排出特定的水生生态系统.③挥发作用:有机污染物可能从水体进入大气,因而减少其在水中的浓度.④沉积作用:污染物被吸附沉积于水体底部或从底部沉积物中解吸,均可改变污染物的浓度.(4)转化过程:①生物降解作用:微生物代谢污染物并在代谢过程中改变它们的毒性.②光解作用:污染物对光的吸收有可能导致影响它们毒性的化学反应的发生.③水解作用:一个化合物与水作用通常产生较小的,简单的有机产物.④氧化还原作用:涉及减少或增加电子在内的有机污染物以及金属的反应都强烈地影响环境参数.(5)生物累积过程:①生物浓缩作用:通过可能的手段如通过鱼鳃的吸附作用,将有机污染物摄取至生物体.②生物放大作用:高营养级生物以消耗摄取有机毒物进入生物体低营养级生物为食物,使生物体中有机毒物的浓度随营养级的提高而增大.请叙述有机物水环境归趋模式的基本原理。

水环境化学作业(1)
一、填空题
1.天然水中的[总碱度]= +2 + [OH-] —。
2.水环境中胶体颗粒物的吸附作用有、和
3.影响胶体微粒聚沉的因素有_________、___________、_________、水体pH及流动状况,带相反电荷颗粒间的相互作用。
4.适用于水体颗粒物对污染物吸附的等温式有_______________、
_________________和_______________三种方程。
其中
_______________可求饱和吸附量。
5.某一氧化还原体系的标准电极电位为0.771,其pE o为______。
6、腐殖质中不溶于NaOH的部分称为__________,可溶于NaOH的部分称为__________,既溶于碱又溶于酸的部分称为_________。
7、天然水的PE随水中溶解氧的减少而,因而表层水呈
环境。
二、简答题
1. 向某一含有碳酸的水体加入重碳酸盐,问:①总酸度、②总碱度、
③无机酸度、④酚酞碱度、⑤CO2酸度,是增加还、减少还是不变。
2. 什么是表面吸附作用、离子交换吸附作用和专属吸附作用?并说明水合氧化物对金属离子的专属吸附和非专属吸附的区别。
3. 请说明水体中胶体的凝聚和絮凝之间的区别。
三、计算题
1.含镉废水通入H2S达到饱和并调整pH为8.0,计算水中剩余镉离子浓度。
[Ksp(CdS=7.9×10-27)]
2.用Langmuir方程描述悬浮物对溶质的吸附作用,假设溶液平衡浓度为
3.00×10-3mol/L,溶液中每克悬浮物固体吸附溶质0.50×10-3mol/L,当平衡浓度降至 1.00×10-3mol/L时, 每克吸附剂吸附溶质0.25×10-3mol/L,问每克吸附剂可以吸附溶质的限量是多少?
3. 若有水A,pH为7.5,其碱度为6.38 mmol/L,水B的pH为9.0,
碱度为0.80 mmol/L,若以等体积混合,问混合后的pH值是多少?
4. 在一个pH为6.5,碱度为1.6 mmol/L的水体中,若加入碳酸钠使其碱化,问需要加多少mmol/L的碳酸钠才能使水体pH值上升至8.0。
若用NaOH强碱进行碱化,又需要多少碱?。