高考化学工业流程题大全题
- 格式:doc
- 大小:2.77 MB
- 文档页数:17

精心整理高三化学工业实验试题精选1、(2014 山东高考)工业上用重铬酸钠(Na Cr O )结晶后的母液(含少量杂质 Fe 3+)生产重22 7铬酸钾(K 2Cr 2O 7)。
工艺流程及相关物质溶解度曲线如图: (1)由 Na 2Cr 2O 7 生产 K 2Cr 2O 7 的化学方程式为____________________________,通过冷却结晶析出大量 K 2Cr 2O 7 的原因是____________________________。
(2)向 Na 2Cr 2O 7 母液中加碱液调 PH 的目的是____________________________。
(3)固体 A 主要为__________________(填化学式),固体 B 主要为________(填化学式)。
(4)用热水洗涤固体 A ,回收的洗涤液转移到母液______(填“I ”“II ”或“III ”)中,既能提高产率又可使能耗最低。
2、(2014 年江苏高考)烟气脱硫能有效减少二氧化硫的排放。
实验室用粉煤灰(主要含 Al O 、2 3SiO 2 等)制备碱式硫酸铝[Al 2(SO 4)x (OH)6—2x]溶液,并用于烟气脱硫研究。
(1)酸浸时反应的化学方程式为;滤渣Ⅰ的主要成分为。
(2)加 CaCO 3 调节 pH 至 3.6,其目的是中和溶液中的酸,并使 Al 2(SO 4)3 转化为 Al 2(SO4)x (OH)6—2x。
滤渣Ⅱ的主要成分为 (填化学式);若溶液的 pH 偏高,将会导致溶液中铝元素的含量降低,其原因是(用离子方程式表示)。
(3)上述流程中经完全热分解放出的 SO 2 量总是小于吸收的 SO 2 量,其主要原因是;与吸收 SO 2 前的溶液相比,热分解后循环利用的溶液的 pH 将(填“增大”、“减小”或“不变”)。
3、(2014 年江苏高考)实验室从含碘废液(除 H O 外,含有 CCl 、I 、I -等)中回收碘,其实验24 2过程如下:(1)向含碘废液中加入稍过量的 Na 2SO 3 溶液,将废液中的 I 2 还原为 I -,其离子方程式为;该操作将 I 2 还原为 I -的目的是。
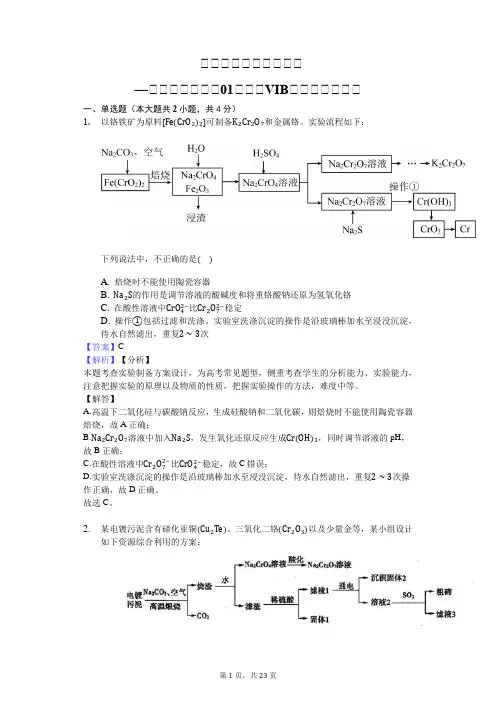
高高高高高高高高高高—高高高高高高高01高高高VIB高高高高高高高一、单选题(本大题共2小题,共4分)1.以铬铁矿为原料[Fe(CrO2)2]可制备K2Cr2O7和金属铬。
实验流程如下:下列说法中,不正确的是()A. 焙烧时不能使用陶瓷容器B. Na2S的作用是调节溶液的酸碱度和将重铬酸钠还原为氢氧化铬C. 在酸性溶液中CrO42−比Cr2O72−稳定D. 操作①包括过滤和洗涤。
实验室洗涤沉淀的操作是沿玻璃棒加水至浸没沉淀,待水自然滤出,重复2∼3次【答案】C【解析】【分析】本题考查实验制备方案设计,为高考常见题型,侧重考查学生的分析能力、实验能力,注意把握实验的原理以及物质的性质,把握实验操作的方法,难度中等。
【解答】A.高温下二氧化硅与碳酸钠反应,生成硅酸钠和二氧化碳,则焙烧时不能使用陶瓷容器焙烧,故A正确;B.Na2Cr2O7溶液中加入Na2S,发生氧化还原反应生成Cr(OH)3,同时调节溶液的pH,故B正确;C.在酸性溶液中Cr2O72−比CrO42−稳定,故C错误;D.实验室洗涤沉淀的操作是沿玻璃棒加水至浸没沉淀,待水自然滤出,重复2∼3次操作正确,故D正确。
故选C。
2.某电镀污泥含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量金等,某小组设计如下资源综合利用的方案:已知:碲和硫位于同主族,煅烧时Cu 2Te 发生的反应为,滤渣中TeO 2溶于稀硫酸发生的反应为TeO 2+H 2SO 4=TeOSO 4+H 2O 。
下列说法错误的是( )A. “高温煅烧”电镀污泥时铜、碲和铬元素都被氧化B. “酸化”时可向溶液中加入硫酸C. “固体1”的主要成分为CuD. “滤液3”可以循环利用【答案】C【解析】【分析】本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离提纯方法、流程中发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大。


工业流程题高中化学题目
温馨提示:文档内容仅供参考
当涉及到工业流程的高中化学题目时,以下是一些例子:
描述硫酸的制备工艺及其反应方程式。
详细说明氯气的制备方法以及反应条件。
解释苯的制备工艺,包括反应方程式和所使用的原料。
说明氨的工业制备方法及其反应方程式。
描述制备纯净铜的工业过程,包括反应方程式和纯化步骤。
详细解释制备氢氧化钠的工业过程,包括反应方程式和纯化方法。
解释硝酸的工业制备方法,包括反应方程式和所需原料。
描述制备纯净铝的工业流程,包括反应方程式和纯化步骤。
详细说明制备硝酸盐肥料的工业过程,包括反应方程式和纯化方法。
解释制备聚氯乙烯(PVC)的工业过程,包括反应方程式和聚合条件。
这些题目涵盖了一些常见的工业流程,可以帮助学生了解化学知识在实际应用中的应用和重要性。
请注意,每个工业流程都有更详细的步骤和条件,这里提供的是简化的概述。
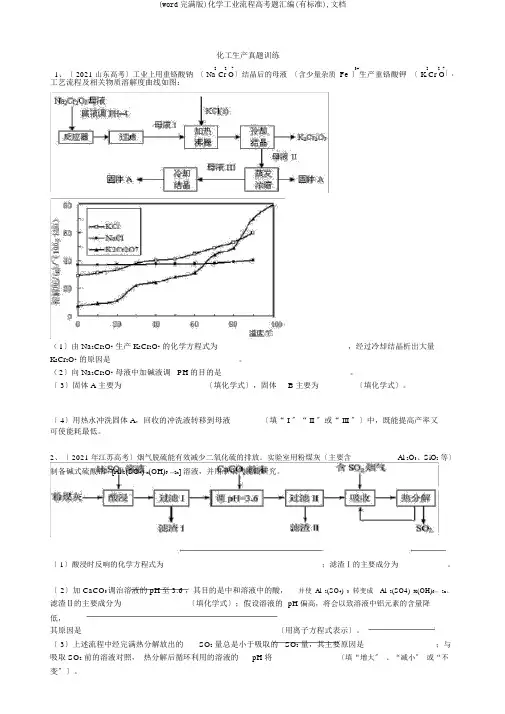
化工生产真题训练2273+227〕。
1、〔 2021 山东高考〕工业上用重铬酸钠〔 Na Cr O〕结晶后的母液〔含少量杂质Fe 〕生产重铬酸钾〔 K Cr O工艺流程及相关物质溶解度曲线如图:(1〕由 Na2Cr2O7生产 K2Cr2O7的化学方程式为 ____________________________ ,经过冷却结晶析出大量K2Cr2O7的原因是 ____________________________ 。
(2〕向 Na2Cr2O7母液中加碱液调 PH的目的是 ____________________________ 。
〔 3〕固体 A 主要为 __________________ 〔填化学式〕,固体 B 主要为 ________〔填化学式〕。
〔 4〕用热水冲洗固体 A,回收的冲洗液转移到母液 ______ 〔填“ I 〞“ II 〞或“ III 〞〕中,既能提高产率又可使能耗最低。
Al 2O3、SiO2等〕2、〔 2021 年江苏高考〕烟气脱硫能有效减少二氧化硫的排放。
实验室用粉煤灰〔主要含制备碱式硫酸铝[Al 2(SO4) x(OH)6—2x] 溶液,并用于烟气脱硫研究。
〔 1〕酸浸时反响的化学方程式为;滤渣Ⅰ的主要成分为。
〔 2〕加 CaCO3调治溶液的 pH至 3.6 ,其目的是中和溶液中的酸,并使Al2(SO4)3转变成Al2(SO4)x(OH)6—2x。
滤渣Ⅱ的主要成分为〔填化学式〕;假设溶液的pH 偏高,将会以致溶液中铝元素的含量降低,其原因是〔用离子方程式表示〕。
〔 3〕上述流程中经完满热分解放出的SO2量总是小于吸取的SO2量,其主要原因是;与吸取 SO2前的溶液对照,热分解后循环利用的溶液的pH 将〔填“增大〞、“减小〞或“不1/113、〔 2021 年江苏高考〕实验室从含碘废液〔除H 2O 外,含有 CCl 4、 I 2、 I - 等〕中回收碘,其实验过程如下:〔 1〕向含碘废液中参加稍过分的 Na SO 溶液,将废液中的 I-;2复原为 I ,其离子方程式为2 3该操作将 I 2 复原为 I -的目的是 。

11.现有NaCl 、24Na SO 和3NaNO 的混合物,选择适当的试剂除去杂质,从而得到纯净的3NaNO 晶体,相应的实验流程如图所示。
(1)写出实验流程中下列物质的化学式:试剂X_______,沉淀A_______。
(2)上述实验流程中①①①步均要进行的实验操作是_______(填操作名称)。
(3)按此实验方案得到的溶液3中肯定含有_______(填化学式)杂质。
为了解决这个问题,可以向溶液3中加入适量的_______(填化学式)。
(4)①实验室需要 240 mL 2.0013mol L NaNO -⋅溶液,所用仪器除天平、烧杯、药匙、玻璃棒外还有_______、_______(填仪器名称);①配制该溶液时,若出现以下情况,会导致溶质的物质的量浓度偏高的是_______(填序号) a.洗净的容量瓶未烘干 b.溶液转移至容量瓶中后没有洗涤烧杯c.定容时俯视刻度线d.发现凹液面超过了刻度线,立即将多余的溶液吸出2用海底锰结核(主要成分为MnO 2,含少量MgO 、Fe 2O 3、Al 2O 3、SiO 2)为原料,制备金属锰、镁的一种工艺流程路线如图:已知:①几种难溶物的溶度积(25①)如表所示: 化学式 Mg(OH)2 Mn(OH)2 Al(OH)3 Fe(OH)3K sp1.8×10−11 1.8×10−13 1.0×10−33 4.0×10−38①溶液中某离子浓度≤1.0×10−6 mol∙L−1时,认为该离子沉淀完全。
(1)“锰结核粉末”中MnO 2与SO 2反应的离子方程式为 _______。
(2)“滤液1”中c(Mn 2+)为0.18 mol∙L −1,则“调节pH”的范围为_______,“滤渣2”的成分为_______。
(3)“①”处“萃取剂”萃取的成分是_______;(4)MgCl 2·6H 2O 制取无水MgCl 2时,需要在干燥的HCl 气流中加热分解,其中HCl 的作用为_______。
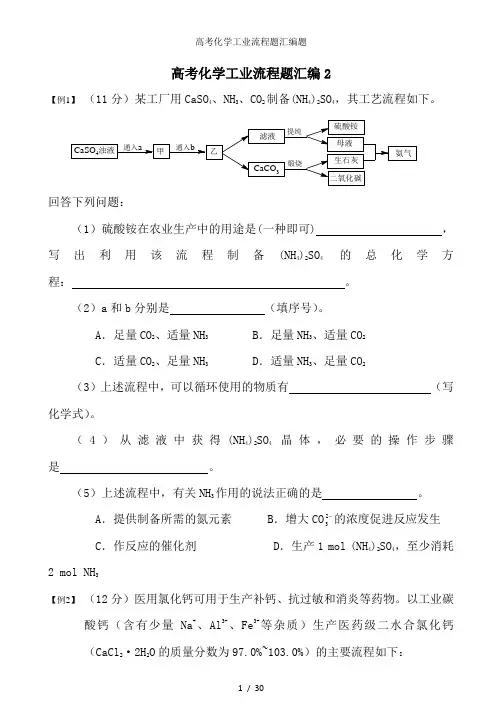
高考化学工业流程题汇编2【例1】(11分)某工厂用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如下。
回答下列问题:(1)硫酸铵在农业生产中的用途是(一种即可) ,写出利用该流程制备(NH4)2SO4的总化学方程:。
(2)a和b分别是(填序号)。
A.足量CO2、适量NH3 B.足量NH3、适量CO2C.适量CO2、足量NH3 D.适量NH3、足量CO2(3)上述流程中,可以循环使用的物质有(写化学式)。
(4)从滤液中获得(NH4)2SO4晶体,必要的操作步骤是。
(5)上述流程中,有关NH3作用的说法正确的是。
A.提供制备所需的氮元素 B.增大CO2的浓度促进反应发生3C.作反应的催化剂 D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3【例2】(12分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。
以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:(1)除杂操作是加入Ca(OH)2,调节溶液pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。
检验Fe(OH)3是否沉淀完全的实验操作是。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止Ca2+在蒸发时水解;②。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL 容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有。
②计算上述样品中CaCl2·2H2O的质量分数为。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有;。
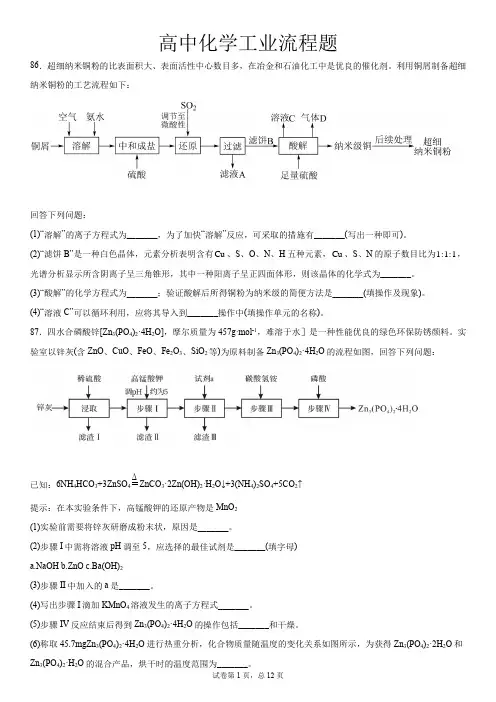
高中化学工业流程题86.超细纳米铜粉的比表面积大、表面活性中心数目多,在冶金和石油化工中是优良的催化剂。
利用铜屑制备超细纳米铜粉的工艺流程如下:回答下列问题:(1)“溶解”的离子方程式为_______,为了加快“溶解”反应,可采取的措施有_______(写出一种即可)。
(2)“滤饼B”是一种白色晶体,元素分析表明含有Cu、S、O、N、H五种元素,Cu、S、N的原子数目比为1:1:1,光谱分析显示所含阴离子呈三角锥形,其中一种阳离子呈正四面体形,则该晶体的化学式为_______。
(3)“酸解”的化学方程式为_______;验证酸解后所得铜粉为纳米级的简便方法是_______(填操作及现象)。
(4)“溶液C”可以循环利用,应将其导入到_______操作中(填操作单元的名称)。
87.四水合磷酸锌[Zn3(PO4)2·4H2O],摩尔质量为457g·mol-1,难溶于水]是一种性能优良的绿色环保防锈颜料。
实验室以锌灰(含ZnO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图,回答下列问题:已知:6NH4HCO3+3ZnSO4ΔZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2↑提示:在本实验条件下,高锰酸钾的还原产物是MnO2(1)实验前需要将锌灰研磨成粉末状,原因是_______。
(2)步骤I中需将溶液pH调至5,应选择的最佳试剂是_______(填字母)a.NaOHb.ZnOc.Ba(OH)2(3)步骤II中加入的a是_______。
(4)写出步骤I滴加KMnO4溶液发生的离子方程式_______。
(5)步骤IV反应结束后得到Zn3(PO4)2·4H2O的操作包括_______和干燥。
(6)称取45.7mgZn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。

高三化学化工流程题例题下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!高三化学化工流程题解析:以硫酸工业制备为例在高三的化学学习中,化工流程题是一种常见的题型,它要求学生理解和应用化学原理,理解化学反应过程,并能根据化工生产流程进行分析和推理。
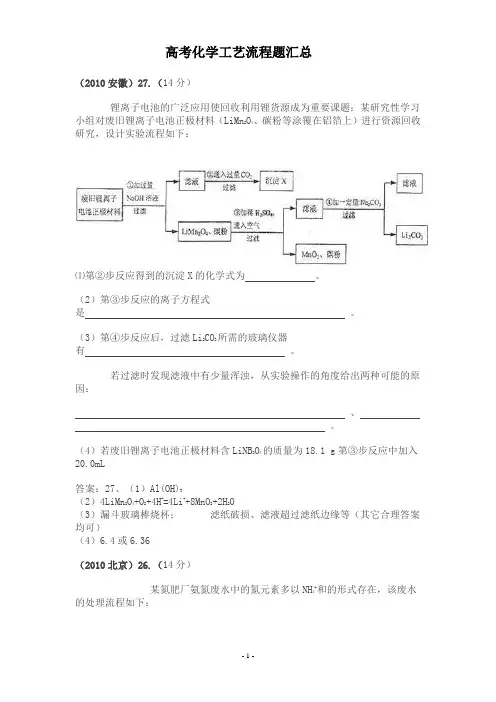
高考化学工艺流程题汇总(2010安徽)27.(14分)锂离子电池的广泛应用使回收利用锂货源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:⑴第②步反应得到的沉淀X的化学式为。
(2)第③步反应的离子方程式是。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:、。
(4)若废旧锂离子电池正极材料含LiNB2O4的质量为18.1 g第③步反应中加入20.0mL答案:27、(1)Al(OH)3(2)4LiMn2O4+O2+4H+=4Li++8MnO2+2H2O(3)漏斗玻璃棒烧杯;滤纸破损、滤液超过滤纸边缘等(其它合理答案均可)(4)6.4或6.36(2010北京)26.(14分)某氮肥厂氨氮废水中的氮元素多以NH4+和的形式存在,该废水的处理流程如下:(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:。
②用化学平衡原理解释通空气的目的:。
(2)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成。
两步反应的能量变化示意图如下:①第一步反应是反应(选题“放热”或“吸热”),判断依据是。
②1mol NH4+(aq)全部氧化成NO3—(aq)的热化学方程式是。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。
若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是。
答案:(14分)(1)①NH4++OH-===NH3.H2O②废水中的NH3被空气带走,使NH3.H2O NH3+H2OD的平衡向正反应方向移动,利于除氨(2)①放热△H=-273kJ/mol<0(反应为的总能量大于生成物的总能量)②NH4+(aq)+2O2(g)===2H+(aq)+NO3-(aq)+H2O(l)△ H=-346kJ/mol③5:6(2010广东)32.(16分)碳酸锂广泛应用于陶瓷和医药等领域,以β-锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、5.2、9.7和12.4。

2.下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
(1)写出工业上用FeS2制取SO2的化学方程式。
(2)写出上图中部分装置的作用:甲:①混合SO2和O2;②;丙和丁:。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;②(4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于;丙和丁相当于。
(5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率3.氨在国民经济中占有重要的地位。
现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。
例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:设备A的名称是,设备B的名称是。
(2)硝酸厂的尾气中含有NO和NO2等污染物,籽了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:Na2CO3+2NO2====NaNO2+NaNO3+CO2但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。
写出甲烷与NO2反应的化学反应方程式:。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。
高考专题练习—-工艺流程题1.(15分)聚合氯化铝晶体的化学式为[Al 2(OH)n Cl 6—n ·xH 2O]m ,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl 3溶液的pH ,通过促进其水解而结晶析出。
其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al 2O 3、Al ,还有SiO 2等杂质。
聚合氯化铝生产的工艺流程如下:(1)搅拌加热操作过程中发生反应的离子方程式; 。
(2)生产过程中操作B 和D 的名称均为(B 和D 为简单操作)。
(3)生产过程中可循环使用的物质是(用化学式表示)。
(4)调节pH 至4。
0~4。
5的目的是.(5)实验室要测定水处理剂产品中n 和x 的值。
为使测定结果更准确,需得到的晶体较纯净。
生产过程中C 物质可选用。
A .NaOHB .AlC .氨水D .Al 2O 32.(16分)将磷肥生产中形成的副产物石膏(CaSO 4·2H 2O )转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO 4·2H 2O 、(NH 4)2CO 3外,还需要_______________等原料; (2)石膏悬浊液中加入碳酸铵溶液后反应的化学方程式为:______________________________________________________________________________;(3)过滤Ⅰ操作所得固体有______________________(填化学式)等物质,该固体可用作生产水泥的原料; (4)过滤Ⅰ操作所得滤液是(NH 4)2SO 4溶液。
检验滤液中含有NH 4+的方法是:_____________________________________________________________________________;(5)氯化钙结晶水合物(CaCl 2·6H 2O )是目前常用的无机储热材料,选择的依据除熔点较低和熔化的热效应高外,还因为其____________________________________________,举出该晶体的无水物在实验室的一种用途____________________________________________ 。
工业流程题,实验题(锆专题)1氢氧化锆[Zr(OH)4]广泛应用于塑料、橡胶、交换树脂等多种化工行业。
实验室中以含锆废料(含ZrO2和少量Cu、Si、Al的氧化物)为原料制备氢氧化锆的工艺流程如下。
下列说法正确的是A.“熔融”操作可在瓷坩埚中进行B.“浸取”后通过分液可得到含有Na2SiO3和NaAlO2的浸液C.Cu2+与NH3形成配离子的稳定性强于Cu2+与H2O形成配离子的稳定性D.可用浓NaOH溶液洗涤Zr(OH)4粗品2以锆矿石(主要成分为ZrO2,还含有SiO2及钠、铝、铜的氧化物等杂质)为原料制备工业纯ZrO2的工艺流程如图:下列说法错误的是A.“高温氯化”结束前通一段时间氧气的目的是除去过量的炭黑B.“溶液1”中含有的溶质主要为NaCl、NaOH、Na2SiO3C.“碱浸”后分离操作要用到的玻璃仪器有烧杯、玻璃棒、漏斗D.“除杂”的目的是除去铜元素3氧化锆是一种高级耐火材料,氧化钇主要用作制造微波用磁性材料。
一种利用玻璃窑炉替换下的锆废砖(主要成分ZrO2、Y2O3、CaO等)提纯氧化锆和氧化钇的工艺流程如下:下列说法正确的是A.“酸化、焙烧”时可用盐酸代替硫酸B.“中和1”发生反应的离子方程式为Zr4++4OH-=Zr OH4↓C.“焙烧”时Zr与Y元素化合价均发生改变D.滤液2可以处理后返回“酸化、焙烧”使用,实现循环4锆产品的主要原料是锆英砂,全球90%的氧氯化锆(ZrOCl2)来源于中国。
氧氯化锆可溶于水,微溶于盐酸,工业上以锆英砂(含91.5%ZrSiO4,杂质不与NaOH溶液反应)为原料生产ZrOCl2的一种工艺流程如图所示。
已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:(1)锆英砂在“碱烧”前粉碎的目的是,“碱烧”时ZrSiO4生成了Na2ZrO3和另一种钠盐X,X的化学式为,X的用途是(写一种)。
(2)“转型”时发生反应的化学方程式为。
高考化学工业流程题专题训练 【试一试】自我检测基础掌握如何? 【练1】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:请回答下列问题:________。
(2)电解熔融的氧化铝时,加入冰晶石的作用是________________。
(3)操作I 、操作II 、操作III 都是________________(填操作名称),实验室要洗涤Al(OH)3沉淀应该在________________装置中实行。
(4)生产过程中,除NaOH 、H 2O 能够循环使用外,还能够循环使用的物质有________(填化学式)。
用此法制取铝的副产品是________(填化学式)。
(5)写出Na 2CO 3溶液与CaO 反应离子方程式:__________________________________。
(6)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:________(填化学式)。
【考题·点悟】看看以前是怎么考的!【练2】亚氯酸钠(NaClO 2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。
以下是过氧化氢法生产亚氯酸钠的工艺流程图:已知:①NaClO 2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO 2•3H 2O 。
②纯ClO 2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH 溶液是指160 gNaOH 固体溶于水所得溶液的体积为1L 。
(1)160 g/L NaOH 溶液的物质的量浓度为 。
若要计算该溶液的质量分数, 还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a .将SO 2氧化成SO 3,增强酸性;b .稀释ClO 2以防止爆炸;c .将NaClO 3氧化成ClO 2溶解 吸收塔 NaClO 3配料ClO 2发生器H 2O 稀H 2SO 4160g/LNaOH SO 2和空 气混合气 H 2O 2过滤 滤液NaClO 2•3H 2O(3)吸收塔内的反应的化学方程式为。
高考化学一轮复习题:工业流程题1.(2022·福建·厦门双十中学模拟预测)砷的化合物可用于半导体领域,如我国“天宫”空间站的核心舱“天和号”就是采用砷化镓薄膜电池来供电。
一种从酸性高浓度含砷废水[砷主要以亚砷酸()33H AsO 形式存在]中回收砷的工艺流程如下:已知:①2333332As S 6NaOH Na AsO Na AsS 3H O +=++ ①()()23233As S (s)3S aq 2AsS aq --+①砷酸()34H AsO 是一种弱酸,在酸性条件下有强氧化性,能被2SO 、氢碘酸还原 (1)23As S 中砷元素的化合价为_______价。
(2)“沉砷”过程中FeS 是否可以用过量的2Na S 替换?请做出判断并从平衡移动的角度解释原因:_______。
(3)向滤液①中通入氧气进行“氧化脱硫”,请写出脱硫的化学反应方程式_______。
(4)用2SO 进行“还原”过程,请写出其离子反应方程式:_______,若需检验还原后溶液中是否仍存在砷酸,则还需要的另取的实验试剂_______。
(5)已知:常温下,pH 7>时,吸附剂表面带负电,pH 越大,吸附剂表面带的负电荷越多;pH<7时,吸附剂表面带正电,pH 越小,吸附剂表面带的正电荷越多。
当溶液pH 介于7~9,吸附剂对五价砷平衡吸附量随pH 的升高而下降,试分析其原因:_______。
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH ,将砷元素转化为()342Ca AsO 沉淀。
若沉降后上层清液中()2+c Ca为3210mol /L -⨯,则该溶液中34AsO -的浓度为_______mol/L(已知:()19sp 342Ca AsO 810K -⎡⎤=⨯⎣⎦)。
2.(2022·黑龙江·哈师大附中三模)锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。
2023届高考化学第一轮专题复习真题试卷模拟——工业流程题(1)6LiPF 中基态Li +的电子排布式为___________,6PF -中P 原子上的孤电子对数为___________。
(2)反应釜1中生成的3LiHCO 在反应釜2中转化为LiF 沉淀,其反应的离子方程式为___________。
本工艺未采用23Li CO (工业级)与氢氟酸直接反应制备LiF 的原因是___________。
已知:TiO 2难溶于盐酸;K sp [Fe(OH)3]=1.0×10−38。
回答下列问题:(1)为提高“酸浸”速率,对“赤泥”的处理方式为___________;滤渣I 的主要成分是___________(填化学式)。
(2)“氧化”时加入足量H 2O 2的目的是___________;氧化后溶液中Fe 3+浓度为0.001mol∙L −1,常温下“调pH”时,若控制pH =3,则Fe 3+的去除率为___________(忽略调pH 前后溶液的体积变化)。
(3)已知25℃时,K h1(C 2O 24-)=a ,K h2(C 2O 24-)=b ,K sp [Sc 2(C 2O 4)3]=c 。
“沉钪”时,发生反应:2Sc 3++3H 2C 2O 4 Sc 2(C 2O 4)3↓+6H +,该反应的平衡常数K =___________(用含a 、b 、c 的代数式表示)。
(4)Sc 2(C 2O 4)3·6H 2O 在空气中加热至550℃时生成Sc 2O 3、CO 2和H 2O ,写出反应的化学方程式___________。
3.(2023·山东潍坊·统考模拟预测)氧化铈(2CeO )是一种应用非常广泛的稀土氧化物。
现以氟碳铈矿(含3CeFCO 、2SiO 等)为原料制备氧化铈,其工艺流程如图所示:已知:①3Ce +在空气中易被氧化,易与24SO -形成复盐沉淀;②硫脲()具有还原性,酸性条件下易被氧化为()232SCN H ;③4Ce +在硫酸体系中能被萃取剂[()2HA ]萃取,而3Ce +不能。
高考化学工业流程题汇编2 【例1】 (11分)某工厂用CaSO 4、NH 3、CO 2制备(NH 4)2SO 4,其工艺流程如下。
回答下列问题:(1)硫酸铵在农业生产中的用途是(一种即可) ,写出利用该流程制备(NH 4)2SO 4的总化学方程: 。
(2)a 和b 分别是 (填序号)。
A .足量CO 2、适量NH 3B .足量NH 3、适量CO 2C .适量CO 2、足量NH 3D .适量NH 3、足量CO 2(3)上述流程中,可以循环使用的物质有 (写化学式)。
(4)从滤液中获得(NH 4)2SO 4晶体,必要的操作步骤是 。
(5)上述流程中,有关NH 3作用的说法正确的是 。
A .提供制备所需的氮元素B .增大CO 23 的浓度促进反应发生C .作反应的催化剂D .生产1 mol (NH 4)2SO 4,至少消耗2 mol NH 3【例2】 (12分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。
以工业碳酸钙(含有少量Na +、Al 3+、Fe 3+等杂质)生产医药级二水合氯化钙(CaCl 2·2H 2O 的质量分数为97.0%~103.0%)的主要流程如下:(1)除杂操作是加入Ca(OH)2,调节溶液pH 为8.0~8.5,以除去溶液中的少量Al 3+、Fe 3+。
检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH 约为4.0,其目的有:①防止Ca 2+在蒸发时水解;② 。
(3)测定样品中Cl -含量的方法是:a.称取0.7500 g 样品,溶解,在250 mL 容量瓶中定容;b.量取25.00mL 待测溶液于锥形瓶中;c.用0.05000 mol·L -1 AgNO 3溶液滴定至终点,消耗AgNO 3溶液体积的平均值为20.39 mL 。
①上述测定过程中需用溶液润洗的仪器有 。
②计算上述样品中CaCl 2·2H 2O 的质量分数为 。
③若用上述方法测定的样品中CaCl 2·2H 2O 的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ; 。
【例3】 (11分)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:(1)从海水中可以得到食盐。
为了除去粗盐中的Ca 2+、Mg 2+、SO 2-4及泥沙,可将粗盐溶于水,然后进行下甲滤液母液生石灰煅烧提纯通入a 通入b CaSO 4浊液乙CaCO 3硫酸铵二氧化碳氨气列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量NaCO3溶液,⑤加过量BaCl2溶液。
正确的操作顺序是。
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③(2)电解 NaCl溶液是氯碱工业的核心反应,请写出其化学方程式。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。
微溶于水,有毒性和强腐蚀性。
他们参观生产过程后,绘制了如右装置简图,请你参与分析讨论:①整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
③C中液体产生颜色为。
为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是。
【例4】(11分)某厂排放的废液中含有大量的K+、Cl-、Br-,还含有少量的Ca2+、Mg2+、SO2-4。
某研究性学习小组拟取这种工业废水来制取较纯净的氯化钾晶体及液澳,他们设计了如下的流程:可供试剂a、b、c选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液BaCl2溶液、Ba(NO3)2溶液、苯、CCl4、H2O2溶液、KMnO4(H+)溶液。
根据以上流程回答相关问题:(1)试剂a、b分别是、。
(2)操作①、②、③、④的名称是(填字母序号)a过滤、分液、过滤、蒸发结晶b分液、蒸馏、过滤、蒸发结晶c分液、过滤、过滤、蒸发结晶d分渣、分液、过滤、蒸发结晶(3)除去无色液体I中的Ca2+、Mg2+、SO-24离子,选出e所代表的试剂,按滴加顺序依次是(只填化学式)。
(4)调节pH的作用是;操作方法是。
(5)操作④中用到的瓷质仪器名称是____ 。
【例5】(12分)高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。
其制备路线如下:试回答下列问题(1)操作①搅拌的目的是:。
(2) 操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为:_______________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。
(计算结果保留一位小数)(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为。
【例6】(8分)某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
其实验方案如下:(1)所加试剂①、②分别是__________________。
(2)从滤液E中得到绿矾晶体的实验操作是________________________________________________________________________;从滤渣F制取胆矾的第一步操作最好采用________________________________________________________________________。
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由________________________________________________________________________________________________________________________________________________。
【例7】(1 1分)某工厂用CaS04、NH2、CO2制备(NH4)2SO4,其工艺流程如下。
回答下列问题:(1)硫酸铵在农业生产中的用途是(一种即可),写出利用该流程制备(NH4)2SO4的总化学方程:。
(2)a和b分别是(填序号)。
A.足量CO2、适量NH3B.足量NH3、适量CO2C.适量CO2、足量NH3D.适量NH3、足量CO2(3)上述流程中,可以循环使用的物质有(写化学式)。
(4)从滤液中获得(NH4)2S04晶体,必要的操作步骤是。
(5)上述流程中,有关NH3作用的说法正确的是。
A.提供制备所需的氮元素B.增大CO2-3的浓度促进反应发生C.作反应的催化剂D.生产l mol (NH4)2SO4,至少消耗2 mol NH3【例8】(12分)某固体混合物可能由Si、NH4C1、MgCl2、FeC12、Al2(SO4)3中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。
回答下列问题:(1)发生反应⑤后,仍存在的白色沉淀的化学式为。
(。
成分质量计算过程SiNH4C1MgC12FeC12A12(SO4)3【例9(1)二氧化锰与氢氧化钾共熔并通入氧气:(2)电解锰酸钾溶液:下列说法正确的是()A.根据(1)可推知,MnO2氧化性强于O2B.根据上述过程,每生成1 mol KMnO4共转移6 mol电子C.第二步电解时,KMnO4在阳极区生成D.第二步电解时阴极周围pH减小【例10】随着人类社会的发展,氮氧化物(NO x)已成为大气中的主要气态污染物之一。
(1)超音速飞机排放的尾气是平流层中NO x的主要来源。
它们破坏臭氧层的机理为:上述反应的总反应式为,其中是催化剂。
(2)汽车尾气中含有NO x、CO和碳氢化合物等。
①汽车尾气净化装置里装有Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。
尾气净化装置中发生的总反应化学方程式为。
②NO x和碳氢化合物在阳光照射下发生光化学反应产生二次污染物的现象,称为“光化学烟雾”。
有学者对某城市一天中光化学烟雾的变化情况进行测定,实验结果如图所示。
由图象可知,二次污染物有等,醛和O3的峰值出现在14:00左右的主要原因是。
③测定汽车尾气中NO x的方法之一是用3%的H2O2溶液吸收尾气中的NO x生成HNO3,再用NaOH标准溶液滴定HNO3。
若要测定标准状况下尾气中NO x的体积分数,所需的数据有(选填序号)。
A.所测尾气的总体积B.两种氮氧化物的体积比C.NaOH标准溶液的物质的量浓度D.所消耗NaOH标准溶液的体积E.从滴定开始到指示剂变色所需的时间(3)硝酸工业尾气中的NO x可用纯碱溶液吸收,有关的化学反应为:现用0.5 L 2 mol·L-1的纯碱溶液恰好吸收一定量硝酸工业尾气中的NO x,吸收液质量增加44 g (设CO2全部排出)。
则NO2和NO的体积比为。
【例11】 (10分)过度排放CO 2会造成“温室效应”,科学家正在研究如何将CO 2转化为可以利用的资源,其中一种方案就是将CO 2转化为可再生燃料甲醇(CH 3OH )。
其化学方程式为:请填空:(1)写出上述反应的平衡常数表达式K= 。
(2)在容积为2 L 的密闭容器中,用一定量二氧化碳与一定量氢气在一定条件下合成甲醇,实验结果如图所示。
下列说法正确的是(填序号) 。
A .在300℃,从反应开始到平衡,甲醇的平均反应速率B .反应体系从300 ℃升温到500℃,平衡常数K 变大C .该反应的正反应为放热反应D .处于C 点的反应体系从300℃升温到500℃ n (H 2)/n (CH 3OH )增大(3)25℃、1.01×105Pa 时16 g 液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ 热量,此反应的热化学方程式为 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是 ,正极的电极反应式为 。
【例12】 (10分)氢溴酸在医药和石化工业上有广泛用途。
下图是模拟工业制备氢溴酸粗品并精制流程:根据上述流程回答下列问题:(1)混合①中发生反应的化学方程式为__________。