2008高考化学一轮复习 碳族元素 ppt
- 格式:ppt
- 大小:1.13 MB
- 文档页数:32

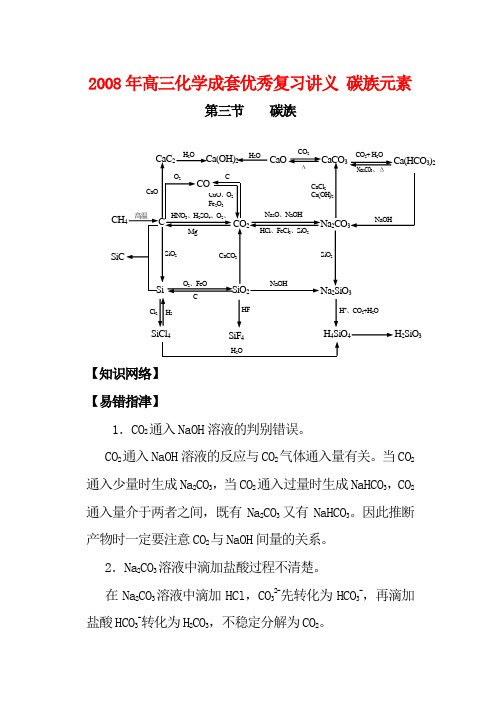
2008年高三化学成套优秀复习讲义碳族元素第三节碳族【知识网络】【易错指津】1.CO2通入NaOH溶液的判别错误。
CO2通入NaOH溶液的反应与CO2气体通入量有关。
当CO2通入少量时生成Na2CO3,当CO2通入过量时生成NaHCO3,CO2通入量介于两者之间,既有Na2CO3又有NaHCO3。
因此推断产物时一定要注意CO2与NaOH间量的关系。
2.Na2CO3溶液中滴加盐酸过程不清楚。
在Na2CO3溶液中滴加HCl,CO32-先转化为HCO3-,再滴加盐酸HCO3-转化为H2CO3,不稳定分解为CO2。
如:在10mL0.01mol/L纯碱溶液中,不断搅拌并逐滴加入1.2mL0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为(1998年上海高考题)A.1.334mLB.2.240mLC.0.672mLD.0mL思路分析:反应过程为:CO32-−→−+H CO2。
−+H HCO3-−→盐酸溶液中n(HCl)=0.00006mol,纯碱溶液中n(Na2CO3)=0.0001molCO32- + H+ = HCO3-0.0001mol 0.0001mol 现盐酸不足,故无气体产生。
答案:D3.CO2通入CaCl2溶液中是否有沉淀的分析错误。
可用反证法:如能产生沉淀,则反应的化学方程式为:CO2+CaCl2+H2O=CaCO3↓+2HCl。
因CaCO3溶于盐酸,故反应不能发生。
因为CO2只有通入中性或碱性溶液才能产生CO32-,并同时产生部分H+,若原溶液无法消耗这部分H+,则不利于CO2转化为CO32-,也就无法与Ca2+形成沉淀。
若要使CaCl2与CO2反应生成沉淀,就必须加入部分碱溶液中和CO2与H2O反应而产生的H+。
同理,该思维方式适用于CO2、SO2通入CaCl2或BaCl2溶液。
4.不要把Na2CO3+SiO2−−高温Na2SiO3+CO2↑与−→Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓相混。

高三化学第一轮复习:高: 课题39 第七章碳族元素第二讲硅及其化合物一、复习目标:1.掌握硅和二氧化硅的性质。
2、了解新型无机非金属材料。
二.知识回顾(一)硅及其化合物1.硅〈1〉硅的存在在自然界中,硅全部以____态存在,是构成矿物和岩石的主要成分。
在地壳中,硅的含量在所有元素中居第__位,仅次于氧。
〈2〉、硅的物理性质单质硅有晶体硅和无定形硅两种。
晶体硅是___色、有___光泽、脆而硬的固体,是良好的___材料。
〈3〉硅的化学性质(1)常温下硅的化学性质稳定,但能和氟、HF、强碱(NaOH)发生反应。
①硅和氟气反应生成四氟化硅气体,化学方程式为:。
②硅和氢氟酸反应生成四氟化硅,放出学方程式为:。
③硅与NaOH溶液作用生成硅酸钠,反应的化学方程式为:(2)在加热条件下,硅能和某些非金属单质发生反应。
①硅与氧气在加热时反应生成二氧化硅程式为。
②硅和C12在加热条件下反应生成四氯化硅的化学方程式为:〈4〉硅的制取:自然界中没有游离态的硅,常见的化合态的硅有和等。
工业上,用焦炭在电炉中还原二氧化硅得到含有少量杂质的粗硅。
反应的化学方程式:。
在该反应中,氧化剂是,还原剂。
2、二氧化硅(1)物理性质:二氧化硅广泛存在于自然界中,沙子、石英的主要成分就是二氧化硅,SiO2不溶于水,熔点、硬度。
水晶、石英是二氧化硅晶体。
(2)二氧化硅出化学性质①酸性氧化物的性质:Si02是酸性氧化物,是的酸酑,于水。
常温下Si02与NaOH溶液反应得到硅酸钠(Na2SiO3),反应的化学方程式为:高温下Si02能和碱性氧化物(如CaO)反应生成硅酸盐,反应的化学方程式为②常温下,SiO2能与氢氟酸(HF)反应,此反应常用于刻蚀玻璃,反应的化学方程式为:。
③二氧化硅的弱氧化性:Si02高温下与C作用可制取粗硅,反应的化学方程式为:_(3)二氧化硅的用途 :①Si02是制造光导纤维的主要。
②Si02常被用来制造石英表中的压电材料(3)Si02用于制造各种例3、硅酸(1)硅酸(H2Si03)硅酸不溶于水,其酸性比碳酸的酸性___。



高三化学第一轮复习课题 38 第七章碳族元素无机非金属材料第一讲碳族元素一.复习目标:1.理解碳族元素的相似性和递变规律.2.掌握碳及其化合物的性质。
二.重点难点:碳族元素的性质比较(相似性、递变性、特殊性)三.知识回顾:(一)碳族元素1.碳族元素的组成和结构(1)碳族元素包括(名称及元素符号)_____,_____,_____,_____,_____五种元素,位于元素周期表的____族.(2)碳族元素原子最外层有__个电子,其最高正价为___,最高价氧化物及其水化物的化学式分别表示为___,___,___,气态氢化物的化学式表示为____,随着原子序数的增大,碳族元素的原子半径依次_____.(3)碳族元素位于活泼的金属向活泼的非金属过渡的中间位置,故在化学反应中不易__或__电子,易形成____键.2. 碳族元素性质的递变规律随着原子序数的增大,碳族元素由非金属元素逐渐转变为____元素,即____性逐渐增强,_____性逐渐减弱;最高价含氧酸的酸性逐渐____,碱性逐渐____;气态氢化物的稳定性逐渐____,还原性逐渐____.3.碳族元素的特殊性碳族元素的主要化合价有___和___,其中___和___有负价。
碳族元素在化合物中多以___价稳定,而铅在化合物中则以___价稳定。
铅的+4价化合物在化学反应中易得到电子,具有____性。
+2价锡的化合物具有较强的____性。
(二)、碳及其化合物1.碳的化学性质:4-C←0C→2+C→4+C〈1〉可燃性:完全燃烧不完全燃烧〈2〉还原性①与CO2反应②与CuO反应③与H2O反应④与浓H2SO4的反应⑤与浓硝酸反应〈3〉弱氧化性:与氢气作用2、碳的氧化物—— CO和CO2的比较4.除去CO 、CO 2 气体中混有的杂质 (1)CO 中混有CO 2 通过_____溶液的洗气瓶; (2)CO 2 中混有CO 通过灼热的CuO ;(3)CO 2 混有O 2 通过灼热的金属铜Cu ; (4)CO 2 中混有SO 2 通过盛有饱和的__________溶液(5)CO 2 中混有HCl 气体 通过盛有__________ 溶液的洗气瓶 (6)CO 2 中混有H 2S 可通过盛有CuSO 4溶液的洗气瓶。