分析化学----仪器分析(重点)PDF
- 格式:pdf
- 大小:565.55 KB
- 文档页数:19

分析化学(第8版)习题参考解答——仪器分析1. 仪器分析简介仪器分析是一种利用各种仪器设备进行化学分析的方法,它具有快速、准确和灵敏等特点,被广泛应用于各个领域的化学研究和工业生产中。
仪器分析包括一系列的方法和技术,常用于分析和测定样品中的化学成分、结构和性质等信息。
本文将重点介绍分析化学(第8版)中的仪器分析部分的习题解答。
2. 选择题解答2.1 问题1Q: 以下哪种方法可以用于分析和鉴定有机物的结构?A. 质谱法B. 红外光谱法C. 核磁共振法D. 气相色谱法解答:选项A、B、C和D都是常用的用于分析和鉴定有机物结构的方法。
其中,质谱法可以用于测定有机物的分子量和分子结构,红外光谱法可以用于检测有机物中的官能团,核磁共振法可以提供有机分子的结构信息,而气相色谱法可以分离和鉴定有机物混合物中的成分。
因此,正确答案选项是D,即气相色谱法。
2.2 问题2Q: 下列哪个仪器对于病毒颗粒的直接观察和分析最为适合?A. 红外光谱仪B. 紫外可见分光光度计C. 电子显微镜D. 质谱仪解答:选项A、B和D都不适合对病毒颗粒进行直接观察和分析。
红外光谱仪和紫外可见分光光度计主要用于分析物质的化学性质,质谱仪用于测定物质的分子量和分子结构。
而电子显微镜可以提供高分辨率的图像,对于病毒颗粒的直接观察和分析非常适合。
因此,正确答案选项是C,即电子显微镜。
3. 简答题解答3.1 问题1Q: 请简要介绍质谱法的原理和应用。
解答:质谱法是一种用于测定化合物的分子量和分子结构的分析方法。
它基于将化合物分子在特定条件下进行电离并进行质量分析的原理。
具体来说,质谱分析主要包括四个步骤:样品的蒸发与电离、离子的加速和分离、离子检测和信号处理。
在质谱仪中,样品首先通过蒸发器蒸发,形成气体或蒸气态的离子。
然后,这些离子被加速器加速,并通过一系列电场和磁场的作用,根据其质量与电荷比(m/z)的不同,被分离为不同的轨道。
最后,离子被检测器检测,并传递给信号处理系统进行分析和数据处理。

分析化学仪器分析目录第一章化学分析技能试题部分 (2)第一节酸碱滴定部分 (2)第二节氧化还原部分 (3)第三节配位滴定 (5)第四节质量分析 (7)第二章仪器分析技能 (8)第一节气相色谱法 (8)第二节分光光度法 (13)第三节原子吸收光度法 (14)第四节电化学分析法 (17)第三章综合分析操作问答 (20)第一章化学分析技能答案部分第一节酸碱滴定部分1、用盐酸标准滴定溶液标定氢氧化钠溶液得其值溯源是什么?答:NaOH←-Hcl←Na2CO3,其量值溯源最终是标准物质碳酸钠。
2、50毫升滴定管的分度值是多少?能读至多少?答:50毫升的滴定管的分度值是0.10毫升,可以估读到0.02毫升。
3、滴定管按照用途可分为几种?应用中应该注意什么?答:按照其用途可以分成酸式和碱式滴定管两类。
酸式滴定管用于盛装酸性、氧化性、和中性标准溶液,但是不能盛装碱性溶液。
碱性滴定管用于盛装碱性溶液和非氧化性的标准溶液,不能盛装AgNO3、I2、KMNO4标准溶液,以免氧化试管。
4、简述无色和篮线衬背滴定管应该如何读数?答:无色滴定管无色或浅色溶液――读溶液弯月面下实线的最低点;深色溶液――读取与液面两侧最高点相平行的刻度。
蓝色衬背滴定管无色或浅色溶液――溶液两个弯月面相交于滴定管蓝线的一点;有色溶液――读取同无色滴定管。
5、标准滴定溶液主要应用于那些测定?答:主要用于测定产品的主要成分以及产品的杂质。
6、标准溶液的稳定性如何?答:一般标准滴定溶液,在使用合适的容器、温度(25摄氏度以下)条件、避光、密闭保存,可以稳定两个月。
稳定性差的标准溶液,如硫酸亚铁铵,使用时应与样品测定同时测定其浓度,易挥发的有机溶剂标准滴定溶剂受温度影响大,也应在样品测定的同时标定其浓度。
7、简述酸碱滴定中CO2的来源和影响。
答:二氧化碳来源于水中溶解的二氧化碳,标准碱溶液和配制标准溶液的试剂本身吸收了二氧化碳,滴定过程中溶液吸收空气中的二氧化碳。




分析化学:仪器分析部分
分析化学是一门重要的学科,它涉及到物质的组成和性质的测定,是化学的基础。
它的应用范围非常广泛,涉及从材料科学和生命科学到环境科学和农业科学等各个领域。
在分析化学中,仪器分析扮演着重要的角色。
仪器分析是一项精确的科学技术,它为研究者提供了准确、精确的定量分析技术,从而促进研究者在有关领域的科学研究和应用。
在仪器分析中,研究者可以使用不同的仪器来测定样本中的各种物质,以此来确定其组成和性质。
在仪器分析中,常用的仪器包括原子吸收光谱仪、热重分析仪、紫外-可见分光光度计、质谱仪和电感耦合等。
原子吸收光谱仪是一
种用于测定元素的仪器,它可以测定样品中的痕量元素含量。
热重分析仪是一种常用的仪器,可以测定样品的各种物性,包括熔点、熔点沉降、收缩率等。
紫外-可见分光光度计也是一种常用的仪器,用来
测定指示剂的浓度以及测定有机物质的吸收率。
质谱仪是用来测定物质的实际分子质量的仪器,它可以用来分析分子的结构和性质。
而电感耦合等分子分析技术则可以用来测定核酸和蛋白质的结构以及物
质的定性和定量分析。
仪器分析是分析化学的重要组成部分,它不仅能为研究者提供准确的测量数据,还可以用于生产制造过程中物质成分的在线检测,为生产过程中的质量控制工作提供有力的技术支持。
另外,仪器分析也可以用于食品检测,以确保食品的安全性和质量,为食物安全提供保
障。
分析化学的仪器分析部分是一个复杂的系统,它不仅可以在研究领域发挥重要作用,还能在实际应用中发挥巨大的作用。
因此,仪器分析在分析化学领域中显得尤为重要。


《分析化学》考试大纲(包括“化学分析”和“仪器分析”两部分)“化学分析”部分该考试大纲适用于分析化学及其相关专业的硕士研究生入学考试。
分析化学是化学类各专业的重要主干基础课,化学分析部分主要内容包括:数据处理与质量保证、滴定分析法、重量分析法、吸光光度法、分离与富集方法。
要求考生牢固掌握其基本的原理和测定方法,建立起严格的“量”的概念。
能够运用化学平衡的理论和知识,处理和解决各种滴定分析法的基本问题,包括滴定曲线、滴定误差、滴定突跃和滴定可行性判据,掌握重量分析法及吸光光度法的基本原理和应用、分析化学中的数据处理与质量保证。
了解常见的分离与富集方法。
正确掌握有关的科学实验技能,具备必要的分析问题和解决问题的能力。
考试内容一、绪论:分析化学的任务和作用,分析方法的分类。
二、定量分析化学概论分析化学中的误差,有效数字及其运算规则,滴定分析概述。
三、酸碱平衡和酸碱滴定法分布分数δ的计算,质子条件与pH的计算,对数图解法,酸碱缓冲溶液,酸碱指示剂,酸碱滴定基本原理,终点误差,酸碱滴定法的应用,非水溶液中的酸碱滴定。
四、络合滴定法分析化学中常用的络合物,络合物的平衡常数,副反应常数和条件稳定常数,金属离子指示剂,络合滴定法的基本原理,络合滴定中酸度的控制,提高络合滴定选择性的途径,络合滴定方式及其应用。
五、氧化还原滴定法氧化还原平衡,氧化还原滴定原理,氧化还原滴定法中的预处理,氧化还原滴定法的应用六、重量分析法和沉淀滴定法重量分析概述,沉淀的溶解度及其影响因素,沉淀的类型和沉淀的形成过程,影响沉淀纯度的主要影响因素,沉淀条件的选择,有机沉淀剂,重量分析中的换算因素,沉淀滴定法,滴定分析小结七、吸光光度法光度分析法的设计,光度分析法的误差,其它吸光光度法和光度分析法的应用。
八、分析化学中的数据处理标准偏差,随即误差的正态分布,少量数据的统计处理,误差的传递,回归分析,提高分析结果准确度的方法。
九、分析化学中常用的分离和富集方法液-液萃取分离法,离子交换分离法,液相色谱分离法,气浮分离法,一些新的分离和富集方法十、复杂物质的分析示例硅酸盐分析,铜合金分析,废水试样分析考试要求:一、绪论:了解分析化学的任务和作用,分析方法的分类。

仪器分析必考知识点总结一、仪器分析的基本原理1. 分析化学的基本概念分析化学是研究样品中微量和痕量成分的定性和定量分析方法的一门科学,它是化学的一个重要分支。
在分析化学中,需要使用各种仪器和方法对样品进行分析,以确定其中各种成分的含量和性质。
2. 仪器分析的基本原理仪器分析是指利用各种仪器设备进行样品分析的过程。
它主要包括对样品进行前处理、采集数据、数据处理和结果判定等步骤。
仪器分析的基本原理是根据样品的性质选择适当的仪器和方法,进行定性和定量分析。
3. 仪器分析的应用范围仪器分析主要应用于化学、生物、环境等领域,用于对材料成分、结构、性质等进行分析。
它在科学研究、工程技术和产品质量控制等方面具有广泛的应用。
二、仪器分析的常用方法和技术1. 光谱分析技术光谱分析技术是一种利用物质与电磁辐射的相互作用来分析物质的技术。
主要包括紫外可见吸收光谱、红外光谱、拉曼光谱、荧光光谱等。
2. 色谱分析技术色谱分析技术是一种利用物质在固定相和流动相中的相互作用来分离和分析物质的技术。
主要包括气相色谱、液相色谱、超高效液相色谱等。
3. 质谱分析技术质谱分析技术是一种利用物质的质荷比对物质进行分析的技术。
主要包括质谱仪、飞行时间质谱仪、离子阱质谱仪等。
4. 电化学分析技术电化学分析技术是一种利用物质与电化学电极的相互作用来分析物质的技术。
主要包括电化学电位法、极谱法、循环伏安法等。
5. 热分析技术热分析技术是一种利用物质的热学性质来分析物质的技术。
主要包括热重分析、差示扫描量热分析、热膨胀分析等。
6. 激光分析技术激光分析技术是一种利用激光与物质相互作用来分析物质的技术。
主要包括激光诱导击穿光谱、激光诱导荧光光谱等。
三、仪器分析的操作流程和注意事项1. 样品的准备样品的准备是仪器分析的第一步,它包括样品采集、处理和预处理等。
在进行样品准备时,需要注意避免样品的污染和损坏,保证样品的代表性和可比性。
2. 仪器的选择根据样品的性质和分析的要求,选择适当的仪器和分析方法进行分析。
仪器分析(完整版)绪论⼀、什么是仪器分析?仪器分析有哪些特点?(简答,必考题)仪器分析是分析化学的⼀个重要部分,是以物质的物理或物理化学性质作为基础的⼀类分析⽅法,它的显著特征是以仪器作为分析测量的主要⼿段。
1、灵敏度⾼,检出限量可降低。
如样品⽤量由化学分析的mL、mg级降低到仪器分析的g、L级,甚⾄更低。
适合于微量、痕量和超痕量成分的测定。
2、选择性好。
很多的仪器分析⽅法可以通过选择或调整测定的条件,使共存的组分测定时,相互间不产⽣⼲扰。
3、操作简便,分析速度快,容易实现⾃动化。
4、相对误差较⼤。
化学分析⼀般可⽤于常量和⾼含量成分分析,准确度较⾼,误差⼩于千分之⼏。
多数仪器分析相对误差较⼤,⼀般为5%,不适⽤于常量和⾼含量成分分析。
5、需要价格⽐较昂贵的专⽤仪器。
⼆、仪器分析的分类光化学分析法,电化学分析法,⾊谱分析法和其他仪器分析⽅法。
三、仪器分析法的概念仪器分析法是以物质的物理或物理化学性质为基础,探求这些性质在分析过程中所产⽣的分析信号与物质的内在关系,进⽽对待测物进⾏定性、定量及结构分析及动态分析的⼀类测定⽅法。
四、仪器分析法的主要性能指标精密度,准确度,灵敏度,标准曲线的线性范围,检出限(浓度—相对检出限;质量—绝对检出限)五、选择分析⽅法的⼏种考虑仪器分析⽅法众多,对⼀个所要进⾏分析的对象,选择何种分析⽅法可从以下⼏个⽅⾯考虑:1.您所分析的物质是元素?化合物?有机物?化合物结构剖析?2.您对分析结果的准确度要求如何?3.您的样品量是多少?4.您样品中待测物浓度⼤⼩范围是多少?5.可能对待测物产⽣⼲扰的组份是什么?6.样品基体的物理或化学性质如何?7.您有多少样品,要测定多少⽬标物?光谱分析法导论⼀、什么是光谱分析法以测量光与物质相互作⽤,引起原⼦、分⼦内部量⼦化能级之间的跃迁产⽣的发射、吸收、散射等波长与强度的变化关系为基础的光学分析法,称为光谱分析法——通过各种光谱分析仪器来完成分析测定——光谱分析仪器基本组成部分:信号发⽣系统,⾊散系统,检测系统,信号处理系统等。
(完整版)分析化学知识点总结1.分析⽅法的分类按原理分:化学分析:以物质的化学反应为基础的分析⽅法仪器分析:以物质的物理和物理化学性质为基础的分析⽅法光学分析⽅法:光谱法,⾮光谱法电化学分析法:伏安法,电导分析法等⾊谱法:液相⾊谱,⽓相⾊谱,⽑细管电泳其他仪器⽅法:热分析按分析任务:定性分析,定量分析,结构分析按分析对象:⽆机分析,有机分析,⽣物分析,环境分析等按试样⽤量及操作规模分:常量、半微量、微量和超微量分析按待测成分含量分:常量分析(>1%), 微量分析(0.01-1%), 痕量分析(<0.01%)2.定量分析的操作步骤1) 取样2) 试样分解和分析试液的制备3) 分离及测定4) 分析结果的计算和评价3.滴定分析法对化学反应的要求有确定的化学计量关系,反应按⼀定的反应⽅程式进⾏反应要定量进⾏反应速度较快容易确定滴定终点4.滴定⽅式a.直接滴定法b.间接滴定法如Ca2+沉淀为CaC2O4,再⽤硫酸溶解,⽤KMnO4滴定C2O42-,间接测定Ca2+ c.返滴定法如测定CaCO3,加⼊过量盐酸,多余盐酸⽤标准氢氧化钠溶液返滴d.置换滴定法络合滴定多⽤5.基准物质和标准溶液基准物质: 能⽤于直接配制和标定标准溶液的物质。
要求:试剂与化学组成⼀致;纯度⾼;稳定;摩尔质量⼤;滴定反应时⽆副反应。
标准溶液: 已知准确浓度的试剂溶液。
配制⽅法有直接配制和标定两种。
6.试样的分解分析⽅法分为⼲法分析(原⼦发射光谱的电弧激发)和湿法分析试样的分解:注意被测组分的保护常⽤⽅法:溶解法和熔融法对有机试样,灰化法和湿式消化法7.准确度和精密度准确度: 测定结果与真值接近的程度,⽤误差衡量。
绝对误差: 测量值与真值间的差值, ⽤ E 表⽰ E = x - x T相对误差: 绝对误差占真值的百分⽐,⽤E r 表⽰ E r =E /x T = x - x T /x T ×100%精密度: 平⾏测定结果相互靠近的程度,⽤偏差衡量。
浅谈分析化学中的化学分析与仪器分析摘要:近年来,在社会快速发展的推动下,我国教育事业的发展也取得了巨大的成绩,从而有效的推动了各个学科教学质量的限制提升。
分析化学在化学课程中属于较为重要的一个部分,其实质就是借助各种专业知识、方法、仪器对时空中的物质性质、组成等诸多方面的信息加以全面的掌握,这样才可以达到物质分析的目标。
就现如今实际情况来说,分析化学逐渐的被人们运用到了医学、药学、地质学、生命科学等诸多领域之中。
化学分析和仪器分析是分析化学中的重点技术,我们需要对其进行进一步的研究,从而在实践工作中将其作用切实的施展出来。
关键词:化学分析;仪器分析;改革导言:在科学技术快速发展以及工业生产建设工作全面落实的形式下,为化学分析仪器和相关技术的发展起到了积极的推动作用。
与之前情况相对比来说,实用性和准确度都得到了显著的提升,可选择使用的方法也在不断的扩展。
所以我们还需要对化学分析和仪器分析技术的实际,按运用进行更深入的研究分析,并且为两项技术的未来持续健康发展创造良好的基础。
1化学分析和仪器分析1.1特点首先,二者的发展速度都相对较快,并且在实践中也可以利用计算机技术来对多个样品进行分析,这样就可以在较短的时限内来对多个样品的分析结果加以掌握。
其次,拥有良好的灵敏度,微量的特定物质也可以借助这项技术来完成检测。
再有,能够完成在线分析以及遥控检测,这样可以切实的控制人工成本,并且实现良好的经济的目标。
还有,拥有良好的实用性,适合运用到各种物质的分析工作之中。
最后,不会造成样品损伤的情况,可以运用到较高要求以及较为复杂的样本分析中。
1.2局限性首先,需要的设备相对较为复杂,并且对于资金的需求量较多,设备后期的维护以及环境的要求都相对较高。
其次,就仪器分析来说,这项技术的基础就是标准物质,也就是结合对照标准物质来获取相关信息,所以标准物质会对结果造成诸多的影响。
再有,尽管精确度相对于以往来说有了较大的提升,但是这两种技术之间还存在明显的差别,所以在微量和痕量物质分析中无法发挥出其原有的作用。
一、名词解释1、化学分析:以化学反应为基础的分析方法。
2、仪器分析:以物质的物理和物理化学性质为基础的分析方法。
3、标准曲线:被测物质的浓度(或含量)与仪器响应信号的关系曲线。
4、线性范围:标准曲线的直线部分所对应的被测物质浓度(或含量)的范围。
5、灵敏度:物质单位浓度或单位质量的变化引起响应信号值变化的程度。
6、检出限:某一方法在给定的置信水平上可以检出被测物质的最小浓度或最小质量,称为这种方法对该物质的检出限。
7、统计权重:g=2J+1表示支能级的简并度,叫做统计权重。
8、禁戒跃迁:不符合光谱选择定则的跃迁叫禁戒跃迁。
9、光谱支项:把J值不同的光谱项称为光谱支项。
10、共振线:在所有原子谱线中,凡是由各个激发态回到基态所发射的谱线。
11、灵敏线:灵敏线是指有一定强度, 能标记某元素存在的特征谱线。
12、最后线:最后线是指当样品中某元素的含量逐渐减少时,最后仍能观察到的几条谱线。
13、分析线:对每一元素,可选择一条或几条(2~3条)灵敏线或最后线来进行定性分析、定量分析,这种谱线称为分析线。
14、热变宽:由原子在空间做相对热运动引起的谱线变宽。
15、压力变宽:由于同种辐射原子间或辐射原子与其它粒子(分子、原子、离子和电子等)间的相互碰撞而产生的谱线变宽。
16、光谱通带:单色器出射光束波长区间的宽度。
17、特征浓度:能产生1%吸收(即吸光度值为0.0044)信号时所对应的被测元素的浓度。
18、特征质量:能产生1%吸收或产生0.0044吸光度时所对应的被测元素的质量。
19、共振原子荧光:气态基态原子吸收的辐射与发射的荧光波长相同时,产生共振荧光。
20、非共振原子荧光:气态基态原子吸收的辐射与发射的荧光波长不相同时,产生非共振荧光。
21、振动弛豫:在同一电子能级中,激发态分子以热的形式将多余的能量传递给周围的分子,以-1210s极快速度,降至同一电子态的最低振动能级上,这一过程称为振动弛豫。
22、内转化:当两个电子能级非常靠近以至其振动能级有重叠时,常发生电子由高能级以无辐射跃迁方式转移至低能级。
仪器分析知识点总结各章第一章仪器分析的基本概念和原理1.1 仪器分析的定义仪器分析是利用仪器设备对样品进行检测、分析和测量,以获取样品中特定组分的含量、性质和结构等信息的一种分析方法。
1.2 仪器分析的分类仪器分析按照分析方法的不同可以分为物理分析、化学分析和生物分析三大类,其中每类又分为多个不同的分支。
1.3 仪器分析的基本原理仪器分析的基本原理是根据目标分析物的性质和特点,选用合适的分析仪器进行检测和分析。
常用的仪器分析原理包括光谱分析原理、色谱分析原理、质谱分析原理等。
第二章光谱分析2.1 光谱分析的基本概念光谱分析是利用样品对电磁波的吸收、散射、发射或者透射特性进行分析的方法,分析样品中的成分、结构和性质。
2.2 原子吸收光谱分析原子吸收光谱分析(AAS)是利用原子对特定波长的光的吸收特性来测定样品中金属元素的含量的分析方法。
原子吸收光谱分析的原理是利用吸收特性和比例计算出样品中目标元素的含量。
2.3 紫外可见光谱分析紫外可见光谱分析(UV-Vis)是利用样品对紫外和可见光的吸收特性进行分析的方法,常用于测定有机物和某些无机物的含量和结构。
2.4 荧光光谱分析荧光光谱分析是利用样品对激发光的发射特性进行分析的方法,荧光光谱常用于生物分析、环境分析和材料科学等领域。
第三章色谱分析3.1 色谱分析的基本概念色谱分析是利用色谱仪器对样品中的组分进行分离、检测和定量测定的方法,主要包括气相色谱分析、液相色谱分析和超临界流体色谱分析等。
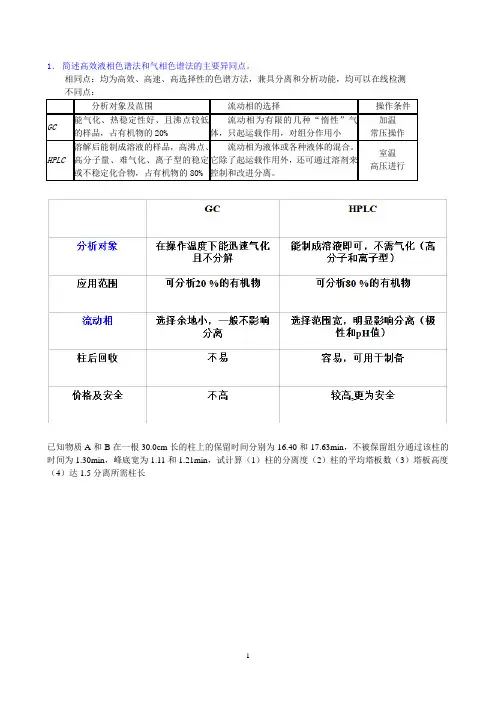
3.2 气相色谱分析气相色谱分析(GC)是将样品分离为各个成分,再通过气相色谱柱进行分离和检测的方法,主要用于分析有机物、气体和挥发性物质。
3.3 液相色谱分析液相色谱分析(HPLC)是将样品分离为各个成分,再通过液相色谱柱进行分离和检测的方法,主要用于分析生物化学物、药物和小分子有机化合物等。
3.4 色谱联用技术色谱联用技术是将不同色谱方法和检测手段结合起来,以达到更高的分离能力和检测灵敏度,常见的色谱联用技术包括气相色谱-质谱联用(GC-MS)和液相色谱-质谱联用(LC-MS)等。
一、名词解释1、化学分析:以化学反应为基础的分析方法。
2、仪器分析:以物质的物理和物理化学性质为基础的分析方法。
3、标准曲线:被测物质的浓度(或含量)与仪器响应信号的关系曲线。
4、线性范围:标准曲线的直线部分所对应的被测物质浓度(或含量)的范围。
5、灵敏度:物质单位浓度或单位质量的变化引起响应信号值变化的程度。
6、检出限:某一方法在给定的置信水平上可以检出被测物质的最小浓度或最小质量,称为这种方法对该物质的检出限。
7、统计权重:g=2J+1表示支能级的简并度,叫做统计权重。
8、禁戒跃迁:不符合光谱选择定则的跃迁叫禁戒跃迁。
9、光谱支项:把J值不同的光谱项称为光谱支项。
10、共振线:在所有原子谱线中,凡是由各个激发态回到基态所发射的谱线。
11、灵敏线:灵敏线是指有一定强度, 能标记某元素存在的特征谱线。
12、最后线:最后线是指当样品中某元素的含量逐渐减少时,最后仍能观察到的几条谱线。
13、分析线:对每一元素,可选择一条或几条(2~3条)灵敏线或最后线来进行定性分析、定量分析,这种谱线称为分析线。
14、热变宽:由原子在空间做相对热运动引起的谱线变宽。
15、压力变宽:由于同种辐射原子间或辐射原子与其它粒子(分子、原子、离子和电子等)间的相互碰撞而产生的谱线变宽。
16、光谱通带:单色器出射光束波长区间的宽度。
17、特征浓度:能产生1%吸收(即吸光度值为0.0044)信号时所对应的被测元素的浓度。
18、特征质量:能产生1%吸收或产生0.0044吸光度时所对应的被测元素的质量。
19、共振原子荧光:气态基态原子吸收的辐射与发射的荧光波长相同时,产生共振荧光。
20、非共振原子荧光:气态基态原子吸收的辐射与发射的荧光波长不相同时,产生非共振荧光。
21、振动弛豫:在同一电子能级中,激发态分子以热的形式将多余的能量传递给周围的分子,以-1210s极快速度,降至同一电子态的最低振动能级上,这一过程称为振动弛豫。
22、内转化:当两个电子能级非常靠近以至其振动能级有重叠时,常发生电子由高能级以无辐射跃迁方式转移至低能级。
23、荧光发射:处于第一激发单重态最低振动能级中的电子以辐射跃迁的方式返回基态的各个振动能级所发射出的光辐射称之为荧光,此过程称之为荧光发射。
24、系间窜跃:激发单重态与激发三重态之间的无辐射跃迁。
当不同多重态的两个电子能层有较大重叠时,处于这两个能层上的受激电子的自旋方向发生变化,产生无辐射跃迁,该过程称为系间窜跃。
25、磷光发射:处于第一激发三重态最低振动能级中的电子以辐射跃迁的方式返回基态的各个振动能级所发射出的光辐射称之为磷光,此过程称之为磷光发射。
26、猝灭:激发分子与溶剂分子或其它溶质分子的相互作用,发生能量转移,使荧光或磷光强度减弱甚至消失。
这一现象称为猝灭,又称为外转换。
27、延迟荧光:处于激发三重态的某些分子还可以通过热激发又一次系间窜跃回到激发单重态,再通过发射荧光回到基态,这个过程需要时间较长,这种荧光称为延迟荧光。
28、荧光激发光谱:固定测量波长为荧光最大发射波长,然后改变激发波长,根据所测得的荧光强度与激发光波长的关系,即可绘制激发光谱曲线。
29、荧光发射光谱:固定激发光波长为其最大激发波长,然后测定不同的波长时所发射的荧光强度,即可绘制荧光光谱曲线。
30、内部重原子效应:当分子中引入重原子取代基,使磷光增强,这种作用称为内部重原子效应。
31、外部重原子效应:含重原子的溶剂(如碘乙烷、溴乙烷),增大了系间窜跃(S1 T1)跃迁的几率,使磷光增强,这种作用称为外部重原子效应。
32、生色团:在紫外可见区能产生吸收,含有不饱和键的基团称为生色团。
33、助色团:一些基团,它们本身并不产生吸收峰,但是它们与生色团相连时,会使生色团的吸收峰向长波方向移动,并且增加其吸光度,这些基团称为助色团。
34、试剂空白:当显色剂或其他试剂在测定波长处有吸收时,采用试剂做参比(不加待测物),称为试剂空白。
35、液接电位:当两种不同组分的溶液或两种组分相同,但浓度不同的溶液相接触时,离子因扩散而通过相界面的速度不同,相界面有微小的电位差产生,称为液体接界电位,简称液接电位。
36、浓差极化:由于电极表面离子的浓度与溶液本体浓度不同而使电极电位偏离平衡电位的现象称为浓差极化。
37、电化学极化:因电化学反应本身的迟缓而造成电极电位偏离可逆平衡电位的现象称为电化学极化。
38、指示电极:电极的电位随着溶液中待测离子的活度变化而变化,称为指示电极。
39、参比电极:在恒温恒压条件下,电极电位不随溶液中被测离子活度的变化而变化,具有基本恒定电位值的电极称为参比电极。
40、钠差(碱差):用pH玻璃电极测定pH大于10或钠离子浓度较高时,pH的测定值低于实际数值,产生负误差,称为碱差或钠差。
41、酸差:用pH玻璃电极测定pH小于1的强酸溶液时,pH的测定值高于实际值,产生正误差,称为酸差。
42、离子选择性电极相应的线性范围:校准曲线的直线部分所对应的离子活度范围称为离子选择性电极响应的线性范围。
43、检出限:指ISE能够检测被测离子的最低浓度。
44、程序升温:在一个分析周期内柱温随时间由低温向高温作线性或非线性变化。
45、归一化法:所有的被测组分都出峰,把含量按百分计称为归一化法。
46、等度洗脱:洗脱过程中,洗脱剂的强度保持不变。
47、梯度洗脱:随着时间的改变,冲洗强度发生变化。
48、正相分配色谱:固定项为极性,流动相为非极性的液液分配色谱。
49、反相分配色谱:固定项为非极性,流动相为极性的液液分配色谱。
50、化学键合相:通过共价键将有机固定液结合到硅胶载体表面,得到各种性能的固定相。
二、问答题1、选择内标元素及分析线对得原则是什么?答:无干扰、无自吸、背景干扰小;内标元素含量恒定;分析线对的激发电位、电离电位应该接近;分析线对得波长和强度尽量接近。
2、原子吸收光谱分析法中,背景干扰是怎样产生的?如何抑制和校正光谱背景?简述连续光源背景校正技术的原理。
答:原子吸收光谱分析中的背景干扰主要是指原子化过程中产生的分子吸收和固体微粒产生的光散射。
在实际工作中,多采用改变火焰类型、燃助比和调节火焰观测高度来抑制分子吸收干扰。
校正方法有:邻近线校正背景法、氘灯背景校正法、塞曼效应背景校正法。
原理:切光器使入射强度相等的锐线辐射和连续辐射交替地通过原子化吸收区。
氘灯测出的主要是背景吸收信号,空心阴极灯测的是原子吸收和背景信号,二者相减得原子吸收值。
3、列出原子吸收光谱法中实现峰值吸收所要具备的条件。
答:(1)发射线必须比吸收线要窄得多;(2)二者中心频率相同。
4、简述影响物质荧光发射的主要因素。
答:(1)共轭效应:凡是增加体系的共轭度,都会增大荧光的强度,并使荧光光谱红移。
(2)刚性平面结构:多数具有刚性平面结构的有机分子具有强烈的荧光。
(3)取代基效应:芳香族化合物苯环上的不同取代基对该化合物的荧光强度和荧光光谱有很大的影响。
a)给电子基团使荧光增强;b)吸电子基团会减弱甚至会猝灭荧光。
(4)温度的影响:温度上升使荧光强度下降。
(5)溶剂的影响溶液;pH的影响等。
5、如何区别荧光和磷光?其依据是什么?答:激光停止后,荧光立即消失,磷光可持续一段时间。
6、有机化合物分子中的电子跃迁有哪几种类型?哪些类型的跃迁能在紫外—可见吸收光谱中反映出来? 答:σ→*σ、n →*σ、π→*π、n →*π,其中π→*π、n →*π能在紫外—可见吸收光谱中反映出来。
7、作为苯环的取代基,+3NH —不具有助色作用,2NH —却有助色作用;OH —的助色作用明显小于-O —,试给予解释。
答:助色团至少要有一对非键n 电子,这样才能与苯环上的π电子相作用,产生助色作用。
2NH —含有一对非键n 电子,具有助色作用,而+3NH —非键n 电子消失了,无助色作用。
-O —中的氧原子比OH —多了一对非键n 电子,其助色效果也就更显著。
8、4—甲基戊烯酮有两种异构体:实验发现一种异构体在235nm 处有一强吸收峰(κ=1000L ·-1mol ·-1cm ),另一种异构体在220nm 以后没有强吸收。
试判断具有前一种紫外吸收特征的是哪种异构体。
答:前者的共轭体系使吸收峰发生红移,且摩尔吸收系数也发生很大变化,故此异构体为前者。
第二种结构无共轭,单一的n→*π、π→*π在200nm左右,所以在220nm后无强吸收。
9、产生红外吸收的条件是什么?是否所有的分子振动都能产生红外吸收光谱?为什么?答:不是。
(1)辐射光子具有的能量与发生振动跃迁所需的跃迁能量相等;(2)只有发生偶极矩变化的振动才能吸收红外辐射。
10、和是同分异构体,试分析二者红外光谱的差异。
答:后者分子中存在羰基,在1745-1cm会有一强吸收带,而前者无此特征峰;前者分子中存在羟基伸缩振动,在3650—3200-1cm范围内;碳氢伸缩振动,在3010-3040-1cm出现;碳cm;碳碳双键伸缩振动在1161-1氧伸缩振动在1300-1000-1cm出现,而后者无此特征峰。
11、在用电位法测定溶液PH时,为什么必须使用标准缓冲溶液?答:(1)通过对消的方法,消除常数K;(2)起到定位的作用。
12、试述速率理论方程式中A、B/u、Cu的意义。
答:A:涡流扩散项;B/u:分子扩散项;Cu:传质阻力项。
13、试述热导检测器、氢火焰离子化检测器、电子捕获检测器、火焰光度检测器的工作原理。
答:TCD原理:1)被测组分的蒸气与载气具有不同的热导系数; 2)热丝阻值随温度变化而改变;3)利用惠斯顿电桥测量。
FID原理:1)氢在氧中燃烧生成的火焰为有机分子的燃烧和电离提供了能源;2)有机物分子在氢火焰中进行化学电离;3)化学电离产生的离子在置于火焰附近的静电场中定向移动而形成离子流。
ECD原理:1)检测器内有能放出β射线的放射源(63Ni);2)载气分子能被β射线电离,在电极间形成一定的基流;3)样品分子有能捕获电子的官能团。
FPD原理:1)检测器中有富氢火焰,为含硫、磷的化合物提供燃烧和激发的条件;2)样品在富氢火焰中燃烧时,含硫、含磷化合物能发射出特征光;3)特征光通过滤光片后,由光电倍增管把光强度信号转换成电信号。
14、若用氧化铝HPLC柱进行色谱分离,流动相为苯-丙酮,进行梯度洗脱时应当增大还是减小苯的比例?为什么?答:减小。
因为流动相的极性小于固定相极性,属于正相分配色谱,梯度洗脱时极性由小增大,逐渐出峰苯为非极性溶剂,逐渐减小苯的比例可使溶剂极性增大。
三、其他重点1、原子能级用光谱项描述:L n 12S +;光谱支项:J 12S L n +2、在发射光谱中,谱线的辐射是从弧焰中心轴辐射出来的,中心部位温度高,边缘处的温度较低,元素的原子或离子从光源中心部位辐射被光源边缘基态或较低能态同类原子吸收,使发射谱线减弱——谱线自吸。