电极的极化和极化曲线_电极的极化
- 格式:pdf
- 大小:268.42 KB
- 文档页数:3


电极极化曲线
电极极化曲线是研究电化学反应过程中电极表面现象的重要工具,它能直观地反映电极在充放电过程中的电势变化。
电极极化曲线主要包括两部分:伏安曲线和循环伏安曲线。
伏安曲线(Volt-Ampere curve)描述了电极在恒定电流条件下,电势与电流之间的关系。
当电极表面发生氧化还原反应时,电流会随之变化,从而形成伏安曲线。
伏安曲线可以分为三个区域:活性区、过渡区和线性区。
活性区位于曲线的左侧,此时电流与电势关系不稳定,电极表面反应活跃;过渡区位于活性区右侧,电流与电势关系逐渐变得稳定;线性区位于过渡区右侧,电流与电势呈线性关系。
循环伏安曲线(Cyclic Voltammetry curve)则是研究电极在循环充放电过程中,电势与电流的关系。
循环伏安曲线通常呈矩形,包括四个阶段:吸附、脱附、充电和放电。
吸附阶段表现为电流逐渐增大,电势上升;脱附阶段电流逐渐减小,电势下降;充电阶段电流迅速上升,电势迅速上升;放电阶段电流迅速下降,电势下降。
通过分析循环伏安曲线,可以了解电极材料的电化学性质、电极表面反应动力学参数以及电极寿命等信息。
电极极化曲线在电化学研究中的应用十分广泛,如锂电池、燃料电池、金属空气电池等领域。
通过对电极极化曲线的分析,可以优化电极设计、提高电池性能、延长电池寿命等。
此外,电
极极化曲线还可以应用于金属腐蚀研究,为防腐措施提供理论依据。
总之,电极极化曲线是研究电化学领域中不可或缺的重要工具。


极化曲线-电极电位与极化电流或极化电流密度之间关系的曲线叫作极化曲线极化曲线-电极电位与极化电流或极化电流密度之间关系的曲线叫作极化曲线,极化曲线是以电极电位为纵坐标,以电极上通过的电流为横坐标获得的曲线,它表征腐蚀原电池反应的推动力电位与反应速度电流之间的函数关系。
极化曲线分为4个区,活性溶解区、过渡钝化区、稳定钝化区、过钝化区。
学术术语来源——钛种植体基台与种植体上部结构合金的耐腐蚀性能文章亮点:1 金属种植体的腐蚀非常重要,因为它对种植体的生物相容性和机械整合产生不利影响。
随着基底材料的腐蚀,其表面钝化膜溶解,就会有离子释放到周围环境中。
过多金属离子的释放会产生不利的生物反应,甚至导致种植失败。
大量资料评价了钛种植体的耐腐蚀性,然而种植体上部结构合金的选择仍然存在着问题,合金本身的腐蚀及多种合金同时应用引起的电偶腐蚀已受到广泛关注。
2 实验利用动电位极化技术研究并探讨钛种植体基台、金合金、镍铬合金、钴铬合金及钛合金在人工唾液中的电化学腐蚀行为,并进行相互比较,发现金合金、纯钛是耐腐蚀性较好的材料,镍铬合金的腐蚀速度最大,应尽量避免用镍铬合金作为种植体上部结构。
关键词:生物材料;口腔生物材料;稳态电位;电偶序;电偶腐蚀;纯钛;金合金;钴铬合金;钛合金;镍铬合金主题词:钛;金合金;铬合金摘要背景:国内有学者运用动电位极化技术测定常用牙科金属自腐蚀电位值来评价低贵金属的腐蚀性能,发现合金的贵金属含量是影响其耐腐蚀性能的主要原因。
目的:评价TA2型商业纯钛、金合金、钴铬合金、钛合金及镍铬合金的体外耐腐蚀性能。
方法:将TA2型商业纯钛、金合金、钴铬合金、钛合金及镍铬合金分别浸入人工唾液中,运用动电位极化技术测量5种材料在人工唾液中的自腐蚀电位和自腐蚀电流密度。
结果与结论:5种合金的自腐蚀电位值由大到小排列顺序为金合金、商业纯钛、钛合金、钴铬合金、镍铬合金;金合金与纯钛电位较正,不易发生腐蚀;钛合金和钴铬合金居中,由于可以形成稳定氧化膜,具有较强的抗孔蚀和缝隙腐蚀能力;镍铬合金电位较负,则较容易发生溶解。

原电池和电解池极化曲线电池的极化曲线是描述电池在不同工作条件下的电压与电流之间关系的曲线。
在电池中,极化是指由于电极上的反应而导致的电压降低。
极化曲线可以用来分析电池的性能、稳定性和寿命。
原电池的极化曲线:
原电池(也称为非充电性电池)是一种一次性电池,不能通过外部电源重新充电。
其极化曲线通常表现为电池在使用过程中电压逐渐下降的趋势。
原电池的极化主要包括两个方面:
1. 浓差极化(Concentration Polarization):电池中的化学反应产生了产物,导致反应物在电极附近浓度下降,从而影响电池的性能。
2. 极化由于电解质移动:随着电池放电,电解质中的离子在电极表面移动,这可能导致极化,特别是在高电流密度下。
电解池的极化曲线:
电解池是一种可以通过外部电源进行充电和放电的电池。
其极化曲线通常显示为充电和放电过程中电流密度和电压之间的关系。
1. 充电时的极化:在电解池充电时,可能会出现极化,其中一些能量被用于克服电极上的电化学反应的阻力。
2. 放电时的极化:在电解池放电时,极化可能是由于反应物的浓度变化、电化学反应速率的限制等原因。
极化曲线的形状和特性取决于电池的类型、电极材料、电解质以及操作条件等因素。
在研究电池性能、设计电池系统或优化电池操作
时,分析极化曲线是一种常见的手段。
极化曲线的测量有助于了解电池的动力学行为,为电池性能的优化提供指导。



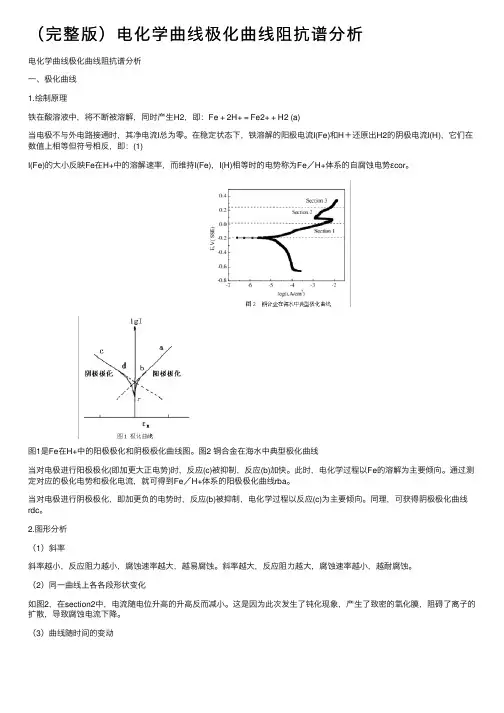
(完整版)电化学曲线极化曲线阻抗谱分析电化学曲线极化曲线阻抗谱分析⼀、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产⽣H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的⼤⼩反映Fe在H+中的溶解速率,⽽维持I(Fe),I(H)相等时的电势称为Fe/H+体系的⾃腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合⾦在海⽔中典型极化曲线当对电极进⾏阳极极化(即加更⼤正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进⾏阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越⼩,反应阻⼒越⼩,腐蚀速率越⼤,越易腐蚀。
斜率越⼤,反应阻⼒越⼤,腐蚀速率越⼩,越耐腐蚀。
(2)同⼀曲线上各各段形状变化如图2,在section2中,电流随电位升⾼的升⾼反⽽减⼩。
这是因为此次发⽣了钝化现象,产⽣了致密的氧化膜,阻碍了离⼦的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),⾃腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增⼤,亦说明更容易腐蚀。
⼆、阻抗谱1.测量原理它是基于测量对体系施加⼩幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因⽽阻抗谱可以通过多种⽅式表⽰。

文章编号:100123849(2008)0720029206 电极的极化和极化曲线( )①——极化曲线覃奇贤, 刘淑兰(天津大学化工学院,天津 300072)Polar ization of Electrode and Polar ization Curve ( )(the end )——Polar ization CurveQ I N Q i 2x ian ,L I U Shu 2lan3 电极电位的测量311 液体接界电位1)定义 两种组成不同、浓度不同或者组成及浓度均不相同的电解液相接触时,在界面上产生的电位差,叫做液体接界电位,以E j 表示。
2)产生原因 当两种组成不同、浓度不同或者组成及浓度均不相同的电解液相接触时,由于两相中相同离子或不同离子存在浓度梯度,必然发生扩散,达稳态时,在两相界面间形成了双电层,双电层所具有的电位差就是液体接界电位。
3)液体接界电位的消除 液体接界电位是不可逆成分,原电池中存在液体接界电位,使原电池电动势的数值丧失热力学意义。
因此在电极电位的测量中必须设法消除或者是将其减到最小。
最常用的方法是采用盐桥,将液体接界电位减到最小。
盐桥实际上是将两种不同溶液隔开的中间溶液,该溶液的浓度很高(一般采用饱和溶液),而且所含正离子与负离子的迁移数比较接近,最常用的是饱和KC l 溶液。
当饱和的KC l 溶液与两种不同溶液相接触时,接界处的电位差主要是由KC l 的扩散产生的,在两个相界面形成的液体接界电位比原来的数值小得多,而且符号相反,因此总的数值将更小。
值得注意的是,盐桥中的溶液不应与原电池中的电解液发生反应,例如待测溶液为A gNO 3溶液,则不能选用KC l 盐桥。
通常用做盐桥的电解质还有KNO 3和N H 4NO 3。
312 电极电位的标度在电极电位的定义中规定,以标准氢电极为负极,待测电极为正极组成原电池,测得该原电池的电动势,叫做待测电极的电极电位,如手册中[1]给出的标准电极电位就是氢标电极电位。
将一种金属(电极)浸在电解液中,在金属与溶液之间就会形成电位,这种电位称为该金属在该溶液中的电极电位。
当有外加电流通过此电极(电解)时,其电极电位会发生变化,这种现象称为电极的极化。
如果电极为阳极,则电极电位将向正方向偏移,称为阳极极化;对于阴极,电极电位将向负方向偏移,称为阴极极化。
令:(16.1)图16.1 典型的阴、阳极极化曲线对于可逆电极,即为平衡电极电位; 对于不可逆电极,为系统达到稳态时的电极电位,即稳态电极电位,或称自腐蚀电位。
习惯上将电极电流密度为i 时对应的电极电位与平衡电极电位之差定义为在该电流密度时的过电位,用符号表示。
并规定阴、阳极的过电位均为正。
根据上述定义,可以分别写出阴、阳极的过电位计算公式为:过电位是一个很重要的电化学参量。
例如在金属电沉积中,析出金属的过电位越小,消耗的电能也就越少。
在电解提纯工艺中,往往借助改变析出金属的过电位,来改变金属的析出顺序,从而获得所需的金属,达到提纯的目的。
如前所述,过电位的大小与流经电极的电流密度有关,电极电位(或过电位)与电流密度的关系曲线称为极化曲线。
图16.1是一种典型的极化曲线。
随着电流密度的增加,电极电位将越来越偏离平衡电位,亦即过电位将越来越大。
极化曲线还常用半对数座标表示,如图16.2 所示。
考察图16.2 可知,当电流密度较大时,过电位与电流密度的对数成线性关系,即:式(16.4),式(16.5) 均称为塔菲尔(Tafel)公式。
图16.2 半对数极化曲线示意图事实上,对于任一电极总是同时存在着两个共轭反应(也可存在两对或两对以上的反应),一是还原反应:(16.6)与之相对应的共轭反应是氧化反应:(16.7)式中o为氧化态;R 为还氧态。
由反应(16.6) 产生的电流密度称为阴极电流密度,用符号表示;而因反应(16.7) 产生的电流密度称为阳极电流密度,用符号i阳表示。
习惯上规定i阴为正,i阳为负。
则电极上的总电流密度i 应是阴极和阳极电流密度的代数和,即:i = i阴+ i阳(16.8)当电极上施以很大的负电压时,反应(16.7)被抑制,而以反应(16.6)为主,即i阴》|i阳|,则i≈i 阴,电极为阴极。
金属电极的极化曲线是描述金属电极在电化学反应过程中电势与电流之间关系的曲线。
它通常是通过进行极化实验来获取的,其中对电极施加一定的电位或电流,并测量相应的电流或电势响应。
极化曲线通常具有三个主要区域:
1. 阳极极化区:在该区域内,电极表面发生氧化反应,即金属电极溶解或氧化。
在该区域,电流随电位的增加而增加,形成一个斜上升的曲线。
2. 反极化区:在该区域内,电极表面的氧化反应逐渐减弱或停止,电流开始饱和。
在该区域,电流变化缓慢,形成一个相对平缓的曲线。
3. 阴极极化区:在该区域内,电极表面发生还原反应,即金属电极得到电子或还原。
在该区域,电流随电位的增加而减小,形成一个斜下降的曲线。
极化曲线的形状和特征取决于金属电极的特性、电解质溶液的成分和浓度,以及外部施加的电位或电流。
通过分析极化曲线,可以获得有关电极的电化学反应、电化学反应动力学以及电极的电化学性能的信息。
这对于研究腐蚀、电镀、电池等电化学过程具有重要意义。
理想极化曲线和实测极化曲线导言极化曲线是电化学实验中常用的一种实验方法,用于表征电化学电极的电化学性质。
理想极化曲线是在理想条件下通过计算得到的曲线,而实测极化曲线是实际实验测量得到的曲线。
本文将详细解释理想极化曲线和实测极化曲线的概念、原理、实验方法和应用,并通过实例加以说明。
理想极化曲线理想极化曲线是在假设电化学电极满足一定条件下通过计算得到的曲线。
它通常由两个部分组成:极化曲线和Tafel曲线。
极化曲线极化曲线是电化学反应过程中电极电位随电流密度变化的曲线,通常以电位为横坐标,以电流密度为纵坐标。
理想极化曲线可以通过计算得到,其中主要包含两个重要参数:开路电位和极化电流密度。
开路电位是极化曲线与电位轴的交点,反映了电极表面的电化学活性。
极化电流密度则是极化曲线降至负饱和值(忽略质子活化)时的电流密度,用于衡量电极材料的电化学反应活性。
Tafel曲线Tafel曲线是描述电化学反应速率与电极电位之间关系的曲线,它是理想极化曲线的一部分。
Tafel曲线可以通过实验测量得到,其斜率给出了电极反应的速率常数。
在Tafel曲线中,通常存在两个部分:阳极Tafel曲线和阴极Tafel曲线。
阳极Tafel曲线描述了阳极反应速率与阳极电位之间的关系,阴极Tafel曲线描述了阴极反应速率与阴极电位之间的关系。
实测极化曲线实测极化曲线是通过实际电化学实验测量得到的曲线,它反映了电化学电极在实验条件下的电化学性质。
实测极化曲线的形状和理想极化曲线通常是相似的,但具体参数可能会有差异。
实验方法为了测量实测极化曲线,需要进行电化学实验,并且需要注意以下几点。
首先,选择合适的工作电极和参比电极。
工作电极是被测量的电极,参比电极具有稳定的电位,用于测量工作电极的电位。
其次,控制实验条件,如温度、溶液浓度、电解质种类等。
保持实验条件的一致性,可以减小实测极化曲线的误差。
然后,通过改变工作电极的电位,测量电流密度,并记录测得的数据。
文章编号:100123849(2008)0620028203 电极的极化和极化曲线( )——电极的极化①覃奇贤, 刘淑兰(天津大学化工学院,天津 300072)摘要:对金属表面处理技术中遇到的有关电极电位、电极过程的速度控制步骤及电极的极化等基本概念,做了深入浅出的解释。
重点介绍了电极极化产生的原因,极化的分类,标准电极电位、平衡电极电位和稳定电位之间的区别和联系,电极电位的测量及标度,极化曲线在电镀中的应用举例,以及在测量中经常遇到的一些问题,如正确选用参比极化,参比电极的制做,液体接界电位及其消除等。
关 键 词:电极电位;电化学极化;电镀;极化曲线中图分类号:TQ153 文献标识码:BPolar ization of Electrode and Polar izationCurve( )——Polar ization of ElectrodeQ I N Q i2x ian,L I U Shu2lan引 言在金属表面处理工艺的研究和生产实践中,经常会遇到电极电位、极化及电极电位与电流密度之间的关系等基本概念,例如电沉积合金的基本条件,必须考虑合金组分的标准电极电位和阴极极化的大小[1]。
选择晶粒细化剂及光亮添加剂等,要考查阴极电极电位(或过电位)与阴极电流密度之间的关系[2]。
研究镀层的耐蚀性要测量腐蚀电流及腐蚀电位等等。
有些电极电位的数据如水溶液中一些电极的标准电极电位[3]和几种常见参比电极的电极电位[4]可以从手册上查到。
而绝大多数数据都是靠实验测量,要使查到或测量获得的数据正确、可靠,能指导科研工作和生产实践,必须弄清楚有关的基本概念,并掌握正确的测量方法。
1 电极电位111 电极与溶液界面间的电位差在电镀槽内阴极与阳极间有电流通过时,均有电极反应发生(包括主反应和副反应),其反应速度大小的重要决定因素之一,是界面间存在电场的作用,这个电场是由界面间存在的双电层给出的,电极反应的速度与双电层的电位有密切的关系。
但是,迄今为止电极与溶液界面间的绝对电位差是无法测量的,也不能精确计算。
因此,为了解决电化学问题,都是采用相对电位差的概念。
即用参比电极与某待测电极组成原电池,测量原电池的电动势,用这一数值来描述某待测电极界面间电位差的相对大小。
目前国际上均采用标准氢电极作参比电极来测量某待测电极的相对电位差。
・82・ Jun.2008 P lating and F in ish ing V o l.30N o.6Serial N o.183①收稿日期:2007210215作者简介:覃奇贤(19362),男,广西武鸣人,天津大学化工学院教授(已退休)1 112 电极电位的概念1)氢标电极电位 氢标电极电位是一个特殊原电池的电动势,原电池中的正极是某待测电极[例如M M Z+,a(M Z+)],负极是标准氢电极[P t,H2(P= 100kPa) H+,a(H+)=1],该原电池的电动势称做某待测电极的氢标电极电位,简称电极电位。
2)平衡电极电位 某电极反应的氧化态和还原态处于平衡状态下的氢标电极电位,以E e表示。
3)标准电极电位 某电极反应的氧化态活度与还原态活度均为1时的平衡电极电位,以E0表示。
2 电极的极化211 问题的提出将两个可逆电极浸在装有同一种溶液的电解槽中,当电极上无电流通过时,两电极反应是可逆的,此时V=E A,e2E K,e,式中V为槽电压,E A,e和E K,e分别为阳极的平衡电极电位和阴极的平衡电极电位。
当有一定电流I通过电解槽时,则V′=E A2E K+IR,式中的R为电解液的欧姆电阻,E A和E K分别为有电流I通过时的阳极电极电位和阴极电极电位。
因为I >0,故IR>0,则V′一定大于E A,e2E K,e,若这个差值全部是由IR引起的,则V′2(E A,e2E K,e)=IR,实际上V′的增加值超过了IR,表明,电解槽中有电流通过时,E A≠E A,e,E K≠E K,e,即两个电极的电极电位均偏离了平衡电极电位,而且通过电极的电流不同, E A和E K的变化也不一样,这样就引出了电极的极化这一概念。
电镀槽的槽电压V在生产中需要经常测量,它可以计算电镀生产中电能的消耗,还可以判断电镀生产是否正常。
但是,槽电压是一个多种因素综合的数据,它的变化不能反映出是哪一项发生了变化。
为了针对性地解决问题,必须弄清每一项的变化情况。
其中镀液的欧姆压降IR,I是已知的,R可通过镀液电导率的测量得到。
而阴极和阳极电极电位随I的变化必须分别进行测量,这就是下面即将讨论的电极的极化,为了消除电极面积对电极电位的影响,采用单位面积上通过的电流,即电流密度。
212 电极的极化当有电流通过电极时,电极电位偏离平衡电极电位的现象叫电极的极化。
1)阴极极化 电流通过阴极时,电极电位向负方向移动,即E K比E K,e负,叫阴极极化。
2)阳极极化 电流通过阳极时,电极电位向正方向移动,即E A比E A,e正,叫阳极极化。
3)过电位 当电极上有电流通过时,电极电位(E K或E A)将偏离平衡电极电位(E K,e或E A,e),二者之差值叫过电位,以∃E表示。
∃E=E2E e阴极极化时,E K<E K,e,故∃E<0阳极极化时,E A>E A,e,故∃E>0213 稳态极化曲线稳态是指电极上通过的电流以及电极电位不随时间改变的状态。
在稳态下,测量得到的电流密度与电极电位(或过电位)之间的关系曲线叫做极化曲线。
图1和图2为典型的稳态阴极极化曲线和阳极极化曲线。
214 电极过程的速度控制步骤电极过程是由几个不同的单元步骤组成的,有时还可能有平行的步骤存在。
最简单也是最基本的电极过程应包括三个接续进行的步骤,以电沉积金属的阴极过程为例,三个必不可少的接续进行的步骤为:1)欲沉积的金属离子自主体溶液向阴极表面附近液层输送,即液相传质步骤;2)金属离子在阴极与溶液界面间得电子还原为金属原子,叫做电子转移步骤;3)还原的金属原子进入晶格形成金属晶体,叫做新相生成步骤。
在相同的推动力下,几个接续进行的步骤单独进行时速度大小不一样,但是,当几个・92・2008年6月 电镀与精饰 第30卷第6期(总183期) 步骤接续进行时,在稳态下,整个电极过程的速度由速度最慢的那个单元步骤控制,电极过程的速度由它决定,这个控制着整个电极过程速度的最慢的单元步骤就叫做速度控制步骤。
215 电化学极化和浓度极化21511电化学极化1)交换电流密度 将金属M 浸入含有M z+离子的溶液中,在两相界面间便发生了物质的转移和电荷的转移,最后建立了物质平衡和电荷平衡,其电极电位即为平衡电极电位。
此时界面间金属离子的还原速度等于金属的氧化速度,以电流密度J 0表示,叫做交换电流密度。
2)电化学极化 以金属电沉积的阴极过程为例,当对镀液进行强烈搅拌,使液相传质步骤无任何困难,将处于平衡状态下的阴极通以外电流,此时电极与镀液界面间的还原反应速度一定大于氧化反应速度,由于电子转移步骤存在着阻力,还原反应不能将外电源输送的电子全部消耗,电极表面负的剩余荷增加,使得电极电位向负方向移动,即产生了极化。
这种由于电子转移步骤的阻力引起的电极的极化叫做电化学极化。
3)交换电流密度与电化学极化的关系交换电流密度J 0是描述电极处于平衡状态的参量,但是它与平衡电极电位E e 不同,E e 是热力学函数,而J 0是动力学函数。
两个E e 相同的电极,其J 0可以相差几千倍。
J 0大的电极,当有外电流通过时,电极反应比较容易进行,则电极电位相对于E e 的移动数值小,即电化学极化小。
相反,J 0小的电极,当有外电流通过时,电极反应的阻力大,电极电位相对于E e 的移动数值大,即电化学极化大。
J 0的数值可以从手册上查出,也可以实验测量。
J 0与电极反应的本性、温度及反应物的浓度有关。
在电镀中,无论哪种使用场合的镀层,都要求结构致密,表面光滑平整,这样的镀层只能在电化学极化比较大的条件下完成。
分析一下生产中沿用多年的电镀液可以发现,只有电镀铁、钴和镍能够从不加添加剂的简单盐镀液中获得结晶细致、平整光滑的镀层,这是因为铁、钴及镍的电极反应的J 0小,产生比较大的电化学极化。
而与它们的J 0相差几千倍的锌及铜等,若采用简单盐电镀液,则需加入添加剂,或者采用络合物电解液,以增大电化学极化,获得合格的镀层。
21512浓度极化1)什么叫浓度极化 浓度极化又叫做浓差极化,有些电极反应的交换电流密度很大,也即是电子转移步骤的阻力很小,液相传质步骤成为控制步骤,由于液相传质困难,使得电极电位偏离平衡电位的现象叫浓度极化。
2)极限电流密度 某金属离子还原为金属的电极过程,若液相传质为控制步骤时,随着阴极电流密度的增加,紧靠电极表面附近液层中反应物的浓度将逐渐减小,极限情况下降到0,此时的电流密度最大,叫做极限电流密度,以J d 表示。
在电镀工艺规范中,一般都给出阴极电流密度的上限和下限值,其中下限值是为了保证一定的沉积速度,而上限值则是为了避免金属电沉积发生浓度极化,因为浓度极化控制下得到的是疏松多孔或海绵状镀层,毫无实用价值。
通常生产中采用阴极移动、机械搅拌、空气搅拌及镀液循环等措施来减小液相传质的阻力,增大允许使用的电流密度上限值。
但是金属电沉积的另一个特例,即电化学方法制取金属粉末,则是要在液相传质步骤控制下进行,使电极反应在极限电流密度下进行。
参考文献:[1] 覃奇贤,郭鹤桐,刘淑兰,等1电镀原理与工艺[M ]1天津:天津科学技术出版社,199312341[2] 郭鹤桐,覃奇贤1电化学教程[M ]1天津:天津大学出版社,2000192,32523281[3] Dobo s D .E lectrochem ical D ata [M ].N ew Yo rk :E lserier Scientific Publish ing Company ,1975.250.[4] 朱元保,沈子琛,张传福,等1电化学数据手册[M ]1长沙:湖南科学技术出版社,1985123022321(待续)《实用电铸技术》由刘仁志编著、化学工业出版社出版的《实用电铸技术》已于2006年9月在全国各地新华书店发行。
化学工业出版社 机械电气分社 金属材料编辑部 T el :010*********,地址:(100029)北京市朝阳区惠新里3号,网上书店:www .ci p .com .cn E -ma il :dzb @ci p .com .cn・03・ Jun .2008 P lating and F in ish ing V o l .30N o .6Serial N o .183。