SPSS正交设计优化琼胶酶产生菌的发酵条件
- 格式:pdf
- 大小:3.02 MB
- 文档页数:6


琼胶降解菌产酶条件优化、酶学性质和糖代谢途径尹群健;陈潇骁;杨宏胜;林明师;毛欣琪;方再光【摘要】为确定热带海洋环境中琼胶降解菌的最佳产酶条件和最适培养条件,提高其产酶能力,采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)比色法测酶活,研究其酶学性质并利用高通量测序获得其参加糖代谢的酶.单因素和多因素研究结果表明:FG12的最佳产酶条件为1%蛋白胨、0.8%琼脂、0.02% K2HPO4、pH 7.5、28℃;最适培养条件为0.8%琼脂粉、0.5%蛋白胨、pH 6.8.优化后的酶活达到739.58 U/mL,比优化前提高了273.49%.琼胶酶的最适温度为36℃,在36~55℃之间的热稳定性很好;最适pH值为7.5,在pH为6.5~7.5时,酸碱稳定性较好.高通量测序的代谢图中,FG12中含有多种不同数量的酶参与糖代谢,能通过基因改造提高酶产量.因此,FG12是一株高效琼胶降解菌,为潜在的工程菌.【期刊名称】《广东农业科学》【年(卷),期】2014(041)009【总页数】6页(P117-122)【关键词】琼胶降解菌;琼胶酶;产酶条件;酶学性质;糖代谢途径【作者】尹群健;陈潇骁;杨宏胜;林明师;毛欣琪;方再光【作者单位】海南大学热带生物资源教育部重点实验室/海南省热带水生生物技术重点实验室,海南海口 570228;海南大学热带生物资源教育部重点实验室/海南省热带水生生物技术重点实验室,海南海口 570228;海南大学热带生物资源教育部重点实验室/海南省热带水生生物技术重点实验室,海南海口 570228;海南大学热带生物资源教育部重点实验室/海南省热带水生生物技术重点实验室,海南海口 570228;海南大学热带生物资源教育部重点实验室/海南省热带水生生物技术重点实验室,海南海口 570228;海南大学热带生物资源教育部重点实验室/海南省热带水生生物技术重点实验室,海南海口 570228【正文语种】中文【中图分类】TQ925琼胶是一种重要的海藻多糖,是由琼胶糖和硫琼胶组成的混合物[1]。

利用SAS优化琼胶酶产生菌DT-7发酵条件刘璐,章宗铭宁波大学生命科学与生物工程学院,浙江宁波 (315211)E-mail: zzm1215@摘要: 从筛选出的琼胶酶产生菌DT-7出发,对其发酵的6个条件进行单因素分析,再利用SAS统计软件Fractional factorial设计选出两个显著因子X2(热休克),X5 (发酵时间),再用响应面中Central Composite: Uniform Precision设计进行试验设计以及优化,最后用SAS中的响应面分析和RSREG (响应面回归)过程进行数据分析建立二次响应面回归模型,并进而寻求最优响应因子水平。
经整理,所得相关的数学模型Y1 = 499 + 7.853534*X2 + 3.63391*X5 - 6.28126*X2*X2 + 3.1*X2*X5 - 11.25627*X5*X5。
从中得到发酵最优条件X1(接种量)=1.5%,X2 (热休克) =31s,X3(初始pH)=7.5,X4(摇床转速)=120rpm,X5(发酵时间)=28.4h X6(发酵温度)=23.5℃可发酵产生最大值酶活为502.2U/ml。
按上述配方进行发酵,测得平均酶活为501.9 U/ml,与SAS统计软件计算出的数据吻合。
关键词:琼胶酶;单因素;Fractional factorial设计;Central Composite设计;响应面分析琼胶主要从石花菜、江篱、鸡毛菜等红藻中提取分离,由琼胶糖(agarose)和硫琼胶(agaropectin)组成,琼胶糖是由1,3 连接的β-D-半乳吡喃糖和1,4 连接的3,6-内醚-α-L-半乳吡喃糖残基反复交替连接的链状中性糖[1]。
硫琼胶结构较复杂,含有D-半乳糖、3,6-半乳糖酐、半乳糖醛酸和硫酸基,丙酮酸[2]。
琼胶酶能降解琼胶多糖,生成琼胶低聚糖,这些降解产物在食品领域均有良好的应用前景。
而且,琼胶酶在PCR 产物回收等方面也极具应用价值。

正交法测定酶的最适条件流程Enzymes are essential proteins that act as biological catalysts in various cellular processes. They are highly specific and sensitive to their surrounding conditions, including temperature, pH, and substrate concentration. Therefore, determining the optimum conditions for enzyme activity is crucial for understanding and utilizing their potential in industrial and research applications.酶是在各种细胞过程中起作用的生物催化剂,它们是非常特异的,并且对其周围的条件,包括温度、pH 值和底物浓度非常敏感。
因此,确定酶活性的最适条件对于理解和利用它们在工业和研究应用中的潜力至关重要。
One commonly used method for determining the optimum conditions for enzyme activity is the use of orthogonal arrays, also known as orthogonal experiments or Taguchi methods. Orthogonal arrays allow for the systematic variation of multiple factors simultaneously, reducing the number of experiments needed to determine the optimal conditions.一个通常用于确定酶活性最适条件的方法是使用正交阵列,也称为正交实验或田口方法。
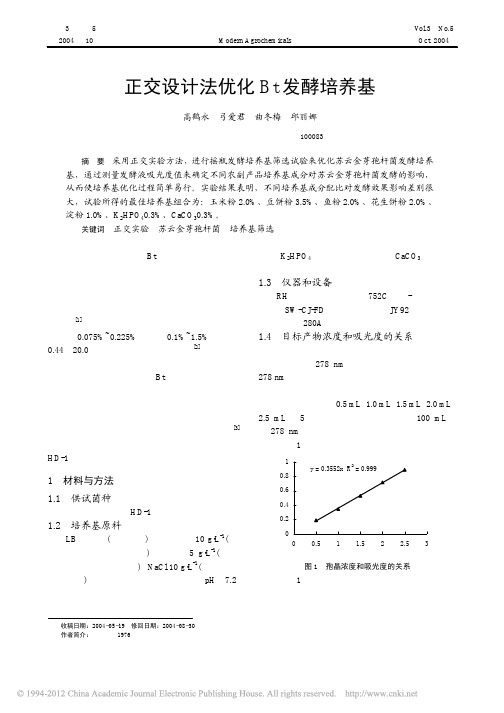
第3卷第5期现代农药V ol.3 No.5正交设计法优化Bt发酵培养基高鹤永弓爱君曲冬梅邱丽娜(北京科技大学应用科学学院北京 100083)摘要采用正交实验方法,进行摇瓶发酵培养基筛选试验来优化苏云金芽孢杆菌发酵培养基,通过测量发酵液吸光度值来确定不同农副产品培养基成分对苏云金芽孢杆菌发酵的影响,从而使培养基优化过程简单易行。
实验结果表明,不同培养基成分配比对发酵效果影响差别很大,试验所得的最佳培养基组合为:玉米粉2.0%、豆饼粉3.5%、鱼粉2.0%、花生饼粉2.0%、淀粉1.0%、K2HPO40.3%、CaCO30.3%。
关键词正交实验苏云金芽孢杆菌培养基筛选苏云金杆菌杀虫剂(Bt)是联合国粮农组织和世界卫生组织推荐、目前在世界上生产和使用量最大的生物杀虫剂。
与化学杀虫剂相比,其主要特点是:对人畜及其它有益生物无害,无环境污染,害虫不易对其产生抗药性,是具有广阔应用前景的生物农药[1]。
苏云金芽孢杆菌对营养物质的要求不高,在含氮0.075%~0.225%,含糖0.1%~1.5%和糖氮比0.44~20.0的环境下就能很好的生长[2]。
国际上生产此菌的主要原料为酵母浸出液、大豆粉、淀粉、葡萄糖等。
虽然由此生产的Bt成品效价高,但存在着原料成本高的问题,造成粮食产品的浪费,从而失去了与化学农药的竞争力。
为了便于工业化大规模发酵生产,降低生产成本,本文利用一些生产成本低廉的农副产品作为发酵培养基的主要碳氮源[3],采用正交设计试验结合测定发酵液吸光度,确定了HD-1菌株的最佳产毒发酵培养基组分。
1 材料与方法1.1 供试菌种苏云金芽孢杆菌HD-11.2 培养基原料LB培养基(质量浓度):胰蛋白胨10 g·L-1(北京双旋微生物培养基制品厂)、酵母膏5 g·L-1(北京双旋微生物培养基制品厂)、NaCl 10 g·L-1(北京益利化学品公司)、琼脂(北京化学试剂公司)pH=7.2。

THEORY | 理论研究June 2018 China Food Safety ·69·正交试验设计在优化酿酒酵母培养条件中的应用Application of orthogonal experiment design in optimizing culture conditions of Saccharomyces cerevisiae摘 要:本文以优化酿酒酵母培养条件为例,详细阐述了正交试验设计的应用过程,包括正交试验设计中的具体环节如:定指标、选因素、定水平、列因素水平表、选正交表等。
具体采用了L 9(33)正交表对影响酿酒酵母生长的关键因素:培养时间、培养温度和摇床转速进行了正交试验设计,同时详细阐述了如何对试验结果进行方差分析和极差分析。
关键词:正交试验设计;优化;培养条件;酿酒酵母Abstract: In this paper, to optimize the cultureconditions of Saccharomyces cerevisiae as an example, the application process of orthogonal experiment designis described in detail. The specific links of orthogonal experiment design are as follows: setting indicators, factoring, setting level, column factor table, choosing the orthogonal table and so on. Adopting the L 9 (33) orthogonal table on the growth of Saccharomyces cerevisiae including: the incubation time, the culture temperature and therotational speed of the shaker were investigated by orthogonal test. At the same time, the variance analysis and the analysis of the results were analyzed in detail.Key words: orthogonal experiment design; optimization; culture conditions; Saccharomyces cerevisiae.酿酒酵母也称出芽酵母或面包酵母,为革兰氏染色阳性菌,单细胞,球形、椭圆形(3~8 μm)或细胞延伸呈退化型假菌丝。

正交试验设计优化酵母发酵FBP条件
赵秀举;刘志国
【期刊名称】《中国酿造》
【年(卷),期】2013(032)011
【摘要】以酿酒酵母为试验材料,采用正交试验设计优化发酵果糖l,6-二磷酸(FBP)的条件:酵母添加量,蔗糖添加量,渗透剂比例,微量营养素含量.结果表明,酵母5%,蔗糖9%,甲苯、吐温-20各1%,MgCl2·6H2O 0.12%为发酵FBP的优化条件.在此基础上进行了酵母细胞破碎和固定化研究,使FBP含量得以进一步提高.同时活性干酵母发酵FBP的优化条件被应用到废旧酵母,提高了废旧酵母的利用价值.
【总页数】3页(P36-38)
【作者】赵秀举;刘志国
【作者单位】武汉轻工大学生物与制药工程学院农产品加工湖北省协同创新中心,湖北武汉430023;武汉轻工大学生物与制药工程学院农产品加工湖北省协同创新中心,湖北武汉430023
【正文语种】中文
【中图分类】TQ920.6;TQ46
【相关文献】
1.正交试验设计优化凤尾菇菌丝体多糖发酵条件 [J], 姜贺;汪岩;夏泽;李洪龙
2.正交试验设计优化丝绸水解条件 [J], 刘娟;杨柳;徐方圆;施超欧;吴珊珊;郑翠
3.洗面奶微波消解处理条件的正交试验设计优化 [J], 周元元;刘和蓓;邹勇平;谢虹
4.正交试验设计优化气相色谱分析条件 [J], 刘国军;李宁辉;宋子平
5.正交试验设计优化近红外检测牛乳中蛋白质的建模条件 [J], 彭丹; 刘亚丽; 李林青; 毕艳兰
因版权原因,仅展示原文概要,查看原文内容请购买。

琼胶酶高产海洋细菌QM42的发酵条件优化
王霁宁;严孝强;杜宗军
【期刊名称】《中国酿造》
【年(卷),期】2012(031)007
【摘要】通过单因素试验和正交试验对琼胶酶高产海洋细菌QM42发酵条件进行了优化.经过发酵培养试验,确定优化培养基组成:蛋白胨浓度5.0g/L、酵母粉浓度0.50g/L、琼胶浓度3.0g/L;在培养初始pH值为7.0、装液量50mL/150mL、培养盐度50g/L,29℃条件下发酵48h,粗酶液酶活力达到627.65U/mL.
【总页数】4页(P86-89)
【作者】王霁宁;严孝强;杜宗军
【作者单位】山东大学海洋学院,山东威海264209;山东大学海洋学院,山东威海264209;山东大学海洋学院,山东威海264209
【正文语种】中文
【中图分类】Q93-335
【相关文献】
1.产琼胶酶菌株NBRC102603发酵条件优化及酶的分离纯化 [J], 朱慧文;孙延娜;周晓龙;郝梅;郭振博;施超;朱启忠
2.海洋细菌NBRC10260产琼胶酶发酵条件优化 [J], 朱启忠;朱慧文;孙艳娜;周晓龙;郝梅;郭振博;施超
3.产琼胶酶海洋细菌的分离、鉴定及其分解琼胶实验 [J], 王祥红;贾仁洁;张超;汤志宏
4.一株高产琼胶酶海洋细菌的筛选与鉴定 [J], 周钦茂;谢燕纯;陈彦梅;张扬;柯德森;陈琼华
5.海洋细菌Vibrio fluvialis的分离鉴定、产琼胶酶条件优化及酶的分离纯化 [J], 李驰; 李春生; 杨贤庆; 戚勃; 赵永强; 王悦齐
因版权原因,仅展示原文概要,查看原文内容请购买。


发酵纤维-正交优化/响应面实验方法一、发酵前准备(1)发酵底物混合发酵底物(菊苣叶:菊苣粕:麸皮=1:3:3);尿素(2)培养基梭菌增殖培养基(RCM):1000mL水中加蛋白胨10g,牛肉粉10g,酵母粉3g,葡萄糖5g,可溶性淀粉1g,氯化钠5g,醋酸钠3g,L-半胱氨酸盐酸盐0.5g,琼脂0.5g,pH值6.8±0.1。
马铃薯培养基(PDA):200g马铃薯去皮,切成块加水,煮沸30min(注意火力的控制,可适当补水),用纱布过滤,滤液加葡萄糖20g,琼脂15-20g补足水至1000ml,pH值5.6±0.2。
乳酸菌培养基(MRS):蒸馏水1000mL,蛋白胨10g,牛肉膏10g,酵母膏5g,柠檬酸氢二铵[(NH4)2HC6H5O7] 2g,葡萄糖20g,吐温-80 1mL,乙酸钠(CH3COONa·3H2O)5g,磷酸氢二钾2g,硫酸镁(MgSO4·7H2O)0.58g,硫酸锰(MnSO4·H2O)0.25g,琼脂18g,pH值6.2-6.6。
二、单因素发酵(1)菌种活化及种子液的制备丁酸梭菌:将菌种接种于装有增值培养基RCM的试管中,培养基上覆盖2cm 左右液体石蜡,培养基提前灭菌,37℃静置培养48h以形成芽孢。
将上述芽孢培养物置于80℃水浴处理10min,再分别以1mL的接种量转接到灭过菌的装有9mL 增殖培养基的试管中,以灭菌后空白培养基作为对照,在650nm处测吸光值,确定菌液浓度。
或采用厌氧菌双层培养法。
黑曲霉:将斜面生长的黑曲霉,转接种于PDA固体培养基上,28℃恒温培养箱中培养至表面铺满孢子,用液体培养基冲洗孢子获得孢子悬液,用双层纱布过滤掉菌丝后于4℃保存备用。
然后用血球计数板计数/紫外分光光度计确定孢子浓度,视情况调整孢子浓度至0.8-1.2×108个/mL,发酵培养基的含水量包含接入的菌液。
乳酸菌:将乳酸菌冻干粉接入乳酸菌(MRS)培养基进行活化,再将其转入乳酸菌液体培养基中进行扩大培养,制备种子液,菌液浓度参考冻干粉每克的活菌数。

实验利用正交试验设计选择和优化最适培养基一、实验目的1. 掌握单正交试验选择微生物最适发酵条件和培养基的基本方法;2. 掌握微生物摇瓶发酵实验的基本操作技术;3. 初步掌握用正交表试安排试验及对实验结果进行分析的方法。
二、实验原理对于一个生物作用过程,其结果或产物的得到受到多种因素的影响。
如发酵中,菌种接入量、酶的浓度、底物浓度、培养温度、pH 值、菌种生长环境中的氧气、二氧化碳浓度、各种营养成分种类及其比例等。
对于这种多因素的实验,如何合理地设计实验,提高效率,以达到所预期的目的是需要进行认真考虑和周密准备的。
正交实验法是安排多因素、多水平的一种实验方法,即借助正交表的表格来计划安排实验,并正确地分析结果,找到实验的最佳条件,分清因素和水平的主次,这就能通过比较少的实验次数达到好的实验效果。
现以灰黄霉素产生菌D-756为例,研究不同氯化物浓度及大米粉配比对灰黄霉素产生菌D-756变种发酵特性的影响。
试验共三个因素,每个因素取三个水平。
1. 确定试验的培养基组成成分(因素)和每种组成成分的含量(水平)影响试验指标的因素很多,由于试验条件的限制,不可能逐一或全面地加以研究,因此要根据已有的专业知识及有关文献资料和实际情况,固定一些因素于最佳水平,排除一些次要的因素,而挑选一些主要因素。
正交试验设计法正是安排多因素试验的有利工具。
当因素较多时,除非事先根据专业知识或经验等,能肯定某因素作用很小而不选取外,对于凡是可能起作用或情况不明或看法不一的因素,都应当选入进行考察。
因素的水平分为定性与定量两种,水平的确定包含两个含义,即水平个数的确定和各个水平数量的确定。
对定性因素,要根据试验具体内容,赋予该因素每个水平以具体含义。
定量因素的量大多是连续变化的,这就要求试验者根据相关知识或经验、或者文献资料首先确定该因素的数量变化范围,而后根据试验的目的及性质,并结合正交表的选用来确定因素的水平数和各水平的取值。


果胶酶高产菌株筛选发酵条件优化以及酶学性质的研究果胶酶是一种重要的工业酶,具有广泛的应用前景。
为了提高果胶酶的产量,本研究旨在筛选果胶酶高产菌株,并优化其发酵条件,同时对其酶学性质进行研究。
首先,我们从自然环境中采集了一系列样品,包括土壤和水体样品。
然后,将这些样品进行稀释并接种到含有果胶为唯一碳源的培养基中。
经过连续传代和筛选,最终从中获得了一株具有较高果胶酶活性的菌株A。
接下来,为了优化菌株A的发酵条件,我们设计了一系列实验。
首先是培养基的优化。
我们通过改变碳源、氮源和矿物盐等成分的浓度和组合,最终确定了一种最适合菌株A生长和果胶酶产量的培养基配方。
然后,对于菌株A的培养条件进行了进一步的优化。
我们调整了温度、pH值、培养时间和初始菌体浓度等参数,并通过检测果胶酶活性来评估不同条件下的产酶效果。
最终,找到了最适宜的发酵条件,菌株A在这种条件下果胶酶的产量显著提高。
接下来,我们对菌株A产生的果胶酶进行了酶学性质的研究。
首先是酶活温度和酶活pH的测定。
我们利用不同温度和不同pH值下的底物降解实验,确定了菌株A产生的果胶酶的最适活性温度和最适活性pH。
然后,对菌株A产生的果胶酶进行了酶动力学性质的研究。
我们通过测定果胶酶对果胶的降解效果,建立了不同底物浓度下果胶酶的反应速率曲线,并利用Michaelis-Menten方程对其进行了分析。
最后,我们对菌株A产生果胶酶的产酶机制进行了初步探究。
通过基因组测序和蛋白质组学技术的应用,我们发现菌株A产生果胶酶的基因和调控机制,为进一步提高果胶酶产量和改良菌株奠定了基础。
总结而言,本研究通过筛选果胶酶高产菌株并优化发酵条件,成功提高了果胶酶的产量。
同时,对果胶酶的酶学性质进行了深入研究,探究了其最适工作温度、pH值以及底物浓度对酶活性的影响。
通过对产酶机制的初步探究,为今后果胶酶的应用及菌株改良提供了一定的参考依据综上所述,本研究通过对菌株A产生的果胶酶进行了全面的酶学性质和酶动力学性质的研究,同时对其产酶机制进行了初步探究。

正交试验设计步骤-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN正交试验设计步骤1 在SPSS中手动录入数据。
请注意写入空白列。
2 点击数据→正交设计→生成,出现“生成正交设计”对话框。
按因素水平表进行赋值,空白列的赋值为1“1”,2“2”,3“3”3 点击“数据”→“正交设计”→“显示”,空白列的D可不加到右边的“因子”框中。
4 测量数据填入表8中的“STATUS_”列的相应单元格中5单击“分析”→“一般线性模型”→“单变量”注意不要选“空白列”6 单击“对比”→选择“简单”7 单击“模型”→选择“设定”→将“A”、“B”、“C”选入右边的“模型”中→单击“构建项”中的“主效应”,8 单击“选项”→将“因子与因子交互”中的“A”、“B”、“C”选入“显示均值”中→勾选“比较主效应”,9 结果分析(1)方差分析结果主体间因子值标签N硬脂酸钠溶液浓度1403根据正交试验方差分析可知,硬脂酸钠溶液浓度和硫酸铝溶液浓度对试验指标的影响非常显著,而处理时间对试验指标的影响不显著。
影响程度的大小也有差异,A>B(2)单因素统计量分析1. 硬脂酸钠溶液浓度成对比较因变量:STATUS_差异。
综合上述两表可以得出:B3均数最大(),且B1与B2、B3之间存在显著性的差异,B2、B3之间不存在显著性的差异。
3.浸渍时间估计综合上述两表可以得出:C1均数最大(),C1、C2、C3之间不存在显著性的差异。
(3)结论涤纶防水整理的较佳工艺条件是A3B3C1,即硬脂酸钠溶液浓度60g/L,硫酸铝溶液浓度60g/L,处理时间5min。


琼脂糖酶产生菌Brevundimonas sp.发酵条件探讨赵蓉蓉;陈雪婷;桑卫国;章宗铭【期刊名称】《宁波大学学报(理工版)》【年(卷),期】2014(000)001【摘要】为研究微生物发酵法获取高产量、高活性的琼脂糖酶,以海洋细菌Brevundimonas sp.为实验菌株,首先采用单因子分析法对发酵条件进行初步研究,然后用部分析因试验设计方法选出2个显著因子热休克时间和发酵时间,用中心组合设计方法进行试验设计及其发酵条件优化,最后建立二次响应面回归模型.从该模型可获得适宜发酵条件:接种量1.5%,热休克时间31 s,初始pH 7.5,摇床转速120 r·min-1,发酵时间28.4 h,发酵温度23.5℃.发酵条件优化后可产最大酶活502.2 U·mL-1,产酶活力较优化前提高了35%.%To obtain high yields and high activeness of agarase, marine bacteria strain Brevundimonas sp. agarase-producing is selected to study the optimal fermentation conditions. Using single factor analysis of the fermentation conditions for a preliminary study, fractional factorial design is used to select two significant factors of heat shock time and fermentation time, the central composite design is adopted in experimental design and optimization of the fermentation conditions. Then quadratic response surface regression model is established. The optimal fermentation condition is obtained from the following model:Inoculation of 1.5%;heat shock time 31 s;initial pH7.5;rotation speed 120 r·min-1;fermentation time 28.4 h;fermentation temperature 23.5℃. The highest activity of agarase is 502.2 U·mL-1 underthe optimal fermentation conditions, which is 1.35 times as high as that under the original conditions. This study is expected to provide some technical guidance for future application of the microbial strain in commercialization of the agarase.【总页数】5页(P13-17)【作者】赵蓉蓉;陈雪婷;桑卫国;章宗铭【作者单位】宁波大学海洋学院,浙江宁波 315211;宁波大学海洋学院,浙江宁波 315211;宁波大学海洋学院,浙江宁波 315211;宁波大学海洋学院,浙江宁波 315211【正文语种】中文【中图分类】Q815【相关文献】1.木聚糖酶产生菌Gh-5培养基配方及发酵条件的优化 [J], 杨子荣;王静;许萌;张琇2.产β-甘露聚糖酶Aspergillus sp. LQ21的分离、鉴定及发酵条件的研究 [J], 赵伟;郑甲;周洪波3.碱性β-甘露聚糖酶产生菌的筛选、鉴定及发酵条件优化 [J], 汤文晶; 李松; 马忠宝; 杨倩; 汤斌4.一株碱性木聚糖酶产生菌的筛选及发酵条件的优化 [J], 易旭东;潘虎;田云;刘博伦;林元山5.耐碱性β-甘露聚糖酶产生菌的分离鉴定及发酵条件优化 [J], 汪梦昀;缪礼鸿;励飞;刘蒲临;廖卫芳因版权原因,仅展示原文概要,查看原文内容请购买。

第23卷第2期宁波大学学报(理工版) V ol.23No.2 2010年4月JOURNAL OF NINGBO UNIVERSITY ( NSEE ) Apr. 2010文章编号:1001-5132(2010)02-0011-06SPSS正交设计优化琼胶酶产生菌的发酵条件王晓燕1, 桑卫国1,2*(1.宁波大学生命科学与生物工程学院, 浙江宁波 315211;2.宁波大学应用海洋生物技术教育部重点实验室, 浙江宁波 315211)摘要: 实验以从海洋环境中分离获得的一株琼胶酶产生菌Halomonas sp. DT-3为出发菌株, 研究其发酵产酶的最佳培养基组成和发酵条件. 以琼胶、蛋白胨、酵母膏、NaCl、K2HPO4、MgSO4、CaCl2为考察因素, 发酵液中琼胶酶活力为指标, 通过SPSS软件设计L27(37)正交试验. 结果表明: 通过正交实验得出菌株发酵产酶最佳培养基组成为琼胶0.5%、NaCl3.5%、蛋白胨0.3%、酵母膏0.2%、K2HPO4 0.1mmo l·L-1、MgSO4 0.3mmo l·L-1、CaCl2 1mmo l·L-1, 菌株发酵琼胶酶活力稳定在191U·mL-1左右.关键词: SPSS; 琼胶酶; 发酵; 优化中图分类号: TS254 文献标识码: A琼胶酶是一类能够降解琼胶多糖的酶的总称,其降解产物为琼胶寡糖[1]. 产琼胶酶的细菌主要存在于海洋环境中. 在潮汐带, 已经证明每克淤泥中含有的琼胶降解菌可达1×107个, 大约占所有好气细菌的2%~4%. 琼胶酶的应用广泛, 在医药领域, 制备所得的琼脂寡糖具有抗肿瘤、抗氧化、增强免疫等多种生理活性功能[2]; 在海水养殖领域, 可用于海藻单细胞的分离和海藻原生质体的制备, 是海藻遗传工程的工具酶; 琼胶寡糖还可用于饮料、面包及低热量食品的生产, 作为天然防腐剂和淀粉老化抑制剂[3], 利用琼胶酶还可从琼脂糖凝胶中回收DNA和RNA等. 由于产琼胶酶的菌株大多数来源于海洋, 受海洋特殊生长环境的影响, 这些菌种产酶性状不稳定. 目前, 实现了工业化生产的只有大西洋假单胞菌(Pseudomonas atlantica), 其产品来自于Sigma公司, 价格昂贵[4], 应用范围也仅限于科研工作中, 这大大阻碍了琼胶酶及琼胶低聚糖的开发应用. 影响菌株琼胶酶产量和活力的因素, 除菌种外, 培养基组成和发酵条件也十分重要. 因此, 选择适当的碳源、氮源及无机盐并对其组成进行合理的设计和配制, 使其既能满足产酶微生物生长的需要, 也能满足菌株产酶的需要. 同时优化培养条件, 如培养温度、培养基起始pH、发酵时间等, 可进一步提高菌株产琼胶酶的能力. 实验运用SPSS 11.5软件设计7因素3水平正交试验, 选用琼胶、蛋白胨、酵母膏、NaCl、K2HPO4、MgSO4、CaCl2为考察因素, 以发酵液中琼胶酶活力为指标, 对琼胶酶产生菌株发酵培养基的组成和发酵条件进行优化, 为实现琼胶酶的工业化生产提供实验依据.收稿日期:2009-06-16. 宁波大学学报(理工版)网址: 基金项目:农业部水产种质资源与养殖生态重点开放实验室科研项目(KFT2006-2).第一作者:王晓燕(1982-), 女, 山东烟台人, 在读硕士研究生, 主要研究方向: 食品生物技术.E-mail:**************************12 宁波大学学报(理工版) 20101材料与方法1.1菌种来源盐单胞菌属, 命名为Halomonas sp. DT-3, 来源于温州洞头某紫菜养殖场中的腐烂坛紫菜(Por- phyra haitanensis).1.2培养基固体斜面培养基(w/v): 蛋白胨0.5%, 酵母膏0.1%, 琼脂1.5%, 陈海水配制, pH 7.2~7.6.发酵培养基(w/v): 蛋白胨0.3%, 酵母膏0.2%,琼脂0.3%, NaCl 2.5%, pH 7.2~7.6.1.3实验方法1.3.1 琼胶酶活力的测定方法实验采用测定还原糖含量的DNS法[5]来测定琼胶酶活力的大小. 琼胶酶作用于琼胶, 将琼脂多糖水解产生系列寡糖, 产生具有还原性的末端. 在碱性条件下, 3,5-二硝基水杨酸溶液与还原糖溶液共热后, 被还原成棕红色的氨基化合物. 在一定范围内, 还原糖的量与棕红色物质颜色深浅成一定比例, 可用于比色测定.标准曲线的制作[6]: 准确称取100mg半乳糖(预先在105℃下干燥至恒重), 用少量蒸馏水溶解后, 转移到100mL容量瓶中, 定容, 摇匀, 浓度为l m g·mL-1. 取9支25mL具塞比色管, 按表1分别加入试剂, 将各管溶液混合均匀后, 在沸水浴中加热5min, 立即用冷水冷却到室温, 分别定容到25mL, 摇匀, 于520nm处测光吸收值. 然后根据吸光值作标准曲线, 如图1所示.将一个酶活力单位定义为在上述条件下, 每分钟产生1μg还原糖所需的酶量. 酶活力公式为: 酶活力(U·mL-1) = (A/0.1801)×1000×n/t, 式中: A 为吸光值, 0.1801为标准曲线的斜率, n为酶液稀释的倍数, t为反应时间.图1 520nm半乳糖标准曲线1.3.2 琼胶酶产生菌发酵培养基组成的L27(37)正交试验设计以琼胶、蛋白胨、酵母膏、NaCl、K2HPO4、MgSO4、CaCl2为考察因素, 发酵液中琼胶酶的活力为指标, 优化琼胶酶产生菌发酵培养基的组成, 实验因素见表2.用SPSS 11.5软件进行正交设计, 实验数据直接输入设计的表格进行计算, 所有试验重复3次, 分别平行取样, 然后用SPSS 11.5进行数据分析.1.3.3 菌株发酵条件的研究采用单因素实验对发酵条件进行优化.(1) 培养基初始pH对产酶的影响. 培养基的起始pH值分别为5、5.5、6、6.5、7、7.5、8、8.5、9, 其他条件不变, 培养36h后测定发酵液酶活力.(2) 培养温度对产酶的影响. 培养温度分别设为20、24、28、32、36℃, 其他条件不变, 培养36h后测定发酵液酶活力.(3) 摇床转速对产酶的影响. 将接种的发酵培养基分别在40、80、120、160、200r·min-1条件下, 调节培养基通气量, 其他条件不变, 培养36h后测定发酵液酶活力.(4) 接种量对产酶的影响. 分别以0.5%、1%、1.5%、2%、2.5%、3%的接种量进行发酵培养, 其表1 半乳糖标准曲线的制作管号0 1 2 3 4 5 6 7 8 半乳糖标液/mL 0 0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40 蒸馏水/mL 2.01.951.901.851.80 1.75 1.70 1.65 1.60DNS/mL 1.51.51.51.51.5 1.5 1.5 1.5 1.5第2期 王晓燕, 等: SPSS 正交设计优化琼胶酶产生菌的发酵条件 13他条件不变, 培养36h 后测定发酵液酶活力. 2 结果与讨论2.1 发酵培养基组成和优化2.1.1 不同碳源对菌株发酵产酶的影响分别选取葡萄糖、果糖、麦芽糖、蔗糖、乳糖、淀粉、琼胶为唯一碳源, 浓度均为0.3%, 发酵30h 后测定发酵液酶活力, 选择最佳碳源, 结果如图2所示. 由图2可知, 菌株在以琼胶为唯一碳源的培养基中发酵产酶, 且琼胶酶的活力最高. 在其他碳源的培养基中酶活力很低. 由此可见琼胶是琼胶酶产生菌株发酵产酶的最佳碳源, 可以诱导菌株产生琼胶酶.图2 不同碳源对产酶的影响2.1.2 不同氮源对菌株发酵产酶的影响分别取硝酸钠、蛋白胨、酵母膏、硝酸铵、氯化铵作为氮源, 浓度均为0.2%, 发酵30h 后测定酶活力, 结果见图3. 由图3可知, 此菌株能在多种氮图3 不同氮源对产酶的影响源中生长, 但在不同氮源中生长时其产酶量显著不同. 其在酵母膏和蛋白胨作为氮源时, 产酶效果最佳, 故选取酵母膏和蛋白胨作为菌株发酵的氮源.2.1.3 不同无机盐对菌株发酵产酶的影响K +、Ca 2+、Mg 2+、Fe 3+和Fe 2+是海洋细菌培养过程中常用到的金属离子, 因此选择取由CaCl 2、FePO 4· 4H 2O 、FeSO 4·7H 2O 、KH 2PO 4、MgSO 4·7H 2O 、Na 2HPO 4·12H 2O 、K 2HPO 4·3H 2O 作为唯一的无机盐加入培养基中, 离子浓度均为1mmol·L -1, 测定发酵产酶量, 结果见图4. 由图4可知, K +、Ca 2+、Mg 2+的加入对此菌的生长和产酶均有促进作用, 尤其是CaCl 2的加入, 使酶活显著增加. 故选取CaCl 2、K 2HPO 4·3H 2O 和MgSO 4·7H 2O 作为发酵培养基中要添加的无机盐.图4 不同无机盐对发酵产酶的影响2.2 发酵条件的优化2.2.1 培养基起始pH 对产酶的影响发酵培养基的初始pH 值对细菌生长和产酶都具有明显的影响. 一般认为培养基中的氢离子和氢氧根离子对微生物的影响是间接的, 首先作用于胞外的可解离的弱酸或弱碱, 形成易透过细胞膜的游离态进入胞内再作用于参与代谢的各种酶类, 从而影响菌体的生长和产物的合成. 测定发酵液不同初始pH 对菌株发酵产酶的影响, 结果见图表2 培养基正交试验各因素和水平因素(w /v )水平琼胶A NaCl B 蛋白胨C酵母膏D K 2HPO 4 E MgSO 4 F CaCl 2 G1 0.3 1.5 0.1 0.1 0.1 0.1 0.52 0.4 2.5 0.2 0.2 0.2 0.2 13 0.5 3.5 0.3 0.3 0.3 0.3 1.514 宁波大学学报(理工版) 20105. 由图5可知, 起始pH 在6.5~7.5范围内, 发酵液酶活力较高, 当起始pH 值小于6或大8.5时发酵液酶活力均较低, 因此, 偏酸或偏碱的培养环境均不利于菌株发酵产酶.图5 不同pH 值对产酶的影响2.2.2 培养温度对产酶的影响温度是最重要的影响微生物生长和生存的环境因素之一. 温度能以2种相反的方式影响活的微生物体. 当温度升高时, 细胞内的化学和酶促反应都以较快的速度进行, 微生物的生长也会变得越来越快. 但是超过特定的温度, 蛋白质、核酸及细胞组分会受到不可逆转的损害. 因此当温度在一定范围内上升时, 微生物生长和代谢机能会逐渐上升达到某一极点, 在该极点会出现钝化反应. 超过此极点, 细胞机能会急剧下降到零, 实验结果见图6. 由图6可知, 菌体在不同的培养温度下发酵产酶的活力不同. 该菌株在25~30℃时发酵培养, 发酵液具有较高的酶活力, 发酵产酶的最适培养温度为28℃. 温度较高时, 菌体生长速度快, 代谢产酶的时间短, 对生产效益和节约能源均有好处. 然而, 过高的发酵培养温度却不利于胞外酶的稳定性,酶在较高温度下容易失活.图6 不同温度对发酵产酶的影响2.2.3 摇床转速对产酶的影响在微生物发酵中, 增加摇瓶转速可以增加容氧量, 使菌株可以快速地利用琼胶, 从而有利于诱导菌株产生琼胶酶. 但也不是发酵过程中溶解氧越高越好, 因为溶解氧过大不仅造成浪费而且还可能改变代谢途径. 从图7可知, 在100~150r ·min -1转速下发酵液酶活力较高, 当转速为120r ·min -1时, 酶活力达到最大值. 当摇瓶转速超过160r ·min -1时, 菌体产酶活力呈下降趋势. 因此认为发酵产酶的的最佳摇床转速为120r ·min-1.图7 不同摇床转速对产酶的影响2.2.4 接种量对产酶的影响由图8可知, 接种量在1%~2%时发酵液中酶活力较高. 过低的接种量易引起杂菌生长, 不利于酶的产生. 随着接种量的加大, 菌体的生长繁殖变旺盛, 对于酶的产生却没有促进作用. 因此, 选择1%为最佳接种量.图8 接种量对产酶的影响 通过单因子实验对发酵条件进行了优化, 确定了最佳发酵温度、初始pH 值、摇床转速以及接种量. 结果表明菌株发酵产酶的最佳发酵条件为温度28℃, 初始pH 为6.5, 摇床转速120r ·min -1, 接种量1%.第2期王晓燕, 等: SPSS正交设计优化琼胶酶产生菌的发酵条件 152.3SPSS正交设计方差分析利用SPSS统计软件对正交设计的实验结果进行方差分析[7], 结果见表3和表4.由表3可知, 琼胶、NaCl、蛋白胨、CaCl2的P值分别为0.002、0.008、0.005、0.032, 对菌株发酵产琼胶酶的影响显著(0.05>P>0.01), 影响因素主次顺序为: 琼胶>蛋白胨>NaCl>CaCl2>MgSO4>酵母膏>K2HPO4. 对表4作因素配对比较, 确定琼胶酶产生菌发酵的最佳培养基组为A3B3C3D2E1F3G2, 即琼胶0.5%, NaCl 3.5%, 蛋白胨0.3%, 酵母膏0.2%, K2HPO4 0.1mmol·L-1, MgSO4 0.3mmol·L-1, CaCl2 1mmol·L-1. 综合实验中的最适培养基组成和最佳发酵条件, 经若干次发酵实验后, 菌株发酵琼胶酶活力稳定在191U·mL-1左右.3结论利用SPSS 软件设计正交试验优化了琼胶酶表3 培养基正交实验方差分析因素偏差平方和自由度平均偏差F值显著性纠偏模型26647.156(a) 14 1903.368 4.769 0.005 截距 248083.763 1 248083.763621.6050.000A 9260.834 24603.41711.5340.002B 5847.082 22923.5417.3250.008C 6776.762 23388.3818.4900.005D 495.140 2247.5700.6200.554E 24.234 212.1170.0300.970F 574.091 2287.0450.7190.507G 3723.014 21861.5074.6640.032误差 4789.226 12 399.102总误差 279520.145 27纠偏总值 31436.382 26表4 培养基正交实验结果实验序号 A B C D E F G 实验结果实验序号A B C D E F G 实验结果1111111135.15152232223107.802112222290.6516231312398.153113333372.1517232123179.004121123363.85182332312136.005122231173.10193112313106.156123312288.8520312312187.007131132284.20213131232176.758 1 3 2 2 1 3 3 109.20 22 321213293.509133321192.5023322321389.0010211321266.6024323132192.5011212132364.0025331222199.0012213213196.20263323332159.15132********.00273331113190.6514 2 2 2 1 1 1 2 73.0016 宁波大学学报(理工版) 2010产生菌发酵产酶的培养基组成, 确定其最佳发酵产酶培养基组成为: 琼胶0.5%, NaCl 3.5%, 蛋白胨0.3%, 酵母膏0.2%, K2HPO4 0.1mmol·L-1, MgSO4 0.3mmol·L-1, CaCl2 1mmol·L-1 . 进一步通过单因子实验确定了菌株发酵产酶的起始pH为6.5, 最适的温度为28℃, 摇床转速为120r·min-1, 培养时间为36h. 在最佳的培养基组成和发酵条件下进行实验, 结果菌株产酶的最高酶活力可以达到191 U·mL-1. 经发酵培养基和培养条件优化后, 菌株Halomonas sp. DT-7的产酶性状稳定, 产酶活力较高, 可用于发酵生产琼胶酶, 为下一步琼胶酶的分离纯化和酶性质研究奠定了基础.参考文献:[1]缪伏荣, 李忠荣. 琼胶的降解及其产物的开发应用[J].现代农业科技, 2007, 25(2):125-128.[2]欧昌荣, 汤海青. 琼胶酶生产菌的筛选、鉴定及其酶学性质的初步研究[J]. 食品科学, 2005, 12(6):86-90.[3]张红艳, 林凯. 国外天然防腐剂的研究进展[J]. 粮食加工, 2004, 10(3):57-60.[4]李能章, 邱荣蓉, 彭远义. 琼胶酶的研究进展[J]. 生命科学研究, 2006, 8(2):62-66.[5]Borel E, Hostettler F, Deuel H. Quantitative zucker-bestimmung mit 3,5-dinitrosalicylsaure and phenol[J].Helv Chim Acta, 1952, 35:115-120.[6]Kohtaro Kirimura, Noriyoshi Masuda, Yousuke Iwasaki,et al. Purication and characterization of a novel β-agarase from an alkalophilic bacterium, alteromonas sp. E-1[J].Journal of Bioscience and Bioengineering, 1999, 87(4): 436-441.[7]卢纹岱. SPSS for Windows统计分析[M]. 3版. 北京:电子工业出版社, 2006.Optimization of Fermentation Conditions of an Agarase-producingBacterium by SPSS Orthogonal DesignWANG Xiao-yan1, SANG Wei-guo1,2*( 1.Faculty of Life Science and Biotechnology, Ningbo University, Ningbo 315211, China;2.Key Laboratory of Applied Marine Biotechnology of Ministry of Education, Ningbo University, Ningbo 315211, China ) Abstract: To study the optimal culture medium and fermentation conditions of an agarase- produced bacterium Halomonas sp. DT-3 that is extracted from marine environment. The selection factors of orthogonal design are based on considering the following components: the content of agar, NaCl, peptone, yeast extract, K2HPO4, MgSO4, CaCl2. The investigation index is determined by the activity of agarase of fermentation broth. The experimental data are processed using the software SPSS. The results give the optimal culture medium and fermentation conditions of the agarase-producing bacterium, which can be listed as follows: agar 0.5%, NaCl3.5%, peptone 0.3%, yeast extract 0.2%, K2HPO4 0.1mmol·L-1, MgSO4 0.3mmol·L-1, CaCl2 1mmol·L-1, temperature 28℃, pH 6.5, rotation speed 120r·min-1, inoculum size 0.1%.Key words: SPSS; agarase; fermentation; optimizationCLC number: TS254 Document code: A(责任编辑 史小丽)SPSS正交设计优化琼胶酶产生菌的发酵条件作者:王晓燕, 桑卫国作者单位:王晓燕(宁波大学生命科学与生物工程学院,浙江,宁波,315211), 桑卫国(宁波大学生命科学与生物工程学院,浙江,宁波,315211;宁波大学应用海洋生物技术教育部重点实验室,浙江,宁波,315211)刊名:宁波大学学报(理工版)英文刊名:JOURNAL OF NINGBO UNIVERSITY(NATURAL SCIENCE AND ENGINEERING EDITION)年,卷(期):2010,23(2)1.缪伏荣.李忠荣琼胶的降解及其产物的开发应用[期刊论文]-现代农业科技 2007(2)2.欧昌荣.汤海青.管斌琼胶酶生产菌的筛选、鉴定及其酶学性质的初步研究[期刊论文]-食品科学 2005(6)3.张红艳.林凯.阎春娟国内外天然食品防腐剂的研究进展[期刊论文]-粮食加工 2004(3)4.李能章.邱荣蓉.彭远义琼胶酶的研究进展 2006(2)5.Borel E.Hostettler F.Deuel H Quantitative zuckerbestimmung mit 3,5-dinitrosalicylsaure and phenol 19526.Kohtaro Kirimura.Noriyoshi Masuda.Yousuke Iwasaki Purication and characterization of a novel β-agarase from an alkalophilic bacterium,alteromonas sp.E-1 1999(4)7.卢纹岱SPSS for Windows统计分析 2006本文链接:/Periodical_nbdxxb-lg201002003.aspx。
