第2章 2.3~2.4离子晶体的结构共价晶体的结构
- 格式:pdf
- 大小:1.87 MB
- 文档页数:38

第⼆部分晶体的结构第⼆部分晶体结构2.1 晶体学基础概述根据结合键类型不同,晶体可分为⾦属晶体、离⼦晶体、共价晶体和分⼦晶体。
晶体结构:晶体中原⼦(离⼦或分⼦)在三维空间的具体排列⽅式。
空间点阵与晶胞1.相关概念空间点阵(lattice)晶格(space lattice)阵点(结点)晶胞(cell)选取晶胞应遵循⼀定的原则晶胞⼤⼩和形状表⽰⽅法⼆、晶系和布拉菲点阵根据晶体的对称性和每个阵点周围具有相同的环境,布拉菲运⽤数学⽅法推算,将花样繁多的晶体结构归纳为14种空间点阵(称为布拉菲点阵)。
根据晶格常数a、b、c及α、β、γ是否相等,⼜将14中空间点阵归属于七⼤晶系。
晶体结构和空间点阵之间的区别空间点阵(space lattice):晶体中质点排列的⼏何学抽象,⽤以描述和分析晶体结构的周期性和对称性。
由于各阵点的周围环境相同,只有14种类型。
晶体结构(crystal structure):晶体中原⼦(离⼦或分⼦)在三维空间的具体排列⽅式。
由于组成晶体的物质质点及其排列⽅式不同,晶体结构是⽆限的,但总能按其原⼦(分⼦或离⼦)排列的同期性和对称性,归属于14种空间点阵中的⼀种。
七⼤晶系:1.三斜晶系(triclinic system):a≠b≠c,α≠β≠γ≠ 90°2.单斜晶系(monoclinic system ):a≠b≠c,α=γ=90°≠β2.正交(斜⽅)晶系(orthogonal system ):a≠b≠c,α=β=γ= 90°4.四(正)⽅晶系(tetragonal system ):a=b ≠ c,α=β=γ=90°5.⽴⽅晶系(cubic system ):a=b=c,α=β=γ=90°6.六⽅晶系(hexagonal system ):a=b ≠ c,α=β=90°,γ=120°7.菱形晶系(rhombohedral system):a=b=c,α=β=γ≠90°⼗四种空间点阵:1 简单⽴⽅点阵:a=b=c,α=β=γ =90°2 体⼼⽴⽅点阵:a=b=c,α=β=γ =90°3 ⾯⼼⽴⽅点阵:a=b=c,α=β=γ =90°4 简单四⽅点阵:a=b ≠ c,α=β=γ =90°5体⼼四⽅点阵:a=b ≠ c,α=β=γ =90°6 简单菱⽅点阵:a=b=c,α=β=γ≠ 90°7 简单六⽅点阵:a=b ≠ c,α=β=90°,γ =120°8 简单正交点阵:a≠b≠c,α= β= γ = 90°9 底⼼正交点阵:a≠b≠c,α= β= γ = 90°10 体⼼正交点阵:a≠b≠c,α= β= γ = 90°11 ⾯⼼正交点阵:a≠b≠c,α= β= γ = 90°12 简单单斜点阵:a≠b ≠c α= β =90°≠γ12 底⼼单斜点阵:a≠b ≠c α= β =90°≠γ14 简单三斜点阵:a≠b≠c α≠β≠γ≠90°⾦属晶体的结构主要为:FCC、BCC、HCP三、晶向指数和晶⾯指数1.⽴⽅晶系中的晶向指数晶向指数的确定⽅法晶向指数规律2.⽴⽅晶系中的晶⾯指数晶⾯指数的确定⽅法晶⾯指数规律2.六⽅晶系的晶向和晶⾯指数4.晶带晶带(zone)——相交或平⾏于某⼀直线的所有晶⾯的组合晶带轴:此直线为晶带轴。



第一章材料中的原子排列第一节原子的结合方式1 原子结构2 原子结合键(1)离子键与离子晶体原子结合:电子转移,结合力大,无方向性和饱和性;离子晶体;硬度高,脆性大,熔点高、导电性差。
如氧化物陶瓷。
(2)共价键与原子晶体原子结合:电子共用,结合力大,有方向性和饱和性;原子晶体:强度高、硬度高(金刚石)、熔点高、脆性大、导电性差。
如高分子材料。
(3)金属键与金属晶体原子结合:电子逸出共有,结合力较大,无方向性和饱和性;金属晶体:导电性、导热性、延展性好,熔点较高。
如金属。
金属键:依靠正离子与构成电子气的自由电子之间的静电引力而使诸原子结合到一起的方式。
(3)分子键与分子晶体原子结合:电子云偏移,结合力很小,无方向性和饱和性。
分子晶体:熔点低,硬度低。
如高分子材料。
氢键:(离子结合)X-H---Y(氢键结合),有方向性,如O-H—O(4)混合键。
如复合材料。
3 结合键分类(1)一次键(化学键):金属键、共价键、离子键。
(2)二次键(物理键):分子键和氢键。
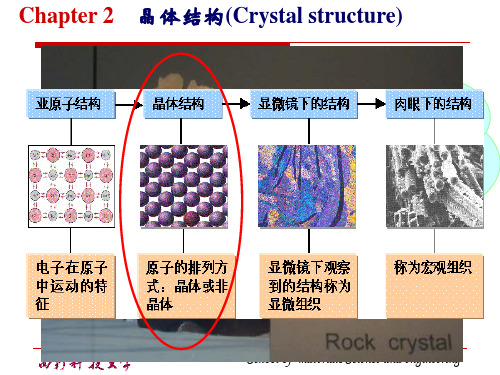
4 原子的排列方式(1)晶体:原子在三维空间内的周期性规则排列。
长程有序,各向异性。
(2)非晶体:――――――――――不规则排列。
长程无序,各向同性。
第二节原子的规则排列一晶体学基础1 空间点阵与晶体结构(1)空间点阵:由几何点做周期性的规则排列所形成的三维阵列。
图1-5特征:a 原子的理想排列;b 有14种。
其中:空间点阵中的点-阵点。
它是纯粹的几何点,各点周围环境相同。
描述晶体中原子排列规律的空间格架称之为晶格。
空间点阵中最小的几何单元称之为晶胞。
(2)晶体结构:原子、离子或原子团按照空间点阵的实际排列。
特征:a 可能存在局部缺陷;b 可有无限多种。
2 晶胞图1-6(1)――-:构成空间点阵的最基本单元。
(2)选取原则:a 能够充分反映空间点阵的对称性;b 相等的棱和角的数目最多;c 具有尽可能多的直角;d 体积最小。
(3)形状和大小有三个棱边的长度a,b,c及其夹角α,β,γ表示。

第2章晶体结构提纲:2.1 晶体学基础2.2 金属的晶体结构2.3 合金相结构2.4 离子晶体结构2.5 共价晶体结构2.6 聚合物的晶态结构2.7 非晶态结构学习要求:掌握晶体学基础及典型晶体的晶体结构,了解复杂晶体(包括合金相结构、离子晶体结构,共价晶体的结构,聚合物的晶态结构特点)、准晶态结构、液晶结构和非晶态结构。
1.晶体学基础(包括空间点阵概念、分类以及它与晶体结构的关系;晶胞的划分,晶向指数、晶面指数、六方晶系指数、晶带和晶带定律、晶面间距的确定、极射投影);2.三种典型金属晶体结构(晶胞中的原子数、点阵常数与原子半径、配位数与致密度、堆垛方式、间隙类型与大小);3.合金相结构(固溶体、中间相的概念、分类与特征);4.离子晶体的结构规则及典型晶体结构(AB、AB2、硅酸盐);5、共价晶的结构规则及典型晶体结构体(金刚石)6、聚合物的晶态结构、准晶态结构、液晶结构和非晶态结构。
重点内容1.选取晶胞的原则;Ⅰ) 选取的平行六面体应与宏观晶体具有同样的对称性;Ⅱ)平行六面体内的棱和角相等的数目应最多;Ⅲ)当平行六面体的棱角存在直角时,直角的数目应最多;Ⅳ)在满足上条件,晶胞应具有最小的体积。
2.7个晶系,14种布拉菲空间点阵的特征;(1)简单三斜(2)简单单斜底心单斜(3)简单正交底心正交体心正交面心正交(4)简单六方(5)简单四方体心四方(6)简单菱方(7)简单立方体心立方面心立方3.晶向指数与晶面指数的标注,包括六方体系,重要晶向和晶面需要记忆。
4.晶向指数,晶面指数,晶向族,晶面族,晶带轴,共带面,晶面间距5.8种,即1,2,3,4,6,i,m,。
或C1,C2,C3,C4,C6 ,C i,C s,S4。
微观对称元素6.极射投影与Wulff网;标hkl直角坐系d4⎧⎨⎩微观11213215243滑动面 a,b,c,n,d螺旋轴 2;3,3;4,4,4;6,6,6,6,67.三种典型金属晶体结构的晶体学特点;在金属晶体结构中,最常见的是面心立方(fcc)、体心立方(bcc)和密排六方(hcp)三种典型结构,其中fcc和hcp系密排结构,具有最高的致密度和配位数。












第二章晶体结构一、教学要求(1)内容提要:物质通常有三种聚集状态:气态、液态和固态。
而按照原子(或分子)排列的规律性又可将固态物质分为两大类,晶体和非晶体。
晶体中的原子在空间呈有规则的周期性重复排列;而非晶体的原子则是无规则排列的。
原子排列在决定固态材料的组织和性能中起着极重要的作用。
金属、陶瓷和高分子的一系列特性都和其原子的排列密切相关。
一种物质是否以晶体或以非晶体形式出现,还需视外部环境条件和加工制备方法而定,晶态与非晶态往往是可以互相转化的。
本章主要内容包括::晶体学基础;金属的晶体结构;合金相结构;离子晶体结构;共价晶体结构;聚合物的晶态结构;非晶态结构。
(2)基本要求掌握晶体的空间点阵、晶胞、晶向和晶面指数、晶体的对称性等结晶学基础知识,了解32种点群和230种空间群等;掌握三种典型的金属晶体结构、合金相结构、离子晶体结构和硅酸盐晶体结构,了解共价晶体结构和分子与高分子晶体结构。
(3)重点难点重点:结晶学基本原理及典型的金属晶体、合金相、离子晶体结构。
难点:空间点阵、非化学计量化合物和鲍林规则。
(4)主讲内容①晶体学基础;②金属的晶体结构;③合金相结构;④离子晶体结构;⑤共价晶体结构;⑥聚合物晶体结构。
二、具体章节及学时分配(总计22.0h):2009-3-2,2009-9-1,2011.03.27引言——晶体的结构特征与基本性质(1.0h)2.1晶体结构的周期性(4.0-6.0h)2.2.1点阵与平移群一、点阵结构与点阵(1)一维点阵结构与直线点阵;(2)二维点阵结构与平面点阵(3)三维点阵结构与空间点阵二、点阵的条件与性质(1)定义;(2)条件;(3)点阵与点阵结构的对应关系。
2.2.2点阵单位与点阵参量一、点阵单位与点阵常数(1)直线点阵单位与线段参数(2)平面点阵单位与网格参数(3)空间点阵单位与晶胞参数二、其他晶体结构参数(1)(原子)阵点坐标与原子间距;(2)晶向(直线点阵)指数(3)晶面(平面点阵)指数;(4)晶面间距与晶面夹角(5)晶带与晶带定律三、极射投影*2.2.3 倒易点阵与晶体衍射*2.2晶体结构的对称性(4.0h)2.3.1对称性的基本概念——对称及其对称元素与对称操作2.3.2宏观对称性—晶体外形(有限)表现的对称性—点对称性一、点对称操作与宏观对称元素;二、点群及其表示方法——32个点群(晶类);三、晶系与空间点阵型式——7种晶系与14种布拉菲点阵2.3.3微观称对性—晶格基元(无限)排列的对称性—体对称性一、空间对称操作与微观对称元素;二、空间群及其表示方法;三、等效点系——2.3.4点群与空间群的关系2.3.4 晶体结构符号2.3典型晶体结构分析(8.0h)2.3.1金属晶体结构2.3.2共价晶体结构2.3.3离子晶体结构2.3.4分子晶体结构2.3.5高分子(晶体)结构2.4 合金相结构引言——晶体的结构特征与基本性质晶体与非晶体的区别,主要在于组成物质的各种粒子(原子、离子或分子及其集团)具有在空间按一定周期性排列的规律,即所谓的“长程有序”(周期平移有序)。