Discovery Studio 3.5 CDOCKER教程
- 格式:pdf
- 大小:496.55 KB
- 文档页数:8

Discovery Studio 药物发现与生物大分子计算模拟平台个人电脑上的全新分子建模环境,专业的生命科学分子模拟软件[PDF资料下载]Discovery Studio™ (简称DS), 基于Windows/Linux系统和个人电脑、面向生命科学领域的新一代分子建模和模拟环境。
它服务于生命科学领域的实验生物学家、药物化学家、结构生物学家、计算生物学家和计算化学家,应用于蛋白质结构功能研究,以及药物发现。
为科学家提供易用的蛋白质模拟、优化和药物设计工具。
通过高质量的图形、多年验证的技术以及集成的环境,DS将实验数据的保存、管理与专业水准的建模、模拟工具集成在一起,为研究队伍的合作与信息共享提供平台。
建立在最新的流程管理平台Pipeline Pilot基础上的DS让数据的共享和交流变得更为方便和简洁。
DS 中的部分功能流程(protocols)可以在Pipeline Pilot中进行编辑和组合,编辑组合而得的新流程可以导入Discovery Studio中使用,这样使得科研流程的方便共享成为可能。
同时,Pipeline Pilot这个开放平台技术还为使用者整合自己的或第三方的软件工具提供了接口。
科研人员可以在一个统一的平台上完成从基因到先导化合物设计的一系列工作,并且可以通过web形式共享研究成果。
DS的服务器-客户端模式使得科研人员能够最方便且最大限度地实现计算资源共享。
DS目前的主要功能包括:蛋白质的表征(包括蛋白-蛋白相互作用)、同源建模、分子力学计算和分子动力学模拟、基于结构药物设计工具(包括配体-蛋白质相互作用、全新药物设计和分子对接)、基于小分子的药物设计工具(包括定量构效关系、药效团、数据库筛选、AD MET)和组合库的设计与分析等。
DS 可以应用于生命科学以下研究领域:新药发现,生物信息学,结构生物学,酶学,免疫学,病毒学,遗传与发育生物学,肿瘤研究。
一、Discovery Studio功能模块简介二、Discovery Studio可以运行的硬件平台三、Accelrys软件应用于生命科学Accelrys软件应用于生命科学Discovery Studio功能模块简介- 基本界面和显示模块Discovery Studio StandaloneDiscovery Studio Visualizer Client- 蛋白质模拟模块DS MODELERDS Protein RefineDS Protein HealthDS Protein FamiliesDS Sequence Analysis- 基于结构的药物发现和设计模块DS Flexible DockingDS LigandFitDS LigandScoreDS LibDockDS CDOCKE RDS Protein DockingDS LudiDS De Novo EvolutionDS LigandFit CAP/ DS Ludi CAPDS GOLD interface- 基于药效团的药物发现和设计模块DS Catalyst ConformationDS Catalyst HypothesisDS Catalyst SBPDS Catalyst ScoreDS Catalyst ShapeDS Catalyst DB BuildDS Catalyst DB SearchDS De Novo Ligand BuilderHypoDBPCDB (PharmaCoreDB)- 基于小分子的药物发现和设计模块DS QSA RGFA ComponentVAMP Descriptors Component/ DMol3 Descriptors ComponentDS Library DesignDS ADMETDS TOPKAT- 分子力学和分子动力学计算模块DS CHARMmDS CHARMm LiteDS CFF (高级II类力场)DS MMFF (Merck Molecular Force Field)- 分析模块DS BiopolymerDS Analysis基本界面和显示模块·Discovery Studio Standalone可视化界面,是利用Discovery Studio软件进行分子设计和模拟的基础,支持服务器-客户端安装在同一台机器上的运行模式。

抗体3D结构的预测(MODEL ANTIBODIES)教程介绍抗体分子是生物学和医学领域用途最为广泛的蛋白分子。
以肿瘤特异性抗原或肿瘤相关性抗原、抗原独特型决定簇、细胞因子及其受体、激素及一些癌基因产物作为靶分子,利用传统的免疫方法或通过细胞工程、基因工程等技术制备的多克隆抗体、单克隆抗体、基因工程抗体广泛应用于疾病诊断、治疗及科学研究等领域,并以其毒副作用小、天然和高度特异性的疗效,创造出了巨大的社会效益和经济效益。
抗体和抗体-抗原复合物的结构通常被用于了解基于抗体的药物的作用机制,在抗体工程上提供帮助。
X射线晶体学方法有助于抗体结构的解析,但是与计算模拟相比,耗费的经济成本和时间成本太高。
本教程中使用DS基于一个合成人类Fv区域的序列构建3D抗体模型,相对于X射线晶体结构选择性评估模型的质量。
随着大量的抗体Fv区域、Fab区域和高度保守区的结构被解析出来,使用同源模建的方法构建抗体结构成为可能。
构建一个抗体Fv或Fab区域结构模型的一个典型的流程是首先根据已知抗体模板结构构建框架结构,然后必要的时候使用额外的模板优化互补决定区。
在本教程中的任务包括以下几个步骤:♦结构模板的识别♦抗体Framework区模型的构建♦构建抗体Loop区♦模型可靠性的评估抗体序列的分析和识别载入序列。
在本教程中对于序列的分析这一步对于构建抗体结构不是必须的,但是对于序列上述两个序列依次分别为抗体MA5的重链(H)序列和轻链(L)序列。
计算完成之后会自动打开一个序列注释结果窗口(如上图),蓝色的表示轻链可变区,粉红色的表示CDR loop区,同样的结构域在序列注释窗口显示同样的颜色。
如果你在序列注释窗口中选择一段loop区,相应的氨基酸会在下方的序列窗口中以同样的颜色显示出来。
小技巧:鼠标右键点击序列窗口的标尺工具可以选择Residue ID,显示出每个氨基酸的残基号。
同理,可以用同样的方法把重链的序列分析注释显示出来。

Discovery Studio MCSS教程MCSS –基于片段的分子对接技术介绍目前,分子对接技术已经成为基于结构的药物设计(Structure-based drug design)中一种常用的计算机辅助药物设计方法。
但当对接的配体分子尺寸及柔性均很大,采用分子对接方法很难准确的找到配体分子在靶标结构中正确的位置(location)、取向(orientation)、构象(conformation)。
故为了更加准确的确定配体分子中相应的片段(基团)在靶标结构中结合位点处的正确位置(position),可以采用基于片段的药物设计方法(Fragment based drug design)。
Discovery Studio采用经典的MCSS算法实现FBDD。
MCSS作为一种片段对接的方法,可以被用来分析靶标结构中配体结合位点的特性。
采用此方法,分子片段先被随机放置在结合位点中,然后程序采用CHARMm对这些随机片段进行能量优化以找到最适的片段位置。
片段采用独立的MCSS_Score来打分和排序。
本教程中,布洛芬片段被对接进入COX-1受体的结合位点中。
对接得到的片段将与晶体结构中布洛芬的原始构象进行叠合比较。
该教程涵盖如下内容:●准备MCSS●运行MCSS●分析MCSS结果准备MCSS在文件浏览器(Files Explorer)中,打开Samples | Tutorials | Receptor-Ligand Interactions | 1EQG.dsv。
DS将在一个新的3D窗口中打开该受体,且受体活性中心的结合球显示在屏幕中心。
(图1)在工具浏览器(Tools Explorer)中,展开Receptor-Ligand Interactions | Define and Edit Binding Site,点击Show/Hide Residues Outside Sphere,然后点击Show/Hide Sphere。

Discovery Studio基本操作介绍在使用软件进行课题研究前,我们首先应该了解并掌握该软件使用的一些基本操作。
为后续的体系处理做好准备工作。
这个教程包括:●小分子配体准备●蛋白文件的处理小分子配体准备在Discovery Studio(DS)中,可以直接构建分子结构,也可以将在其它画图软件中画好的结构直接拷贝到DS中,本教程演示如何在DS中构建小分子结构。
1. 调用Sketching功能从View菜单下,打开Toolbars,选择Sketching。
Toolbars中将显示各种Sketching的工具,这些工具可以用来构建化合物的初始结构。
2. 利用Sketching构建化合物的3D空间构象打开一个分子显示窗口(Molecule Window),菜单栏File|New|Molecule Window。
注:DS中有四种窗口模式,包括Molecule window(显示分子结构),Protein Sequence Window (显示蛋白序列),Nucleotide Sequence Window(显示核酸序列),Script Window(显示脚本语言),因此我们需要根据载入的文件类型选择窗口。
DS中构建化合物的3D空间构象非常容易,也非常灵活。
本教程以以下化合物为示例,以图示的方法演示如何构建化合物的结构。
NHCl OOSOHNNH选择,在窗口中画出结构1。
点击(可以通过菜单栏View|Toolbars|Sketching调出)将其选中,然后选择菜单栏Chemistry|Bond|Aromatic得到结构2。
选择,鼠标指于芳环单键处并单击,构建稠环结构3。
选择,构建连接单键,再选择,鼠标指于C原子处并单击构建环状结构,最后得到结构4。
选择和构建单键和环状结构,选择再次点击相应的键就可以构建双键结构,最终可得到结构5。
更换元素类型,选中某个碳原子,选择菜单栏Chemistry|Element更换相应元素即可,最后得结构6。

附录:准备一个PDB文件作为同源性建模模板同源建模的基本原理是,你映射的一个未知的蛋白质序列一种已知蛋白质的结构。
因此,如果你没有已知的蛋白质,或模板,你将无法建立模型。
模板的共同来源是蛋白质在结构生物信息学研究的实验室数据银行(目标)。
该网站RCSB是HTTP:/ /。
org /。
蛋白质数据库(PDB)可能是世界上领先的公共源三维生物分子数据(1)。
截至七月2006,超过37000项可在PDB。
每个月都有更多的人加入。
X射线衍射仪和其它固态技术占大多数的结构。
然而,超过5500的核磁共振结构还可用。
这些沉积的结构包括蛋白质,肽,核酸,碳水化合物,这些分子的配合物。
在发现工作室环境中工作的这些分子是一个关键的过程给你的建模工作。
这个练习如何准备一个PDB文件作为一个模板同源建模项目。
你将在课程中学习如何:•加载PDB文件直接从蛋白质数据银行,•生产和检验蛋白质报告,•清除晶体单元电池,•分裂分子,•删除不需要的组件,和保存已完成的文件。
1、开始发现工作室2在3D窗口中显示的结构是两人HDAC8蛋白的晶体结构在复杂的抑制剂,684个晶体的水,和几个离子。
抑制剂是曲古抑菌素A,一个很的结构。
3、检查蛋白质报告在深入了解蛋白质,我们应该花一点时间来看看有什么。
一种快连锁。
但我们要清楚我们几个非原子以及。
4、删除单元电池晶体单元单元在分子力学计算中的意义不大。
有时它只是更容易这个文件是由多个部分组成的。
我们可以通过层次结构查看组件其他练习窗口。
然而,我们实际上可以分开的组件的PDB文件更快的四的成分是蛋白质(1t64_a和1t64_b),配体(1t64_nonprotein),和结晶水(1t64_water)。
拆分命令的三个选项允许在如何处理对象的操作中有一定的灵活性。
所有打出的层次结构视图中所有链和非蛋白结构为独立的对象,并列出每个氨基酸序列为序列单独序列。
蛋白打出所有的蛋白链结构为独立的对象层次结构中的每个视图和列表的氨基酸序列为序列单独序列。
拉伸动力学计算结合自由能介绍拉伸分子动力学模拟可以使原来在微妙至秒时间范围内发生的生物物理过程在纳秒尺度内进行模拟,从而动态再现目前实验所无法提供的一些过程,如蛋白去折叠、配体解离和构象变化等过程。
上述这些过程可以通过在拉伸动力学模拟中让事件按照指定方向主动发生,而不像在标准分子动力学模拟中需要被动等待事件的发生。
本教程中,我们使用T4溶菌酶蛋白作为研究目标,模拟配体2-丙基苯酚从活性口袋的解离的过程。
具体见参考文献(J. Mol. Biol.2009, 394, 747-763). 本教程假定你已经熟悉建立和运行标准分子动力学模拟的过程。
对于该体系的SMD模拟比较复杂,因为配体的位置位于结合口袋的深处,而且将配体从结合口袋里拉出来的同时伴随着蛋白的散开,退出配体和蛋白的复原等过程。
1.准备蛋白配体模拟体系从菜单File | Open URL,在ID框中填入3HTB之后点击Open。
选择Macromolecules | Protein Report工具栏,点击Protein Report工具栏下方的Protein Report,通过蛋白报告可以检查出该蛋白是否有缺失残疾或其它需要校正的地方。
然后点击Prepare Protein工具栏下方的Clean Protein按钮,对蛋白质进行简单清理,该过程主要是包括删除蛋白文件中多余的构象,为蛋白加上N端和C端等过程。
接下来我们将手动删除蛋白中的晶体水分子和盐。
通过Ctrl+H打开Hierarchy View窗口,见下图,选择Water点击键盘上的Delete删除水分子。
另外第二个A链是磷酸根基团、BME残基和JZ4配体。
删除磷酸根基团和BME残基,保留JZ4配体和蛋白。
到这里,体系已经准备好了,接下来是给体系加入立场参数和水盒子,然后准备动力学模拟。
在做拉伸动力学之前需要使用标准动力学方法将复合物进行能量最小化,短的平衡过程和动力学模拟过程。
选择Simulation | Change Forcefield工具栏,在其下方的Forcefield中选择CHARMm力场,Partial Charge中选择Momany-Rone电荷,之后点击Apply Forcefield应用所选的力场和电荷。

预测蛋白聚集位点(Protein Aggregation)教程介绍抗体等具有治疗功能的蛋白,如果处于比较高的浓度下,会有发生聚集的趋势。
这会导致抗体的活性下降,并引起免疫反应。
抗体的聚集趋势计算是一种衡量蛋白表面氨基酸聚集倾向性的指标。
具有比较高的聚集趋势得分的位点表明了该区域的氨基酸倾向于发生聚集。
因此这些位点的预测,使得我们可以通过氨基酸定点突变的方法来改造蛋白,增强其稳定性。
本教程使用Calculate Aggregation Scores对一个全长IgG1抗体分子(PDB号为1h2h)进行蛋白聚集位点的预测计算,并分析预测的结果。
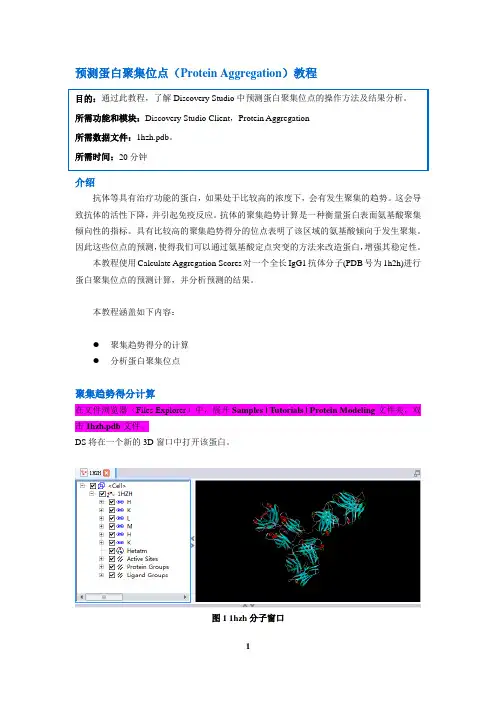
本教程涵盖如下内容:●聚集趋势得分的计算●分析蛋白聚集位点聚集趋势得分计算在文件浏览器(Files Explorer)中,展开Samples | Tutorials | Protein Modeling文件夹,双击1hzh.pdb文件。
DS将在一个新的3D窗口中打开该蛋白。
图1 1hzh分子窗口Ctrl+H打开Hierarchy窗口,然后选中Water,点击Delete删除蛋白结构中的结晶水分子。
在工具浏览器(Tools Explorer)中,展开Simulation | Change Forcefield,将Forcefield设为CHARMm Polar H,然后点击Apply Forcefield,这将为蛋白赋上CHARMm Polar H力场。
图2 Apply Forcefield设置界面在工具浏览器(Tools Explorer)中,展开Macromolecules | Predict Protein Aggregation工具面板,点击Calculate Aggregation Scores。
在弹出的参数设置界面中,将Input Typed Protein设为1hzh:1HZH,将Cutoff Radius设为5,7,10。
点击Run运行该任务。
该任务在奔腾4,2Gb内存和2.8GHz的计算机平台上运行大约需要3分钟。

Discovery Studio Grow Scoffold教程Grow Scoffold –活性位点先导化合物优化介绍先导化合物优化是一个复杂过程,为了得到一个临床前候选药物,通常需要对有前景化合物及骨架不断地进行化学结构优化,以提高化合物的活性、选择性、生物利用度、药效及药代动力学性质,并降低毒性。
该过程通常是药物开发过程中的瓶颈。
通过使用实用且有效的先导化合物优化软件,根据可获取的化合物试剂的快速推荐出容易合成的候选化合物的结构。
基于结构的先导化合物优化主要集中于蛋白靶点的活性位点的化合物结构的设计。
Grow Scaffold工具可以根据蛋白靶点活性位点的特点,通过基于化学反应的原位生长(reaction-based in situ enumeration)方法来找出那些能够产生潜在化合物的试剂,并对它们进行打分排序。
p38α是一个典型的丝氨酸/苏氨酸蛋白激酶,属于丝分裂原活化蛋白激酶(mitogen activated protein kinase)家族。
它在内皮、免疫和炎性细胞中广泛表达,在肿瘤坏死因子和白细胞介素- 1等促炎症细胞因子产生的调控中扮演着重要作用。
实验已经证明,选择性地抑制其中任何一个细胞因子都能够有效治疗各种炎症和免疫疾病,如风湿性关节炎、炎症性肠病,败血性休克,和骨质疏松症。
二芳基脲是p38α的一个先导化合物,BoehringerIngelheim首先对它开展了先导化合物优化,随后Pfizer也开展了相关研究(图1)。
图1 p38α的先导化合物及优化过的先导化合物在本教程中你将使用Grow Scaffold流程来重现BoehringerIngelheim及Pfizer通过结构优化所发现的化合物。
本教程分为两部分:(一)使用基于反应的原位生长方法产生优化过的先导化合物(二)使用自定义反应来产生先导化合物(一)使用基于反应的原位生长方法产生优化过的先导化合物1.执行优化计算图2蛋白质三维结构示意图复合物结构采用PDB号为1KV2的晶体结构,本教程中所采用的该结构文件已经从PDB 库中下载并经过Prepare Protein模块处理。


Discovery Studio Flexible Docking教程Flexible Docking –全柔性受体-配体对接技术介绍柔性分子对接是指在对接过程中,蛋白的侧链和配体分子构象都可以自由变化,多用于精确考查分子间的结合模式,但由于计算量和计算时间的缘故,在实际应用中,一般只将活性位点处残基侧链定义为柔性,可以考虑其构象的改变。
在Flexible Docking中,配体将按如下步骤对接到考虑活性部位氨基酸残基侧链柔性的受体中:•选择受体柔性氨基酸残基,使用ChiFlex(CHARMm)通过改变侧链构象计算出一组蛋白构象•使用LibDock将柔性配体对接到每一个受体构象的活性部位•使用ChiRotor(CHARMm)在刚性配体存在的情况下优化选定的蛋白侧链•使用CDOCKER优化最后的配体对接构象在本教程中研究的两个蛋白分子为同一个HIV-RT受体,但由于所含的配体不同,两蛋白PDB编号不同,分别为1s1x和1fk9。
配体结构的差别会引起蛋白构象的改变,这也是柔性对接的理论基础。
本教程将1fk9中结合的配体对接到1s1x中。
具体步骤包括:•准备对接的分子体系•执行分子对接计算•分析对接结果•计算对接结果的RMSD值准备对接的分子体系1.蛋白和配体文件的准备在文件浏览器(Files Explorer)中,找到并双击打开Samples| Tutorials| Receptor-Ligand Interactions| 1s1x_prot.dsv文件。
该蛋白将在一个新的三维窗口中打开。
(图1)此蛋白文件已经过处理:已赋予CHARMm力场,所以在对接之前不需再进行力场的赋予;此外,结合位点也已识别,窗口中只显示该结合位点周围的8个残基及其相应的残基名,在对接过程中将会考虑这8个残基的侧链柔性,上述8个残基已被定义为一组并命名为1s1x_res8,系统视图中已显示。
图1 打开蛋白文件在文件浏览器(Files Explorer)中,找到并双击打开Samples| Tutorials| Receptor-Ligand Interactions|1fk9_lig.sd文件。
使用DS Visualizer3.5在PPT中动态展示分子三维结构在做Presentation时,经常需要向观众展示一个分子的3D结构,如蛋白质、多肽、核酸以及小分子化合物,如果能够动态的展示,则可以起到事半功倍的效果。
Accelrys公司的Discovery Studio Visualizer 3.5可以帮助你实现这个功能。
首先,登录Accelrys公司网站/products/discovery-studio/visualization-download.php,填写免费注册信息,即可在邮箱中获取DS Visualizer and ActiveX Control 3.5的下载地址,下载获得两个文件:DS35Client.exe和DS35ActiveX.exe(也可通过本文后地址下载)。
安装DS35Client.exe,在DS Visualizer中载入蛋白质PDB文件,主菜单File > save as,在files of type下拉列表中选择DS ActiveX Control Files(.pptx, .xml, .html, .htm)(图1),即可生成一个一页的pptx文件,选中该页面,复制并插入目标PPT文件中,就可以实时动态展示分子了。
在展示过程中可以点击右键实现各种功能(图2)。
如需在其他电脑中播放该PPT,只需将安装DS35ActiveX.exe(31MB)即可。
需要注意的是,Powerpoint的版本要在2007以上方可,否则会提示无法生成xml文件。
该功能十分实用,且所用到的DS Visualizer3.5和DS ActiveX Control 3.5均为免费软件。
DS Visualizer3.5:/share/link?shareid=102833&uk=235436026DS ActiveX Control 3.5:/share/link?shareid=102836&uk=235436026江大-大牙兔2012/11/5。
Discovery Studio Analyze Ligand Poses教程介绍分子之间的非键相互作用是生命体系中分子识别的基础。
在基于结构的药物设计过程中,识别和优化配体分子和受体分子间的相互作用是一个基本过程,因此,全面细致的分析非键相互作用非常关键。
本教程将采用热稳定的腺苷A2A受体和反相激动剂ZM241385的复合物,其中A2A受体是G-蛋白偶联受体,是帕金森氏症的药物靶标,其拮抗剂Preladenant正处于临床阶段。
本教程将分析对接至A2A受体的配体分子构象。
执行计算并分析结果在文件浏览器(Files Explorer)中,双击打开Samples|Tutorials|Receptor-Ligand Interactions|3pwh_dockedposes.dsv。
打开一个分子对接结果,包含3pwh蛋白分子和多个小分子的对接构象。
(图1)说明:对接分子共有50个,具有一定多样性,其中20个为参照分子,带有CHEMBL前缀,30个为诱饵分子,带有ZINC前缀。
这50个分子基于Dock Ligands (CDOCKER)模块对接至已经预处理过的腺苷A2A受体分子,最终得到3pwh_dockedposes.dsv文件中的对接结果。
本教程通过对该对接结果的分析来获取重要的非键相互作用信息,从而进一步优化虚筛流程。
图1 3pwh对接结果在工具浏览器(Tools Explorers)中,展开Receptor-Ligand Interactions |View Interactions,点击Analyze Ligand Poses。
相应的参数出现在参数浏览器中。
点击Input Ligands参数项,下拉列表中选择3pwh_dockedposes:All,选中3pwh_dockedposes 窗口中所有配体构象。
其余参数保留默认设置,点击Run运行任务。
(图2)点击Background让任务后台运行,等待任务完成。
Discovery Studio Molecular Dynamics教程Molecular Dynamics –分子动力学方法介绍分子动力学(Molecular Dynamics, MD)是分子模拟中最常用的方法之一。
该方法基于分子力场,能够动态的描述分子的运动状况,继而描述生命的动态过程。
分子动力学在生命科学领域中的应用非常广泛,如蛋白质折叠的机理研究、酶催化反应的机理研究、与功能相关蛋白质的运动研究、生物大分子大范围构象变化的研究等等。
近几十年来,分子动力学方法已经成功的运用于大分子体系低能量构象的模建、X射线晶体衍射以及NMR实验结果的处理。
[1,2]现在分子动力学方法已经成了理论生物学研究中必不可少的方法之一。
[3,4]分子动力学模拟主要包括如下几个步骤:1.模拟体系升温过程(Heating Stage)2.模拟体系平衡过程(Equilibrium Stage)3.模拟体系采样过程(Production Stage)4.分析体系的目标性质(Analysis)然而,由于一般的待模拟体系的初始结构或多或少的存在缺陷(比如,初始结构不完整或存在不合理的结构区域),所以我们往往需要对初始结构进行预处理才能进行分子动力学模拟。
一个完整的分子动力学模拟过程应包括如下几个步骤:1.初始结构检查及预处理2.给模拟体系赋力场参数3.考虑溶剂效应4.初始结构能量最小化5.动力学模拟(包括升温、平衡、采样)6.结果分析目前,常用的分子动力学模拟软件都基于Unix(Linux)操作系统。
实施每一个模拟的步骤都需要特定的命令来调用相关的程序对模拟体系进行处理。
同时,模拟者还需要熟知每个参数的意义并定义相关的参数值。
最终分析过程也需要配合其他软件才能完成。
这对初级分子动力学模拟者而言是非常困难的(模拟者不仅需要掌握分子动力学软件的使用命令,还需要掌握操作系统相关的命令)。
为了解决这样的问题,Discovery Studio为用户提供了基于窗口的分子动力学模拟工具。
Discovery软件操作手册GNT国际公司目录一.工区建立与管理 (1)二.数据加载 (3)三.微机地质应用 (10)四. 微机三维地震解释综合应用 (19)五.微机单井测井解释及多井评价 (39)六.储层管理与预测 (54)七.smartSECTION模块 (63)八.正演建模 (69)一.工区建立与管理1.1工区目录(home)建立我们一般习惯把Discovery工区放在一个文件夹下,这样可方便进行管理。
1) 利用Windows资源管理器,建立一个文件夹,如proj-dis,同时可以把其它机器上的Discovery工区放在次目录下。
2) 在桌面上双击GeoGraphix Discovery图标,打开工区管理模块ProjectExplorer。
3) 进入ProjectExplorer > File> New> Home。
4) 通过浏览器确定proj-dis文件夹,点击确定按钮。
5) 点击下一步按钮,直至完成。
6) 在工区管理模块ProjectExplorer左侧,出现proj-dis工区目录,这样就可以在该目录下建立Discovery工区。
1.2工区(project)创建一般来说,任何一个地学软件工作流程的第一步都是建立一个工区,Discovery 软件也不例外。
工区的建立包括为工区名、路径、坐标系统和工区范围等。
1) 在桌面上点击GeoGraphix Discovery 图标,启动ProjectExplorer2) 在工具栏点击New Project 按钮或从菜单条选File > New> Project。
出现NewProject Wizard(新工区向导)的工区对话框。
3) 在Project Name(工区名)框中,输入工区名称。
4) 在Description(描述)框中,输入对工区的描述(如:位置、远景区等)。
5) 压力和深度单位,在中国,选择米制(这对底图和数据库坐标系统都没有影响)。
分子对接相互作用力discovery studio分子对接是一种主要用于计算机辅助药物设计的方法,可用于模拟和预测药物与靶标分子之间的相互作用。
在分子对接中,一方是药物分子(ligand),另一方是靶标分子(receptor)。
这两个分子通过非共价相互作用力进行结合,形成稳定复合物。
因此,对于药物发现研究而言,了解药物和靶标分子之间相互作用力的特性至关重要。
Discovery Studio是一种用于计算机辅助药物设计和药物发现的软件平台。
它内置了多种用于分子对接的工具和算法,可以帮助研究人员进行药物分子的筛选和优化,提高研发效率。
本文将以Discovery Studio的分子对接工具为主题,介绍其在药物发现中的应用和相互作用力的计算方法。
一、Discovery Studio分子对接的原理及流程在Discovery Studio中,分子对接的过程可以大致分为以下几个步骤:准备受体结构、准备配体结构、建立格点和计算能量。
1. 准备受体结构受体结构一般是指药物的靶标蛋白,可以从真实蛋白结构数据库中获取。
在进行分子对接之前,需要对受体结构进行优化和准备工作。
这包括去除水分子、修复缺失的原子、填充缺失的氢原子,并对蛋白进行能量最小化的处理。
2. 准备配体结构配体结构是指药物分子或其他小分子化合物。
首先,需要将配体结构进行优化和准备工作。
这包括去除水分子、修复缺失的原子、填充缺失的氢原子,并对配体进行能量最小化的处理。
此外,需要确定配体的荷电状态和形式,如药物分子的离子化状态。
3. 建立格点在分子对接过程中,通常会建立一个三维网格(grid)作为搜索空间,用于计算配体与受体之间的相互作用力。
这个网格的构建需要选择合适的参数和方法。
一般而言,可以使用栅格框(grid box)来定义搜索空间的大小和位置。
4. 计算能量在分子对接过程中,需要计算配体与受体之间的相互作用能量。
这些能量包括范德华力、库仑力、极化等效力等。
Discovery Studio Replace Fragment教程介绍骨架跃迁(Scaffold Hopping)是将一个配体的核心骨架替换为一个新的具有类似功能的基团来提高化合物的性质或者寻找具有类似功能的全新化合物。
应用这种方法,在充分考虑活性的基础上,可以设计出突破专利保护,结构新颖,且可能改善药物代谢动力学性质的全新药物分子。
在本教程中,我们将使用replace fragment流程来对第三代血管紧张素肽转化酶(ACE)抑制剂赖诺普利进行骨架跃迁。
ACE催化非生物活性的十肽血管紧张素I转化为活性的八肽血管紧张素II。
血管紧张素II是一个强力的血管收缩剂,并能促进缓激肽(促进血管舒张)的降解。
这种双重功效使得ACE在肾素血管紧张素系统(RAS)中发挥关键作用,并使得它成为治疗高血压,心脏衰竭,糖尿病肾病和II型糖尿病中一个非常有前景的靶点。
在本教程中,我们将使用Replace Fragment来寻找赖诺普利中的乙酸脯氨酸子结构的替代结构。
主要任务如下:(一)直接基于小分子产生替代片段(二)使用蛋白活性位点优化产生的潜在的替代片段(三)使用不同的性质来识别全新骨架(一)直接基于小分子产生替代片段在教程的第一部分,我们将使用Replace Fragment流程,只基于配体结构,来发现赖诺普利的乙酰脯氨酸子结构的替代结构。
赖诺普利在1983年就被发现,而能够用于基于结构设计的ACE的晶体结构直到2003年才被公布,因此化合物的骨架跃迁经常是在没有蛋白结构下进行的。
1.执行骨架跃迁计算在文件浏览器(Files Explorer)中,找到并双击打开Samples | Tutorials | Receptor-Ligand Interactions | 1o86_ligand.sd文件.显示小分子的三维结构。
在分子视图窗口(按住Ctrl+G打开)选中化合物的乙酰脯氨酸的子结构,或者在系统视图(Hierarchy View,按住Crtl+H打开)中,选中化合物的C15, O17, O22-C29原子(图1)。