瑞氏染色操作步骤
- 格式:docx
- 大小:26.77 KB
- 文档页数:2


瑞氏染色操作步骤瑞氏染色是一种常用的细胞染色方法,主要用于观察细胞核形态和染色体结构。
下面将详细介绍瑞氏染色的操作步骤。
一、实验前准备1.1 材料准备瑞氏染色所需的材料有:0.075mol/L KCl、甲醛、乙酸、96%乙醇、苯酚红溶液、甲基绿溶液和天然丝。
1.2 设备准备实验所需的设备有:离心机、恒温水浴器和显微镜等。
二、样品制备2.1 细胞培养首先需要培养好待检测的细胞,使其达到适当生长状态。
在培养过程中,应注意避免污染和过度生长等问题。
2.2 细胞处理将待检测的细胞收集到离心管中,并加入0.075mol/L KCl缓冲液进行离心。
将上清液倒掉,再加入甲醛进行固定处理。
2.3 固定处理将含有甲醛的离心管放置在恒温水浴器中,在37℃下固定处理30分钟,使细胞膜破裂并释放染色体。
2.4 滴定染色将固定后的细胞加入苯酚红溶液,再滴入甲基绿溶液,使染料均匀地覆盖在细胞上。
三、显微镜观察将染好色的细胞片放置在显微镜下进行观察。
可以通过调节显微镜的焦距和光源亮度等参数来获得更清晰的图像。
四、实验注意事项4.1 操作过程中应注意保持无菌环境,避免污染样品。
4.2 在固定处理时,应控制好温度和时间,避免过度固定或过短固定导致样品失真。
4.3 在滴定染色时,应注意均匀地覆盖在细胞上,并避免出现气泡等问题。
总结:瑞氏染色是一种常用的细胞染色方法,其操作步骤包括实验前准备、样品制备、显微镜观察和实验注意事项等方面。
在操作过程中需要注意保持无菌环境、控制好温度和时间、均匀地覆盖染料等问题,以获得更准确的实验结果。
![[课件]瑞氏染色PPT](https://uimg.taocdn.com/5af6e1163968011ca30091e9.webp)

瑞氏染色操作流程一、瑞氏染色实验前准备1.1准备染色液和显影液针对瑞氏染色实验,首先要准备染色液和显影液,染色液由25mL的瑞氏染料,90mL的盐酸溶液(浓度为5%),以及1mL的激发剂混合而成。
而显影液则是在10mL的9N的硫酸、10mL的5%的NaOH溶液、10mL的1%的苯甲醇和10mL的1%的芳香族醇基乙醇混合而成。
1.2准备染色木质菌梗在预先准备瑞氏染色液和显影液后,接下来要准备染色用的木质菌梗才能开始瑞氏染色实验。
首先,用洗碗笠将要染色的木质菌梗洗淨,然后用医用刀在木质菌梗中切出厚约2mm的薄片,最后用蒸汽–水泼淋法将木质菌梗片浸湿,方可准备瑞氏染色实验。
二、瑞氏染色实验操作2.1放置染色片在准备好染色液和显影液,以及木质菌梗薄片后,此时要把准备的的木质菌梗薄片放置在染色槽内,以留出表面空间,方便染色液充分浸渍。
2.2加入染色液之后将准备的瑞氏染色液加入染色槽,在实验室内控制温度为37℃,放置20分钟后,可以观察菌梗表面是否呈染色,一般都可以看到浅色到深色之间的蓝色或紫色染色,这说明瑞氏染色已经取得成功。
2.3加入显影液如果瑞氏染色实验成功,那么接下来可以准备将木质菌梗片洗净后加入显影液了,而此时温度需要将控制在22℃,放置5-10分钟后,可以发现菌梗片变淡,并且半透明,证明显影液已经取得成功。
2.4用x网影像再接着,用X网影像观测染色后的木质菌梗,当观测到菌梗表面开始出现斑斑点点发亮时,这表明染色实验结束,在此基础上对木质菌梗进行另一个体系的判断,也就是对菌梗的形态和染色的准确性进行分类、认定和鉴定。
三、瑞氏染色实验结束完成上述瑞氏染色实验操作后,就可以对经过染色后的木质菌梗进行分析、鉴定,完成木质菌梗的离子吸收率、分子斑点和染色效果等等内容,通过瑞氏染色实验把细菌聚集在一起,以便进行实验分析,这正是瑞氏染色实验取得成功的原因。

瑞氏染色法瑞氏染色法(Wright's stain;美蓝-伊红Y):用瑞氏染色液对细菌进行染色以便进行显微镜检查的染色法。
1 .瑞氏染料是由碱性染料美蓝( Methvlem blue )和酸性染料黄色伊红( Eostm Y )合称伊红美蓝染料即瑞氏(美蓝-伊红Y)染料。
伊红钠盐的有色部分为阴离子,无色部分为阳离子,其有色部分为酸性,故称伊红为酸性染料。
美蓝通常为氯盐是碱性的,美蓝的中间产物结晶为三氯化镁复盐,其有色部分为阳离子,无色部分为阴离子,恰与伊红钠盐相反。
2 .用甲醇作瑞氏染料溶剂,即成瑞氏染液。
甲醇是瑞氏染料良好溶剂,有两种作用:( 1 )甲醇使瑞氏染料中美蓝( M )与伊红( E )在溶液中离解,可使细胞成分选择性吸附其中的有色物质而着色。
甲醇ME (瑞氏染料)————→ M + + E -在配制的瑞氏染液中美蓝如放置过久即可氧化而含有天青,美蓝天青与伊红化合物能使核染成紫红色,但不能使胞浆染为蓝色,多余美蓝就可以使胞浆染成蓝色,染色主要是化学作用,是离子彼此结合的反应。
( 2 )甲醇具有强大的脱水力,可将细胞固定在一定形态及增加细胞结构的表面积,提高细胞对染料吸收作用,同时由于甲醇吸附染色液中的水,使染色液升温,加速染色反应。
3. 瑞氏染液配制:(1) 瑞氏染液配制:瑞氏染料 830gm 或 1g甲醇( AR ) 500ml 或 600ml先称干燥(事先放入温箱干燥过夜)瑞氏染料放置乳钵内,用乳棒轻轻敲碎染料成粉末,再行研磨至听不到研芝麻声即呈细粉末,加少许甘油或甲醇溶解研磨,使染料在乳缸内显“一面镜”光泽,而无染料粉粒沉着,再加较多量甲醇研磨呈一面镜光亮,静置片刻,将上层液体倒入一清洁储存瓶内(最好用甲醇空瓶),再加甲醇研磨,重复数次,直至乳钵内染料及甲醇用完为止,摇匀,密封瓶口,存室温暗处,储存愈久,则染料溶解、分解就越好,一般储存 3 个月以上为佳。
(2) 缓冲液:1) 缓冲液作用:染色对氢离子浓度是十分敏感的,据观察 pH 值的改变,可使蛋白质与染料形成的化合物重新离解。




简述瑞氏染色法的步骤
瑞氏染色法是一种常用的染色技术,可以用于细胞和组织的染色。
它
是由丹麦科学家汉斯·克里斯蒂安·瑞氏于1884年首次提出的。
该方法
通过使用甲苯和乙醇的混合物处理样本,然后用胰蛋白酶去除细胞膜上的
脂肪,最后用甲苯溶液进行染色,以显示细胞的核和胞质细胞器。
具体步
骤如下:
1.处理样本:首先,将待染色的细胞或组织样本置于甲苯中,以去除
样本中的脂肪。
2.脱水:将样本放入一系列乙醇浓度不断增加的溶液中,以脱水样本。
这一步骤有助于防止样本的脂肪重新进入细胞。
3.清洗:用清洁的甲醇或二甲苯清洗样本。
这一步骤有助于去除残留
的脂肪和乙醇。
4.染色:将样本放入瑞氏染色剂中。
瑞氏染色剂是一种由甲苯、酸性
染料(如酸性果胶酸和酸性红G)和邻苯二甲酸二丁酯组成的溶液。
该溶
液可以染色细胞核和胞质细胞器。
5.清洗:将样本从染色剂中取出,用甲醇或二甲苯轻轻洗涤,以去除
多余染料。
6.干燥:用空气吹干样本或者放置在加热器中干燥。
7.盖片:将样本置于玻璃盖片上,加入合适的封片剂(如硬脂酸树脂),然后覆盖另一块盖片。
8.固定:将盖片置于120°C的烘箱中固定,使其更加耐久。
使用瑞氏染色法可以染色细胞核为蓝色或紫色,并使胞质细胞器以深红色或橙色显现。
这种染色方法在生物学、医学和组织学等领域被广泛使用,它可以帮助研究人员观察细胞和组织的结构与功能,提供有关细胞和组织的信息。

英文拼写 Wright's stain是由酸性染料伊红和碱性染料美蓝组成的复合染料,溶于甲醇。
后解离为带正电的美蓝和带负电的伊红离子。
使用方法瑞氏(Wright's staim;美蓝-伊红Y)染色:1.瑞氏染料是由碱性染料美蓝(Methvlem blue)和酸性染料黄色伊红(Eostm Y)合称伊红美蓝染料即瑞氏(美蓝-伊红Y)染料。
2.用甲醇作瑞氏染料溶剂,即成瑞氏染液。
甲醇是瑞氏染料良好溶剂,有两种作用:(1)甲醇使瑞氏染料中美蓝(M)与伊红(E)在溶液中离解,可使细胞成分选择性吸附其中的有色物质而着色。
甲醇ME(瑞氏染料)----→M+ + E-在配制的瑞氏染液中美蓝如放置过久即可氧化而含有天青,美蓝天青与伊红化合物能使核染成紫红色,但不能使胞浆染为蓝色,多余美蓝就可以使胞浆染成蓝色,染色主要是化学作用,是离子彼此结合的反应。
(2)甲醇具有强大的脱水力,可将细胞固定在一定形态及增加细胞结构的表面积,提高细胞对染料吸收作用,同时由于甲醇吸附染色液中的水,使染色液升温,加速染色反应。
染液配制(1) 瑞氏染液配制:瑞氏染料 830gm或1g甲醇(AR)500ml或600ml○先称干燥(事先放入温箱干燥过夜)瑞氏染料放置乳钵内,用乳棒轻轻敲碎染料成粉末,再行研磨至听不到研芝麻声即呈细粉末,加少许甘油或甲醇溶解研磨,使染料在乳缸内显“一面镜”光泽,而无染料粉粒沉着。
○再加较多量甲醇研磨呈一面镜光亮,静置片刻,将上层液体倒入一清洁储存瓶内(最好用甲醇空瓶),再加甲醇研磨,重复数次,至乳钵内染料及甲醇用完为止,摇匀,密封瓶口。
○存室温暗处,储存愈久,则染料溶解、分解就越好,一般储存3个月以上为佳。
(2) 缓冲液:●缓冲液作用:○染色对氢离子浓度是十分敏感的,据观察pH值的改变,可使蛋白质与染料形成的化合物重新离解。
○缓冲液须保持一定的pH使染色稳定,PBS的pH 一般在6.4~6.8,○偏碱性染料可与缓冲液中酸基起中和作用,偏酸性染料则与缓冲液中的碱基起中和作用,使pH恒定。
瑞氏染色操作流程瑞氏染色法是世界上最古老、最普及的染色技术,被广泛用于医学细胞学检测,是一种染色技术,它可以帮助病理学家、细胞学家和其他科学家识别微小结构中的细胞组织。
此外,瑞氏染色也可以用于研究细胞的固有特性,以及细胞表面的分子变化。
瑞氏染色的基本原理是,通过对细胞或组织样品进行染料染色来识别各种特征,这种染色使得不同的细胞组件具有不同的特征,从而形成一个更明显的细胞或细胞结构的图像模式。
其中常用的染料有碘(Iodine)、普鲁士蓝(Prussian Blue)、磷酸盐(Phosphates)、硝酸盐(Nitrates)和卤素盐(Halides)等。
瑞氏染色包括如下几个步骤:1、样品前处理:这一步骤需要对要染色的样品进行前处理,包括将样品分解成单个细胞,使样品能够更容易被染料吸收。
2、染料添加:将符合特定染料的溶液添加到样品中,以使染料更容易渗透和吸收样品中的细胞结构。
3、照明:把染色后的样品照亮,以增加染料的发色效果。
4、清洗:对染色后的细胞样品进行清洗,以减少未发色的染料,并清除屏蔽染料发色的其他杂质。
5、观察与分析:用透射显微镜观察染色后的组织样品,或者用免疫组织化学或免疫细胞化学技术观察染色后的细胞样品,以获得更具体的细胞结构信息以及对细胞结构的分析。
瑞氏染色是一种快速高效的细胞观察技术,能够清晰地提供细胞结构和内部蛋白质结构信息,并可实现快速识别和快速检测。
目前,瑞氏染色在医学细胞学、遗传学研究中均有广泛应用。
由于其易于操作、简单易行、成本低、结果准确且对视觉效果好等优点,瑞氏染色在细胞核酸分析、生化检测、微生物培养特性分析、细胞培养监测以及分子遗传学分析等方面有着广泛的应用。
瑞氏染色的操作步骤虽然简单,但在操作过程中仍旧注意到一点十分重要,即要正确地添加染料,使其具有色彩和密度的稳定性,以及正确的照明,以保证获得较高的发色效果,同时,在观察和分析该细胞样品时,建议使用放大镜,以获得更准确的细胞结构信息和足够的数据用于分析。
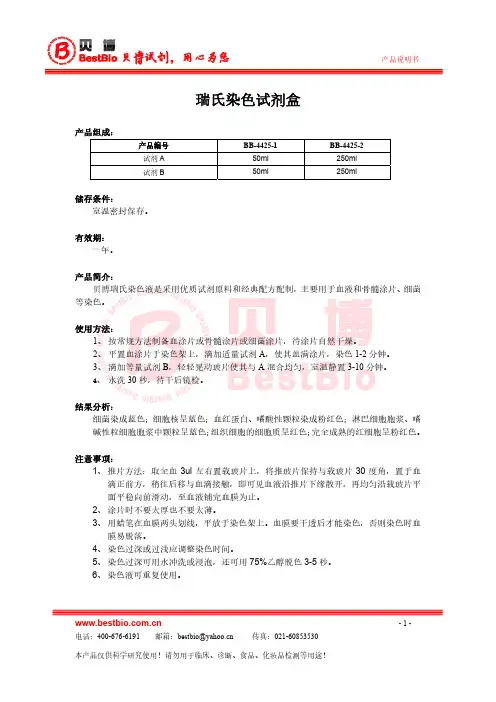
瑞氏姬姆萨染色操作规程生效日期:20150125 页码:第1页共2页1 目的:规范瑞氏姬姆萨染色操作规程,保证染色效果。
2 原理:2.1 染色原理:瑞氏姬姆萨染色液是利用Romanowsky Stain技术原理改良而成。
细胞的着色过程是染料透入被染物并存留其内部的一种过程,此过程既有物理吸附作用,又有化学亲和作用。
各种细胞及细胞的各种成分由于其化学性质不同,对瑞氏-姬姆萨染色液中的酸性染料(伊红)和碱性染料(亚甲蓝)的亲和力也不一样。
因此,标本涂片经瑞氏-姬姆萨染色液染色后,相应各类细胞呈现不同的着色,从而达到辨别其形态特征的目的。
2.2 试剂组成:瑞氏姬姆萨A液(瑞氏染料、姬姆萨染料)瑞氏姬姆萨B液(磷酸盐)3 操作步骤:3.1 滴加瑞氏姬姆萨A液(约0.5ml-0.8ml)涂片上,并让染液覆盖整个标本染色1min;3.2 再将瑞氏姬姆萨B液加于A液上面(滴加量为A液的2-3倍),以嘴或洗耳球吹出微风使液面产生涟漪状,使两液充分混合,染色3-10min。
(染血片时间可略短,染骨髓片时间应视细胞量多少而异)3.3 水洗(冲洗时不能先倒掉染液,应以流水冲去,以防有沉渣沉淀在标本上),干燥、镜检。
4 结果解释:4.1 血细胞涂片、骨髓涂片染色:红细胞呈粉红色,白细胞浆中颗粒清楚,并显示出各种细胞特有的色彩,细胞核染紫红色,核染色质结构清楚。
4.2 阴道分泌物(妇科白带染色):4.2.1 滴虫:经过染色后的滴虫跟活的滴虫呈现完全不同形态,一般情况下,看不到鞭毛,经过染色后,滴虫多为梨形、圆形、椭圆形或呈不规则形态,浆被染成灰蓝或天蓝色,核小,枣核状,常偏于一侧,需注意观察,避免与上皮细胞混淆。
4.2.2 念珠菌(霉菌):染成深蓝色,可见芽生孢子,假菌丝细长而直。
4.2.3 白细胞:形态上与血细胞涂片的白细胞相同,一般白细胞的多少,提示发炎程瑞氏姬姆萨染色操作规程生效日期:20150125 页码:第2页共2页度的高低,对医生的诊断具有一定的指标作用。
瑞氏染色操作流程
1.实验准备
- 收集需要染色的细胞或组织样本,并固定在载玻片或试管中。
常用的固定方法包括用乙醇、甲醛、Perfix等。
-根据样品的特性和染色目的,选择适当的瑞氏染色方法和试剂。
常用的瑞氏染色方法包括瑞氏-厄利染色法、瑞氏-黛染色法等。
2.染色步骤
-将固定的细胞或组织样本浸入去离子水中,使其恢复至自然状态。
-准备适当浓度的染色试剂。
瑞氏染色试剂一般包括硒铁酸盐和酸性柠檬酸溶液。
-将样本浸入硒铁酸盐溶液中,浸泡时间根据实验需要和染色方法而定。
染色时间过长可能导致染色物质过量或染色效果不佳。
-用去离子水或PBS缓冲液冲洗样本,使其清洁并去除多余的染色试剂。
-将样本浸入酸性柠檬酸溶液中,去除多余的染色物质并增强染色效果。
-再次用去离子水或PBS缓冲液冲洗样本。
3.结果观察和分析
-将处理后的样本进行显微镜观察。
瑞氏染色可以用于可视化染色物质(如核酸和蛋白质)或细胞器结构(如核、线粒体等)。
-在显微镜下观察样本时,可以调整镜头焦距、曝光时间等参数,以获得清晰且准确的图像。
-观察到的染色结果可以进行进一步的分析和解释。
例如,可以量化染色强度或比较不同样本之间的染色差异。
总结:
瑞氏染色是一种常用的细胞和组织染色技术,可以用于生物学实验室的各种研究和应用。
该操作流程包括样本固定、染色步骤和结果观察与分析。
通过瑞氏染色,可以可视化并研究细胞和组织中的特定结构和分子,为生物学研究提供重要的实验基础。
瑞氏染色流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!现代科学技术的发展日新月异,其中生物技术作为一个重要的领域,为人类社会的进步和发展带来了许多不可或缺的成果。
瑞氏染色液说明书【产品名称】瑞氏染色液【包装规格】货号:DM0005单瓶包装规格分别为:100ml、250ml、500ml、5000ml;每套/盒包装规格分别为:2×20ml/盒、2×100ml/盒、2×250ml/盒、2×500ml/盒、2×5000ml/盒。
【预期用途】主要用于对血细胞进行染色。
【检验原理】瑞氏色素是酸性染料伊红(Eosin)和碱性染料亚甲蓝(MethyleneBlue)组成的复合染料,各种细胞成分化学性质不同对各种染料的亲和力也不一样,如血红蛋白、嗜酸性颗粒为碱性蛋白质,与酸性染料伊红结合,染粉红色,称为嗜酸性物质;细胞核蛋白、淋巴细胞、嗜碱性粒细胞胞质为酸性,与碱性染料结合后,染紫蓝色或蓝色,称为嗜碱性物质;中性颗粒呈等电状态与伊红和亚甲蓝均可结合,染淡紫红色,称为嗜中性物质;原始红细胞、早幼红细胞胞质、核仁含较多酸性物质,染成较浓厚的蓝色;中幼红细胞既含酸性物质,又含碱性物质,染成红蓝色或灰红色;完全成熟红细胞,酸性物质彻底消失后,染成粉红色。
本染色液经常用于血液和细胞涂片、骨髓细胞涂片、细菌染色,细胞质呈红色,细胞核及细菌呈蓝色,嗜酸性颗粒呈橘红色。
【主要组成成分】试剂组成主要成分1、瑞氏染液瑞氏染料、甲醇2、磷酸盐缓冲液磷酸盐【储存条件及有效期】5℃~35℃环境保存,原包装未开封染色液的有效期为24个月,在有效期内的已开封染色液应在开封后6个月内使用完,每次用后应及时拧紧瓶盖,以免挥发或变质。
【样本要求】1、血细胞涂片染色:要求新鲜全血或EDTA.2K抗凝血。
2、阴道分泌物(妇科白带)涂片染色:新鲜标本离开人体涂片后,需尽快以火焰或酒精固定,以避免细胞变形。
3、骨髓涂片染色:涂片制成后,应在空气中快速摇动或扇干,防止细胞皱缩变形或固空气潮湿而溶血,不能用高温或火烤干燥。
4、脱落细胞涂片:取样本并涂片,待检涂片固定可采用自然干燥法或湿片固定法(具体操作可根据不同检体及所采用的固定液所对应的规范操作要求进行);若采用湿片固定法,标本浸泡时间稍长些,效果会更佳;若采用湿片固定液固定标本,固定液用后需经常过滤,更换,防止细胞交叉污染。
瑞氏染色操作步骤
瑞氏染色是一种常见的染色技术,用于细胞、组织和生物样本的
研究中。
该技术可用于确定细胞形态、染色体数量和形态、染色体变
异等。
以下是瑞氏染色的操作步骤:
1.样本处理:样本一般采用新鲜的、保存良好的细胞或组织样本。
在处理之前,需要检查样本是否符合要求。
例如,细胞样本应具有充
足的数量和活力,组织样本应达到一定的厚度和大小。
此外,需要对
样本进行预处理,如固定处理、去除上皮细胞等。
2.制片:制作干片是瑞氏染色的重要步骤。
首先,用无菌的玻片
将样本涂抹均匀。
有时还需要使用刮片等工具辅助涂抹。
然后,制片
需通过加热、干燥等过程。
这使得细胞或组织与玻片表面相关联,以
便在后续染色过程中处理。
3.染色:将制片进行染色是瑞氏染色的核心步骤。
瑞氏染色使用
吉姆萨染色(Giemsa stain)或艾因染色(Ehrlich stain)方法。
在
吉姆萨染色中,可以使用不同的吉姆萨组合来改变细胞或染色体染色
的颜色。
在艾因染色中,使用配制艾因染液进行染色。
两种方法的染
色时间和温度也有所不同。
在染色过程中,需要控制好样本的染色时
间和温度,以避免染色过度或过轻。
4.显微镜观察:经过染色后,制片需要用显微镜观察。
观察时要
准确、认真、耐心、细致。
需要注意的是,显微镜的放大倍数和焦距
要调整到合适的位置,以获得清晰的细胞或染色体图像。
5.结果分析:根据显微镜观察得到的图像,可以对样本进行分析
和判断。
主要从细胞形态、染色体数量和形态、染色体变异等方面进
行评估,并与常模比较,以便对生物样本进行分类、鉴定和研究。
总的来说,瑞氏染色是一种简单、常用的染色技术,适用于细胞、组织和生物样本的研究。
操作过程中需要注意样本处理、制片、染色、显微镜观察和结果分析等关键步骤。
只有仔细、细致地操作,才能获
得高质量的实验数据。