氨基酸蛋白质核酸
- 格式:doc
- 大小:482.50 KB
- 文档页数:7



氨基酸、肽和蛋白质、核酸
氨基酸不能再水解。
NH+3 和COO-的红外吸收光谱在
~
=3070及1500~1600cm-1
氨基酸除有各自的比旋光度、等电点等物理性质可用于鉴定外,α-氨基酸与水合茚三酮反应,生成蓝或紫色产物,反应很灵敏,是检定氨基酸的一个常用方法。
α-氨基酸又可与铜离子作用生成蓝色的内络盐。
含有苯环的氨基酸与浓硝酸作用生成白色沉淀、加热变黄,遇碱则呈橙黄色,这可能是苯环上生成了硝基化合物。
具有氨基的氨基酸可以和亚硝酸作用,放出氮气。
蛋白质是由许多α-氨基酸通过肽键连接成多肽的大分子化合物,分子量很高。
蛋白质水解最终产物除氨基酸外,还有糖、色素、含磷、铁等非蛋白质成份(统称辅基)。
蛋白质和氨基酸一样,也是两性物质,能与强酸、强碱作用成盐,有一定的等电点。
都能与水合茚三酮反应显蓝色;蛋白质与浓硝酸作用变黄,再加氨处理又变橙色,可能和氨基酸一样,是由于蛋白质中苯环部分发生了硝化反应。
蛋白质可经盐析,脱水剂(C2H5OH,CH3COCH3)等作用而沉淀,在热、紫外光、或化学试剂作用时变性。
这和简单的氨基酸不尽相同。
此外,缩二脲反应是区分氨基酸和蛋白质的重要反应。
1。




第三节蛋白质和核酸学习目标核心素养1.了解氨基酸的组成和结构,知道氨基酸的两性。
2.了解氨基酸的组成、结构特点和主要化学性质,知道氨基酸和蛋白质的关系。
3.了解蛋白质的组成、结构和性质(盐析、变性、水解、颜色反应等)。
了解氨基酸、蛋白质与人体健康的关系。
4.认识蛋白质、酶、核酸等物质与人体健康的关系。
1.从微观官能团的角度理解氨基酸、蛋白质性质和核酸的性质,形成结构决定性质的观念,能从宏观和微观相结合的视角分析和解决实际问题。
(宏观辨识与微观探析)2.从蛋白质的性质出发,具有较强的问题意识,设计实验方案,并能对实验进行评价和优化。
(科学探究与创新意识)3.认识蛋白质和核酸在生命科学发展中的重要应用,感受化学对社会发展的重大贡献。
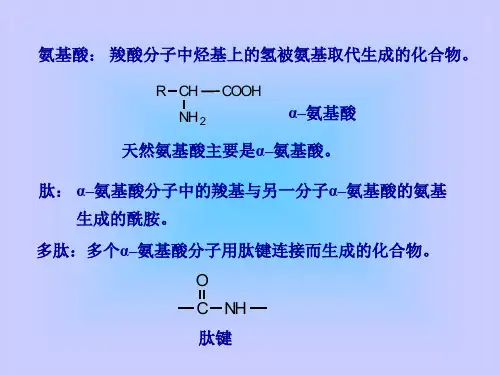
(科学态度与社会责任)一、氨基酸的结构与性质1.概念和结构:(1)概念:羧酸分子中烃基上的氢原子被氨基取代的化合物。
(2)结构:α-氨基酸的结构简式为,官能团为氨基(—NH2)和羧基(—COOH)。
(3)常见的氨基酸。
俗名结构简式系统命名甘氨酸α-氨基乙酸丙氨酸α-氨基丙酸谷氨酸2-氨基-1,5-戊二酸苯丙氨酸α-氨基苯丙酸2.氨基酸的性质:(1)物理性质。
颜色状态熔点溶解性水强酸或强碱乙醇、乙醚无色晶体较高大多数能溶能溶难溶(2)化学性质。
①两性。
氨基酸分子中既含有羧基,又含有氨基,是两性化合物,因而能与酸、碱反应生成盐。
a.α 氨基酸与盐酸的反应:。
b.α 氨基酸与氢氧化钠的反应:。
②成肽反应。
两个氨基酸分子(可以相同,也可以不同),在酸或碱的存在下加热,通过一分子的氨基和另一分子的羧基间脱去一分子水,缩合成含有肽键()的化合物的反应,称为成肽反应。
例如,氨基酸二肽或多肽蛋白质。
【微思考】既能与酸反应,又能与碱反应的物质有哪些?提示:氨基酸、Al、Al2O3、Al(OH)3、弱酸的酸式盐(如NaHCO3)、弱酸的铵盐[如(NH4)2CO3]。
【教材二次开发】教材介绍了氨基酸的成肽反应,成肽反应的反应机理是什么?有哪些成肽方式?提示:酸脱羟基、氨脱氢。



组成细胞的分子:蛋白质和核酸(知识梳理)组成细胞的分子:蛋白质和核酸【学习目标】1、说出氨基酸的结构特点以及氨基酸形成蛋白质的过程2、概述蛋白质的结构和功能3、理解核酸的基本结构,掌握核酸的结构和功能。
4、以特定的染色剂染色,观察并区分DNA和RNA在细胞中的分布。
5、氨基酸的结构特点以及氨基酸形成蛋白质的过程、蛋白质的结构和功能(重点)。
6、氨基酸形成蛋白质的过程、蛋白质结构多样性的形成原因(难点)【要点梳理】要点一、蛋白质1、氨基酸及其种类(1)氨基酸的组成元素:C、H、O、N,有的含有S (2)氨基酸是组成蛋白质的基本单位。
含有氨基和羧基的有机化合物都叫做氨基酸。
天然氨基酸现已发现的有300多种,但作为构成蛋白质的氨基酸大约有20种。
(3)组成蛋白质的氨基酸的结构:①构成蛋白质的氨基酸分子,可用氨基酸的结构通式表示如下:②构成蛋白质的氨基酸的结构特点是:多少也不等,排列的次序又变化多端,由氨基酸形成的肽链的空间结构千差万别,导致蛋白质分子的结构也多种多样。
从而决定蛋白质分子功能的多样性。
空间结构:一个蛋白质分子可以含有一条或几条肽链,肽链通过一定的化学键互相连接在一起,这些肽链不呈直线,也不在同一个平面上,而是一条或几条肽链盘曲折叠形成具有复杂空间结构的蛋白质分子。
如胰岛素的空间结构图(教材中图2一6)。
蛋白质的空间结构可以从以下四个方面来理解:①氨基酸的种类不同,形成的肽链不同,如图1所示:②氨基酸的数目不同,形成的肽链不同,如图2所示:③氨基酸的排列次序不同,形成的肽链不同,如图3所示:④肽链的数目和空间结构不同,构成的蛋白质不同,如图4所示:3、蛋白质的功能蛋白质功能举例结构蛋白构成细胞和生物体的成分。
如构成人和动物肌肉的肌动蛋白和肌球蛋白;构成生物膜的蛋白质催化作用绝大多数酶,如唾液淀粉酶、胃蛋白酶等运输作用如血红蛋白、载体蛋白免疫作用抗体、细胞因子调节作用起信息作用的部分激素:如胰岛素、生长激素等也能做源物质婴幼儿时期,主要喝奶,从中获取能量4、蛋白质结构中的数量关系氨基酸平均相对分子质量氨基酸数目肽键数目脱去水分子数多肽相对分子质量氨基数目羧基数目1条肽链a mm-1m-1ma-18(m-1)至少1个至少1个N条肽链a mm-nm-nma-18(m-n)至少n个至少n个要点二、核酸1、核酸概述(1)种类:脱氧核糖核酸和核糖核酸(2)组成元素:C、H、O、N、P(3)组成成分:碱基、磷酸、五碳糖(4)组成单位:核苷酸:脱氧核苷酸(A、T、C、G)核糖核苷酸(A、U、C、G) (5)结构DNA为规则的双螺旋结构RNA通常为单链结构(6)分布DNA主要分布在细胞核内,线粒体和叶绿体中也有少量DNARNA主要分布在细胞质中,如线粒体、叶绿体、核糖体要点诠释:碱基是一类含有氮元素的有机物。
蛋白质和核酸编稿:宋杰审稿:于冬梅【学习目标】1、了解氨基酸、蛋白质与人体健康的关系,认识人工合成多肽、蛋白质、核酸的意义;2、掌握氨基酸和蛋白质的结构特点及其重要的化学性质。
【要点梳理】要点一、氨基酸的结构和性质蛋白质是生命活动的主要物质基础,氨基酸是组成蛋白质的基本结构单位,而核酸对蛋白质的生物合成又起着决定作用。
因此,研究氨基酸、蛋白质、核酸等基本的生命物质的结构,有助于揭开生命现象的本质。
【高清课堂:蛋白质和核酸#蛋白质和核酸】1.氨基酸的组成和结构。
(1)氨基酸是羧酸分子中烃基上的氢原子被氨基取代后的生成物。
氨基酸分子中含有氨基和羧基,属于取代羧酸。
(2)组成蛋白质的氨基酸几乎都是α-氨基酸。
α-氨基酸的结构简式可表示为:常见的α-氨基酸有许多种。
如:2.氨基酸的物理性质。
天然氨基酸均为无色晶体,主要以内盐形式存在,熔点较高,在200℃~300℃时熔化分解。
它们能溶于强酸或强碱溶液中,除少数外一般都能溶于水,而难溶于乙醇、乙醚。
提示:(1)内盐是指氨基酸分子中的羟基和氨基作用。
使氨基酸成为带正电荷和负电荷的两性离子(如)。
(2)氨基酸具有一般盐的物理性质。
3.氨基酸的主要化学性质。
(1)氨基酸的两性。
氨基酸是两性化合物,能与酸、碱反应生成盐。
氨基酸分子既含有氨基又含有羧基,通常以两性离子形式存在,溶液的pH不同,可发生不同的解离。
不同的氨基酸在水中的溶解度最小时的pH(即等电点)不同,可以通过控制溶液的pH分离氨基酸。
(2)氨基酸的成肽反应。
在酸或碱存在的条件下加热,一个氨基酸分子的氨基与另一个氨基酸分子的羧基间脱去一分子水,缩合形成含有肽键()的化合物,称为成肽反应。
例如:由两个氨基酸分子间脱水形成的含有肽键的化合物叫二肽。
由三个氨基酸分子间脱水形成的含有肽键的化合物叫三肽,以此类推,三肽以上均可称为多肽。
相对分子质量在10000以上并具有一定空间结构的多肽,称为蛋白质。
4.α-氨基酸的鉴别。
第二单元 氨基酸 蛋白质 核酸细品书中知识 关键词:氨基酸、氨基酸的结构、蛋白质的性质、盐析和变性 1.氨基酸的分子结构(1)羧酸分子烃基上的氢原子被氨基取代的化合物的化合物称为氨基酸,氨基酸的官能团是氨基和羧基。
组成蛋白质的氨基酸几乎都是α-氨基酸,它们的结构简式的通式可表示为R CH NH 2COOH 。
(2)几种常见的氨基酸甘氨酸:H 2N -CH 2COOH ,丙氨酸:CH 3CH NH 2COOH,苯丙氨酸:C 6H 5CH 2CH 2COOH,谷氨酸:CH NH 2COOHCH 2CH 2HOOC 。
例1:L 多巴胺是一种有机物,它可用于帕金森综合征的治疗,这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和2001年诺贝尔化学奖的研究成果。
下列关于L 多巴胺酸碱性的叙述正确的是( )A.既没有酸性,又没有碱性B.既具有酸性,又具有碱性C.只有酸性,没有碱性D.只有碱性,没有酸性解析:在氨基酸、蛋白质的分子中因含—NH 2和—COOH ,故既可与酸发生中和反应,又可与碱发生中和反应。
答案:B点拨:本题依据有机物的结构推测其具有的性质。
通过本题的分析解答,应明确,解答此类题目的关键是分析并找出其结构中含有的官能团;同时还要注重有关知识的归纳总结,如能与强碱、强酸都反应的物质类别等。
2.氨基酸的性质氨基酸的性质,要抓住两性特点,在氨基酸分子中含有碱性的氨基和酸性的羧基,具有两性。
(1)碱性氨基酸可以跟酸生成铵盐(氨基酸为阳离子)(2)酸性氨基酸还可以跟碱反应生成羧酸盐(氨基酸为阴离子)(3)缩合反应一个氨基酸分子中的羧基与另一个氨基酸分子中的氨基能够缩合失水,形成的缩合产物叫二肽。
二肽继续与氨基酸发生缩合反水反应,形成三肽、四肽等。
两种不同的氨基酸可形成四种不同的链状二肽。
例2:某细菌能产生一种“毒性肽”,其化学式为C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:甘氨酸H2N–CH2–COOH、丙氨酸CH3CH(NH2)COOH、苯丙氨酸Ph–CH2CH(NH2)COOH和谷氨酸HOOCCH2 CH2CH(NH2)COOH。
第二单元 氨基酸 蛋白质
核酸
【学习任务】
1.了解氨基酸的组成、结构特点和主要化学性质。
2.
了解氨基酸、蛋白质与人体健康的关系。
3.了解蛋白质的组成、结构特点和主要化学性质。
4.认识人工合成多肽、蛋白质、核酸等的意义,了解我国在生命科学研究领域中的贡献,体会化学科学在生命科学发展中的重要作用。
【学习准备】
1、既与酸反应又与碱反应的物质有哪些?
2、盐析、变性和渗析三者的区别是什么?
3、焰色反应、显色反应、颜色反应三者的区别是什么?
4
、二肽是由几个氨基酸分子形成的?多肽分子和其所含的肽键数目有什么关系?
5、医用酒精、84消毒液、过氧乙酸等为什么能杀菌消毒?解救误服重金属盐中毒的病人时,为什么可服用大量生鸡蛋、牛奶或豆浆等解毒?
【学习活动】
学习活动1:
氨基酸的结构和性质 [活动探究]分析常见的氨基酸
知识归纳:1.结构:氨基酸的官能团为 和。
2.氨基酸的性质
(1)物理性质
固态氨基酸主要以形式存在,熔点高,不易挥发,溶于有机溶剂。
(2)化学性质
①两性:在氨基酸分子中是酸性基团,是碱性基团,在酸性条件主
要以阳离子形态存在;在碱性条件下主要以阴离子形态存在,其反应关系为:
②成肽反应
在的存在下加热,氨基酸分子之间通过一个分子的和另一个分子的
间脱去一分子水,缩合形成含有肽键()的化合物。
例如:
总结1:
[练习1]在4种化合物:①NaHCO3、②Al(OH)3、③(NH4)2S、④H2NCH2COOH 中,跟盐酸和氢氧化钠溶液都能反应的化合物是()
A.②④
B.
C.①②③
D.
[变式探究1] 把晶体丙氨酸溶于水,使溶液呈碱性,则下列四种微粒中存在最多的是
A. B.
C. D.
[练习2]L-多巴是一种有机物,分子式为C9H11O4N,它可用于帕金森综合症的治疗,
其结构简式为,这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果。
下列关于L-多巴的叙述不正确的是A.它属于α-氨基酸,既具有酸性,又具有碱性 B.它能与Fe2(SO4)3溶液发生显色反应
C.它可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环
D.它既与酸反应又与碱反应,等物质的量的L-多巴最多消耗NaOH与HCl的物质的量之比为
1:1
[变式探究2] 下面是蛋白质结构重复片断,写出合成该蛋白质的单体。
学习活动2:蛋白质的组成和性质
[实验探究1]蛋白质的盐析
①按下列实验操作完成实验:
②实验现象:加入饱和(NH4)2SO4或Na2SO4溶液,试管
内蛋白质均,加蒸馏水后沉淀。
③结论:非重金属盐盐[如(NH4)2SO4、Na2SO4、NaCl等]溶液浓度较大时,则会使蛋白质溶解度而从溶液中,这种作用称为。
④蛋白质的盐析是一个过程,采用和可分离提纯蛋白质。
[实验探究2] 蛋白质的变性
①按下列实验操作完成实验:
实验操作Ⅰ实验操作Ⅱ:②实验现象:加热及加入醋酸铅溶液,Ⅰ、Ⅱ两支试管内蛋白质均;加入蒸馏水后沉淀。
[实验探究3]蛋白质的特征反应
(1)颜色反应:取一小块鸡皮,置于蒸发皿中,滴加3~5滴浓硝酸,在酒精灯上微热,观察到的现象是。
实验结论:,常用此反应来鉴别蛋白质。
(2)蘸取少量鸡蛋清或取一根头发,放在酒精灯火焰上灼烧,可闻到。
常用此反应区分毛料纤维与合成纤维。
知识归纳:1.蛋白质的组成
(1)定义:蛋白质是由通过等相互连接而形成的一类具有特定结构和一定生物学功能的生物大分子。
(2)组成:蛋白质中含有及少量的S,属于化合物,溶于水具有的某些性质。
2.蛋白质的性质
(1)两性:在多肽链的两端存在着和,因此蛋白质既能与酸反应,又能与碱反应。
(2)水解
(3)盐析
①向蛋白质溶液中加入浓的无机盐[如Na2SO4、(NH4)2SO4等]溶液,破坏蛋白质溶解形成的胶体结构→降低蛋白质的溶解性→蛋白质转变为沉淀析出。
②特点:只改变了蛋白质的,而没有改变他们的化学性质,是的过程。
③应用:多次盐析和溶解可以分离、提纯蛋白质。
(4)变性
①影响因素:
物理因素:加热、加压、搅拌、振荡、紫外线照射、超声波等;
化学因素:、、、乙醇、丙酮、三氯乙酸(CCl3COOH)、甲醛(福尔马林)等。
②特点:变性会使蛋白质发生结构上的改变,也会使其丧失原有的生理活性,是
过程。
(5)颜色反应
①分子中含有苯环的蛋白质跟浓硝酸作用时呈色。
②蛋白质遇双缩脲试剂显色。
3.酶
(1)酶的含义
酶是具有:生理活性,对于许多有机化学反应和生物体内进行的复杂化学反应具有很强催化作用的蛋白质。
(2)酶的催化作用和特点:①条件温和,②,③。
总结2:
[练习3]下列关于蛋白质的叙述中,正确的是()
A.蛋白质溶液里加入饱和(NH4)2SO4溶液可提纯蛋白质
B.重金属盐使蛋白质变性,所以吞服“钡餐”会引起中毒
C.温度越高,酶对某些反应的催化效率就越高
D.任何结构的蛋白质遇到浓硝酸都会变成黄色
[变式探究3] 近年克隆技术快速发展,各国先后克隆出了羊、牛、猪、猴等多种动物。
克隆技术的关键技术之一是找到一些特殊的酶,这些酶能激活普通细胞,使之能像生殖细胞一样发育成个体。
下列有关酶的叙述中错误的是()
A.酶是一种具有催化作用的蛋白质
B.酶的催化作用具有专一性
C.高温或重金属盐能降低酶的活性
D.酶只有在强酸性或强碱性条件下才能发挥作用
[练习4]试用蛋白质的性质,解释下列现象。
(1)在豆浆中加入石膏或氯化镁,能使豆浆凝结为豆腐。
(2)误服可溶性重金属盐,可以服用大量牛奶、蛋清或豆浆解毒。
(3)福尔马林能防腐,可用于浸制标本。
(4)用灼烧的方法可鉴别毛织物和棉织物。
[变式探究4]下列有关实验的叙述中不正确的有( )
①乙酸乙酯中混有乙酸,可选用饱和Na 2CO 3溶液洗涤,然后将两层液体分开; ②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;
③向蛋白质溶液中加入饱和(NH 4)2SO 4溶液,出现盐析现象,加水溶解; ④溴乙烷与NaOH 的乙醇溶液混合共热可得到乙烯;
⑤滴定时左手控制滴定管,右手握持锥形瓶,边滴边摇动锥形瓶,眼睛注视滴定管中的液面;
用盐析法分离高级脂肪酸钠和甘油的混合溶液; ⑦用渗析法除去蛋白质胶体中混有的少量Na +和Cl -。
A.①③ B. C.④⑥
D.
学习活动3:核酸
【学以致用】
1、要使蛋白质从溶液中析出而又不改变蛋白质的主要性质,最好多加入( ) A.饱和Na 2SO
4溶液 B.稀NaOH 溶液 C.饱和CaSO 4溶液 D.稀BaCl 2溶液
2
、把①蔗糖②淀粉③蛋白质④油脂在稀H 2SO 4存在的条件下分别进行水解,最后生成物只有一种有机物的是( ) A.①和② B.只有
C.②③④
D.只有④
3、关于生物体内氨基酸的叙述错误的是( )
A.构成蛋白质的氨基酸分子的结构通式是
B.人体内氨基酸的分解代谢终产物是水、二氧化碳和尿素
C.人体内所有氨基酸均可以互相转化
D.两个氨基酸分子通过脱水缩合形成二肽 4、褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。
下列说法不正确
...的是()
A.色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点
B.在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出
C.在一定条件下,色氨酸可发生缩聚反应
D.褪黑素与色氨酸结构相似,也具有两性化合物的特性
5、下列有机物水解断键处(用虚线表示)不正确的是()
A. B.
C. D.
6、已知半胱氨酸的结构简式为则下列说法不正确的是()
A.半胱氨酸属于α-氨基酸
B.半胱氨酸是一种两性化合物
C.两分子半胱氨酸脱水形成的二肽的结构简式为
D.与NaOH溶液加热时可放出一种碱性气体。