肌钙蛋白和肌红蛋白测定试剂盒介绍(精)
- 格式:ppt
- 大小:509.00 KB
- 文档页数:48
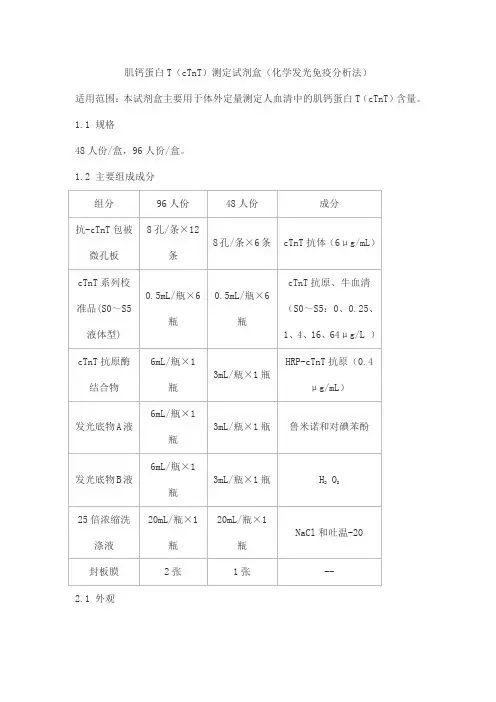
肌钙蛋白T(cTnT)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒主要用于体外定量测定人血清中的肌钙蛋白T(cTnT)含量。
1.1 规格
48人份/盒,96人份/盒。
1.2 主要组成成分
2.1 外观
液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量
装量不少于标示值。
2.3 准确性
回收率应在90.0%~110%范围内。
2.4 剂量-反应曲线线性相关系数
在[0.25,64]μg/L范围内,用log-logit数学模式拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度
2.5.1 重复性(C.V%)应不高于15.0%;
2.5.2 批间差(C.V%)应不高于20.0%。
2.6 最低检出量
应不高于0.250μg/L。
2.7 质控血清测定值
应在允许的范围之内。
2.8 特异性
cTnT与肌红蛋白、cTnI、肌酸激酶同工酶的交叉反应如下:
2.9 稳定性
2.9.1 37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性
按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与湖南隆润达生物技术有限公司的cTnT试剂盒比对赋值。
肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)说明书【产品名称】通用名称:肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)英文名称:Myoglobin(CLIA)【包装规格】2×30 人份/盒、2×50 人份/盒、2×100 人份/盒【预期用途】用于体外定量测定人体血清或(和)血浆中肌红蛋白的含量。
肌红蛋白(MYO)分子量为17.8 kD,由一个多肽链和一个亚铁血红素辅基组成,由人体骨骼肌和心肌细胞合成并贮存,不存在于其它细胞。
实验证明由骨骼肌和心肌来源的两种肌红蛋白无免疫学上的差异。
肌红蛋白的主要生理功能为携带氧气供细胞呼吸。
肌红蛋白是检测急性心肌梗死(AMI) 的早期指标,具有极高的灵敏度但是特异性较差,在AMI 早期心肌细胞受损,由于MYO 的分子量小,可以很快从破损的细胞中释放出来,在AMI 发病1~3 小时后血中浓度迅速上升,6~7 小时达峰值,12 小时内几乎所有AMI 患者MYO 都有升高,升高幅度大于各心肌酶,因此可以作为AMI 的早期诊断标志物。
由于MYO 也存在于骨骼肌中,而且仅从肾脏清除,所以急性肌损伤、急性或慢性肾衰竭、严重的充血性心力衰竭、长时间休克及各种原因引起的肌病患者、肌内注射、剧烈的锻炼、某种毒素和药物摄入后,MYO 都会升高。
因此,采用血清MYO 水平作为诊断AMI 的早期指标,仅限于没有上述相关疾病的患者。
在有急性症状的患者中,4 小时内MYO 水平不升高,AMI 的可能性极低。
由于在AMI 后血中MYO 很快从肾脏清除,发病l8~30 小时内可完全恢复到正常水平。
故MYO 测定有助于在AMI 病程中观察有无再梗塞或者梗塞再扩展。
MYO 频繁出现增高,提示原有心肌梗死仍在延续。
另外,在神经肌肉疾病如肌营养不良、肌萎缩和多肌炎时血清MYO 水平亦升高。
心脏外科手术患者血清MYO 升高,可以作为判断心肌损伤程度及愈合情况的一项客观指标。
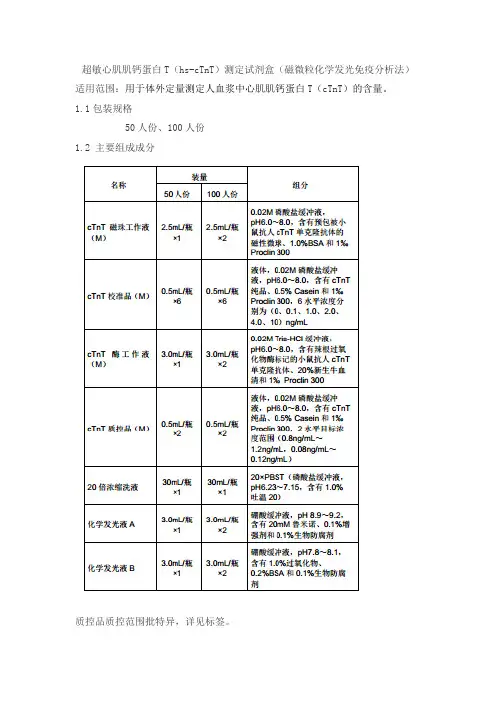
超敏心肌肌钙蛋白T(hs-cTnT)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血浆中心肌肌钙蛋白T(cTnT)的含量。
1.1包装规格50人份、100人份1.2 主要组成成分质控品质控范围批特异,详见标签。
2.1 外观2.1.1 试剂盒各组分应齐全、完整,液体无渗漏;2.1.2 中文包装标签应清晰,无磨损。
2.2 空白限空白限浓度应不高于0.005ng/mL。
2.3 线性在[0.005,10]ng/mL区间内,线性相关系数(r)应不低于0.99,且线性区间[0.005,2.0]ng/mL内,绝对偏差应不超过±0.3ng/mL;线性区间(2.0,10]ng/mL内,相对偏差应不超过±15%。
2.4 重复性分别用高、低浓度的样本各重复检测10次,其变异系数(CV)应不大于10%。
2.5 准确度用Human Cardiac Troponin Complex(NIST SRM2921)国际标准品作为样本进行检测,其测量结果的相对偏差应在±20%区间内。
2.6 分析特异性测定浓度均为1000ng/mL的心肌肌钙蛋白C、心肌肌钙蛋白I、骨骼肌肌钙蛋白I,测定结果应不高于0.005ng/mL。
2.7 溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容。
校准品溯源至美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)的Human Cardiac Troponin Complex(SRM2921)。
2.8 质控品赋值有效性本试剂盒质控品的测定结果应在质控范围内。
2.9 批间差用3个批号的产品分别检测同一份样本,3批产品间的相对极差(R)应不大于15%。
2.10 稳定性试剂盒在(2~8)℃储存条件下的有效期为12个月,试剂盒在规定的条件下保存,取到效期后的试剂盒进行检测,检验结果应符合2.1、2.2、2.3、2.4、2.5、2.6的规定。

肌钙蛋白/肌红蛋白/肌酸激酶同工酶三合一测定(胶体金法)的标准程序【目的】体外肌钙蛋白/肌红蛋白/肌酸激酶同工酶的检测【适用仪器】干化学法【该SOP变动程序】本标准操作程序的修改可有使用本SOP文件的工作人员提出,并报请专业主管及科主任签字生效。
【检验原理】本法采用胶体金免疫层析技术,将金标抗-Myoglobin(Ab1、金标抗VK-MB和金标抗2nI(Ab1预先包被玻璃纤维上,膜上测试区固定抗-cTnI(Ab2)抗-CK-dM、抗Myoglobin (Ab2和质控区的相应抗体,测试时,标本中如含有肌红蛋白或肌酸激酶同工酶或心肌肌钙蛋白I时,分别与预先包被的金标抗体结合,结合物在毛细效应下向上层析,随后会被固定在膜上相应测试区的抗体捕获,从而在相应测试区出现紫红色条带。
如果是阴性标本,则测试区内无紫红色条带,质控区内所显示条带是判定是否有足够标本,层析过程是否正常的标准,同时也作为试剂的内控标准。
【操作步骤】1、使用前将试剂和血样标本恢复至室温。
2、从原包装试剂袋中取出试剂盒,在1小时内应尽快地使用,特别是在室温高于30C,并且在高度潮湿的环境中,打开包装后应立即使用。
3、将试剂盒放在干净的水平的台面上:血清或血浆标本:用滴管垂直滴入3滴血清或血浆标本(约120ul )于试剂盒样本孔中,开始计时。
静脉血标本:用滴管垂直滴入3滴静脉全血(约120ul )于试剂盒样本孔中,开始计时。
指尖血标本:用玻璃毛细管吸取或直接滴加3滴指尖血于试剂盒样本孔中,滴加1滴缓冲液,开始计时。
4、等待紫红色条带出现,测试结果应在10-20分钟读取,20分钟后读取的结果无效。
【检验结果的解释】阳性(+ ):四条紫红色条带出现。
三条位于测试区(T1)、(T2 )和(T3 )内,另一条位于质控区(C)。
阳性结果表明:标本中只含有三种心肌标志物。
若只有三条紫红色条带出现。
二条位于测试区(T1)、(T2)和33)任何两个区内,另一条位于质控区(C)。

肌钙蛋白T测定试剂盒产品技术要求万孚1.产品简介:肌钙蛋白T测定试剂盒是一种高灵敏度、高特异性的试剂盒,用于检测肌钙蛋白T水平。
该试剂盒通过化学发光免疫分析法,利用特异性的抗体与肌钙蛋白T结合,生成免疫复合物,进而产生化学发光信号,通过光度计测量信号强度,从而确定样本中肌钙蛋白T的浓度。
2.抗体:该试剂盒中所使用的抗体应为高亲和力、高特异性的肌钙蛋白T抗体。
抗体应经过充分的验证,并能与肌钙蛋白T特异性结合,不与其他相关物质发生非特异性反应。
3.校准品:试剂盒应包含不同浓度的校准品,用于构建标准曲线。
校准品应经过准确测定其肌钙蛋白T浓度,并保证稳定性。
4.灵敏度:试剂盒应具有足够的灵敏度,能够检测出低至0.01 ng/mL的肌钙蛋白T浓度。
5.线性范围:试剂盒应具有宽广的线性范围,能够涵盖生理范围内的肌钙蛋白T浓度变化。
6.重复性:试剂盒应具有良好的重复性,同一样本的重复测定结果应具有较小的变异性。
7.特异性:试剂盒应具有良好的特异性,不受其他相关物质的干扰。
8.稳定性:试剂盒的试剂和材料应具有良好的稳定性,能够保持在规定的储存条件下长期保存。
9.操作简便性:试剂盒的操作步骤应简单明了,能够被普通实验室人员快速掌握并使用。
10.结果解读:试剂盒的结果应能够准确、直接地反映样本中肌钙蛋白T的浓度,并能够被普通实验室人员快速解读。
以上是对肌钙蛋白T测定试剂盒产品技术要求的详细描述,通过满足这些要求,可以确保该产品可以准确、可靠地测定肌钙蛋白T水平,从而在临床诊断和研究中发挥重要作用。
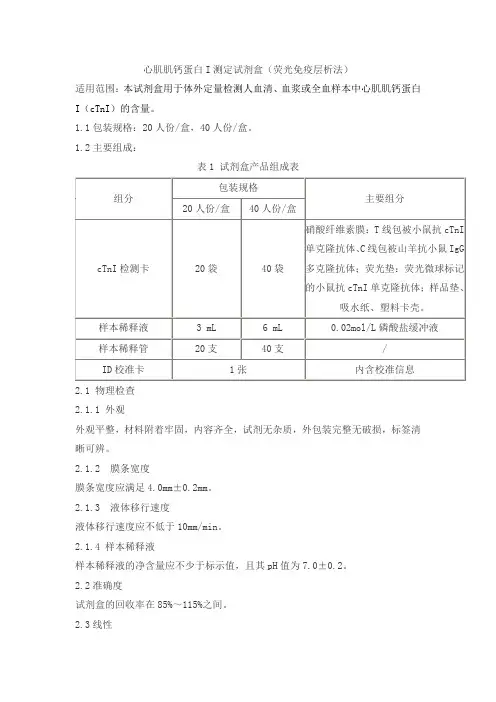
心肌肌钙蛋白I测定试剂盒(荧光免疫层析法)
适用范围:本试剂盒用于体外定量检测人血清、血浆或全血样本中心肌肌钙蛋白I(cTnI)的含量。
1.1包装规格:20人份/盒,40人份/盒。
1.2主要组成:
表1 试剂盒产品组成表
2.1 物理检查
2.1.1 外观
外观平整,材料附着牢固,内容齐全,试剂无杂质,外包装完整无破损,标签清晰可辨。
2.1.2 膜条宽度
膜条宽度应满足4.0mm±0.2mm。
2.1.3 液体移行速度
液体移行速度应不低于10mm/min。
2.1.4 样本稀释液
样本稀释液的净含量应不少于标示值,且其pH值为7.0±0.2。
2.2准确度
试剂盒的回收率在85%~115%之间。
2.3线性
在[0.2,50]ng/mL范围内,线性相关系数(r)应不低于0.990。
2.4 重复性
分别测定高、低两个浓度的样本,变异系数(CV)应不高于10.0%。
2.5 批间差
用三个不同批号试剂盒分别测定高、低两个浓度的样本,三个批号试剂盒之间的批间变异系数应不高于15.0%。
2.6 空白限
试剂盒空白限应不大于0.1ng/mL。
2.7校准信息溯源性
校准信息所用工作校准品根据GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的规定,溯源至工作校准品,工作校准品通过已上市产品进行赋值。
2.8 稳定性
试剂盒在规定的条件下保存至有效期末,取到效期后两个月内的试剂盒,检测2.2、2.3、2.4、2.6项,结果应符合要求。

2性能指标
2.1外观
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 、Rc 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.4最低检测限
应不大于0.006 ng/mL。
2.5线性
试剂盒在0.006 ng/mL~50 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 6%。
2.7批间差
变异系数CV 应≤ 10%。

实验室中那些不同种类的常见ELISA试剂盒区别在哪【一】心肌梗塞检测elisa试剂盒:如肌钙蛋白、肌红蛋白、C-反应蛋白等。
【二】细胞因子检测试剂盒:如白介素、选择素、集落刺激因子,肿瘤坏死因子,干扰素,转化生长因子,趋化因子,细胞因子受体,粘附分子,生长因子,凋亡因子等。
【三】肝纤维化检测elisa试剂盒:如纤维连接蛋白,透明质酸,胶原,基质金属蛋白酶抑制因子,elisa试剂盒基质金属蛋白酶,层粘蛋白等。
【四】内分泌检测elisa试剂盒如甲状腺、胰腺、性激素、孕酮、睾酮、生长激素、生长抑素、内皮素、皮质醇、骨钙素、催乳素、促肾上腺皮质激素、促卵泡素、雌二醇、雌三醇、5-羟色胺,17-羟孕酮等。
【五】传染病检测elisa试剂盒如幽门螺杆菌,乙脑,乙肝,丙肝,丁肝,戊肝,庚肝,衣原体,性病,腺病毒,微小病毒B19,天疱疮,水痘-带状疱疹病毒,生殖支原体,伤寒,沙眼,腮腺炎,人型支原体,麻疹,轮状病毒,流行性出血热,淋球菌,莱姆病,柯萨奇,elisa试剂盒抗解尿支原体,军团菌,结核,胶原,尖锐湿疣,甲肝,脊髓灰质炎,急性胰腺炎尿胰蛋白酶,霍乱,呼吸道合胞病毒,肝吸虫,副流感,肺炎,带状疱疹,传染性单核细胞增多症,层粘蛋白,布鲁氏杆菌,百日咳,白喉,艾柯病毒,EB病毒,A 族链球菌等。
【六】自身免疫检测elisa试剂盒:如甲状腺,盐水可提取核抗原抗体(ENA),抗核抗体,DNA,抗心磷脂抗体,类风湿因子,循环免疫复合物,抗胰岛细胞抗体,胰蛋白酶原,Sm,大疱性类疱疮,蛋白酶,抗组蛋白抗体,粒细胞弹性蛋白酶,皮肤抗体,肾上腺抗体,肾小球基底膜,肾小球基底膜抗体,髓过氧化物酶,条纹肌抗体,网硬蛋白抗体,胃壁细胞抗体,胃蛋白酶,系统性红斑狼疮,细菌性渗透性增强因子等。
【七】肿瘤标志物检测elisa试剂盒:如肿瘤标志物,组织多肽抗原,肿瘤相关因子,胰腺癌,直肠癌,细胞角蛋白片段,胃肠癌,铁蛋白,糖链抗原,神经特异性稀醇化酶,上皮膜抗原,elisa试剂盒乳腺癌,人抗小鼠抗体,前列腺,甲胎蛋白,肝癌,大肠癌,肺癌,大小便隐血检测,癌胚抗原,β-2微球蛋白等。
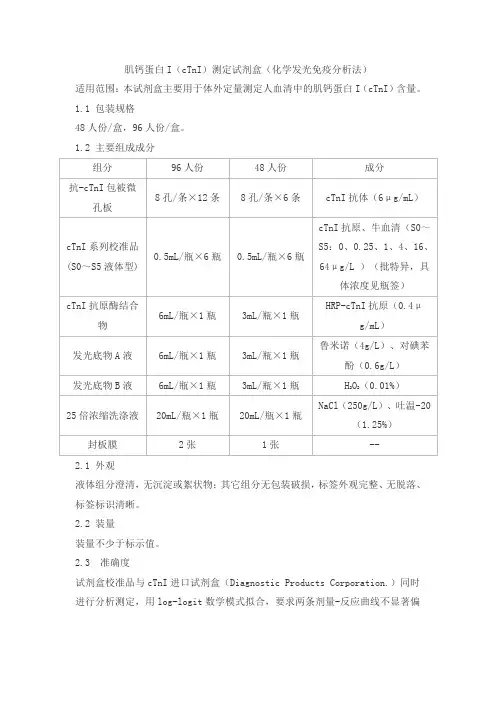
肌钙蛋白I(cTnI)测定试剂盒(化学发光免疫分析法)适用范围:本试剂盒主要用于体外定量测定人血清中的肌钙蛋白I(cTnI)含量。
1.1 包装规格48人份/盒,96人份/盒。
1.2 主要组成成分2.1 外观液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量装量不少于标示值。
2.3 准确度试剂盒校准品与cTnI进口试剂盒(Diagnostic Products Corporation.)同时进行分析测定,用log-logit数学模式拟合,要求两条剂量-反应曲线不显著偏离平行(t-检验);以cTnI进口试剂盒(Diagnostic Products Corporation.)为对照品,其回收率应在90.0%~110%范围内。
2.4 剂量-反应曲线线性相关系数在[0.25,64]μg/L范围内,用log-logit数学模式拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度2.5.1 重复性以同批次试剂盒,高低两种浓度的质控血清平行测定10次,求其平均值和标准差(SD),批内精密度(CV%)=SD/平均值×100%,重复性(CV%)应不高于15.0%;2.5.2 批间差三种不同批次试剂盒,对同一样品进行重复测定10次,计算各组测定结果的平均值和标准差(SD),批间精密度(CV%)=SD/平均值×100%,批间差(CV%)应不高于20.0%。
2.6 最低检出量应不高于0.250μg/L。
2.7 质控血清测定值应在允许的范围之内。
2.8 特异性cTnI与肌红蛋白、肌钙蛋白T (cTnT)、肌酸激酶同工酶的交叉反应如下:2.9 稳定性2.9.1 热稳定性37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 效期稳定性成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与cTnI进口试剂盒(Diagnostic Products Corporation.)比对赋值。

肌钙蛋白I (cTnI)测定试剂盒(胶乳免疫比浊法)说明书【产品名称】肌钙蛋白I(cTnI)测定试剂盒(胶乳免疫比浊法)【包装规格】a)试剂1:1×15mL 试剂2:1×5mL b)试剂1:2×45mL 试剂2:2×15mL c)试剂1:4×60mL 试剂2:4×20mL d)试剂1:2×60mL 试剂2:2×20mL 【预期用途】用于体外定量测定人血清中肌钙蛋白I 的含量。
肌细胞受损时,肌钙蛋白I (cTnI )立即释放入血,在胸痛发生4-6h 后,血中cTnI 水平超过正常上限,12-24h 达高峰,可持续6~10天之久。
由于cTnI 可检出微小心肌损伤,是公认的快速诊断急性心肌梗死和急性冠脉综合症(ACS )[1]。
测定肌钙蛋白I 常用于心肌细胞受损、急性心肌梗死、急性冠脉综合症的辅助诊断。
【检验原理】样本与胶乳试剂在缓冲液中混合后,其中的肌钙蛋白Ⅰ与胶乳颗粒表面的抗体结合,使相邻的胶乳颗粒彼此交联,发生凝集反应产生浊度变化,该浊度变化与样本中的肌钙蛋白的量成正相关。
【主要组成成分】试剂1主要组分磷酸盐缓冲液30mmol/L聚乙二醇(PEG )0.5%表面活性剂及稳定剂适量试剂2主要组分磷酸盐缓冲液30mmol/L抗人肌钙蛋白(cTnI )抗体乳胶颗粒适量表面活性剂及稳定剂适量注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为12个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI 7020型/7060型/7180型/7600型/LABOSPECT 008AS 型;贝克曼AU400/AU480/AU640/AU680/AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR /TBA-2000FR ;罗氏cobas 8000c 702/cobas 8000c 701/cobas 8000c 502;西门子SIEMENS ADVIA 1800/ADVIA 2400;雅培ABBOTT ARCHITECT c8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C ;科华KHB 卓越310/卓越330/卓越400/卓越450/ZY-1200/ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/CS-600A/CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/BS-400/BS-430/BS-600/BS-800/BS-2000M ;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray 420;英诺华D280;特康TC6010L ;锦瑞GS400;普康6066。

肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)说明书【产品名称】通用名称:肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)英文名称:Myoglobin(CLIA)【包装规格】2×30人份/盒、2×50 人份/盒、2×100人份/盒【预期用途】用于体外定量测定人体血清或(与)血浆中肌红蛋白得含量。
肌红蛋白(MYO)分子量为17、8 kD,由一个多肽链与一个亚铁血红素辅基组成,由人体骨骼肌与心肌细胞合成并贮存,不存在于其它细胞。
实验证明由骨骼肌与心肌来源得两种肌红蛋白无免疫学上得差异。
肌红蛋白得主要生理功能为携带氧气供细胞呼吸。
肌红蛋白就是检测急性心肌梗死(AMI) 得早期指标,具有极高得灵敏度但就是特异性较差,在AMI 早期心肌细胞受损,由于MYO得分子量小,可以很快从破损得细胞中释放出来,在AMI发病1~3小时后血中浓度迅速上升,6~7小时达峰值,12 小时内几乎所有AMI 患者MYO 都有升高,升高幅度大于各心肌酶,因此可以作为AMI 得早期诊断标志物。
由于MYO 也存在于骨骼肌中,而且仅从肾脏清除,所以急性肌损伤、急性或慢性肾衰竭、严重得充血性心力衰竭、长时间休克及各种原因引起得肌病患者、肌内注射、剧烈得锻炼、某种毒素与药物摄入后,MYO 都会升高。
因此,采用血清MYO 水平作为诊断AMI得早期指标,仅限于没有上述相关疾病得患者。
在有急性症状得患者中,4小时内MYO 水平不升高,AMI 得可能性极低.由于在AMI 后血中MYO 很快从肾脏清除,发病l8~30 小时内可完全恢复到正常水平.故MYO 测定有助于在AMI病程中观察有无再梗塞或者梗塞再扩展。
MYO频繁出现增高,提示原有心肌梗死仍在延续。
另外,在神经肌肉疾病如肌营养不良、肌萎缩与多肌炎时血清MYO水平亦升高。
心脏外科手术患者血清MY O升高,可以作为判断心肌损伤程度及愈合情况得一项客观指标。
【检验原理】肌红蛋白测定采用双位点夹心化学发光免疫分析法,其检测原理如下:第一步:将样本与包被着抗肌红蛋白抗体得超顺磁性微粒(磁珠)以及抗肌红蛋白抗体—碱性磷酸酶标记物添加到反应管中,经过孵育,样本中得肌红蛋白与包被在磁珠上得抗肌红蛋白抗体结合,同时抗肌红蛋白抗体-碱性磷酸酶标记物与样本中肌红蛋白另一位点结合。
心肌肌钙蛋白I(cTnI)测定试剂盒(化学发光法)适用范围:本试剂盒用于体外定量测定人血清或血浆中心肌肌钙蛋白I(cTnI)的含量。
分说明1.1 包装规格96人份/盒1.2 主要组成成分表1 主要组成成分备注:校准品溯源至美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)颁布的有证标准参考物质(SRM 2921),校准品(A~F)目标浓度为0、0.5、1.4、4.0、18.0、45.0ng/ml。
2.1 外观组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;包装标签应清晰,易识别。
2.2 装量液体装量应不少于标示值。
2.3 准确度在剂量反应曲线检测范围内,用已知浓度的纯品(源自Hytest公司)做回收试验,其回收率应在85~115%范围内。
2.4 线性在线性范围[0.25,45]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限应不大于0.25ng/ml。
2.6 重复性同一次试验中分别重复检测浓度值为1.35±0.33ng/ml、18.83±3.78ng/ml样本10次,其变异系数(CV)应不大于10.0%。
2.7 批间差用3个批号的试剂盒检测浓度值为1.35±0.33ng/ml、18.83±3.78ng/ml样本,3个批号试剂盒之间的批间变异系数(CV)应不大于15.0%。
2.8 分析特异性测定浓度为1000ng/ml 心肌肌钙蛋白C(Cardiac Troponin C,cTnC),交叉反应率小于0.05%。
测定浓度为1000ng/ml 心肌肌钙蛋白T(Cardiac Troponin T,cTnT),交叉反应率小于0.05%。
测定浓度为1000ng/ml 骨骼肌肌钙蛋白I(Skeletal Troponin I,sTnI),交叉反应率小于0.05%。
Triage Cardiac Panel 产品说明肌酸激酶同工酶 MB (Creatine Kinase MB, CK-MB)、肌红蛋白和肌钙蛋白 I 的快速定量检测。
T r i a g e C a r d i a c P a n e l 1符号术语表请参见 q u i d e l .c o m /g l o s s a r y仅供出口。
在美国没有销售。
计用途Q u i d e l T r i a g e C a r d i a c P a n e l 是一种与 Q u i d e l T r i a g e 检测仪合用的荧光免疫分析方法,用于定量测定 E D T A 抗凝全血或血浆样本中的肌酸激酶 M B 同工酶 (C r e a t i n e K i n a s e M B , C K -M B )、肌红蛋白和肌钙蛋白 I 。
该检测用于辅助诊断心肌梗塞(损伤)。
检测概要和说明在许多情况下,诊断出现胸痛的患者是否有急性心肌梗塞 (a c u t e m y o c a r d i a l i n f a r c t i o n ,A M I ) 很困难。
世界卫生组织将与 A M I 相关的胸痛与其它非心脏原因引起的胸痛区分开的三大标准概述为:1) 病史加上体检;2) 心电图数据;3) 与心肌梗塞相关的血清蛋白标志物的改变。
要正确诊断 A M I 必须满足这些标准中的至少两项。
体检常常不能将 A M I 与其它心脏异常区分开来。
心电图可以帮助 A M I 的诊断,但由于其只在大约 50% 的 A M I 患者中具有诊断意义,因此也有局限性。
一般情况下,形成 Q 波及 S T 段 的改变(抬高或压低)提示有 A M I 。
然而,心电图的结果必须与患者的体检和临床病史一起考虑。
即使患者真正发作了 A M I ,心电图在开始时也可能是正常的。
当其它指标可能为阴性或可疑时,血液蛋白标志物在鉴别诊断 A M I 的过程中发挥着重要的作用。
心肌肌钙蛋白I/肌红蛋白/肌酸激酶同工酶检测试剂盒(胶体金免疫层析法)产品技术审评规范(征求意见稿)本审评规范旨在指导注册申请人对心肌肌钙蛋白I/肌红蛋白/肌酸激酶同工酶(以下简称“心梗三项”)检测试剂盒(胶体金免疫层析法)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本审评规范是对心梗三项检测试剂盒(胶体金免疫层析法)的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围心梗三项检测试剂盒(胶体金免疫层析法)是指利用胶体金免疫层析法对人血清、血浆、全血样本的心梗三项指标(包括心肌肌钙蛋白I、肌红蛋白、肌酸激酶同工酶)进行体外定性分析的试剂盒,包括此三项指标的独立检测或任意组合产品。
从方法学考虑,本规范是指利用基于抗原抗体反应原理的胶体金免疫层析法对心梗三项进行检测的体外诊断试剂,不适用于定量或半定量产品。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)(以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管[2013]242号),心梗三项检测试剂盒(胶体金免疫层析法)管理类别为Ⅱ类,分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《国家食品药品监督管理总局关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求,下面着重介绍与心梗三项检测试剂盒预期用途有关的临床背景情况。