肌红蛋白(Myoglobin)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk
- 格式:docx
- 大小:37.45 KB
- 文档页数:2



肌红蛋白(Myo)测定试剂(荧光免疫层析法)
性能指标
1 外观检查
外观应平整,材料附着应牢固,各组份应齐全,卡固定紧密。
2 物理检查
膜条宽应不小于2.0mm;液体移行速度应不低于10mm/min。
3 线性范围
取同一批号的试剂分别对五个浓度的肌红蛋白参考品进行检测,其检测范围为2.0ng/mL~400.0ng/mL,每份参考品重复检测3次,计算相关系数r,其中r值应≥0.9900。
4 精密度
4.1 批内精密度
随机抽取同一批号的试剂10份,分别对同一浓度的肌红蛋白参考品进行检测,其变异系数CV(%)值应≤15%。
4.2 批间精密度
随机抽取连续三个批号的试剂,每个批号取3份分别对同一浓度的肌红蛋白参考品进行检测,其变异系数CV(%)值应≤15%。
5 准确度
用同一批号试剂分别测定三个水平浓度的肌红蛋白参考品,计算样本测定结果均值和相对偏差,其中相对偏差(Bias%)应在±15%内。
6 最低检出限
取同一批号的试剂10份,对配制参考品基质进行检测,计算样本测定结果均值X和标准偏差SD,其中(X+2SD)≤2.0ng/mL。
7 分析特异性
选择同一浓度的肌红蛋白参考品分别加入胆固醇、甘油三酯、胆红素,使干扰物最终浓度胆固醇60mg/mL、甘油三酯40mg/mL、胆红素2mg/mL,各干扰样本重复检测3次,计算样本检测结果的均值和相对偏差,其中相对偏差(Bias%)应在±15%内。

检验科免疫室分析项目作业指导书第页,共页版本:A/0生效日期:2008-02-01 35重复性测定采用的是美国临床化学实验室标准委员会修订稿EP5—A标准方法进行评估,使用了Elecsys试剂及人血清池、质控进行测定:连续测定10天,每天测定6次(n=60次);E170的批内重复性共测定了21次。
结果如下:分析灵敏度(最低检测限):< 21ng/ml,分析灵敏度代表了能与零区别的最低的肌红蛋白值10.干扰因素该方法不受黄疸(胆红素<65mg/dl)、溶血(血红蛋白〈1.4g/dl)、脂血(脂质〈2200mg/dl)和生物素〈50ng/ml 干扰。
接受高剂量生物素(〉5mg/天)治疗的病人,至少要等最后一次摄入生物素8 小时后才能采血。
不受类风湿因子干扰(1500U/ml)。
50 种常用药物经试验对本测定无干扰作用。
肌红蛋白浓度高到30,000ng/ml 也不出现钩状效应.接受过小鼠单抗治疗或体内诊断的病人可能会出现假阳性反应。
肌红蛋白测定结果应结合病人的病史、临床症状和其他检查结果进行诊断。
11.临床意义肌红蛋白是一种细胞浆蛋白质,存在于心脏和骨骼的横纹肌中,具有转运氧气和贮存氧气的功能,分子量17.8kD,由于分子量较小,当肌细胞受损时,肌红蛋白很快被释放进入血循环中。
检测血清肌红蛋白是诊断急性心肌梗死,早期再度梗死以及观察溶栓治疗后成功再灌注的重要指标。
症状发生后约两小时,肌红蛋白水平即可升高,因此肌红蛋白被认为是心肌梗死很早期的标志物.梗死发生后4-12 小时,肌红蛋白的血浓度达到最高值.24 小时后恢复到正常值水平.肌红蛋白升高也可见于骨骼肌损伤和肾功能极度衰竭的病人。
Elecsys 肌红蛋白采用双抗夹心法原理和两种不同的抗肌红蛋白单克隆抗体。
12.参考文献。

2.性能指标
2.1.外观和性状
2.1.1.颜色性状
质控品复融前外观应呈现粉末块状固体,不起泡,不塌陷,复融后应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.1.2.包装
分装瓶应完整无泄漏,盒贴、瓶贴、标签标识、说明书、参考值表应完整、清晰牢固。
2.2.测量准确度
2.2.1.质控参考值表
质控品应可提供一份参考值表,包含适用型号的迈瑞化学发光免疫分析系统
的检测项目参考值及参考范围。
2.2.2.赋值准确性
经校准的迈瑞全自动化学发光免疫分析仪检测质控品所包含的检测项目,结果应在参考范围内(不同批次的质控品参考范围参见参考值表)。
2.3.均一性
2.3.1.瓶内均一性
质控品瓶内均一性应满足变异系数CV≤8.0%。
2.3.2.瓶间均一性
质控品瓶间均一性应满足变异系数CV≤5.0%。
2.4.生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂
灵敏度的检测试剂,对质控品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I型和HIV-II型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
1。


心肌肌钙蛋白I/肌红蛋白/肌酸激酶同工酶检测试剂盒(胶体金免疫层析法)产品技术审评规范(征求意见稿)本审评规范旨在指导注册申请人对心肌肌钙蛋白I/肌红蛋白/肌酸激酶同工酶(以下简称“心梗三项”)检测试剂盒(胶体金免疫层析法)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本审评规范是对心梗三项检测试剂盒(胶体金免疫层析法)的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围心梗三项检测试剂盒(胶体金免疫层析法)是指利用胶体金免疫层析法对人血清、血浆、全血样本的心梗三项指标(包括心肌肌钙蛋白I、肌红蛋白、肌酸激酶同工酶)进行体外定性分析的试剂盒,包括此三项指标的独立检测或任意组合产品。
从方法学考虑,本规范是指利用基于抗原抗体反应原理的胶体金免疫层析法对心梗三项进行检测的体外诊断试剂,不适用于定量或半定量产品。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)(以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管[2013]242号),心梗三项检测试剂盒(胶体金免疫层析法)管理类别为Ⅱ类,分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《国家食品药品监督管理总局关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求,下面着重介绍与心梗三项检测试剂盒预期用途有关的临床背景情况。
肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)说明书【产品名称】通用名称:肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)英文名称:Myoglobin(CLIA)【包装规格】2×30 人份/盒、2×50 人份/盒、2×100 人份/盒【预期用途】用于体外定量测定人体血清或(和)血浆中肌红蛋白的含量。
肌红蛋白(MYO)分子量为17.8 kD,由一个多肽链和一个亚铁血红素辅基组成,由人体骨骼肌和心肌细胞合成并贮存,不存在于其它细胞。
实验证明由骨骼肌和心肌来源的两种肌红蛋白无免疫学上的差异。
肌红蛋白的主要生理功能为携带氧气供细胞呼吸。
肌红蛋白是检测急性心肌梗死(AMI) 的早期指标,具有极高的灵敏度但是特异性较差,在AMI 早期心肌细胞受损,由于MYO 的分子量小,可以很快从破损的细胞中释放出来,在AMI 发病1~3 小时后血中浓度迅速上升,6~7 小时达峰值,12 小时内几乎所有AMI 患者MYO 都有升高,升高幅度大于各心肌酶,因此可以作为AMI 的早期诊断标志物。
由于MYO 也存在于骨骼肌中,而且仅从肾脏清除,所以急性肌损伤、急性或慢性肾衰竭、严重的充血性心力衰竭、长时间休克及各种原因引起的肌病患者、肌内注射、剧烈的锻炼、某种毒素和药物摄入后,MYO 都会升高。
因此,采用血清MYO 水平作为诊断AMI 的早期指标,仅限于没有上述相关疾病的患者。
在有急性症状的患者中,4 小时内MYO 水平不升高,AMI 的可能性极低。
由于在AMI 后血中MYO 很快从肾脏清除,发病l8~30 小时内可完全恢复到正常水平。
故MYO 测定有助于在AMI 病程中观察有无再梗塞或者梗塞再扩展。
MYO 频繁出现增高,提示原有心肌梗死仍在延续。
另外,在神经肌肉疾病如肌营养不良、肌萎缩和多肌炎时血清MYO 水平亦升高。
心脏外科手术患者血清MYO 升高,可以作为判断心肌损伤程度及愈合情况的一项客观指标。

肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒采用化学发光免疫分析法(CLIA)体外定量测定人血清或血浆中肌红蛋白(MYO)的含量。
1.1 包装规格
96人份/盒
1.2 主要组成成分
表1主要组成成分
注:校准品采用贝克曼MYO检测试剂盒(磁颗粒化学发光法)比对赋值,校准品(A~F)目标浓度为0、20、200、1000、2000、3000ng/ml。
2.1 外观
组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;标签应清晰,易识别。
2.2 装量
液体装量应不少于标示值。
2.3 准确度
在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在
85~115%范围内。
2.4 线性
在线性范围 [10,3000]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限
应不大于10ng/ml。
2.6 重复性
变异系数(CV)应不大于10.0%。
2.7 批间差
批间变异系数(CV)应不大于15.0%。
2.8 分析特异性
测定浓度为5mg/ml血红蛋白,交叉反应率小于0.002%。
2.9 稳定性
产品在2~8℃条件下保存有效期为12个月,取到效期产品在1个月内进行检测,检测结果应满足2.3~2.6,2.8项要求。
术语
4.1 CLIA:Chemiluminescent immunoassay化学发光免疫分析
4.2 MYO:Myoglobin肌红蛋白
4.3 RLU:Relative Light Unit相对光单位。

检验科免疫室分析项目作业指导书第页,共页版本:A/0生效日期:2008-02-01 111.分析原理采用双抗夹心法原理,整个过程18分钟完成。
·第1步:15μl标本、生物素化的抗肌红蛋白单克隆抗体和钌(Ru)标记的抗肌红蛋白单克隆抗体混匀,形成夹心复合物。
·第2步:加入链霉亲和素包被的微粒,让上述形成的复合物通过生物素与链霉亲和素间的反应结合到微粒上。
·第3步:反应混和液吸到测量池中,微粒通过磁铁吸附到电极上,未结合的物质被清洗液洗去,电极加电压后产生化学发光,通过光电倍增管进行测定。
Elecsys自动将标本产生的光电信号与从肌红蛋白定标液得出的Cutoff值相比较。
2.标本要求血清:使用标准取样试管或含分离胶的试管采集。
血浆:肝素(锂、钠、铵)、EDTA-K3 、枸橼酸钠抗凝均可。
标本在2-8 度可稳定1 周,-20 度可稳定3 个月。
只可冻融一次。
含沉淀的标本使用前需离心。
标本和质控品禁用叠氮钠防腐。
标本、定标液和质控品在测定前的温度应与室温平衡;放入仪器后应在2小时内测定以避免蒸发的影响。
3.试剂、校准品、质控品和其他所需材料采用罗氏原装配套试剂。
试剂:M:链霉亲和素包被的微粒(透明瓶盖),1瓶,6.5ml。
粒子浓度0.72mg/ml,含防腐剂。
R1:生物素化的抗肌红蛋白单克隆抗体(灰盖),1瓶,10ml,浓度1.75mg/l,磷酸缓冲液85mmol/l,pH6.5, 叠氮钠<0.1%,含防腐剂。
R2:Ru(bpy)32+标记的抗肌红蛋白单克隆抗体(黑盖),1瓶,10ml。
浓度1.75mg/l,磷酸缓冲液85mmol/l,pH 8.5, 叠氮钠<0.1%,含防腐剂。
校准品:Cal 1 阴性定标液(白盖),2*1ml血清, 含防腐剂Cal 2 阳性定标液(黑盖),2*1ml血清,含防腐剂质控品:Elecsys 肌红蛋白质控品1和2 (PreciControl Cardica II)货号03530477其他所需材料:Elecsys2010/cobas e 411分析仪需要Elecsys 系统缓冲液(ProCell)货号11662988Elecsys 测量池清洗液(CleanCell)货号11662970Elecsys 添加剂液(SysWash)货号11930346Elecsys 系统清洗液支架(Adapter for SysClean))货号11933159Elecsys 2010 反应杯(Assay Cup)货号11706802Elecsys 2010 吸样头(Assay Tip)货号11706799E170 /cobas e 601分析仪需要Elecsys 系统缓冲液(ProCell M)货号12135019Elecsys 测量池清洗液(CleanCell M)货号12135027Elecsys 系统缓冲液/测量池清洗液预热杯(PC/CC-Cup)货号03023141探针冲洗液,12x70ml,用于最终保养及完成试剂吸样后冲洗,货号03005712Elecsys 反应杯/吸样头盒(AssayCups/AssayTips Combimagazine M)货号12102137肌红蛋白(Myoglobin)检验科免疫室分析项目作业指导书第页,共页版本:A/0生效日期:2008-02-01 22Elecsys 废物盒(wasteliner)货号03023150Elecsys 系统清洗液支架(SysClean Adapter M))货号03027651各种分析仪均适用的材料Elecsys 系统清洗液(SysClean)货号112985004.仪器和校准使用仪器:瑞士罗氏诊断公司生产Elecsys 2010/E 170/E 411全自动电化学发光免疫自动分析仪仪器校准:每批肌红蛋白试剂盒必须用新鲜试剂和肌红蛋白 Cal 1,Cal 2定标一次。

2性能指标
2.1外观
外观应符合如下要求:
a)磁珠包被物R1摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2应为无色液体,无沉淀或絮状物;样本处理液R3应为无色液体;校准品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
2.2准确度
将具有溯源性的两个正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.3空白限
空白限不大于0.006ng/mL;
2.4线性
试剂盒在0.01ng/mL~50 ng/mL 区间内,其相关系数(r)的绝对值不低于0.9900。
2.5重复性
变异系数CV≤8%。
2.6批间差
变异系数CV≤10%.
2.7分析特异性
测定浓度均为1000ng/mL 的心肌肌钙蛋白C、心肌肌钙蛋白T、骨骼肌肌钙蛋白I,交叉反应率应≤0.1%。
2.8校准品
2.8.1校准品准确度
测定校准品,C1,C2 测定结果的相对偏差在±10%范围内,C0 测定结果的绝对偏差的绝对值不高于0.006ng/mL。
2.8.2校准品瓶内均一性
校准品C1,C2 瓶内均一性≤8%,C0 的SD≤0.006ng/mL。
2.8.3校准品瓶间均一性
校准品C1,C2 瓶间均一性≤5%,C0 的SD≤0.006ng/mL。
一、实验目的1. 学习肌红蛋白的提取方法;2. 掌握肌红蛋白的鉴定方法;3. 了解肌红蛋白的生物学特性。
二、实验原理肌红蛋白(Myoglobin,Mb)是一种含铁的血红素蛋白,主要存在于肌肉组织中,具有储存氧气和释放氧气的作用。
肌红蛋白分子量为16700道尔顿,由153个氨基酸组成,属于单链蛋白质。
本实验通过提取肌红蛋白,并对其进行鉴定,以了解肌红蛋白的生物学特性。
三、实验材料与仪器1. 实验材料:新鲜猪肉、生理盐水、双缩脲试剂、考马斯亮蓝G-250试剂、蒸馏水、氢氧化钠、盐酸、磷酸氢二钠、磷酸二氢钠、硫酸铵等。
2. 实验仪器:研钵、离心机、紫外可见分光光度计、移液器、电子天平等。
四、实验方法1. 肌红蛋白的提取(1)取新鲜猪肉约50g,用生理盐水洗净,去除脂肪和筋膜;(2)将猪肉切成小块,放入研钵中,加入适量生理盐水;(3)研磨至肉泥状,加入适量硫酸铵,搅拌均匀;(4)室温下静置30分钟;(5)离心(3000r/min,10分钟),取上清液;(6)用硫酸铵沉淀肌红蛋白,重复步骤(4)和(5);(7)取沉淀物,用蒸馏水洗涤,离心(3000r/min,10分钟),取上清液;(8)将上清液置于4℃冰箱中保存备用。
2. 肌红蛋白的鉴定(1)紫外可见分光光度法测定肌红蛋白含量①取一定量肌红蛋白溶液,用蒸馏水稀释至适宜浓度;②使用紫外可见分光光度计,在波长540nm处测定吸光度;③根据标准曲线计算肌红蛋白含量。
(2)考马斯亮蓝G-250法测定肌红蛋白含量①取一定量肌红蛋白溶液,用蒸馏水稀释至适宜浓度;②加入考马斯亮蓝G-250试剂,充分振荡;③静置10分钟;④使用紫外可见分光光度计,在波长595nm处测定吸光度;⑤根据标准曲线计算肌红蛋白含量。
五、实验结果与分析1. 肌红蛋白的提取通过硫酸铵沉淀法,成功提取了肌红蛋白,溶液呈红色。
2. 肌红蛋白的鉴定(1)紫外可见分光光度法测定肌红蛋白含量:根据标准曲线,肌红蛋白含量为0.1mg/mL。
肌红蛋白(MYO)测定试剂盒(胶乳免疫比浊法)适用范围:该产品用于体外定量测定人血清或血浆中肌红蛋白的浓度.1.1 产品规格1.2 组成成分1.2.1 试剂组成试剂1:甘氨酸缓冲液 100mmol/L试剂2:抗人肌红蛋白抗体包被的胶乳悬浊液 <0.5%。
1.2.2 校准品的组成六个水平的液体校准品,在50mmol/L pH=7.0的Capso(3-(环己烷)-1-丙磺酸)缓冲液中添加肌红蛋白纯品,稳定剂<0.1%;定值范围:0ng/mL、(50-150)ng/mL、(150-250)ng/mL、(300-500)ng/mL、(600-1000)ng/mL、(1000-1400)ng/mL。
1.2.3质控品的组成两个水平的液体质控品,在牛血清(20g/L)中添加肌红蛋白纯品,稳定剂<0.1%;目标浓度范围在(50-200)ng/mL和(200-500)ng/mL之间。
2.1 外观液体双试剂:试剂1:无色至淡黄色澄清液体;试剂2: 乳白色液体。
校准品:无色至浅黄色透明液体。
质控品:无色至微黄色透明液体。
2.2 净含量不得低于标示体积。
2.3 空白吸光度试剂空白吸光度应≤1.65。
2.4 分析灵敏度浓度为100ng/mL时,吸光度变化应≥0.015。
2.5 线性在[5,1200]ng/mL线性范围内,线性相关系数r 应≥0.990;在[5,100]ng/mL范围内绝对偏差不超过10ng/mL;在(100,1200]ng/mL范围内的相对偏差不超过±10%。
2.6 精密度变异系数(CV)应≤5%。
2.7 批间差不同批号之间测定结果的相对极差应≤10%。
2.8 准确度回收试验:回收率90%-110%。
2.9 质控品赋值有效性测定值在质控靶值范围内。
2.10校准品溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供肌红蛋白校准品的来源、赋值过程以及测量不确定度等内容。
肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)说明书【产品名称】通用名称:肌红蛋白(MYO)测定试剂盒(化学发光免疫分析法)英文名称:Myoglobin(CLIA)【包装规格】2×30人份/盒、2×50 人份/盒、2×100人份/盒【预期用途】用于体外定量测定人体血清或(与)血浆中肌红蛋白得含量。
肌红蛋白(MYO)分子量为17、8 kD,由一个多肽链与一个亚铁血红素辅基组成,由人体骨骼肌与心肌细胞合成并贮存,不存在于其它细胞。
实验证明由骨骼肌与心肌来源得两种肌红蛋白无免疫学上得差异。
肌红蛋白得主要生理功能为携带氧气供细胞呼吸。
肌红蛋白就是检测急性心肌梗死(AMI) 得早期指标,具有极高得灵敏度但就是特异性较差,在AMI 早期心肌细胞受损,由于MYO得分子量小,可以很快从破损得细胞中释放出来,在AMI发病1~3小时后血中浓度迅速上升,6~7小时达峰值,12 小时内几乎所有AMI 患者MYO 都有升高,升高幅度大于各心肌酶,因此可以作为AMI 得早期诊断标志物。
由于MYO 也存在于骨骼肌中,而且仅从肾脏清除,所以急性肌损伤、急性或慢性肾衰竭、严重得充血性心力衰竭、长时间休克及各种原因引起得肌病患者、肌内注射、剧烈得锻炼、某种毒素与药物摄入后,MYO 都会升高。
因此,采用血清MYO 水平作为诊断AMI得早期指标,仅限于没有上述相关疾病得患者。
在有急性症状得患者中,4小时内MYO 水平不升高,AMI 得可能性极低.由于在AMI 后血中MYO 很快从肾脏清除,发病l8~30 小时内可完全恢复到正常水平.故MYO 测定有助于在AMI病程中观察有无再梗塞或者梗塞再扩展。
MYO频繁出现增高,提示原有心肌梗死仍在延续。
另外,在神经肌肉疾病如肌营养不良、肌萎缩与多肌炎时血清MYO水平亦升高。
心脏外科手术患者血清MY O升高,可以作为判断心肌损伤程度及愈合情况得一项客观指标。
【检验原理】肌红蛋白测定采用双位点夹心化学发光免疫分析法,其检测原理如下:第一步:将样本与包被着抗肌红蛋白抗体得超顺磁性微粒(磁珠)以及抗肌红蛋白抗体—碱性磷酸酶标记物添加到反应管中,经过孵育,样本中得肌红蛋白与包被在磁珠上得抗肌红蛋白抗体结合,同时抗肌红蛋白抗体-碱性磷酸酶标记物与样本中肌红蛋白另一位点结合。
高敏肌钙蛋白-I(HS-cTnI)测定试剂盒(化学发光免疫分析法)性能指标1.1试剂条性能指标1.1.1外观试剂条中第7孔内组分应为棕色含固体微粒的液体或含棕色固体沉淀的透明液体;第12孔内化学发光底物应为无色或淡绿色液体;其余皆应为无色透明液体,无悬浮物、无沉淀、无絮状物。
1.1.2空白限应不大于0.008ng/mL。
1.1.3准确度-相对偏差采用肌钙蛋白标准物质进行检测,其相对偏差应在±20%以内。
1.1.4线性区间试剂盒在0.009ng/mL~50ng/mL区间内,其线性相关系数(r)应不小于0.9900。
1.1.5重复性用急性心肌梗死临界值±50%水平的样本,重复检测10次,其变异系数(CV)应不大于10.0%。
1.1.6批间差用3个批号试剂盒分别检测同一份浓度在急性心肌梗死临界值±50%水平的样本,则3个批号试剂盒之间的批间变异系数(CV)应不大于15.0%。
1.1.7分析特异性测定浓度均为1000ng/mL的心肌肌钙蛋白C(cTnC)、心肌肌钙蛋白T(cTnT)、骨骼肌肌钙蛋白I(sTnI),交叉反应率应小于0.1%。
1.2校准品性能指标1.2.1外观校准品CAL1应为白色或浅黄色粉状冻干块;CAL2应为白色或浅黄色粉状冻干块。
校准品复溶液应为淡蓝色液体,无悬浮物、无沉淀、无絮状物。
1.2.2装量校准品复溶液装量偏差应在±10%之内。
1.2.3准确度高敏肌钙蛋白-I(HS-cTnI)校准品,测试结果偏差应在±10%之内。
1.2.4均一性对同一瓶校准品重复10次检测,对同一批次10瓶校准品进行检测,检测瓶内差和批内瓶间差CV应≤10%。
1.3质控品性能指标1.3.1外观质控品应为透明或淡黄色液体。
1.3.2装量质控品装量偏差应在±10%之内。
1.3.3准确度高敏肌钙蛋白-I(HS-cTnI)质控品,测试结果应在靶值范围内。
1.3.4均一性对同一瓶质控品重复10次检测,对同一批次10瓶质控品进行检测,检测瓶内差和批内瓶间差CV应≤10%。
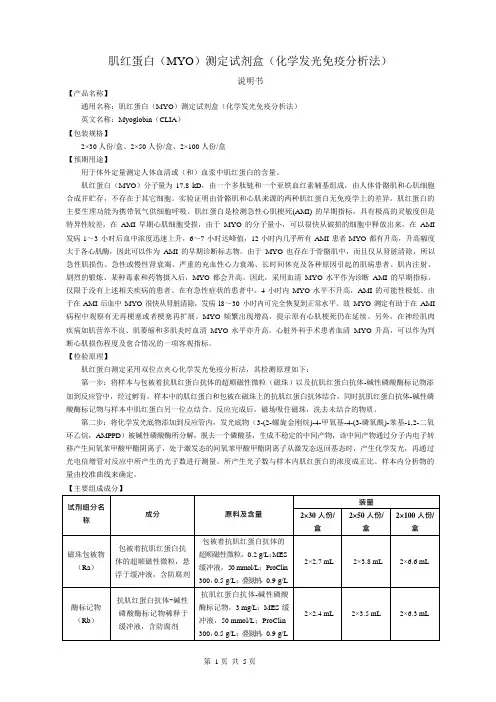
肌红蛋白(Myoglobin)测定试剂盒(电化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人体血清样本中肌红蛋白(Myoglobin)的含量。
1.1产品型号/规格: 50人份/盒、100人份/盒。
1.2主要组成
试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(Myoglobin-Cal)(选配)组成。
组成及含量如下:
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于21.0ng/mL。
2.3 准确度
将已知浓度的Myoglobin样品加入到血清或其它相应基质中,其回收率应在(85%~115%)范围内。
2.4 线性
在[50.0,3000.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度
2.5.1 分析内精密度
在试剂盒的线性范围内,浓度为(100.0±20.0ng/mL)和(1000.0±200.0ng/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度
在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(100.0±20.0ng/mL)和(1000.0±200.0ng/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源到罗氏Myoglobin定标液。