华润三九---工艺规程样板TS-G-GPC-0001-001阿胶配方颗粒工艺规程
- 格式:docx
- 大小:981.38 KB
- 文档页数:14

阿胶颗粒干法制粒工艺研究田守生1,孙四海2,张淹1*,辛杰1,王春艳11. 山东东阿阿胶股份有限公司国家胶类中药工程技术研究中心,山东聊城 2522012. 聊城市人民医院,山东聊城 252000摘要:目的研究阿胶颗粒干法制粒的最佳工艺条件。
方法考察轧轮压力、轧轮转速和送粉速度对颗粒得率的影响,采用L9(34) 正交试验优选阿胶颗粒干法制粒工艺条件。
结果最佳制粒工艺条件为轧辊压力为60~70 kgf/cm2、送粉速度17~19 r/min、轧轮转速为10~12 r/min。
结论阿胶颗粒干法制粒工艺的研究,为阿胶颗粒产业化应用和干法制粒技术在动物类中药中的推广应用提供实验依据。
关键词:阿胶颗粒;干法制粒;正交试验;颗粒得率;动物类中药中图分类号:R283.6 文献标志码:A 文章编号:0253 - 2670(2014)12 - 1714 - 04DOI: 10.7501/j.issn.0253-2670.2014.12.011Study on dry granulation technology for Ejiao granulesTIAN Shou-sheng1, SUN Si-hai2, ZHANG Yan1, XIN Jie1, WANG Chun-yan11. Shandong Dong-E E-Jiao Co., Ltd., National Engineering Technology Research Center of Rubber Medicine, Liaocheng 252201,China2. Liaocheng District People’s Hospital, Liaocheng 252000, ChinaAbstract:Objective To study the optimal technological conditions of Ejiao granules by dry granulation. Methods The effects of rolling wheel press, speed, and powder feeding rate on grain yield were studied, and the dry granulation technology for Ejiao granules was optimized using L9(34) orthogonal test. Results The optimal granulating conditions for the roll pressure was 60—70 kgf/cm2, powder feeding rate was 17—19 r/min, and rolling speed was 10—12 r/min. Conclusion The study on the dry granulation technology for Ejiao granules provides the experimental basis for industrial application and spread of dry granulation technology in Chinese animal medicines.Key words: Ejiao granules; dry granulation; orthogonal test; grain yield; Chinese animal medicine干法制粒技术目前在国际上已广泛应用于制药食品化工等行业[1-2],是采用轮转式干压机或滚筒平压机把药物或药物与辅料混合物压成块状、长条状或片状,然后再粉碎成适合颗粒的制粒方法[3],是一种经济实用的制粒方法[4-5]。

1、目的:规范生产过程和质量控制,以确保产品符合质量标准和达到预定的治疗效果。
2、范围:本规程建立了颗粒生产工艺规程。
本规程适用于颗粒的生产质量管理。
3、职责:质保部负责按本规程实施质量管理、监督。
质检部负责对本规程的原辅料、半成品、成品、包装材料按质量标标准进行监督、验收。
生产部负责按本规程组织生产。
设备部负责对本规程所涉及的设备进行维护、保养。
4、引用标准:中华人民共和国药典(一部)2005版药品生产质量管理规范(GMP)2010修订版质量标准(标准编号:)5、产品概况:5.1 产品名称:汉语拼音:5.2 剂型:本品为颗粒剂。
5.3 规格:每袋装5.0g。
包装规格:5.0g/袋³10袋/盒³200盒/件5.4 性状:本品为颗粒剂,5.5 功能与主治:5.6 用法与用量:5.7 标准处方、投料量及制法5.7.1 标准处方:g制成1000g 5.7.2投料量:以5件(5.0g/袋³10袋/盒³200盒/件)成品计算,所投原辅料的量如下:以50件(5.0g/袋³10袋/盒³200盒/件)成品计算,所投原辅料的量如下:5.7.3 制法:6、生产小儿化痰止咳颗粒工艺流程及生产区域划分(工艺流程图见下页)全处理工艺小儿化痰止咳颗粒工艺流程图:7、生产操作过程及工艺条件7.1 原辅料的预处理7.1.1 拣选:将、拣选出杂质及非药用部分、霉变及虫蛀部分,存放于净药材库备用,挂好状态标志,标明品名、批号、数量、操作人及日期。
7.1.2流浸膏的提取:将所需提取的药材加入渗漉罐,加入药材3倍量的55%的乙醇浸泡48小时后,以每分钟10-30ml的速度进行渗漉,收集初漉液850ml,另器包存,继续渗漉,收集续漉液2000ml,浓缩至稠膏状,加入初漉液,混合后,用55%的乙醇稀释至1000 ml,静置,滤过,即得。
7.1.3 流浸膏的提取:将所需提取的药材加入渗漉罐,加入药材3倍量的55%的乙醇浸泡96小时后,以每分钟40-100ml的速度进行渗漉,收集初漉液850ml,另器包存,继续渗漉,收集续漉液2000ml,浓缩至稠膏状,加入初漉液,混合后,用55%的乙醇稀释至1000 ml,静置,滤过,即得。

速溶阿胶颗粒生产工艺研究于宗斌;彭涛;刘世琪【摘要】目的研究阿胶颗粒的工业化生产工艺.方法采用单因素筛选法确定真空微波膨化技术参数,采用真空微波膨化阿胶制得阿胶粉;通过随机筛选法确定辅料种类和用量;采用正交试验法确定制粒参数.结果最佳工艺条件为阿胶块厚度5 mm 以下,微波加热时间为5 min;阿胶细粉、交联聚维酮、交联羧甲基纤维素钠、硬脂酸镁比例为1000:50:20:1,干法轧辊压力为60 kgf/cm2,送粉速度20 r/min,轧轮转速为10 r/min.结论该研究结果可为规模化生产提供依据.%Objective To study the industrialized production process of Colla Corii Asini Granules. Methods The technical parameters of microwave puffing were determined by the factor selection method, and the Colla Corii Asini power was made by extruding Colla Corii Asini power, the types and dosage of excipients were determined by random screening method, the granulating parameters were deter-mined by orthogonal test. Results The optimum conditions were as follows:the thickness of gelatin was less than 5 mm and the microwave heating time was 5 min. The formulation was Colla Corii Asini powder:the ratio of PVPP:CCMC-Na:MgSt was 1000 :50 :20 :1, the dry roll pressure of the dry roll was 60 kgf/cm2, the powder feeding speed was 20 r/min and the rotation speed was 10 r/min. Conclusion The results provide a basis for large-scale production.【期刊名称】《中国药业》【年(卷),期】2017(026)011【总页数】4页(P19-22)【关键词】阿胶;速溶颗粒;真空微波干燥;制剂处方;干法制粒【作者】于宗斌;彭涛;刘世琪【作者单位】太极集团重庆涪陵制药厂有限公司,重庆 408000;太极集团重庆涪陵制药厂有限公司,重庆 408000;太极集团重庆涪陵制药厂有限公司,重庆 408000【正文语种】中文【中图分类】TQ460.6;R283.6阿胶具有补血止血、滋阴润燥等功效,药食两用,长期服用可补血养血、提高免疫力。

华润三九中药配方颗粒临床不良反应发生率仅0015%华润三九中药配方颗粒是一种广泛使用的中药制剂,经过临床试验和长期的使用,其不良反应发生率非常低,仅为0.015%。
这意味着在临床使用中,只有极少数患者可能会出现不良反应。
以下是对华润三九中药配方颗粒临床不良反应的讨论,同时还将探讨其原因与管理方法。
首先,华润三九中药配方颗粒具有临床应用历史较长的优点,经过多年的临床验证,药物的安全性和有效性得到了广泛认可。
而不良反应的发生率极低,主要是由于其独特的药物组成、制备工艺与质控措施,以及适宜的使用方法所致。
此外,当患者出现不良反应时,也应及时向医疗机构报告,以便进一步分析和评估。
医疗机构应建立完善的药物不良反应报告制度,以及及时反馈系统,及时采取措施,保障患者的用药安全。
1.优质药材和质量控制:华润三九中药配方颗粒选用的是经过严格筛选和鉴定的优质中药材,在质量控制上也有严格的标准和方法。
这些措施可以保证药材的质量稳定,减少药材中有害物质的含量。
2.合理的配方和药物组合:华润三九中药配方颗粒是根据传统中医配方与现代医学知识相结合,经过科学把握的。
药物的配方和组合经过严格筛选和优化,以确保其药效与安全性之间的平衡。
3.临床使用经验和规范:华润三九中药配方颗粒在临床使用中积累了丰富的经验和规范,医务人员能够准确判断患者是否适合使用,以及在使用过程中的监测和调整。
尽管华润三九中药配方颗粒不良反应发生率很低,但仍然需要保持警惕。
医务人员应对患者的用药情况进行评估和监测,及时发现并处理任何可能的不良反应。
同时,患者和医务人员也应重视药物的合理使用,减少不必要的用药风险。
总之,华润三九中药配方颗粒是一种安全有效的中药制剂,其临床不良反应发生率非常低。
通过合理的用药管理和不良反应监测,可以进一步保障患者的用药安全。
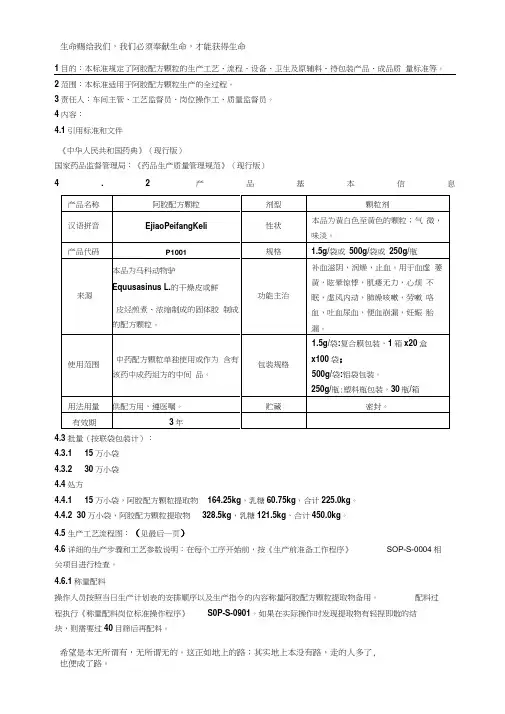
1目的:本标准规定了阿胶配方颗粒的生产工艺、流程、设备、卫生及原辅料、待包装产品、成品质量标准等。
2范围:本标准适用于阿胶配方颗粒生产的全过程。
3责任人:车间主管、工艺监督员、岗位操作工、质量监督员。
4内容:4.1引用标准和文件《中华人民共和国药典》(现行版)国家药品监督管理局:《药品生产质量管理规范》(现行版)4.2产品基本信息4.3批量(按联袋包装计):4.3.1 15万小袋4.3.2 30万小袋4.4处方4.4.1 15万小袋,阿胶配方颗粒提取物164.25kg,乳糖60.75kg,合计225.0kg。
4.4.2 30万小袋,阿胶配方颗粒提取物328.5kg,乳糖121.5kg,合计450.0kg。
4.5生产工艺流程图:(见最后一页)4.6详细的生产步骤和工艺参数说明:在每个工序开始前,按《生产前准备工作程序》SOP-S-0004相关项目进行检查。
4.6.1称量配料操作人员按照当日生产计划表的安排顺序以及生产指令的内容称量阿胶配方颗粒提取物备用。
配料过程执行《称量配料岗位标准操作程序》S0P-S-0901。
如果在实际操作时发现提取物有轻捏即散的结块,则需要过40目筛后再配料。
462混合:把称量好的阿胶配方颗粒提取物加入到混合罐内。
混合参数设置见下表,混合结束后将药粉装于洁净的药用低密度聚乙烯袋内,扎好袋口,贴好标签,注明品名、批号、生产日期、数量等信息。
混合执行《混合岗位标准程序》SOP-S-0903。
生产完毕后,设备清洁执行《料斗型混合设备清洁程序》SOP-I-09064.6.3制粒、整粒:操作人员按照当日的生产计划表的安排顺序取混合后的物料进行干法制粒,参数按照下表设置,开机后操作人员根据压片情况对制粒参数进行调整直至最佳参数点。
制好的颗粒用洁净药用低密度聚乙烯袋装好、密封,并贴上有品名,批号和数量的标签送中间站待用。
制粒过程执行《干法制粒岗位标准程序》SOP-S-0902。
生产完毕后清洁设备执行《颗粒二车间干法制粒岗位设备清洁程序》SOP-I-090-024.6.4复合膜印字:操作人员按照生产安排先制作芯片,然后将芯片装到喷码机上,打开喷码机在面板上输入每袋装量值1.5、颗粒相当于临床使用饮片的当量值2、批号、有效期、生产日期,信息输完试喷检查无误后开始喷印,印字过程中要随时检查印字质量情况,印好的复合膜经复卷机复卷后置于印字内包材间待用,印字执行《喷码岗位操作程序》SOP-S-0904。

1、中药配方颗粒是如何生产的?中药配方颗粒的生产是依据传统中药汤剂的煎煮要求,根据不同品种分别制定生产工艺规程,其基本工艺路线是:优选中药材,炮制加工、提取、浓缩,干燥、制粒、包装、检验。
2、中药配方颗粒与传统汤剂煎煮方法一样吗?中药配方颗粒和传统汤剂煎煮方法相似,是在继承传统汤剂煎煮方法的基础上,结合采用现代科学技术研究生产。
主要表现为:(1)中药配方颗粒的提取工艺是按照传统汤剂的煎药的要求,如加水量、浸泡时间、煎煮次数、先煎、后下、包煎、烊化、溶化、另煎、冲服等。
结合采用现代科学技术手段,研究优化不同中药品种的提取技术参数。
(2)结合现代中药化学、中药药理、中药制药最新研究成果,对研究明确的脂溶性有效成分,采用水提取结合乙醇提取、超临界二氧化碳萃取等技术,充分提取有效成分。
(3)对于传统药材粉末入药的品种,采用超微粉碎技术,达到了细胞破壁,快速发挥药效。
(4)在颗粒制造过程中,采用浸膏粉直接干法造粒,不加赋型剂,部分品种确实需要加入赋型剂的,也是尽量少加。
因此中药配方颗粒和其他冲剂不同,现在临床上使用的冲剂和颗粒剂都是含有较多的糖和辅料,而配方颗粒不含糖,部分品种含辅料也是少量的,保证了中药原有的药性和药效。
3、生产上如何体现“先煎”?先煎是要求增加药物的煎煮时间,目的是为了增加有效成分在水中的溶出,降低药物的毒性,充分发挥药效。
如石膏、煅自然铜等矿石类;石决明、牡蛎等贝壳类;龟甲、鳖甲等角甲类药物;乌头、附子等有毒的药物;石斛、天竹黄等。
该类配方颗粒的生产工艺研究,是通过正交实验的方法优化工艺参数,如石斛需要煎煮2次,共4小时,龟甲砂炒破碎,加水煎煮2次,共10小时,这是家庭煎煮无法做到的。
4、那些品种“先煎”?先煎的品种主要有:龟甲、鳖甲、石膏、煅自然铜、代赭石、寒水石、龙骨、紫石英、牡蛎、石决明、川乌、草乌、附子、石斛、天竹黄、滑石、磁石、珍珠母、阳起石、赤石脂等。
5、生产上如何体现“后下”?后下是要求减少药物的煎煮时间,目的是为了减少挥发油的损耗和免于有效成分分解破坏。

阿胶生产工艺规程xxxxxxxxxxxxxxx有限公司1 产品概述1.1 【产品名称】阿胶汉语拼音 Ejiao1.2 【批准文号】蠡卫食字(2005)第0412180号1.3 【注册商标】“XXX”1.4 【剂型】胶剂1.5 【产品特点】1.5.1 性状:阿胶为长方形或方形块,黑褐色,有光泽。
质硬而脆,断面光亮,碎片对光照视呈棕色半透明状,气微,味微甘。
1.5.2 主要成份:驴皮胶1.5.3 用法用量:烊化兑服,3-9g。
1.5.4 规格:31.25g/块。
1.5.5 贮藏:密闭,置阴凉干燥处。
1.5.6 保质期: 5年。
1.5.7 性味与归经:甘、平。
归肺、肝、肾经。
1.6 历史沿革阿胶最早载于《神农本草经》,被列为上品:历代本草皆有阿胶记载,药学巨著《本草纲目》称之为“圣药”。
据考证,阿胶已有两千多年的生产历史,明清达到鼎盛时期,并形成较大制胶作坊“邓氏树德堂”、“涂氏怀德堂”从事熬胶兼行医,由于借助了临床经验,在长期实践中,不断改进工艺、提高疗效,所产阿胶色质俱佳。
“邓氏树德堂”生产的阿胶在咸丰年间作为皇宫用胶,又称“贡胶”。
1963年,阿胶质量标准收人《中国药典》(1963年版),以后,其质量标准收人历版《中国药典》,至今。
2002年,阿胶被国家列入药食同用品种目录,即“既是食品又是药品的品种名单”中。
2 处方和依据 2.1 处方原料:驴皮1000克 辅料:冰糖40克 大豆油:24克 黄酒:10克 制成阿胶500克。
2.2 处方依据:《中华人民共和国药典》2005年版一部第130页。
3 工艺流程凝 胶 切 胶 晾 胶擦胶、验胶、印字、灭菌内包装4 原药材的炮制4.1 领料:依生产部开写的生产指令和原料领料单领取原料驴皮。
双人复核原料质量、称重数量、进厂编号与实物是否相符,是否符合本厂对原料驴皮的有关规定,核对无误后,双人签字。
4.2 浸泡将驴皮投入浸泡池内加水浸泡,浸泡过程中每天按规定换水。

阿胶颗粒标准拼音名:Ejiao Keli英文名:书页号:X11-11标准编号:WS3-88(Z-13)-96(Z)批准文号:(92)卫药准字Z-01号本品为阿胶经干燥、粉碎,制成的颗粒。
【性状】本品为棕色颗粒或粉末;气香,味微甘。
【检查】水分取本品1g,精密称定,照水分测定法(中国药典1995年版一部附录ⅨH烘干法)测定,不得过7.0%。
总灰分取本品1g,精密称定,照灰分测定法(中国药典1995年版一部附录ⅨK)测定,不得过1.1%。
重金属砷盐应符合阿胶项下有关的各项规定(中国药典1995年版一部513页)。
挥发性碱性物质精密称取本品5g,置100ml量瓶中,加水使溶解并稀释至刻度,摇匀,精密量取5ml置凯式蒸馏瓶中,立刻加1%氢氧化镁混悬溶液5ml,迅速密塞,通入水蒸气进行蒸馏,以2%硼酸溶液5ml为接收液,加甲基红-溴甲酚绿混合指示液5滴,从滴出第一滴凝结水珠时起,蒸馏7分钟停止,馏出液照氮测定法(中国药典1995年版一部附录ⅨL第二法)滴定,即得。
本品100g中挥发性碱性物质的含量以氮(N)计不得过100mg。
粒度取本品5袋,应能全部通过一号筛。
其他应符合颗粒剂项下有关的各项规定(中国药典1995年版一部附录IC)。
【含量测定】取本品0.2g,精密称定,照氮测定法(中国药典1995年版一部附录ⅨL第一法)测定,即得。
本品总氮含量不得少于13.0%。
【功能与主治】补血滋阴,润燥,止血。
用于血虚萎黄,眩晕心悸,肌痿无力,心烦不眠,虚风内动,肺燥咳嗽,劳嗽咯血,吐血尿血,便血崩漏,妊娠胎漏。
【用法与用量】开水冲服,3~8g。
【规格】每袋装8g;4g【贮藏】密封,防潮。
【使用期限】2年。

核心竞争力分析1、品牌优势公司在自我诊疗市场具有较强的品牌运作经验,坚持围绕消费者为核心进行品牌沟通及品牌打造,并通过并购专业品牌,已经拥有包括“999”、“天和”、“顺峰”在的广受消费者认可的产品品牌,公司“1+N”品牌策略获得较好的落实。
“999”品牌在消费者和医药行业中均享有较高的认可度,“999”商标多次被国家权威机构评为“中国最高认知率商标”、“中国最有价值品牌”。
在WPP发布的《2014最具价值中国品牌100强》排行榜中,公司位列榜单第44位。
2、产品优势公司拥有丰富的产品线,其中自我诊疗业务覆盖了感冒、皮肤、胃肠、止咳、骨科等近10个品类,处方药业务品种覆盖了抗肿瘤、心血管及消化等治疗领域。
2014年公司拥有年销售额过亿元的品种15个,产品线较为丰富。
同时,公司非常重视专利技术的开发和获得,通过专利保护、国家中药保护品种等方式构建核心产品知识产权保护体系,确保公司产品保持长期稳定的市场优势。
3、渠道终端优势强大的渠道管理和终端覆盖是公司的核心优势之一,公司拥有一支管理成熟的销售队伍,自我诊疗业务方面,覆盖了除外几乎所有省、市和地区,与全国最优质的经销商和连锁终端广泛合作,通过KA、直控、商控三大平台的建设,不断扩大终端的覆盖。
处方药方面,公司近年顺应国家医改政策,向下延伸至县级医院和基层医疗机构,积极拓展基层医疗市场,相关业务进展顺利,并取得良好效果。
公司未来将继续加强与连锁客户的战略合作伙伴关系,通过持续的优化渠道和终端管理,进一步提升客户满意度,促进公司产品更深和更广的覆盖。
公司未来发展的展望企业文化1.文化理念:企业使命:专注药品制造,关注大众健康,打造信赖品牌企业愿景:致力成为自我诊疗引领者,中药处方药创新者企业核心价值观:诚实守信是华润三九的核心价值观。
华润三九倡导全面的诚信观,诚信于股东、诚信于客户、诚信于员工、诚信于社会。
企业价值理念:关爱大众健康,提供更加安全有效的健康产品及服务,履行社会责任,企业公民建设,追求卓越绩效,企业导向文化。
三九三七粉配方颗粒的优势分析
罗桂贤;刘玥欣;叶豆丹
【期刊名称】《吉林中医药》
【年(卷),期】2017(037)005
【摘要】目的通过观察性状及实验分析等办法比较不同批次三九三七粉配方颗粒,揭示三九三七粉配方颗粒的优势.方法通过比较10种不同来源的三七药材总皂苷的含量,并且结合售价,确定三九三七粉配方颗粒的药材用料.选择五个厂家的13个批次的三七粉配方颗粒,从性状、薄层分析、含量测定等方面进行比较分析,观察三九三七粉配方颗粒是否优于其他厂家.结果三九三七粉配方颗粒选择企业大生产饮片,性价比高.通过观察,三九三七粉配方颗粒性状优于其他厂家.薄层分析显示,各个厂家的颗粒均符合标准要求.含量测定表明,华润三九三七粉配方颗粒当量为1.5,相当于1 g饮片的含量范围为115.2~126.4 mg,远高于其他竞品.结论本研究应用的方法简便易行,通过比较分析,三九三七粉配方颗粒的优势体现在药材性价比高,性状佳,总皂苷含量高,适合作为招标样品展示.
【总页数】5页(P520-524)
【作者】罗桂贤;刘玥欣;叶豆丹
【作者单位】吉林市中心医院,吉林吉林 132011;长春中医药大学,长春 130117;长春中医药大学,长春 130117
【正文语种】中文
【中图分类】R917
【相关文献】
1.中药配方颗粒的优势、不足及前景分析 [J], 杜毅;孙传花
2.中药配方颗粒的优势与劣势分析 [J], 庄俊嵘;徐德生;刘力;金培琪
3.枇蝉止嗽散三九配方颗粒治疗外感咳嗽50例 [J], 应武江
4.中药配方颗粒的应用优势及在某院的使用情况分析 [J], 郝建萍
5.中药配方颗粒在现代中药房管理的优势与问题分析 [J], 张小龙
因版权原因,仅展示原文概要,查看原文内容请购买。
复方阿胶颗粒剂的制备工艺与初步稳定性研究
易军;蔡育彬;周基清
【期刊名称】《广东药学院学报》
【年(卷),期】2013(029)006
【摘要】目的制备复方阿胶颗粒剂,并初步确定其贮存条件.方法以颗粒的休止角、成型性、溶化性、堆密度为指标,通过正交试验筛选颗粒剂的工艺,并通过影响因素
试验确定样品的稳定性及贮存条件.结果工艺筛选结果为:以体积分数90%乙醇制粒,过14目筛,以质量分数5% MCC(PH-200)为助流剂;在优选的工艺条件下,颗粒
的休止角大于30°,成型性约为98%,溶化率大于93%,堆密度小于0.3g·mL-1;影响因素试验结果表明,本品对高温和强光稳定,但对环境湿度较为敏感.结论筛选得到
的复方阿胶颗粒剂制备方法简便可行,建议密闭、置干燥阴凉处保存.
【总页数】4页(P584-587)
【作者】易军;蔡育彬;周基清
【作者单位】广东药学院药科学院,广东广州510006;;广州托吾泰生物科技有限公司,广东广州510620
【正文语种】中文
【中图分类】R944.2+7
【相关文献】
1.复方解酒颗粒剂的制备工艺研究 [J], 杨烁;杨敏
2.复方红芪促睡眠颗粒剂制备工艺研究 [J], 程晨;王燕萍;白瑞斌;张静;杨扶德;胡芳
弟
3.正交试验优选复方威茯方提取工艺及其颗粒剂制备工艺研究 [J], 黄丽贞;邓家刚;谢滟;黄慧学;杨玲玲
4.复方红芪促睡眠颗粒剂制备工艺研究 [J], 程晨;王燕萍;白瑞斌;张静;杨扶德;胡芳弟;;;;;;;
5.中药复方催情颗粒剂的制备工艺优化 [J], 苏圆圆;杨耀森;尹薪项;杨艳艳;褚秀玲因版权原因,仅展示原文概要,查看原文内容请购买。
1 目的:本标准规定了阿胶配方颗粒的生产工艺、流程、设备、卫生及原辅料、待包装产品、成品质量标准等。
2 范围:本标准适用于阿胶配方颗粒生产的全过程。
4 内容:
4.1 引用标准和文件
《中华人民共和国药典》(现行版)
国家药品监督管理局:《药品生产质量管理规范》(现行版)
4.3批量(按联袋包装计):
4.3.1 15万小袋
4.3.2 30万小袋
4.4处方
4.4.1 15万小袋,阿胶配方颗粒提取物164.25kg,乳糖60.75kg,合计22
5.0kg。
4.4.2 30万小袋,阿胶配方颗粒提取物328.5kg,乳糖121.5kg,合计450.0kg。
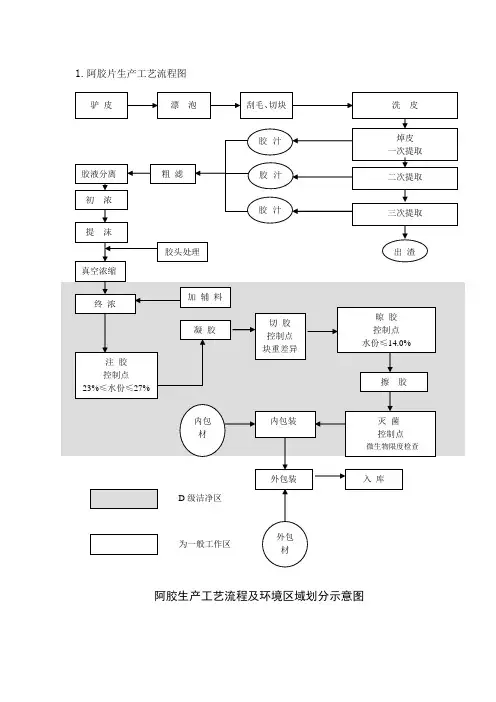
4.5工艺流程图:详见附件一《阿胶配方颗粒生产工艺流程图》。
4.6详细的生产步骤和工艺参数说明:在每个工序开始前,按《生产前准备工作程序》(编号:SOP-S-TY-0003)相关项目进行检查。
4.6.1称量配料:
操作人员按照当日生产计划表的安排顺序以及生产指令的内容称量阿胶配方颗粒提取物以及乳糖备用。
配料过程执行《配方颗粒称量配料岗位标准操作程序》(编号:SOP-S-FS-0001)。
如果在实际操作时发现提取物有轻捏即散的结块,则需要过40目筛后再配料。
4.6.2 混合:
把称量好的阿胶配方颗粒提取物加入到混合罐内。
混合参数设置见下表,混合结束后将药粉装于洁净的药用低密度聚乙烯袋内,扎好袋口,贴好标签,注明品名、批号、生产日期、数量等信息。
混合执行《配方颗粒混合岗位标准操作程序》(编号:SOP-S-FS-0002)。
生产完毕后,设备清洁执行《颗
4.6.3制粒、整粒:
操作人员按照当日的生产计划表的安排顺序取混合后的物料进行干法制粒,参数按照下表设置,开机后操作人员根据压片情况对制粒参数进行调整直至最佳参数点。
制好的颗粒用洁净药用低密度聚乙烯袋装好、密封,并贴上有品名,批号和数量的标签送中间站待用。
制粒过程执行《配方颗粒制粒岗位标准操作程序》(编号:SOP-S-FS-0003)。
生产完毕后清洁设备执行《颗粒二车间干法制粒岗位设
4.6.4 复合膜印字:
操作人员按照生产安排先制作芯片,然后将芯片装到喷码机上,打开喷码机在面板上输入每袋装量值1.5、颗粒相当于临床使用饮片的当量值2、批号、有效期、生产日期,信息输完试喷检查无误后开始喷印,印字过程中要随时检查印字质量情况,印好的复合膜经复卷机复卷后置于印字内包材间待用,印字执行《配方颗粒喷码岗位标准操作程序》(编号:SOP-S-FS-0004)。
生产完毕后,设备清洁执行《颗粒剂二车间喷码岗位设备清洁标准操作程序》(编号:SOP-S-FI-0004)。
4.6.5内包装
4.6.
5.1联袋包装:
4.6.
5.1.1包装规格:1.5克/袋
4.6.
5.1.2颗粒包装机操作工按照分配的任务从中间站领用合格待包颗粒和相应的印好字的复合膜进行内包装,包装机加热温度设置:横封220±40℃;纵封200±40℃。
产品包装执行《配方颗粒内包装岗位标准操作程序》(编号:SOP-S-FS-0005)。
生产完毕后,设备清洁执行《颗粒剂二车间颗粒
包装机清洁标准操作程序》(编号:SOP-S-FI-0005)。
4.6.
5.2大包装:
4.6.
5.2.1包装规格:500克/袋。
4.6.
5.2.2领到该包装任务的操作人员,从车间统计员处领取打印有品名、批号、规格等信息的条码和包装袋,待包颗粒。
在袋上贴好条码,将称好的颗粒倒入袋中,然后真空包装,真空包装机设定中温,抽真空时间6—15秒,抽气完毕,打开机盖,取出药包。
重复操作直至包完。
全部包完后装箱入库。
产品包装执行《配方颗粒真空包装岗位标准操作程序》(编号:SOP-S-FS-0011)。
生产完毕后,设备清洁执行《颗粒剂二车间DZQ-500真空包装机清洁标准操作程序》(编号:SOP-S-FI-0008)。
4.6.
5.3瓶装
4.6.
5.3.1包装规格:250克/瓶
4.6.
5.3.1领到该包装任务的操作人员,从车间统计员处领取打印有品名、批号、规格等信息的标签,从中间站领取塑料瓶和待包颗粒。
摆瓶,上料,开动生产线,速度控制在60瓶/分钟以下。
在生产尾端出口处,给每个瓶子贴上标签,每30瓶装成一箱,打包,一批生产完后入库。
产品包装执行《配方颗粒(瓶装)灌装工序岗位标准操作程序》(编号:SOP-S-FS-0009)。
生产完毕后,设备清洁执行《颗粒剂二车间配方颗粒(瓶装)灌装生产线清洁标准操作程序》(编号:SOP-S-FI-0007)。
4.6.6联袋包装装盒、热收缩膜、装箱、打包:
4.6.6.1包装规格: 1箱x20盒x100袋。
4.6.6.2打印标签:车间统计员按照待包装量打印大小标签。
每盒2张小标签,每箱1张大标签。
4.6.6.3装盒操作人员在纸盒规定位置处贴两张产品小标签,每盒装100袋,包装时注意检查待包装物的质量,对不符合质量要求的要进行剔除。
包装好的小盒放到传送带上,送至收缩膜机、开箱机、装箱机、封箱机、打包联线起点处自动进行收膜、装箱、打包,不成箱的零头手工装箱,贴好标签,不够一盒的药包由车间工艺监督员在本批包装结束后计数销毁。
标签打印执行《配方颗粒标签打印岗位标准操作程序》(编号:SOP-S-FS-0006),外包执行《配方颗粒外包装工序岗位标准操作程序》(编号:SOP-S-FS-0007),热收缩、装箱和打包执行《配方颗粒收缩膜、装箱和打包岗位标准操作程序》(编号:SOP-S-FS-0008)。
4.6.6.4给打包好的大箱贴上用于运输和储存的大标签,将贴好标签的成品和不成箱的零头入库待检。
4.6.7以上生产过程中产生的不合格的中间品、待包装产品、成品等按照《颗粒剂二车间不合格的中间产品、待包装产品、成品的处理标准操作程序》(编号:SOP-S-FS-0010)来处理。
4.7关键工序控制点
4.8经济技术指标
4.12原辅料、包装材料、成品容器、待包装产品和成品质量标准:详见附件二《原辅料、包装材料、成品容器、待包装产品和成品质量标准》。
4.13印刷包装材料的实样,产品批号、生产日期、有效期打印位置:详见附件三《印刷包装材料的实样,产品批号、生产日期、有效期打印位置》。
4.16车间组织机构图:
5 附件:
5.1附件一,阿胶配方颗粒生产工艺流程图;
5.2附件二,原辅料、包装材料、成品容器、待包装产品和成品质量标准; 5.3附件三,印刷包装材料的实样,产品批号、生产日期、有效期打印位置。
6相关记录:
6.1中药配方颗粒生产指令(惠州) SOR-TS-G-HPC-0001-01 6.2中药配方颗粒包装指令(惠州) SOR-TS-G-HPC-0001-02 6.3瓶装配方颗粒包装指令(惠州) SOR-TS-G-HPC-0001-03 6.4中药配方颗粒批生产汇总评价表(惠州) SOR-TS-G-HPC-0001-04
附件一,阿胶配方颗粒生产工艺流程图:
D 级
附件三,印刷包装材料的实样,产品批号、生产日期、有效期打印位置中药配方颗粒连袋装包装材料实样:
中药配方颗粒纸盒实样:
中药配方颗粒瓶装实样:
产品合格证(样图),
包括品名、临床当量、
批号、生产日期、有效
期至、规格、产地的不
干胶条码此处贴带有品名、规格、条形码、批号、生产日期、有效期至、产地的不干胶条码
此处贴带有品名、规格、条形码、批号、生产日期、有效期至、产地的不干胶条码。