天津大学无机化学考试试卷
- 格式:pdf
- 大小:60.04 KB
- 文档页数:5

天津大学22春“药学”《无机化学》期末考试高频考点版(带答案)一.综合考核(共50题)1.用何种试剂可以分离Zn²⁺、Al³⁺?()A.NaOHB.氨水C.Cl⁻D.S²⁻参考答案:B2.当一个化学反应处于平衡时,则()。
A.平衡混合物中各种物质的浓度都相等B.正反应和逆反应速率都是零C.反应混合物的组成不随时间而改变D.反应的焓变是零参考答案:C3.下列各组离子化合物的晶格能变化顺序中,正确的是()。
A.B.C.D.参考答案:B4.分子间力的本质是()。
A.化学键B.电性作用C.磁性作用D.原子轨道重叠参考答案:B5.下列晶体熔点高低顺序正确的是()。
A.B.C.D.参考答案:D6.下列哪个物质可形成分子晶体?()A.H₂SB.KClC.SiD.Pt参考答案:A7.C和H形成CH₄时,H原子的1s轨道和C原子的3个2p轨道杂化形成4个sp³杂化轨道成键的。
()A.正确B.错误参考答案:B8.已知反应式中,下列叙述中不正确的是()。
A.恒温、恒容条件下,压入氖气,化学平衡不移动B.上述反应为放热反应C.增大体系的总压,平衡发生移动D.增大二氧化碳的浓度,平衡向正反应方向移动参考答案:B9.按照鲍林轨道近似能级图,下列各能级中,能量由低到高顺序正确的是()。
A.3d,4s,4p,5sB.4s,5d,6s,7fC.4f,5d,6s,6pD.6s,4f,5d,6p参考答案:D10.电极电势不能判别的是()。
A.氧化还原反应的快慢B.氧化还原反应方向C.氧化还原能力的相对大小D.氧化还原反应的限度参考答案:A11.下列陈述中错误的是在一定温度下,将 1.00mol的SO₃放在 1.00L的密闭容器中,反应2SO₂(g)+O₂(g)=2SO₃(g)达到平衡时,SO₂为0.60mol,则反应的Kc为多少mol/L?()A.2.8B.2.2C.1.5D.1.9参考答案:C12.欲使Mg(OH)₂溶解,可加入()。
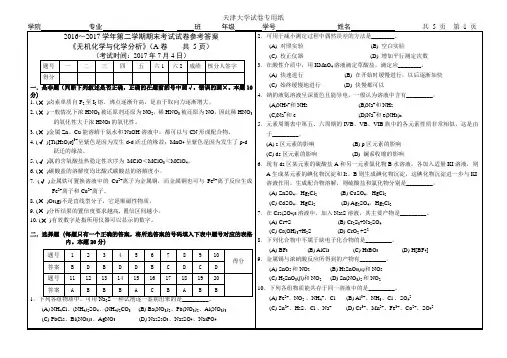
11.下列金属硫化物中,可溶于稀盐酸的是______。
(A) ZnS (B) PbS (C) CuS (D) Ag2S12. 下面三种物质热稳定性顺序正确的是______。
(A) NH4HCO3<Na2CO3<Ag2CO3 (B) NH4HCO3<Ag2CO3<Na2CO3(C) Na2CO3<NH4HCO3<Ag2CO3 (D)Ag2CO3<NH4HCO3<Na2CO313.下列关于硼酸结构的叙述错误的是_______.(A) 硼酸为白色片状晶体,其结构单元为平面三角形的B(OH)3(B) 硼原子通过sp3杂化轨道与三个OH基团成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系14.仅用一种试剂就可以将Ag+, Hg2+, Zn2+, Fe3+, Ni2+ 5种离子区分开,这种试剂可选用_________。
(A) NaCl(B) NaOH (C) K2SO4 (D)H2SO415. 下列有关碱金属过氧化物性质的描述不正确的是_________。
(A)过氧离子中的O-O键不如氧分子中的O-O键牢固(B)碱金属过氧化物具有氧化性(C)碱金属过氧化物具有还原性(D)碱金属过氧化物与冷水反应可生成H2O2, 所以H2O2可看作过氧离子的共轭酸16. 向下列溶液中加入AgNO3溶液,析出黑色沉淀的是_________。
(A)H3PO4(B) NaH2PO4(C) H3PO2(D) Na2H2P2O717. 下列说法不正确的是_________。
(A)还原性HClO4 > HClO3 > HClO(B)热稳定性NaClO > NaClO3 > NaClO4(C)氧化性NaClO >> NaClO3 > NaClO4(D)酸性HClO4 > HClO3 > HClO18. 有关HgCl2和Hg2Cl2的描述不正确的是_________。
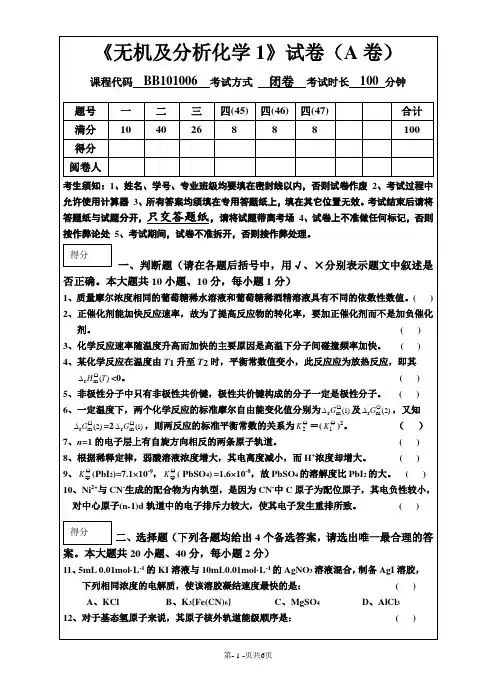

天津大学无机化学考试试卷(下册)答案一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)(每小题1分,共10分)1、( X)在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
2、( X)SnS溶于Na2S2溶液中,生成硫代亚锡酸钠。
3、( X )磁矩大的配合物,其稳定性强。
4、( X)氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。
5、( √)已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
6、( √)如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X)硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO4-可以被OH-还原为MnO42-。
9、( √)配合物Na3[Ag(S2O3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
10、( X)Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分)1、在下列各种酸中氧化性最强的是............... ( B)。
(A)HClO3;(B)HClO;(C)HClO4;(D)HCl。
2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是............... ( C)。
(A)浓HCl;(B)浓H2SO4;(C)浓H3PO4;(D)浓HNO3。
3、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D)。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金. ............... ( C)。
(A)机械强度大;(B)熔点高;(C)具有记忆性能;(D)耐腐蚀。

无机化学要求:一、独立完成,下面五组题目中,请任选其中一组题目作答,满分100分; 二、答题步骤:1. 使用A4纸打印学院指定答题纸(答题纸请详见附件);2. 在答题纸上使用黑色水笔....按题目要求手写..作答;答题纸上全部信息要求手写,包括学号、姓名等基本信息和答题内容,请写明题型、题号; 三、提交方式:请将作答完成后的整页答题纸以图片形式依次粘贴在一个.......Word .... 文档中...上传(只粘贴部分内容的图片不给分),图片请保持正向、清晰; 1. 上传文件命名为“中心-学号-姓名-科目.doc ” 2. 文件容量大小:不得超过20MB 。
提示:未按要求作答题目的作业及雷同作业,成绩以....................0.分记..!题目如下: 第一组:一、填空题(本题共10分)1. 用电对MnO 4-/Mn 2+,Cl 2/Cl -设计成原电池,其负极反应为 ,正极反应为 ,电池符号为 。
( E (MnO 4-/Mn 2+)=1.51V ; E (Cl 2/Cl -)=1.36V )2. 下列氧化剂:KClO 3、Br 2、FeCl 3、KMnO 4,当其溶液中H +浓度增大时,氧化能力增强的是 。
3. KCN ,NH 4F ,NH 4OAc ,NH 4NO 3,Na 2CO 3,各溶液浓度均为0.1 mol·L -1,按pH 值从小到大顺序排列 。
(已知: K (NH 3·H 2O) =1.8×10-5, K (HF)=6.6×10-4, K (HCN)=6.2×10-10,K (HOAc)=1.8×10-5, 1K (H 2CO 3)=4.4×10-7, 2K (H 2CO 3)=4.8×10-11)4. 2NH 3(g)N 2(g) + 3H 2(g),已知298 K 时, m H r ∆= 92.22 kJ·mol -1,m S r ∆ =198.53 J·mol -1·K -1,则标准状态下,NH 3(g)自发分解的温度是____ ___K 。

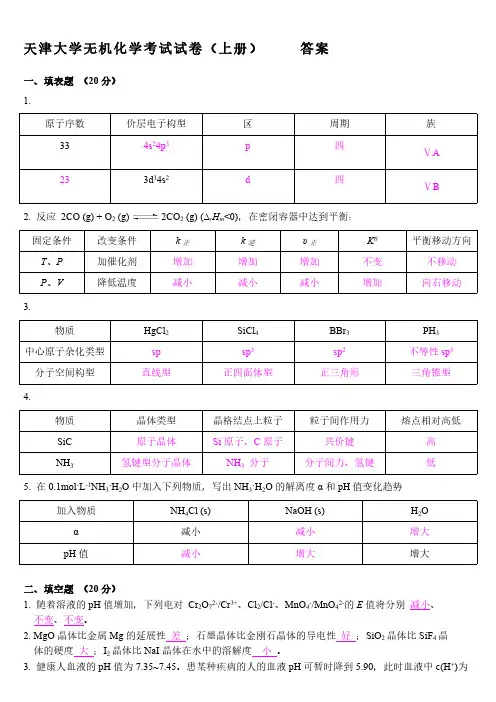
天津大学无机化学考试试卷(上册)答案天津大学无机化学考试试卷答案一、填表题 1. 原子序数33 23 2. 反应2CO (g) + O2 (g) 固定条件T、P P、V 3. 物质中心原子杂化类型分子空间构型 4. 物质SiC NH3 晶体类型原子晶体氢键型分子晶体晶格结点上粒子Si原子、C原子NH3 分子粒子间作用力共价键分子间力、氢键熔点相对高低高低HgCl2 sp 直线型SiCl4 sp3 正四面体型BBr3 sp2 正三角形PH3 不等性sp3 三角锥型改变条件加催化剂降低温度价层电子构型4s24p3 3d34s2 区p d 周期四四族ⅤA ⅤB 2CO2 (g) (?rHm k正增加减小k 逆增加减小υ正增加减小Kθ 不变增加平衡移动方向不移动向右移动 5. 在?L-1NH3?H2O中加入下列物质,写出NH3?H2O的解离度α和pH值变化趋势加入物质α pH值二、填空题 1. 随着溶液的pH值增加,下列电对Cr2O72-/Cr3+、Cl2/Cl-、MnO4-/MnO42-的E值将分别减小、不变、不变。
2. MgO晶体比金属Mg 的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比SiF4晶体的硬度大;I2晶体比NaI晶体在水中的溶解度小。
3. 健康人血液的pH值为~。
患某种疾病的人的血液pH可暂时降到,此时血液中c(H+)为正常状态的28~35 倍。
4. 已知B2轨道的能级顺序为σ1sσ*1sσ2sσ*2sπ2pyπ2pzσ2pxπ*2pyπ*2p zσ*2px,则B2的分子轨道分布式为NH4Cl (s) 减小减小NaOH (s) 减小增大H2O 增大增大(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(π2py)1(π2pz) 1,成键数目及名称两个单电子π键,价键结构式为强的是PbO2 ,还原性最强的是Sn2+ 。
??H?6. 表示?rHm=fm(AgBr, s)的反应式为Ag(s) + 1/2 Br2(l) → AgBr(s) 。

第5章 原子结构与元素周期性一、选择题1.一基态原子的第五电子层只有2个电子,则该原子的第四电子层电子数可能为()。
[北京科技大学2010研]A.8B.18C.8~18D.18~32【答案】C【解析】根据鲍林原子轨道近似能级图中的轨道填充次序,从第四层开始电子依次填入4s,3d,4p,5s,4d,5p。
若第五层只有2个电子,则第四层电子数在8~18个之间。
2.某元素原子最外层只有一个电子。
其量子数n=4,l=0,m=0,m s=+1/2,该原子为()。
[南京航空航天大学2007研]A.11NaB.37RbC.23MnD.24Cr【答案】D3.符合基态碳原子中的一个电子的一组量子数(n,l,m l,m s)为()。
[中科院2010研]A.3,1,-1,1/2B.2,0,0,-1/2C.2,2,-1,1/2D.1,0,1,1/2【答案】B4.在第一、二、三周期的18个元素中,基态原子最外层成单电子数与该元素所在的周期数相等的元素共有()。
[武汉大学2007研]A.3个B.4个C.5个D.6个【答案】B【解析】这四种元素分别是H、C、O、P,第一周期H原子基态最外层成单电子数为1,第二周期C和O原子最外层成单电子数为2,第三周期P原子基态最外层成单电子数为3。
5.核外某电子的角量子数I=3,它的磁量子数m可能取值有()。
[华南理工大学2010研]A.1个B.3个C.5个D.7个【答案】D【解析】磁量子数的取值为0,±1,±2,±3,所以其取值可以有7个。
二、填空题1.元素性质的周期性变化是由于的变化而造成的。
在元素周期系中,电负性最大的元素是,电负性最小的的非放射性元素是,第一电离能最大的元素是。
[北京科技大学2010研]【答案】电子层结构的周期性;F;Cs;He2.第27号元素的基态原子的电子排布式:,它位于第周期、族、区。
[华南理工大学2009研]【答案】1s22s2s2p63s23p63d74s2;四;Ⅷ;d三、判断题1.在碳纳米管中,碳原子的杂化轨道类型与石墨相同,皆为sp2杂化。

天津大学无机化学考试试卷〔下册〕答案一、是非题〔推断以下表达是否正确,正确的在括号中画√,错误的画X〕(每题 1 分,共 10 分) 1、( X )在周期表中,处于对角线位置的元素性质相像,这称为对角线规章。
2、( X )SnS 溶于Na S 溶液中,生成硫代亚锡酸钠。
2 23、( X )磁矩大的协作物,其稳定性强。
4、( X )氧族元素氢化物的沸点凹凸次序为H O>H S>H Se>H Te。
2 2 2 35、(√)[HgCl ]2-的K= 10-16,当溶液中c(Cl-)=·L-1 时,c(Hg2+)/c([HgCl ]2-)的比值为10-12。
4 46、( √)假设某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X )硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO -可以被 OH-复原为 MnO 2-。
4 49、(√)协作物 Na [Ag(S O ) ]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
3 2 3 210、(X )Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题〔在以下各题中,选择出符合题意的答案,将其代号填入括号内〕 (每题 1 分,共20 分) 1、在以下各种酸中氧化性最强的是............... ( B )。
(A)HClO ;(B)HClO;(C)HClO ;(D)HCl。
3 42、以下浓酸中,可以用来和KI(s)反响制取较纯 HI(g)的是...............( C )。
(A)浓HCl;(B)浓H SO ;(C)浓H PO ;(D)浓HNO 。
2 434 33、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D )。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是由于钛镍合金. ............... ( C )。
天津大学无机化学基本概念题一、判断题1. 已知反应C(金刚石)+O2(g)—→CO2(g)的=-·mol-1, 则可认为(CO2,g)= kJ·mol-1。
×正确错误√2. 已知O3(g)的摩尔生成焓为142 kJ·mol-1,则可求出反应2O3(g)—→3O2(g)的标准摩尔反应热=-284 kJ·mol-1。
√正确×错误3. 对于反应 8Al(s)+3Fe3O4(s)—→ 4Al2O3(s)+9Fe(s)的恒压反应热,由于(Al,s)=0,(Fe,s)=0,则可由下式=(Al2O3,s)-(Fe3O4,s)而求得。
×正确√错误4. 一个反应的值越小,其反应速率越快。
×正确√错误5. 由于CaCO3分解是吸热的,所以它的生成焓为负值。
×正确√错误二、选择题1.下列纯态单质中,其标准摩尔生成焓不为零的是()。
石墨(s)×Br2(l)×H2(g)×Hg(g)√2.下列各组符号所代表的体系的性质均属状态函数的是()。
×U、H、W×S、H、Q√U、H、G×S、H、W3.已知反应:N2(g)+2O2(g)─→2NO2(g)的(=·mol-1,则(NO2,g)= kJ·mol-1。
×-××-√4.已知A+B─→M+N的()1=50kJ·mol-1,2M+2N─→2D的()2=-80kJ·mol-1,则反应A+B─→D的=()kJ·mol-1。
√ 10×-30×-110× 905.下列哪一种说法是正确的?单质的焓值等于零;×单质的生成焓值等于零;×最稳定单质(纯态)的标准摩尔生成焓为零;√×(金刚石)=0。
一、判断题1. 温度升高使吸热反应的反应速率提高,放热反应的速率降低,所以升高温度使平衡向吸热方向移动。
2020年天津大学无机化学期中试卷2015.11.17班级 姓名 学号 分数一、 选择题 ( 共10题 20分 )1. 2 分 (3778) 3778对于一个氧化还原反应;下列各组中所表示的m r G ∆; E 和K 的关系应是…………………………………………………………………………………………… ( )(A) m r G ∆>0; E <0;K <1 (B) m r G ∆>0; E >0;K >1 (C) m r G ∆<0; E <0;K >1 (D) m r G ∆<0; E >0;K <12. 2 分 (0438) 0438关于熵;下列叙述中正确的是…………………………………………………………( )(A) 298K 时;纯物质的m S = 0(B) 一切单质的 m S = 0(C) 对孤立体系而言; m r S ∆> 0的反应总是自发进行的 (D) 在一个反应过程中;随着生成物的增加;熵变增大3. 2 分 (3515) 351525℃;2NO 2(g)N 2O 4(g);K c 与K p ( K )的比值( p = 100 kPa )K c /K p 等于…( )(A)2980831.01⨯= 0.0404 (B) 8.31 ⨯ 25 = 207.8(C) 0.0831 ⨯ 298 = 24.8 (D) 0.0821 ⨯ 298 = 24.54. 2 分 (3871) 3871HI 的生成反应的焓变为负值;HI 的分解反应的焓变为正值;则HI 分解反应的活化能 E a ……………………………………………………………………………………………( ) (A) E a <ΔH 分解 (B) E a >ΔH 分解 (C) E a = 0 (D) E a =ΔH 分解5. 2 分 (6709) 6709常用的三种甘汞电极;即(1) 饱和甘汞电极 (2) 摩尔甘汞电极 (3) 0.1 mol ·dm -3 甘汞电极其电极反应为:Hg 2Cl 2(s) + 2e - =2Hg(l) + 2Cl -(aq);在25℃ 时三种甘汞电极的 ϕ的大小次序为………………………………………………………………………………… ( )(A) 1ϕ> 2ϕ>3ϕ (B) 2ϕ> 1ϕ>3ϕ (C) 3ϕ> 2ϕ> 1ϕ(D) 1ϕ= 2ϕ= 3ϕ6. 2 分 (0436) 0436下列反应中;m r S ∆值最大的是………………………………………………………( )(A) C(s) + O 2(g)−→−CO 2(g) (B) 2SO 2(g) + O 2(g)−→−2SO 3(g) (C) CaSO 4(s) + 2H 2O(l)−→−CaSO 4·2H 2O(s) (D) 3H 2(g) + N 2(g)−→−2NH 3(g)7. 2 分 (0715) 0715已知V 3+ / V 2+ 的 ϕ= -0.26 V ;O 2/H 2O 的 ϕ= 1.23 V ;V 2+离子在下述溶液中能放出氢的是………………………………………………………………………………………… ( ) (A) pH = 0的水溶液 (B) 无氧的pH = 7的水溶液 (C) pH = 10的水溶液 (D) 无氧的pH = 0的水溶液8. 2 分 (3427) 3427已知25℃时 H 2O(g) H 2(g) O 2(g)m S / J ·mol -1·K -1 188.7 130.6 205.0在标准状态下;生成1 mol 气态水的 m r S ∆为……………………………………………( ) (A) 205.0 J ·mol -1·K -1 (B) 188.7 J ·mol -1·K -1 (C) 44.4 J ·mol -1·K -1 (D) -44.4 J ·mol -1·K -19. 2 分 (0616) 06160.1 mol/L 和0.05 mol/L 的H 2S 水溶液中:…………………………………………( )A. 两者的H +浓度近似相等 B. 两者的S 2- 浓度近似相等 C. 前者的H + 浓度是后者的两倍 D. 前者的S 2- 浓度是后者的两倍10. 2 分 (3481) 3481下列说法中正确的是…………………………………………………………………( ) (A) 稳定单质的标准生成焓、标准吉布斯生成自由能和标准熵都为零 (B) 放热反应总是可以自发进行的(C) H 2(g)的标准燃烧热等于H 2O(l)的标准生成焓 (D) CO 2(g)的标准生成焓也就是CO(g)的标准燃烧热二、填空题 ( 共 7题 20分 ) 11. 5 分 (0770) 0770写出锌电极[ ϕ(Zn 2+/Zn) = -0.763V]与饱和甘汞电极( ϕ= 0.2415V)组成的原电池符号_____________________________________________________________________________; 正极反应______________________________________________________________ ; 负极反应______________________________________________________________ ; 电池反应______________________________________________________________ ; 平衡常数______________________________________________________________.12. 5 分 (0705) 0705配平下列各反应方程式:(1) PbO 2 + MnBr 2 + HNO 3 −→−Pb(NO 3)2 + Br 2 + HMnO 4 + H 2O(2) CrI 3 + Cl 2 + KOH −→−K 2CrO 4 + KIO 4 + KCl + H 2O13. 2 分 (0819) 0819请填写下面的空格: 化学反应条件的改变对E ;k ;K 的影响活化能E a 速率常数k 平衡常数K升高温度加正催化剂14. 2 分 (3487)3487已知反应:2-4MnO + 10Cl - + 16H +2Mn 2+ + 5Cl 2 + 8H 2Om r G ∆ 1 = -142.0 kJ ·mol -1Cl 2 + 2Fe 2+2Cl - + 2Fe 3+m r G ∆ 2 = -113.6 kJ ·mol -1则反应-4MnO + 5Fe 2+ + 8H+Mn 2+ + 5Fe 3+ + 4H 2O 的m r G ∆为 kJ ·mol -1.15. 2 分 (0569) 0569由N 2和H 2化合生成NH 3的反应中;m r H ∆< 0;当达到平衡后;再适当降低温度则正反应速率将_____________;逆反应速率将_____________;平衡将向________方向移动;平衡常数将________________.16. 2 分 (0137) 0137将 N 2和H 2 按 1:3 的体积比装入一密闭容器中;在 400 ℃ 和 10 MPa 下达到平衡时;NH 3 的体积分数为 39% ; 这时3NH p =____________________________ MPa,2N p =_____________________________ MPa ;2H p =___________________________ MPa .17. 2 分 (0676) 0676pH = 9.56的NH 4Cl 和NH 3·H 2O 的混合溶液中NH 4Cl 和NH 3·H 2O 的物质的量浓度比是_____________________________________.( NH 3·H 2O 的p K b = 4.74 )三、计算题 ( 共 6题 40分 ) 18. 10 分 (3638) 36380.090 mol ·dm -3 Mn(ClO 4)2;0.060 mol ·dm -3Cu(ClO 4)2;0.45 mol ·dm -3 HClO 4等体积混合;再通入H 2S(g) 至饱和;计算该溶液中Cu 2+、Mn 2+的浓度. (已知:H 2S :K 1 = 5.7 ⨯ 10-8; K 2 = 1.2 ⨯ 10-15; K sp (MnS) =1.4 ⨯ 10-15;K sp (CuS) =3.6 ⨯ 10-36)19. 10 分 (3569) 3569已知气相反应N 2O 4(g)2NO 2(g);在45℃时向 1.00 dm 3真空容器中引入 6.00 mmol N 2O 4;当平衡建立后;压力为25.9 kPa .(1) 计算45℃时N 2O 4的解离度α 和平衡常数 p K ;(2) 已知该反应 m r H ∆= 72.8 kJ ·mol -1;求该反应的 m r S ∆;(3) 计算100℃时的 p K 和m r G ∆.20. 5 分 (6604) 6604将2.16 g 丙酸 HC 3H 5O 2与0.56 g NaOH 混合溶于足量水后;准确稀释到100 dm 3容量瓶中;计算该溶液pH 值.(丙酸p K a = 4.89)21. 5 分 (9614) 9614根据下列热力学数据计算MgSO 4和MgCO 3溶解过程的吉布斯自由能变m sol G ∆;判断它们溶解的难易.若难溶还应计算其K sp .MgSO 4(s) MgCO 3(s) Mg 2+(aq) SO 42-(aq) CO 32-(aq)m f H ∆/ kJ ·mol -1 -1278.2-1112.9 -461 -909.2 -677.0m S / J ·mol -1·K -1 91.6 65.7 -117.9 20.1 -56.822. 5 分 (0486) 0486由以下热化学方程; 计算298 K 时N 2O(g) 的标准摩尔生成焓.(1) C(s) + N 2O(g)−→−CO(g) + N 2(g) m r H ∆ 1 = -192.9 kJ ·mol -1(2) C(s) +O 2(g)−→−CO 2(g) m r H ∆ 2 = -393.5 kJ ·mol -1 (3) 2CO(g) + O 2(g)−→−2CO 2(g) m r H ∆ 3 = -566.0 kJ ·mol -123. 5 分 (3703) 3703已知 [H +] = 1.0 mol ·dm -3 时;锰的元素电位图 ( ϕ/ V):MnO -4─── MnO -24─── MnO 2 ─── Mn 3+ ─── Mn 2+ ─── Mn (1) 指出哪些物质在酸性溶液中会发生歧化反应; (2) 求 ϕ(MnO 4-/Mn 2+);(3) 写出用电对Mn 2+/Mn 与标准氢电极组成原电池的电池符号及该电池的自发反应的方程式.0.564 V 2.26 V 0.95 V 1.51 V -1.18 V四、问答题 ( 共 2题 20分 ) 24. 10 分 (0875) 0875Fe 2+ 在水溶液中被Cl 2氧化;总的方程式是:2Fe 2+ + Cl 2−→−2Fe 3+ + 2Cl - 实验发现:当Fe 3+ 和Cl - 浓度增加时;总反应速率下降;试论证哪一种机理可能符合实验观测事实? (1) Fe 2+ + Cl 2Fe 3+ + Cl - + Cl 快速达到平衡 ①Fe 2+ + Cl −→− Fe 3+ + Cl - 逆反应速率可忽略 ② (2) Fe 2+ + Cl 2Fe (IV) + 2Cl - 快速达到平衡 ③Fe(IV) + Fe 2+−→−2Fe 3+ 逆反应速率可忽略 ④k 11k 2k 3 3k 425. 10 分 (6509) 6509已知下列经验平衡常数表示式 (1)2CO 3-23+4][NH ][CO ][NH p ⋅;(2)2323][NH ]][Cl )[Ag(NH -+;(3) p CO 2;(4)p H O52;(5)[H ][NO ][HNO ]3NO23+-p 2试写出对应的化学反应方程式.。