第二章第化学反应限度 计算专题
- 格式:doc
- 大小:231.50 KB
- 文档页数:5




第2章化学反应的方向、限度与速率第1节化学反应的方向基础巩固1.下列说法正确的是()A.放热反应不一定是自发进行的反应B.吸热反应一定是非自发进行的C.自发进行的反应一定容易发生D.反应速率快的一定是自发进行的2.ΔH-TΔS作为化学反应方向的判据,它适用的条件是()A.温度、压强一定 B.压强一定C.温度、体积一定 D.体系中物质的状态一定3.下列反应中,在高温下不能自发进行的是( )A.CO(g)===C(s,石墨)+12O2(g)B.2N2O5(g)===4NO2(g)+O2(g)C.(NH4)2CO3(s)===NH4HCO3(s)+NH3(g)D.MgCO3(s)===MgO(s)+CO2(g)4.以下自发反应可用能量判据来解释的是()A.硝酸铵自发地溶于水B.2N2O5(g)===4NO2(g)+O2(g)ΔH=56.7 kJ·mol-1C.(NH4)2CO3(s)===NH4HCO3(s)+NH3(g)ΔH=74。
9 kJ·mol-1D.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-15.碳酸铵在室温下就能自发地分解产生氨气,下面对其说法正确的是()A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大B.碳酸铵分解是因为外界给予了能量C.碳酸铵分解是吸热反应,根据焓判据不能自发分解D.碳酸盐都不稳定,都能自发分解6.有A、B、C、D四个反应:________;另两个反应中,在温度高于________K时可自发进行的反应是________;在温度低于________K时自发进行的反应是________。
能力提升7.下列有关反应的方向说法正确的是()A.放热的自发过程都是熵值减小的过程B.吸热的自发过程常常是熵值减小的过程C.水自发地从高处流向低处,是趋向能量最低状态的倾向D.只根据焓变来判断化学反应的方向是可以的8.能用能量判据判断下列过程的方向的是( )A.水总是自发地由高处往低处流B.放热反应容易自发进行,吸热反应不能自发进行C.有序排列的火柴散落时成为无序排列D.多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大9.对于化学反应能否自发进行,下列说法中错误的是()A.若ΔH<0,ΔS>0,任何温度下都能自发进行B.若ΔH>0,ΔS<0,任何温度下都不能自发进行C.若ΔH>0,ΔS>0,低温时可自发进行D.若ΔH<0,ΔS<0,低温时可自发进行10.已知“凡气体分子总数增大的反应一定是熵增加的反应”.下列反应不可能自发进行的是( )A.2O3(g)===3O2(g)ΔH<0B.2CO(g)===2C(s)+O2(g)ΔH>0C.N2(g)+3H2(g)===2NH3(g) ΔH<0D.CaCO3(s)===CaO(s)+CO2(g)ΔH>011.已知100 kPa、298。

第二章化学反应的方向、限度与速率测试题一、单选题(共15题)1.下列有关化学反应速率的说法正确的是A.20mL1⋅的硫酸与铁片反应时,加入氯化钾溶液,反应速率不变4mol L-B.增加反应物的质量,反应速率一定加快C.合成氨是一个放热反应,升高温度,正反应速率减慢HNO分别与大小相同的大理石反应的速率相同D.1⋅盐酸和1⋅30.1mol L-0.1mol L-2.反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905.9 kJ·mol-1,在5 L密闭容器中投入1 mol NH3和1 mol 的O2,2分钟后NO的物质的量增加了0.4 mol,下列说法错误的是A.0~2 min v(O2)=0.05 mol·L-1·min-1B.2分钟内O2的转化率是50%C.2分钟末c(H2O)=0.6 mol/L D.2分钟反应放出的热量值等于90.59 kJ3.在密闭容器中,aA(g)bB(g)达到平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是A.平衡向正反应方向移动了B.物质A的转化率减小了C.物质B的质量分数不变D.a>b4.一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生反应3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡,生成0.8molD,并测得C的物质的量浓度为0.4mol·L-1,下列说法正确的是()A.此温度下该反应的平衡常数K等于0.5B.A的平衡转化率为40%C.x的值为1D.A和B的平衡转化率相等5.少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的量,可以使用如下方法中的①由铁粉换铁块②加NaNO3固体③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液④加CH3COONa固体⑤加NaCl溶液⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用100mL0.1mol·L-1盐酸A.③⑤B.①③C.⑥⑦D.⑦⑧6.下列说法正确的是A .化学反应速率为0.8 mol·L -1·s -1,是指1 s 时某物质的浓度为0.8 mol·L -1B .由v =ct∆∆计算平均速率,用反应物表示为正值,用生成物表示为负值 C .同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越快 D .在2SO 2(g)+O 2(g) 2SO 3(g)反应中,t 1、t 2时刻,SO 3(g)浓度分别是c 1、c 2,则t 1~t 2时间内,生成SO 2(g)的平均速率为v =2121--c c t t 7.下列对化学反应预测正确的是A .AB .BC .CD .D8.在一定条件下,恒容密闭容器中反应2A(g)2B(g)+C(g)ΔH>0达到平衡后,能使B 的浓度增大的措施是 A .降温B .升温C .使用催化剂D .减少A 的浓度9.在温度T 1时,向一体积固定为2L 的密闭容器中通入1molCO 2和3molH 2发生反应:CO 2(g)+3H 2(g)CH 3OH(g)+H 2O(g) △H<0,5min 后反应达到平衡,CO 2的转化率为20%。
《第二章第三节化学反应的速率和限度》1.化学反应速率的含义:通常用单位时间内反应物浓度的减少或生成物浓度的增加(均取正值)来表示。
浓度的变化——△C 时间的变化——△t表达式:v=△C/△t 单位:mol/(L•s)或mol/(L•min)注意:(1)在同一反应中用不同物质来表示时,其反应速率的数值可以不同,但都表同一反应的速率。
(必须标明用哪种物质来做标准) (2)起始浓度与化学计量数比无关,但是变化浓度一定与化学计量数成比例。
(3)同一反应各物质的反应速率之比等于化学计量数之比。
例如: 2A(g)+3B (g)C(g)+4D(g)ν(A):ν(B):ν(C):ν(D) = 2:3:1:4(3)化学反应速率均用正值来表示,且表示的是平均速率而不是瞬时速率(4)一般不用纯液体或固体来表示化学反应速率(5)改变压强对无气体参与的反应的化学反应速率无影响。
【例1】某一反应物的初始浓度是2摩尔/升,经过两分钟的反应,它的浓度变成了摩尔/升,求该反应的反应速率。
[ mol/(L•min) ]【例2】某温度时,2L容器中X、Y、Z三种物质的量随时间的变化如图所示。
由图中数据分析,该反应的化学方程式为 3X +Y == 2Z ;反应开始至2min ,Z的平均反应速率为:mol/(L•min)【例3】在2A + B = 3C + 4D的反应中, 下列表示该反应的化反速率最快的是---------------( B )A. V(A) = mol/(L·s)B. V(B) = mol/(L·s)C. V(C) = mol/(L·s)D. V(D) = 1 mol/(L·s)【总结】对于同一反应,比较用不同反应物或生成物表示的反应速率大小时,要换算成同一物质表示的速率,才能比较。
3.影响化学反应速率的因素内因:由参加反应的物质的性质决定。
影响反应速率的因素有外因:浓度、温度、压强、催化剂、其它因素。
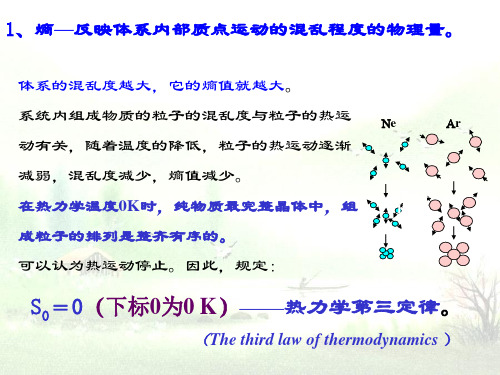
1.(专题2 第二单元)化学反应的方向及判断依据(A)一、选择题1.下列过程是非自发的是( )A.水由高处向低处流B.天然气的燃烧C.铁在潮湿空气中生锈D.室温下水结成冰2.水的三态的熵值的大小关系正确的是( )A.S m(s)>S m(l)>S m(g)B.S m (l)>S m(s)>S m(g)C.S m(g)>S m(l)>S m(s)D.S m(g)>S m(s)>S m (l)3.下列过程属于熵增加的是( )A.一定条件下水由气态变为液态B.高温高压条件下使石墨转化为金刚石C.散落的火柴的无序排列D.CO点燃时生成CO24.下列关于化学反应的自发性叙述中正确的是( )A.焓变小于0而熵变大于0的反应肯定是自发的B.焓变和熵变都小于0的反应肯定是自发的C.焓变和熵变都大于0的反应肯定是自发的D熵变小于0而焓变大于0的反应肯定是自发的5.自发进行的反应一定是( )A.吸热反应B.放热反应C.熵增加反应D.熵增加或者放热反应6.下列关于化学反应的熵变的叙述正确的是( )A.化学反应的熵变与反应的方向无关B.化学反应的熵变直接决定了反应的方向C.熵值增大的反应都是混乱度增大的反应D.熵值增大的反应都能自发进行7.下列说法正确的是( )A.放热反应一定是自发进行的反应B.吸热反应一定是非自发进行的C.自发进行的反应一定容易发生D.有些吸热反应也能自发进行8.碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,对其说法中正确的是( )A.其分解是因为生成了易挥发的气体,使体系的熵增大B.其分解是因为外界给予了能量C.其分解是吸热反应,据能量判据不能自发分解D.碳酸盐都不稳定,都能自发分解9.250℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是( )A.是吸热反应B.是放热反应C.是熵减少的反应D.熵增大效应大于能量效应。
课题:第二章第二节化学反应的限度课本:化学反应原理山东科学技术出版社知识与技能:1.了解化学平衡常数的含义,能利用平衡常数计算反应物的平衡转化率;2.了解温度、浓度、压强等因素对化学平衡的影响,并能够判断平衡移动的方向;3.培养设计实验方案,分析、处理数据的能力。
过程与方法:通过“温度、浓度对化学平衡的影响”实验探究,培养设计实验方案的能力,以及分析实验现象并获取有价值信息的能力;通过对“化学平衡常数”“压强对化学平衡的影响”等问题的讨论,培养分析、处理实验数据的能力,以及从数据中获取信息,总结规律的能力。
情感态度与价值观:在分析问题中能够体会到研究的乐趣,学会如何看待事物的多面性,并最终了解热力学理论研究的重要意义。
教学重难点:化学平衡常数的含义及温度、浓度、压强对化学平衡的影响。
课型:新课课时安排:4课时教学过程:(第一课时)【复习提问】什么叫熵?什么叫熵变?如何判断一个反应能否自发进行?【教师】我们利用△H-T△S来判断一个反应的自发性时,如果它小于0,我们只能说这个反应有反应的可能性,有反应的趋势。
在实际上到底能不能进行反应,还要看有多少反应物发生反应转变成了生成物,另外还要看反应的速率。
如果反应物只有很少的量转变成生成物或反应的速率很小很小,那么我们只能说这个反应虽有自发进行的趋势,但仍然没有发生反应。
所以要研究一个反应,首先要研究它的自发性问题,接下来就要看它进行的程度,也就是限度的问题,最后看反应速率的问题。
好,这节我们就来看看反应限度的问题。
【板书】第2节化学反应的限度【提问】那么如何来表示化学反应的限度呢?或用什么来反映反应的限度呢?【学生】思考,预习【教师】化学反应的限度是指有多少反应物转变为生成物的,所以最好用生成物与反应物的物质的量或浓度的比值来反应。
那么我们来看下面这个表。
【学生】观察,计算:交流研讨: 已知反应H2(g)+I2(g) 2HI (g) ,△H< 0。
用心 爱心 专心第 1页 用心 爱心 专心第二章第化学反应限度 计算专题[学习目标]1.学会用浓度商与平衡常数的关系判断化学反应的方向。
2.掌握平衡常数及转化率的计算技巧。
【课堂互动探究】化学平衡计算的解题模板:三段式法 对于反应:m A(g)+n B(g)p C(g)+q D(g),令A 、B 起始物质的量(mol)分别为a 、b ,达到平衡后,A 的消耗量为mx ,容器容积为V L 。
,m A(g),+,n B(g),p C(g),+,q D(g),起始(mol),a b 0 0, 变化(mol),mx nx px qx , 平衡(mol),a -mx b -nx px qx ) 建立等式求解:①K =⎝ ⎛⎭⎪⎫px V p ·⎝ ⎛⎭⎪⎫qx V q ⎝ ⎛⎭⎪⎫a -mx V m ·⎝ ⎛⎭⎪⎫b -nx V n②c 平(A)=a -mxV (mol·L -1)。
③α(A)平=mx a ×100%,α(A)∶α(B)=mx a ∶nx b =mb na 。
④φ(A)=a -mxa +b +(p +q -m -n )x ×100%。
⑤p (平)p (始)=a +b +(p +q -m -n )x a +b 。
⑥ρ(混)=a ·M (A )+b ·M (B )V(g·L -1)。
⑦M =a ·M (A )+b ·M (B )a +b +(p +q -m -n )x(g·mol -1)。
例1.高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)Fe(s)+CO 2(g)(正反应为吸热反应),其平衡常数可表达为K =[CO 2]/[CO],已知,1 100°C ,K =0.263。
(1)温度升高化学平衡移动后达到新的平衡,高炉内CO 2和CO 的体积比值________,平衡常数K 值________(均选填“增大”、“减小”或“不变”)。
(2)1 100°C 时测得高炉中[CO 2]=0.025 mol·L -1,[CO]=0.1 mol·L -1,在这种情况下,该反应是否处于化学平衡状态________(选填“是”或“否”),此时,化学反应速率v 正________v 逆(填“大于”、“小于”或“等于”),其原因是________________________。
变式训练1.(2014·吉林市模拟)已知:CO(g)+H 2O(g) CO 2(g)+H 2(g) ΔH =-41 kJ·mol -1。
相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
相关数据如下:A .容器①中反应达到平衡时,CO 的转化率为80%B .容器①中CO 的转化率等于容器②中CO 2的转化率C .平衡时,两容器中CO 2的浓度相等D .容器①中CO 反应速率等于H 2O 的反应速率例 2 .已知可逆反应:M(g)+N(g) P(g)+Q(g) ΔH >0,请回答下列问题:(1)在某温度下,反应物的起始浓度分别为:c (M)=1 mol·L -1,c (N)=2.4 mol·L -1;达到平衡后,M 的转化率为60%,此时N 的转化率为________;(2)若反应温度升高,M 的转化率________(填“增大”、“减小”或“不变”);(3)若反应温度不变,反应物的起始浓度分别为:c (M)=4 mol·L -1,c (N)=a mol·L -1;达到平衡后,[P]=2 mol·L -1,a =________;(4)若反应温度不变,反应物的起始浓度为:c (M)=c (N)=b mol·L -1,达到平衡后,M 的转化率为________。
【当堂限时检测】1.在10 L 密闭容器中,1 mol A 和3 mol B 在一定条件下反应:A(g)+x B(g) 2C(g),2 min 后反应达到平衡时,测得混合气体共3.4 mol ,用心 爱心 专心第 2页 用心 爱心 专心生成0.4 mol C ,则下列计算结果不正确的是( )A .平衡时,物质的量比n (A)∶n (B)∶n (C)=2∶11∶4B .x =4C .B 的平均反应速率为0.04 mol/(L·min)D .A 的转化率为20%2.在一个容积为6 L 的密闭容器中,放入3 L X 气体和2 L Y 气体,在一定条件下发生反应:4X(g)+n Y(g)2Q(g)+6R(g),反应达到平衡时,容器内温度不变,混合气体的压强比原来增加了5%,X 的浓度减小1/3,则该反应中的n 值为( ) A .3 B .4 C .5 D .6 3.在一定条件下,可逆反应N 2+3H 2 2NH 3,达平衡时[N 2]=3 mol·L -1,[H 2]=3 mol·L -1,[NH 3]=4 mol·L -1,则反应开始时N 2浓度不可能是( ) A .5 mol·L -1 B .2 mol·L -1 C .3 mol·L -1 D .1 mol·L -14.(原创题)在相同温度下,先在体积为1 L 的密闭容器中充入1 mol H 2(g)和1 mol I 2(g),发生反应:H 2(g)+I 2(g)2HI(g);再在另一体积为2 L 的密闭容器中充入1 mol HI(g);发生反应:HI(g) 12H 2(g)+12I 2(g);达到平衡时,两容器中HI 的体积分数均为50%,则这两者的平衡常数( ) A .前者大 B .前者小 C .相等 D .无法比较 5.一定温度下,在一定容积的密闭容器中充入N 2和H 2发生反应N 2+3H 22NH 3并达到平衡,N 2的转化率为c %。
向平衡混合物中充入N 2,达到新平衡后,N 2的转化率将A .增大B .减小C .不变D .无法确定6. X 、Y 、Z 三种气体,取X 和Y 按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X +2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y 的转化率最接近于( )A .33%B .40%C .50%D .65%7.在一密闭容器中充入1 mol CO 和1 mol H 2O(g),一定条件下反应:CO(g)+H 2O(g)CO 2(g)+H 2(g)达到平衡时生成0.5 mol CO 2,若在相同条件下将H 2O(g)改为4mol ,反应达到平衡时生成CO 2的物质的量为( )A .1.0 molB .0.8 molC .0.6 molD .2.0 mol8.(10分)某温度下,将H 2和I 2各0.10 mol 的气态混合物充入10 L 密闭容器中,充分反应,达平衡后测得c (H 2)=0.008 mol/L ,该反应的平衡常数K 为________;该温度下2HI(g)H 2(g)+I 2(g)的平衡常数K ′为______,反应12H 2(g)+12I 2(g)HI(g)的平衡常数K ″为________。
9. (1)高温下,某反应达平衡,平衡常数K =[CO][H 2O][CO 2][H 2],则反应的化学方程式为________________________________________________________________________。
(2)工业合成氨的反应为N 2(g)+3H 2(g)2NH 3(g)。
设在容积为2.0 L 的密闭固定容器中充入0.60 mol N 2(g)和1.60 mol H 2(g),反应在一定条件下达到平衡时,NH 3的物质的量分数(NH 3的物质的量与反应体系中气体的总的物质的量之比)为47。
计算该条件下反应2NH 3(g)N 2(g)+3H 2(g)的平衡常数。
10.(14分某温度时,在2 L 密闭容器中气态物质X 和Y 反应生成气态物质Z ,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,在图中画出X 、Y 、Z 的物质的量(n )随时间(t )变化的曲线:(2)体系中发生反应的化学方程式是________________________________________________________________________; (3)列式计算该反应在0~3 min 时间内产物Z 的平均反应速率:____________________________________________________________________; (4)该反应达到平衡时反应物X 的转化率α等于________________________________________________________________________; (5)如果该反应是放热反应。
改变实验条件(温度、压强、催化剂)得到Z 随时间变化的曲线1、2、3(如图所示)则曲线1、2、3所对应的实验条件改变分别是:1____________________________________, 2______________,3______________。
用心 爱心 专心第 3页 用心 爱心 专心11.(2014·长春二模)(1)反应Fe(s)+CO 2(g) FeO(s)+CO(g) ΔH 1,平衡常数为K 1;反应Fe(s)+H 2O(g)FeO(s)+H 2(g) ΔH 2,平衡常数为K 2在不同温度时K 1、K 2的值如下表:700 ℃ 900 ℃ K 1 1.47 2.15 K 22.381.67反应CO 2(g)+H 2(g) 2K ,则ΔH =________(用ΔH 1和ΔH 2表示),K =________(用K 1和K 2表示),且由上述计算可知,反应CO 2(g)+H 2(g)CO(g)+H 2O(g)是________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO 2气体,发生反应Fe(s)+CO 2(g)FeO(s)+CO(g) ΔH >0,CO 2的浓度与时间的关系如图所示:①该条件下反应的平衡常数为________;若铁粉足量,CO 2的起始浓度为2.0 mol·L-1,则平衡时CO 2的浓度为________mol·L -1。
②下列措施中能使平衡时c COc CO 2增大的是________(填序号)。