电化学专题讲座
- 格式:doc
- 大小:2.24 MB
- 文档页数:16



专题讲座(六) 隔膜在电化学的作用第一部分:高考真题感悟1.(2020·海南·高考真题)某燃料电池主要构成要素如图所示,下列说法正确的是A .电池可用于乙醛的制备B .b 电极为正极C .电池工作时,a 电极附近pH 降低D .a 电极的反应式为O 2+4e - -4H + =2H 2O2.(2020·山东·高考真题)微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。
现以NaCl 溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含 CH 3COO -的溶液为例)。
下列说法错误的是A .负极反应为 -+-322CH COO +2H O-8e =2CO +7HB .隔膜1为阳离子交换膜,隔膜2为阴离子交换膜C .当电路中转移1mol 电子时,模拟海水理论上除盐58.5gD .电池工作一段时间后,正、负极产生气体的物质的量之比为2:13.(2020·山东·高考真题)采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。
忽略温度变化的影响,下列说法错误的是A .阳极反应为222H O 4e 4H O -+-=+↑B .电解一段时间后,阳极室的pH 未变C .电解过程中,H +由a 极区向b 极区迁移D .电解一段时间后,a 极生成的O 2与b 极反应的O 2等量4.(2021·天津·高考真题)如下所示电解装置中,通电后石墨电极Ⅱ上有O 2生成,Fe 2O 3逐渐溶解,下列判断错误..的是A .a 是电源的负极B .通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色C .随着电解的进行,CuCl 2溶液浓度变大D .当230.01mol Fe O 完全溶解时,至少产生气体336mL (折合成标准状况下)5.(2022·山东·高考真题)设计如图装置回收金属钴。


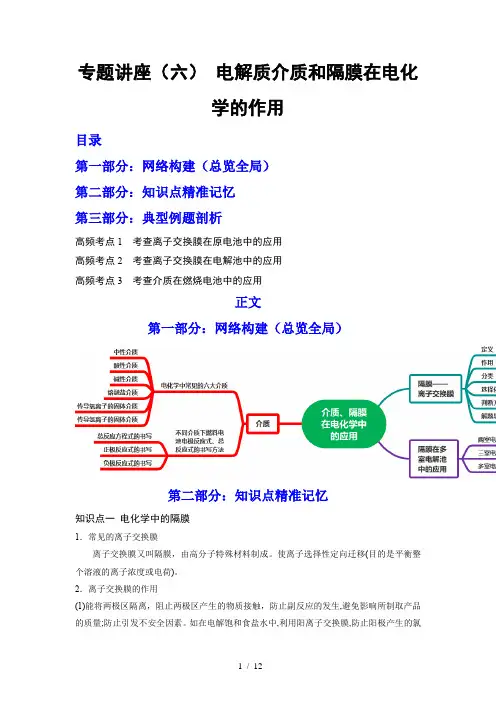
专题讲座(六)电解质介质和隔膜在电化学的作用目录第一部分:网络构建(总览全局)第二部分:知识点精准记忆第三部分:典型例题剖析高频考点1考查离子交换膜在原电池中的应用高频考点2考查离子交换膜在电解池中的应用高频考点3 考查介质在燃烧电池中的应用正文第一部分:网络构建(总览全局)第二部分:知识点精准记忆知识点一电化学中的隔膜1.常见的离子交换膜离子交换膜又叫隔膜,由高分子特殊材料制成。
使离子选择性定向迁移(目的是平衡整个溶液的离子浓度或电荷)。
2.离子交换膜的作用(1)能将两极区隔离,阻止两极区产生的物质接触,防止副反应的发生,避免影响所制取产品的质量;防止引发不安全因素。
如在电解饱和食盐水中,利用阳离子交换膜,防止阳极产生的氯气进入阴极室与氢氧化钠反应,导致所制产品不纯;防止氯气与阴极产生的氢气混合发生爆炸。
(2)能选择性的通过离子,起到平衡电荷、形成闭合回路的作用。
(3)双极膜:由一张阳膜和一张阴膜复合制成的阴、阳复合膜。
该膜的特点是在直流电的作用下,阴、阳膜复合层间的H 2O 解离成H +和OH -并分别通过阳膜和阴膜,作为H +和OH -的离子源。
(4)用于物质的制备、分离、提纯等。
3.离子交换膜的类型(1)阳离子交换膜 (只允许阳离子和水分子通过,阻止阴离子和气体通过)以锌铜原电池为例,中间用阳离子交换膜隔开①负极反应式:Zn-2e -===Zn 2+ ②正极反应式:Cu 2++2e -===Cu③Zn 2+通过阳离子交换膜进入正极区④阳离子→透过阳离子交换膜→原电池正极(或电解池的阴极)(2)阴离子交换膜 (只允许阴离子和水分子通过,阻止阳离子和气体通过 以Pt 为电极电解淀粉KI 溶液,中间用阴离子交换膜隔开①阴极反应式:2H 2O +2e -===H 2↑+2OH -②阳极反应式:2I --2e -===I 2③阴极产生的OH -移向阳极与阳极产物反应:3I 2+6OH -===IO -3+5I -+3H 2O④阴离子→透过阴离子交换膜→电解池阳极(或原电池的负极)(3)质子交换膜 (只允许+在微生物作用下电解有机废水(含CH 3COOH),可获得清洁能源H 2①阴极反应式:2H ++2e -===H 2↑②阳极反应式:CH 3COOH -8e -+2H 2O===2CO 2↑+8H +③阳极产生的H +通过质子交换膜移向阴极④H +→透过质子交换膜→原电池正极(或电解池的阴极)(4)电渗析法将含A n B m的废水再生为H n B和A(OH)m的原理:已知A为金属活动顺序表H之前的金属,B n-为含氧酸根离子离子交换膜选择的依据:离子的定向移动。


课程名称:大学化学授课对象:大学本科生授课学时:2学时教学目标:1. 知识目标:理解电化学基本概念、原理和规律,掌握原电池、电解池的工作原理和应用。
2. 能力目标:培养学生分析问题和解决问题的能力,提高实验操作技能。
3. 思政目标:通过电化学原理的学习,激发学生的爱国情怀,树立节约资源、保护环境的意识。
教学重点:1. 电化学基本概念和原理。
2. 原电池、电解池的工作原理和应用。
教学难点:1. 电化学原理在实际问题中的应用。
2. 电化学实验操作和数据分析。
教学过程:一、导入1. 结合当前我国新能源产业发展,简要介绍电化学在新能源领域的应用,激发学生的学习兴趣。
2. 提出问题:什么是电化学?电化学在现实生活中有哪些应用?二、讲授新课1. 电化学基本概念:介绍电化学、原电池、电解池等基本概念。
2. 原电池原理:讲解原电池的构成、工作原理、电极反应和电动势等。
3. 电解池原理:讲解电解池的构成、工作原理、电极反应和电流效率等。
4. 电化学应用:介绍电化学在新能源、电镀、电池制造等领域的应用。
三、思政教育1. 结合我国新能源产业发展,引导学生思考电化学在节能减排、保护环境等方面的积极作用。
2. 引导学生认识到电化学技术对国家能源安全和经济发展的重要性,激发学生的爱国情怀。
3. 强调节约资源、保护环境的重要性,培养学生的社会责任感。
四、课堂小结1. 总结本节课所学内容,回顾电化学基本概念、原理和应用。
2. 强调电化学在新能源、环保等领域的重要作用,培养学生的环保意识。
五、作业布置1. 阅读教材相关章节,巩固电化学基本概念和原理。
2. 查阅资料,了解电化学在新能源领域的最新研究进展。
教学评价:1. 课堂参与度:观察学生在课堂上的参与程度,包括提问、回答问题等。
2. 实验操作:评价学生在实验课中的操作技能和实验数据处理的准确性。
3. 思政教育效果:通过课堂讨论、作业等形式,了解学生对电化学应用、环保等方面的认识。



专题讲座三“隔膜”原电池、电解池模型1.常见的隔膜隔膜又叫离子交换膜,由特殊高分子材料制成。
离子交换膜分四类:(1)阳离子交换膜,简称阳膜,只允许阳离子通过,即允许H+和其他阳离子通过,不允许阴离子通过。
(2)阴离子交换膜,简称阴膜,只允许阴离子通过,即允许OH-和其他阴离子通过,不允许阳离子通过。
(3)质子交换膜,只允许H+通过,不允许其他阳离子和阴离子通过。
(4)双极性膜,膜的一侧为阳膜,只允许阳离子通过,另一侧为阴膜,只允许阴离子通过。
2.隔膜的作用(1)能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应。
(2)能选择性地允许离子通过,起到平衡电荷、形成闭合回路的作用。
3.隔膜的选择依据:离子的定向移动。
4.隔膜的应用5.多室电解池的类型多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室等,以达到浓缩、净化、提纯以及电化学合成的目的。
(1)两室电解池以惰性电极电解一定浓度的Na2CO3溶液为例,其原理如图所示:①电极名称的判断:根据“阴阳相吸”判断,Na+移向的乙电极是阴极;根据“阳极放氧生酸”判断,左侧有氧气生成的甲电极是阳极。
②电极反应式的书写:右侧阴极区电解液为稀氢氧化钠溶液,根据“阴极放氢生碱”,得4H2O+4e-===2H2↑+4OH-,A为氢气;左侧阳极区电解液为碳酸钠溶液,根据“阳极放氧生酸”,且H+会与CO2-3结合生成HCO-3:2H2O-4e-+4CO2-3 ===O2↑+4HCO-3。
(1)含离子交换膜的电解池的最大优点是能自动把产品(如该电解池产生的NaOH和NaHCO3)分离开,从而降低分离提纯成本。
(2)“阴阳相吸”是很多化学反应的微观基础。
“阴阳相吸”的含义:①阴离子与阳离子相互吸引并发生迁移;②阴极吸引电解液中的阳离子,阳极吸引电解液中的阴离子,并使阳离子与阴离子发生定向移动;③正极吸引自由电子,使电子通过导线由负极定向移动到正极。
高三化学电化学专题复习知识框架化学电池化学能转变为电能原电池金属的电化学腐蚀(自发进行)氧化还原反应——能量变化电解电解质溶液电解池电镀、铜的精炼电能转变为化学能电解法冶练金属(外界能量推动、自发或不自发)一、原电池和电解池的比较:装置原电池电解池实例原理负极:较活泼金属;失去电子;发生氧化反应;(阳极)正极:较不活泼金属(或非金属C石墨);电子流入的一极;发生还原反应;(阴极)阴极:与电源负极相连的极;发生还原反应。
阳极:与电源正极相连的极;发生氧化反应。
形成条件①活动性不同的两电极(连接);②电解质溶液(电极插入其中并与电极自发反应);③形成闭合回路。
①两电极接直流电源;②两电极插入电解质溶液(水溶液或熔化态);③电极(惰性或非惰性);○4形成闭合回路。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:Cu2++2e-=Cu(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-= Cl2↑ (氧化反应)导电外电路:电子由负极→正极溶液中:阳离子→正极阴离子→负极外电路:电子由负极→阴极阳极→正极溶液中:阴离子→阳极,阳离子→阴极能量转化将化学能转变成电能的装置将电能转变成化学能的装置应用①抗金属的电化学腐蚀;②各种一次、二次电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
二、原电池电极反应式和总反应式的书写:书写方法:“对于复杂的原电池反应考试往往是已知的”(1)找出化合价变价的一组元素,由此判断正负极;(负极失去电子,化合价升高,发生氧化反应);(2)判断电解质溶液的酸碱性(或是熔融氧化物/碳酸盐);(3)根据化合价的升降数确定得或失的电子数;(4)根据电解质溶液,利用电解质溶液中存在的离子平衡电荷;(5)根据电解质溶液,完成原子守恒;普通电池:(锌锰干电池、铅酸蓄电池)1.(2016•大连校级模拟)蓄电池是一种可以反复充电、放电的装置。
有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2。
书写电极方程式并判断电极负极pH值变化:(1)此电池放电时,负极的电极反应式是____________________________________________________。
(2)此电池放电时,正极的电极反应式是____________________________________________________。
(3)此电池充电时,阳极的电极反应式是___________________________________________________。
2. 以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池。
Al+3NiO(OH)+H2O+NaOH NaAlO2+3Ni(OH)2。
书写电极方程式并判断电极负极pH值变化:(1)此电池放电时,正极的电极反应式是____________________________________________________。
(2)此电池充电时,阳极的电极反应式是_____________________________________________________。
3.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
3Zn+ 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH(1)此电池放电时,负极的电极反应式是____________________________________________________。
(2)此电池放电时,正极的电极反应式是____________________________________________________。
(3)此电池充电时,阳极的电极反应式是___________________________________________________。
燃料电池:可燃物~O2燃料电池(可燃物作负极,氧气/空气作正极),四种电解质溶液类型:(1)碱性电解质:O2 + 4e- +2H2O = 4OH- (2)酸性电解质:O2 + 4e- +4H+ =2H2O(3)熔融金属氧化物:O2 + 4e- = 2O2- (4)熔融碳酸盐:O2 + 4e- +2CO2= 2CO32-4.以甲醇燃料电池为例,书写四种电解质溶液环境下的电极方程式:[练习]科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。
如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入C3H8空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-。
(1)c电极通入的物质为________。
(2)d电极上的电极反应式为____________________________________。
图解原电池题目:(电子流向、阴阳离子迁移、pH值变化、电极方程式)5.以葡萄糖为燃料的微生物燃料电池的结构示意图如右图所示。
则电池工作时的负极反应为:;6. 以甲烷为燃料的燃料电池的结构示意图如下左图所示。
则电池工作时,负极反应为:;7.有一甲醇燃料电池,其结构示意图如上右图所示,则:(1)该电池工作时,b口通入的物质为,c口通入的物质为。
(2)该电池负极的电极反应式为。
(3)工作一段时间后,当6.4g甲醇完全反应生成CO2时,有N A个电子转移。
8.某电化学气敏传感器如右图所示,可用于监测环境中NH3的含量。
①电流由极流向极;②溶液中OH-向电极(填a或b)移动;③反应消耗的NH3与O2的物质的量之比为;④工作过程中,a极附近pH值(降低或升高);⑤a极的电极反应方程式为:。
9.右图所示是一种酸性燃料电池作为酒精检测仪,可以通过电化学反应,在液晶显示屏显示数值,从而检测酒精含量。
当有2.24L(标况下)O2参与反应时,电路中通过的电子数为N A,此时,有mol C2H5OH通过检测器,同时有mol H+穿过交换膜;该电池的负极反应式为。
10.通过NOx传感器可监测NOx的含量,其工作原理示意图如下:①Pt电极上发生的是反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
11.一种尿素燃料电池结构如下图所示。
其工作时负极的电极反应式可表示为:。
12.一种微生物燃料电池如图所示,下列关于该电池说法正确的是A.a电极发生还原反应,做原电池的正极B.b电极反应式为:2NO3-+10e-+12H+=N2↑+6H2OC.H+由右室通过质子交换膜进入左室D.标况下,电路中产生6moLCO2同时产生22.4L的N213.(2012·四川理综,11)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。
下列有关说法正确的是A.检测时,电解质溶液中的H+向负极移动B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气C.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2OD.正极上发生的反应为O2+4e-+2H2O===4OH-14.将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流。
下列正确的是①通入CH4的电极为正极②正极的电极反应式为O2+2H2O+4e-===4OH-③通入CH4的电极反应式为CH4+2O2+4e-===CO2+2H2O④负极的电极反应式为CH4+10OH--8e-===CO2-3+7H2O⑤放电时溶液中的阳离子向负极移动⑥放电时溶液中的阴离子向负极移动A.①③⑤B.②④⑥C.④⑤⑥D.①②③➢盐桥电池15.(2015·天津理综,4)锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是()A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的c(SO42-)减小C.电池工作一段时间后,乙池溶液的总质量增加D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡16.控制适合的条件,将反应2Fe3++2I-⇌2Fe2++I2设计成如下图所示的原电池。
下列判断不正确的是()A.反应开始时,乙中石墨电极上发生氧化反应B.反应开始时,甲中石墨电极上Fe3+被还原C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极➢锂电池:(简单锂电池,复杂锂电池)(1)金属Li单质一定是负极:负极反应:Li- e- == Li+(2)电解质溶液:通常是聚合物电解质,只传导Li+,一般不能是水溶液,否则会膨胀爆炸;(3)简单锂电池:单纯Li单质作负极,高价态氧化物等(MnO2, CoO2, FePO4)作正极;(4)复杂锂电池:层状结构的石墨作为Li单质的载体,负极材料表示为:LiCn 或LixCn正极材料表示为:CoO2或Li1-X CoO21. Li-MnO2 / FePO4 / SOCl22.Li-SOCl2电池可用于心脏起搏器。
该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。
电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。
3.某种聚合物锂离子电池放电时的反应为CoO2 + LiC6 == 6C + LiCoO2。
书写放电时正负极电极反应方程式:4.某种聚合物锂离子电池放电时的反应为Li1-x CoO2 + Li x C6 == 6C + LiCoO2,其电池如图所示。
下列说法不正确的是:A.放电时,Li x C6发生氧化反应B.充电时,Li+通过阳离子交换膜从左向右移动C.充电时,将电池的负极与外接电源的负极相连D.放电时,电池的正极反应为Li l-x CoO2 + xLi+ + xe- = LiCoO2【锂电池练习】1.(2015•路桥区模拟)随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。
特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式:Li x C6+Li1﹣x CoO2C6+LiCoO2。
下列说法不正确的是()A.充电时Li+从右边流向左边B.放电时,正极锂的化合价未发生改变C.充电时B作阳极,该电极放电时的电极反应式为:Li1﹣x CoO2+xLi++xe﹣=LiCoO2D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收2.(2015•赤峰校级模拟)锂空气电池放电时的工作原理如图所示.下列叙述正确的是()A.放电时Li+由B极向A极移动B.电池放电反应为4Li+O2+2H2O=4LiOHC.正极反应式为O2+4H++4e﹣=2H2O D.电解液a可以为LiCl溶液3.(2015•陕西三模)锂钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为V2O5+xLi═Li x V2O5,下列说法不正确的是()A.向外供电时,锂离子向负极移动B.负极上反应的物质是锂,正极上反应的物质是V2O5 C.正极的电极反应为:V2O5+xe﹣+xLi+═Li x V2O5 D.负极的电极反应为:xLi﹣xe﹣═xLi+4.(2015•安徽模拟)新一代锂电池的反应为:FePO4+Li LiFePO4该电池可用于电动汽车,其以含Li+的导电固体为电解质.下列有关LiFePO4电池说法正确的是()A.放电时电池正极反应为:FePO4+Li++e﹣═LiFePO4 B.充电时LiFePO4只发生氧化反应不发生还原反应C.充电过程中,电池正极材料的质量增加D.加入硫酸可以提高电解质的导电性5.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。