图像引导放疗简介
- 格式:ppt
- 大小:3.45 MB
- 文档页数:24


自适应放射治疗自适应放疗(adaptive radiation therapy, ART)是图像引导放疗(image-guided radiation therapy, IGRT)发展延伸出的一种新型放疗技术。
其实施是通过照射方式的改变来实现对患者组织解剖或肿瘤变化的调整,即通过引导图像(如CT、EPID等)评判患者解剖和生理变化,或治疗过程中所反馈信息如肿瘤大小、形态及位置变化,分析分次治疗与原计划设计之间的差异,从而指导后续分次治疗计划的重新设计。
自适应放射治疗的主要目的是提高肿瘤放疗的精准性,实现对肿瘤靶区高剂量照射的同时,最大限度地减少周围正常组织受到高剂量照射的可能性,进而降低并发症发生概率。
广义上讲,任何一种通过反馈来调节治疗过程的技术均可纳入ART 的范畴,比如影像引导放射治疗(IGRT)、体积引导放射治疗、剂量引导放射治疗(DGRT)、结构引导放射治疗等。
IGRT可谓是ART的初级阶段,它在三维放疗技术的基础上加入了时间因数的概念,充分考虑了解剖组织在治疗过程中的运动和分次治疗间的位移误差,如呼吸和蠕动运动、日常摆位误差、靶区收缩等引起放疗剂量分布的变化和对治疗计划的影响等方面的情况,在患者进行治疗前、治疗中利用各种先进的影像设备对肿瘤及正常器官进行实时的监控,并能根据器官位置的变化调整治疗条件使照射野紧紧“追随”靶区,使之能做到真正意义上的精确治疗。
而DGRT则是在IGRT的基础上提出的,DGRT 除了要对比图像数据外。
还要将治疗时的肿瘤和周围正常组织实际吸收剂量于治疗计划中出来的剂量进行比对,以及时调整患者摆位、治疗计划再优化,甚至在必要时修正处方剂量。
Mackie等于1993年发表了螺旋断层治疗(HT)设计思路的同时,就从理论上提出了利用其CT影像及剂量重建来修正对患者后续分次治疗的设想,这是第1次提及剂量重建和基于治疗时CT图像所获取信息的自适应放疗思想。
特别是近年来随着三维适形放疗和调强放疗的开展,越来越多的研究者关注于肿瘤靶区定义的精确性和对正常组织器官位置、大小和形状的改变都会影响到放疗的精准性。


mr-linac原理MR-LINAC原理是目前医学领域中一项非常重要的技术,它结合了磁共振成像(MR)和线性加速器(LINAC)的优势,为肿瘤治疗提供了更高的精确性和安全性。
本文将从MR-LINAC的原理、优势和应用领域三个方面进行介绍。
一、MR-LINAC原理MR-LINAC技术的核心是将磁共振成像与线性加速器结合起来,实现实时图像引导放疗。
具体来说,MR-LINAC系统由磁共振成像仪和线性加速器两部分组成,两者通过精确的空间校准和时间同步来实现联合工作。
1.1 磁共振成像(MR)部分磁共振成像是一种利用强磁场和无线电波对人体进行成像的技术。
在MR-LINAC系统中,磁共振成像仪通过产生强大的磁场和无线电波,可以获取患者体内的高分辨率三维图像。
这些图像可以帮助医生准确定位肿瘤的位置、形状和大小。
1.2 线性加速器(LINAC)部分线性加速器是一种利用电场加速带电粒子的装置。
在MR-LINAC系统中,线性加速器可以产生高能量的X射线或电子束,用于肿瘤的放疗。
与传统的线性加速器相比,MR-LINAC系统可以根据磁共振成像获得的信息,实时调整放疗的参数,以提高放疗的精确性和安全性。
二、MR-LINAC的优势MR-LINAC技术相比传统的放疗技术具有以下几个优势:2.1 实时图像引导MR-LINAC系统可以实时获取患者体内的高分辨率图像,医生可以根据这些图像来调整放疗的计划和参数,确保放疗的精确性和安全性。
2.2 个体化治疗MR-LINAC系统可以根据患者的个体差异,调整放疗的计划和参数。
通过实时图像引导,可以更好地控制肿瘤的剂量分布,减少对正常组织的损伤。
2.3 减少治疗时间MR-LINAC系统的实时图像引导功能可以减少治疗时间,提高患者的治疗效果。
相比传统的放疗技术,MR-LINAC系统可以更准确地定位肿瘤,减少治疗次数。
三、MR-LINAC的应用领域MR-LINAC技术在肿瘤治疗领域有着广泛的应用。


放疗中的定位和图像引导技术在肿瘤治疗中的应用肿瘤是一种常见的疾病,对患者的身体和心理健康都造成了巨大的影响。
放射治疗(Radiation Therapy)是一种常用的肿瘤治疗方法,它利用高能射线杀死癌细胞和抑制其生长。
在放疗过程中,准确定位和精确控制照射区域非常重要。
为此,医学界引入了定位和图像引导技术,以提高治疗效果和减少不良反应。
定位技术是放疗过程中确保照射准确性的重要手段之一。
传统的基于皮肤标记的定位方法往往会受到患者体形的变化和皮肤鬼影的影响,从而造成定位的误差。
而现代放疗利用图像引导技术进行定位的方法则更为准确。
这些技术包括CT (Computed Tomography)定位、MRI(Magnetic Resonance Imaging)定位和PET (Positron Emission Tomography)定位等。
CT定位是一种基于体内X射线吸收特性进行图像重建的技术。
患者在放疗前会进行CT扫描,从而获得详细的组织结构信息。
医生可以根据CT图像确定目标肿瘤的位置,并进行治疗计划的制定。
CT定位不仅能提供立体图像,而且运行速度较快,因此在放疗中广泛应用。
MRI定位是通过检测组织中水分分布的方式进行图像重建。
相比于CT定位,MRI定位能够提供更清晰的软组织图像,因此对于放疗的定位更为精确。
MRI还可以检测肿瘤的血流动力学变化,以评估治疗后的疗效。
PET定位则是利用放射性核素示踪技术,在放疗前进行PET扫描。
PET扫描可以提供关于体内代谢状态的信息,从而帮助医生确定治疗的靶区。
然而,由于PET扫描的分辨率相对较低,因此常常与其他图像引导技术进行结合使用。
除了定位技术,图像引导技术在放疗中还可以用于照射区域的调整和实时监测。
传统的放射治疗中,医生常常依靠人眼直观感受选择治疗区域,容易受到人为因素的影响。
而借助图像引导技术,医生可以根据患者的实际情况进行调整,以确保照射的精准性。
在放疗过程中,患者体形和肿瘤的位置可能会发生变化,因此,实时监测照射区域的位置和形态非常重要。

乳腺癌放疗乳腺癌放疗:现状与展望一、引言乳腺癌是女性最常见的恶性肿瘤之一,严重威胁女性健康。
近年来,随着医疗技术的不断发展,乳腺癌的治疗手段日益丰富,放疗作为乳腺癌综合治疗的重要组成部分,对于提高患者生存率和生活质量具有重要意义。
本文将对乳腺癌放疗的现状、技术进展及未来展望进行综述。
二、乳腺癌放疗的现状1.放疗在乳腺癌治疗中的地位放疗是乳腺癌综合治疗的关键环节,主要作用于局部控制和降低复发率。
对于早期乳腺癌,放疗可以降低局部复发率,提高生存率;对于局部晚期乳腺癌,放疗可以缓解症状,提高生活质量。
目前,放疗在乳腺癌治疗中的应用已得到广泛认可。
2.放疗技术(1)传统放疗技术:包括二维放疗(2D-RT)和三维适形放疗(3D-CRT)。
2D-RT技术较为简单,但照射范围较大,对正常组织损伤较大;3D-CRT技术可以提高靶区剂量分布,降低正常组织损伤。
(2)调强放疗(IMRT):通过调整射线强度,实现靶区剂量的均匀分布,进一步降低正常组织损伤。
(3)立体定向放疗(SBRT):采用立体定向技术,对靶区进行高剂量照射,具有精确度高、疗程短等优点。
(4)质子放疗:利用质子射线的布拉格峰特性,实现对肿瘤的高剂量照射,同时降低正常组织损伤。
3.放疗在乳腺癌治疗中的应用(1)术后放疗:针对乳腺癌术后患者,放疗可以降低局部复发率,提高生存率。
对于具有高危因素的患者,如淋巴结阳性、肿瘤较大等,术后放疗尤为重要。
(2)新辅助放疗:对于局部晚期乳腺癌,新辅助放疗可以缩小肿瘤体积,降低分期,提高手术切除率。
(3)姑息放疗:对于晚期乳腺癌患者,放疗可以缓解症状,提高生活质量。
三、乳腺癌放疗的技术进展1.图像引导放疗(IGRT):通过实时图像引导,确保放疗靶区的准确性,提高治疗效果。
2.四维放疗(4D-RT):考虑呼吸运动等因素,实现动态照射,降低正常组织损伤。
3.个体化放疗:根据患者的生物学特征,制定个体化放疗方案,提高治疗效果。
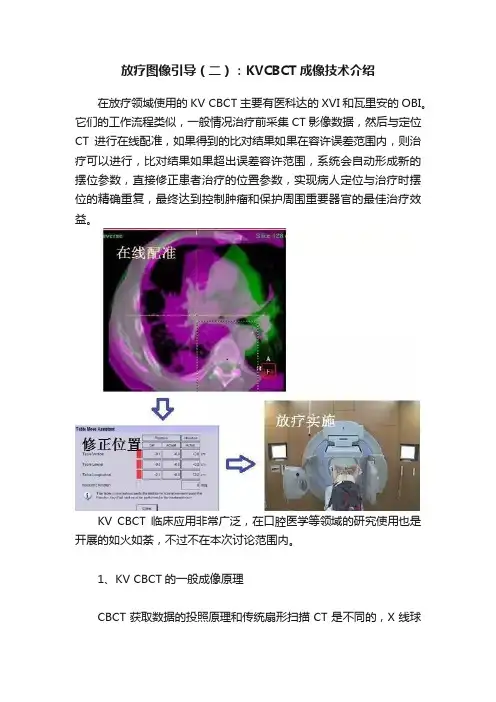
放疗图像引导(二):KVCBCT成像技术介绍在放疗领域使用的KV CBCT主要有医科达的XVI和瓦里安的OBI。
它们的工作流程类似,一般情况治疗前采集CT影像数据,然后与定位CT进行在线配准,如果得到的比对结果如果在容许误差范围内,则治疗可以进行,比对结果如果超出误差容许范围,系统会自动形成新的摆位参数,直接修正患者治疗的位置参数,实现病人定位与治疗时摆位的精确重复,最终达到控制肿瘤和保护周围重要器官的最佳治疗效益。
KV CBCT临床应用非常广泛,在口腔医学等领域的研究使用也是开展的如火如荼,不过不在本次讨论范围内。
1、KV CBCT的一般成像原理CBCT获取数据的投照原理和传统扇形扫描CT是不同的,X线球管以较低的射线量围绕患者做环形DR(数字式投照),获得的图像数据在计算机中重建后进而获得三维图像。
从成像结构看,CBCT用三维锥形束X线扫描代替常规诊断CT的二维扇形束扫描;与此相对应,CBCT采用一种二维面状探测器来代替常规诊断CT的线状探测器。
由上图可知,因为数据获取的方式不一样,常规诊断CT的投影数据是一维的,重建后的图像数据是二维的,后处理工作站上的三维图像是连续多个二维切片堆积而成的;CBCT的投影数据是二维的,重建后直接得到三维图像。
显然,CBCT采用锥形束X线扫描可以显著提高X线的利用率,只需旋转360度即可获取重建所需的全部原始数据,而且用面状探测器采集投影数据可以加速数据的采集速度。
见上图,需要特别指出,诊断级别的CBCT所具有的两个优势即很低的成像剂量和很高的各向同性空间分辨力,在放疗中使用的CBCT 正好相反,即成像软组织分辨率和空间分辨率均比较差,而且成像剂量要比常规诊断CT高一个数量级别。
2、放射治疗用KV CBCT的研发历程1992年,Dr.John Wong 在William Beaumont Hospital开始研究在加速器平台上进行kV 验证的可行性。
1995年,研究团队决定重点研究加速器平台上的kV CBCT的应用,两年后首次获得了kVCBCT 图像。

功能图像引导的适形调强放疗计划研究的开题报告一、研究背景放疗是治疗恶性肿瘤的重要手段之一,而适形调强放疗(IMRT)则是放疗领域中的前沿技术之一。
IMRT技术通过对放射束强度分布进行调整,可以实现照射靶区的最大剂量减少,同时避免对周围正常组织的伤害,因此在化疗和手术中无法彻底治愈肿瘤的情况下,IMRT技术成为了常用治疗手段。
然而,IMRT技术在治疗过程中也存在一些问题,例如病灶形态复杂时难以确定照射的角度、剂量等参数等问题。
功能图像引导的适形调强放疗计划(IG-IMRT)技术应运而生,在计算出病灶的代谢、功能特性后,生成一系列的病理图像,针对这些图像进行分析和处理,自动产生较为准确的放疗计划。
二、研究内容和目的本研究旨在研究功能图像引导的适形调强放疗计划的相关技术和应用,通过结合功能影像和CT影像,实现对靶区和正常组织精准分割,自动分析并确定最适合的治疗计划。
主要内容包括:1.建立小鼠背部裸鼠移植实体肿瘤模型,获取功能影像和CT影像数据。
2.使用功能影像和CT影像数据,利用医学图像处理技术对靶区和正常组织进行分割,自动分析并确定最适合的放疗计划。
3.通过与传统IMRT技术对比实验,验证IG-IMRT技术的疗效和优越性。
本研究旨在探索合理的治疗计划和离线计算的模式,为IMRT技术的临床应用提供参考。
三、研究方法和步骤1. 实验设计:在小鼠背部移植实体肿瘤模型的基础上,获取功能影像和CT影像数据,使用IG-IMRT技术和传统IMRT技术制定不同的放疗计划,对比两种计划的疗效和优越性。
2. 数据处理:对获取到的功能影像和CT影像数据使用医学图像处理技术进行预处理,包括图像配准、分割、去噪等。
3. 功能图像引导的适形调强放疗计划:利用分割后的靶区和正常组织进行适形分割,自动生成合理的,具有治疗策略的适形调强放疗计划。
4. 定义和测量指标:通过设置适当的指标,比较IG-IMRT技术和传统IMRT技术的治疗效果和计划质量。

IGRT及OBI简介所谓IGRT,就是图像引导放疗技术(Image Guided Radiation Therapy),是一种四维的放射治疗技术,它在三维放疗技术的基础上加入了时间因数的概念,充分考虑了解剖组织在治疗过程中的运动和分次治疗间的位移误差,如呼吸和蠕动运动、日常摆位误差、靶区收缩等引起放疗剂量分布的变化和对治疗计划的影响等方面的情况,在患者进行治疗前、治疗中利用各种先进的影像设备对肿瘤及正常器官进行实时的监控,并能根据器官位置的变化调整治疗条件使照射野紧紧“追随”靶区,使之能做到真正意义上的精确治疗。
上述为IGRT的广义,狭义就是在治疗机日复一日的采用图像引导。
目前,IGRT实现的硬件条件主要就是OBI,机载影像系统(on board imager)或图像引导系统。
该系统能联合X线透视监测和靶区成像,提供了放疗时三维软组织靶区影像和实时射线监测,使放疗靶区的确定建立在内靶区的基础上,而不是建立在体表标记或印记上,对放疗过程的在线或离线修正起着重要作用。
瓦里安Trilogy实现IGRT的就是靠OBI和EPID。
OBI系统硬件部分主要有产生kv级的X线球管和接收X 线的探测器,kv影像探测器PaxScan。
该球管的最小焦点为0.4mm,最大为0.8mm,最大输出功率为800kj/h。
PaxScan具有业界目前最高的帧速率(15‐30fps),适合运动幅度大的靶区,图像连续且无间断感。
OBI成像面积为40cm*30cm,3个运动自由度,还兼顾了碰撞限制,能应用于非共面治疗。
OBI的三种工作模式:1 影像模式(Radiography):可以为kv~kv matching,Mv~kv matching,Marker matching。
在拍片模式下,可以自动分析图像并显示误差自动进行肿瘤靶区的三维坐标修正。
2 透视模式(Fluoroscopy):可获得治疗靶区的动态影像,以便核实肿瘤的位置及运动误差。

放疗图像引导(一):各种成像技术介绍图像引导放射治疗(IGRT),是在患者进行治疗前、治疗中利用各种影像设备,对肿瘤及正常器官进行监控,并根据器官位置的变化调整治疗位置、治疗条件,使照射野紧紧“追随”靶区。
所以图像引导对于放射治疗的重要性,好比瞄准镜对于狙击步枪,卫星导航定位系统对于远程导弹。
接下来我们扒一扒那些不同厂家不同设备的图像引导成像技术。
1、电子射野影像系统(Electronic Portal Imaging Device,EPID)这种成像技术出现比较早,在2006年前是应用最广的成像技术,一般以6MV兆伏级X线进行拍片验证,可用较少的剂量获得较好成像质量。
具有体积小、分辨率高、灵敏度高、能响范围宽等优点,临床上摄片操作简单,成本低、容易实现。
既可以离线校正验证射野的大小、形状、位置和患者摆位,也可以直接测量射野内剂量,是一种简单实用的二维影像验证设备。
缺点是摄野片骨和空气对比度都较低,软组织显像不清晰,太依赖操作人员主观判断。
随着技术的发展,基于非晶硅平板探测器的EPID,可以直接测量射野内剂量,是一种快速的二维剂量测量系统,用EPID系统进行剂量学验证的研究开始不断增多,逐渐兴起并推向临床。
笔者相信EPID会迎来第二春。
2、KV级锥形束CT(Cone Beam CT,CBCT)这种成像技术是目前应用最广的图像引导技术,它使用大面积非晶硅数字化X射线探测板,机架旋转一周就能获取和重建一定体积范围内的CT图像。
这个体积内的CT影像重建后的三维影像模型,可以与治疗计划的患者模型匹配比较,并自动计算出治疗床需要调节的参数。
从机器图可以看到CBCT具有体积小、重量轻、开放式架构的特点,可以直接整合到直线加速器上。
CBCT的图像质量空间分辨率高,操作简单快捷。
放疗中最常使用的容积成像功能,可以快速完成在线校正治疗位置,深得技师喜爱。
同时它也具有在治疗位置进行X线透视、摄片等功能,不过这些临床功能使用不多(后续文章会完整介绍CBCT的功能)。
图像引导放疗中的医学图像配准关键技术研究图像引导放疗中的医学图像配准关键技术研究摘要:随着医学影像技术的不断发展,图像引导放疗已经成为现代肿瘤治疗的重要手段之一。
而对于图像引导放疗来说,图像配准技术是非常关键的环节,它可以确保放疗计划的准确性和治疗的精准性。
本文将介绍医学图像配准的基本原理、常用的图像配准方法以及当前图像引导放疗中面临的挑战和未来的发展方向。
1. 引言随着医学成像技术的飞速发展,各种各样的影像设备被广泛应用于临床。
例如,CT(计算机断层扫描)可以提供高分辨率的三维图像,MRI(磁共振成像)可以提供高对比度的软组织图像,PET(正电子发射计算机断层扫描)可以提供代谢活性图像,而超声成像则是一种无损的实时成像技术。
这些医学图像在肿瘤诊断、治疗规划和治疗提供了重要的信息。
2. 医学图像配准的基本原理医学图像配准是将不同影像设备获取的图像进行对齐和融合的过程,其目的是减少不同图像之间的空间错位,实现图像间的伽马校准。
图像配准的基本原理包括特征提取和特征匹配两个步骤。
特征提取是指从图像中选择具有唯一性和稳定性的特征点或特征描述子。
特征匹配是指将待配准图像与参考图像中的特征进行比较,找出相应的匹配点对。
3. 常用的图像配准方法目前,常用的医学图像配准方法主要包括点对点方法、基于特征的方法和基于区域的方法。
点对点方法是将两个图像中的特征点进行匹配,通过计算特征点之间的空间变换矩阵来实现图像的配准。
基于特征的方法则是对图像进行特征提取和匹配,然后通过变换矩阵来对图像进行配准。
基于区域的方法则是将图像划分为小块,通过对比颜色、纹理等特征来进行配准。
4. 图像引导放疗中的配准技术应用图像引导放疗是一种利用医学图像指导肿瘤放射治疗的技术。
它可以通过将患者在放疗过程中的CT图像与治疗计划中的CT图像进行配准,实时跟踪肿瘤位置的变化,调整治疗计划并保证放疗的准确性和精准性。
图像引导放疗中的配准技术主要用于确定患者体表标记与CT图像之间的对应关系,确定治疗计划中肿瘤和正常组织的位置,以及对放疗计划进行验证和调整。
IGRT放疗工作制度一、总则1.1 本制度旨在规范IGRT(Image-Guided Radiation Therapy,图像引导放射治疗)放疗工作流程,确保放疗安全、有效进行,提高患者生存质量和治疗效果。
1.2 本制度适用于我国从事IGRT放疗工作的医疗机构、医护人员及工作人员。
1.3 从事IGRT放疗工作的医疗机构应具备相应的资质和条件,严格按照国家放射诊疗相关法律法规和医院规章制度进行操作。
二、组织管理2.1 成立IGRT放疗小组,由科主任、主治医师、放疗技师、物理师、护士等组成。
2.2 IGRT放疗小组负责制定和完善IGRT放疗工作流程,组织培训和学术交流,提高放疗技术水平。
2.3 科主任负责对IGRT放疗工作进行全面领导,确保各项工作制度的落实和执行。
三、患者管理3.1 医生根据患者的病情、肿瘤部位、体质等因素综合评估,决定是否采用IGRT放疗。
3.2 医生向患者详细解释IGRT放疗的过程、优势、可能的风险及注意事项,取得患者同意后方可进行治疗。
3.3 医生、护士负责患者的日常护理和心理疏导,提高患者对治疗的信心和配合度。
四、设备管理4.1 确保IGRT放疗设备完好、稳定运行,定期进行维护、检查和校准。
4.2 工作人员熟悉掌握设备操作规程,严格按照操作规程进行操作,确保患者安全。
4.3 物理师负责制定和调整治疗计划,确保放疗剂量准确、合理。
五、放疗流程5.1 患者预约并按时到达放疗室,护士进行登记、测量身高体重,并为患者佩戴身份标识。
5.2 医生根据治疗计划,指导患者摆放正确的体位,并进行固定。
5.3 物理师根据患者体位和治疗计划,制作相应的铅挡块或适形铅模。
5.4 放疗技师进行IGRT扫描,获取患者体位和病变信息,传输给治疗计划系统。
5.5 医生根据IGRT扫描结果,调整治疗计划,确保放疗精度。
5.6 放疗技师按照调整后的治疗计划进行放疗,医生、护士密切观察患者病情变化,确保治疗安全。