氧化钠、过氧化钠的比较
- 格式:ppt
- 大小:165.00 KB
- 文档页数:1

过氧化钠做漂白剂的原理
过氧化钠(Na2O2)是一种强氧化剂,可以用作漂白剂。
它的原理如下:
1. 过氧化钠溶解在水中时会释放出氧气。
这些氧气分子具有很强的氧化能力,可以与有色物质中的不饱和键发生反应,使其分解或转变为无色化合物,从而达到漂白的效果。
2. 过氧化钠也可以通过直接与染料或色素发生氧化反应来漂白。
它可以断裂有机染料的色素键或质子化某些羧基,从而改变染料的结构并使其变得无色。
3. 过氧化钠还可以与污渍中的有机物发生氧化反应,将其分解为无害的物质,从而去除污渍并实现漂白的效果。
总而言之,过氧化钠作为漂白剂的原理是通过释放氧气、氧化染料或色素以及分解有机物来实现漂白作用。
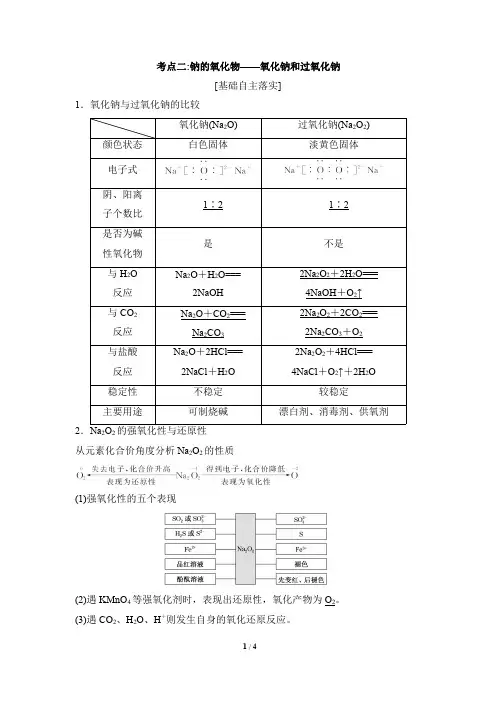
考点二:钠的氧化物——氧化钠和过氧化钠[基础自主落实]1.氧化钠与过氧化钠的比较氧化钠(Na 2O)过氧化钠(Na 2O 2)颜色状态白色固体淡黄色固体电子式阴、阳离子个数比1∶21∶2是否为碱性氧化物是不是与H 2O 反应Na 2O +H 2O===2NaOH 2Na 2O 2+2H 2O===4NaOH +O 2↑与CO 2反应Na 2O +CO 2===Na 2CO 32Na 2O 2+2CO 2===2Na 2CO 3+O 2与盐酸反应Na 2O +2HCl===2NaCl +H 2O 2Na 2O 2+4HCl===4NaCl +O 2↑+2H 2O稳定性不稳定较稳定主要用途可制烧碱漂白剂、消毒剂、供氧剂2.Na 2O 2的强氧化性与还原性从元素化合价角度分析Na 2O 2的性质(1)强氧化性的五个表现(2)遇KMnO 4等强氧化剂时,表现出还原性,氧化产物为O 2。
(3)遇CO 2、H 2O 、H +则发生自身的氧化还原反应。
小题热身1.判断正误(正确的打“√”,错误的打“×”)。
(1)氧化钠、过氧化钠均为碱性氧化物(×)(2)1mol Na2O2固体中含离子总数为4N A(×)(3)Na2O2溶于水产生O2的离子方程式为Na2O2+H2O===2Na++2OH-+O2↑(×)(4)Na2O2的电子式为(×)(5)1mol钠与氧气反应生成Na2O或Na2O2时,失去的电子数目均为N A(√)(6)Na2O2与H2O反应时,Na2O2既是还原剂又是氧化剂(√)(7)Na2O2在潮湿的空气中放置一段时间,最终产物是NaOH(×)(8)7.8g Na2O2与足量的CO2反应,转移电子的个数为0.2N A(×)2.如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。
钠及其氧化物的物质的量均为0.1mol,水的质量为100g。
一.金属钠1.钠的物理性质金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g /cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
2.钠的化学性质钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)②在空气(或氧气)中燃烧:2Na+O2Na2O2(黄色火焰),以上反应说明Na2O2比Na2O 稳定。
可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2NaCl(白烟)(2)钠与水反应:2Na+2H2O =2NaOH +H2↑现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。
③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:①钠与CuSO4溶液反应2Na+2H2O=NaOH+H2↑ (1)CuSO4+2NaOH=Na2SO4+Cu(OH)2(2)合并(1)(2)得:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2↑②钠与FeCl3溶液反应:6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑3.钠的存放和取用由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
4.钠的存在与用途自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。


第9讲 钠及其氧化物[复习目标] 1.了解钠的单质和氧化物的性质及用途。
2.掌握钠与氧气、水、酸、盐溶液反应的特点。
3.了解氧化钠与过氧化钠的区别,掌握Na 2O 2与H 2O 、CO 2反应的规律。
考点一 钠的性质及用途1.物理性质银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大。
2.从钠原子的原子结构认识钠的化学性质——还原性Na――――――――→O 2、Cl 2、H 2O 、H +等失去e-Na +(1)与非金属单质(如O 2、Cl 2)的反应O 2⎩⎨⎧常温:4Na +O 2===2Na 2O ;加热:2Na +O 2=====△Na 2O 2。
Cl 2:2Na +Cl 2=====点燃2NaCl 。
(2)与水反应①离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
②与滴加酚酞的水反应的现象及解释(3)与盐酸反应离子方程式:2Na +2H +===2Na ++H 2↑。
(4)与盐溶液反应与盐溶液反应时一般先与水反应,生成的NaOH 与盐可能发生复分解反应。
如与CuSO 4溶液反应:2Na +2H 2O===2NaOH +H 2↑,2NaOH +CuSO 4===Cu(OH)2↓+Na 2SO 4。
总反应为2Na +2H 2O +CuSO 4===Cu(OH)2↓+Na 2SO 4+H 2↑。
3.钠的制取及保存(1)制取:化学方程式为2NaCl(熔融)=====通电2Na +Cl 2↑。
(2)保存:密封保存,通常保存在石蜡油或煤油中。
4.钠的用途(1)钠钾合金(室温呈液态)可用于核反应堆的导热剂。
(2)用作电光源,制作高压钠灯。
(3)冶炼某些金属金属钠具有强还原性,熔融状态下可以用于治炼金属,如4Na +TiCl 4=====熔融4NaCl +Ti 。
1.钠可以保存在四氯化碳溶液中( )2.金属钠着火时,可用泡沫灭火器或干燥的沙土灭火( ) 3.钠表面自然形成的氧化层能够保护内层金属不被空气氧化( ) 4.金属钠具有强还原性,可与TiCl 4溶液反应制取金属Ti( )5.钠的金属性比钾强,工业上用钠制钾的原理为Na +KCl=====熔融K ↑+NaCl( ) 6.实验结束后剩余的金属钠不能随意丢弃,应放回原试剂瓶中( ) 答案 1.× 2.× 3.× 4.× 5.× 6.√一、钠的性质实验1.(2022·长春期中)下列关于钠的实验现象的叙述不正确的是( ) 选项 实验操作实验现象A 切开一小块钠,观察切面颜色的变化 钠切面颜色变暗,最后呈淡黄色 B把一小块钠投入CuSO 4溶液中钠熔化成闪亮的小球,在液面上四处游动,发出“嘶嘶”的响声,产生蓝色沉淀C 把一小块钠投入滴有紫色石蕊溶液的冷水中钠熔化成闪亮的小球,在液面上四处游动,发出“嘶嘶”的响声,反应后溶液变蓝D 把一小块钠迅速投入热坩埚中,继续加热坩埚片刻钠熔成小球,然后剧烈燃烧,发出黄色火焰,生成淡黄色固体答案A解析切开钠,钠与空气中的O2反应生成Na2O,切面颜色变暗,但最后不会呈淡黄色,A 项错误;把一小块钠投入CuSO4溶液中,钠先与水反应生成NaOH与H2,钠熔化成闪亮的小球,在液面上四处游动,发出“嘶嘶”的响声,NaOH与CuSO4反应生成Cu(OH)2蓝色沉淀,B项正确;把钠投入滴有紫色石蕊溶液的冷水中,钠与水反应生成NaOH与H2,钠熔化成闪亮的小球,在液面上四处游动,发出“嘶嘶”的响声,反应后溶液变蓝,C项正确;钠的熔点低,加热熔化,然后剧烈燃烧,发出黄色火焰,生成淡黄色固体,D项正确。

金属钠及其化合物知识归纳及巩固二、 钠的化合物22属于离子化合物。
其中钠元素以Na +形式存在,两个氧原子通过共用一对电子结合成一个整体,即O 22-,因此该化合物中,阴、阳离子个数比为1:2,Na 2O 2的电子式为,其中氧元素呈-1价。
2. 由于Na 2O 2因而既可表现氧化性又可表现还原性。
又因为氧的稳定价态是-2价,因此Na 2O 2中的氧易得到电子从-1价降到-2价,从而表现强氧化性。
Na 2O 2的漂白性是其强氧化性的表现。
过氧化钠具有强氧化性,能氧化破坏有机色素的分子结构,可以用来漂白织物、麦秆、羽毛等。
这一点与次氯酸、次氯酸盐相同,它能漂白的物质种类多,很彻底,不会逆转。
3. Na 2O 2与H 2O 反应中,电子转移的方向和数目。
Na 2O 2与H 2O 反应时,其反应过程如下:2Na 2O 2+4H 2O===4NaOH+2H 2O 2(非氧化还原反应) 2H 2O 2===2H 2O+O 2↑(氧化还原反应)总反应式为:2Na 2O 2+2H 2O===4NaOH+O 2↑。
显然,反应物H 2O 中的氢、氧两元素的化合价始终没有发生任何变化。
反应的实质是-1价氧元素发生了自身氧化还原反应;Na 2O 2既是氧化剂,又是还原剂;O 2是氧化产物。
该反应电子转移的方向数目可表示如下:Na Na+2e-单线桥法:2Na2O2+2H2O = 4NaOH+O2↑失2e-双线桥发:2Na2O2+4H2O===4NaOH+2H2O+O2↑得2e-4. Na2O2与CO2的反应,相当于在上边反应的基础上增加CO2与NaOH的反应,所以必须是潮湿的CO2才与Na2O2反应。
5. Na2O2是不是碱性氧化物?碱性氧化物是指和酸反应生成盐和水的氧化物。
它有以下特征:(1)与酸反应只生成盐和水;(2)与水直接或间接化合生成相应的碱;(3)与酸性氧化物反应生成相应的含氧酸盐;(4)反应中元素的化合价未发生变化。


钠及其重要化合物知识点总结一.金属钠1钠的物理性质金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g /cnf,比水的密度小,比煤油的密度大,熔点为97.81 C、沸点为882.9 C。
2•钠的化学性质钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+Q=2N@O,(空气中钠的切面变暗)②在空气(或氧气)中燃烧:2Na+O NaO2(黄色火焰),以上反应说明NaO2比NaO稳定。
可见,与02反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+C2 / NaCI(白烟)(2)钠与水反应:2Na+2HO =2NaOH +H T现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。
③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失,④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH再考虑NaOH是否与盐反应。
例如:①钠与CuSO溶液反应2Na+2HO=NaOH+H (1)CuSO+2NaO 耳NaSQ+Cu(OH) (2)合并(1)(2)得:2Na+2HO+CuSONaSO +Cu(OH)2 J +H T②钠与FeCb溶液反应:6Na+6HO+2FeC3=6NaCI+2Fe(OH3J +3H T3.钠的存放和取用由于金属钠的化学性质非常活泼,易与空气中的O、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
4.钠的存在与用途自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。


过氧化钠用作供氧剂的化学方程式
目前,氧化钠一直被广泛地用于化学反应中作为供氧剂。
氧化钠是乙酸钠,其
化学式表示为Na2CO3。
这种化学物质经过水合,可以生成由氧化物钠(Na2O)和
二氧化碳(CO2)组成的固态溶液,反应方程式为:Na2CO3 + H2O → 2NaOH + CO2・。
氧化钠中的钠原子,通过水分子中的水离子与氢原子结合形成NaOH,CO2也将
释放出来,从而提供充足的氧气来支持反应,可以在反应中维持氧气,促使反应进行。
而产生的NaOH作为碱性物质,具有一定的温和性,多用于各种酸性反应,同
时对许多化学反应的影响较小,因此具有一定的安全性。
另外,氧化钠还可以用来调节溶液的pH 值,例如它可以与高浓度的硫酸反应,形成氢硫酸钠,pH值将从1降低到3。
这一特性,使得氧化钠非常适合用作化学反应过程中的中和剂。
总之,氧化钠是一种重要的化学物质,它在化学反应中起着非常重要,多重作用,可以为反应过程提供氧气,保证反应安全,同时还可以用来调节反应环境的
pH值。
第一讲钠及其化合物1.1钠知识网络图解 银白色、密度小 物理性质硬度低、熔点低钠与氧气反应与硫、卤素单质反应钠元素位于元素周期表第三周期第IA化学性质与水反应族,原子最外层有一个电子,易失去,与酸反应有强还原性,显+1价与盐(溶液、熔融盐)反应知识点精析与运用知识点精析知识点1:研究物质性质的基本方法及基本程序1.研究物质的性质,常常运用观察、实验、分类、比较、假说、模型等方法。
2.研究物质性质的基本程序研究物质的性质时,首先要观察物质的外观,了解物质的存在状态、颜色、气味等;其次,通过实验来探究物质的有关性质。
为此要对物质性质进行预测、设计并实施实验来验证所做的预测;然后,通过对实验现象的观察和分析,归纳出与预测一致的性质,并对实验中所出现的特殊现象进行进一步的研究。
关于研究物质性质的程序可用下图来表示。
知识点2:钠原子结构从钠的原子核外电子排布看,其最外电子层上只有一个电子,因此,极易将这一电子失去,而达到稳定结构,形成+1价的钠阳离子(Na +)。
即金属钠的原子结构决定了其性质的活泼。
因其易失电子被氧化,故金属钠是还原剂。
知识点3:钠的物理性质钠是银白色金属,质软(可用刀切割),密度小(0.97g/cm 3),熔点低,是电和热的良导体。
知识点4:钠的化学性质由于钠原子最外层只有一个电子,在化学反应中容易失去最外层的一个电子变为钠离子:Na -e -→Na +所以钠的化学性质极活泼,具有强还原性,是强还原剂,具有金属的典型性质。
1.与非金属反应(1)与氧气的反应常温下能与空气中的氧气化合,表面变暗。
4Na+O 2=2Na 2O在空气或氧气中燃烧,发出黄色火焰,生成淡黄色固体。
2Na+O 2Na 2O 2(2)与硫反应2Na+S=Na 2S (研磨易爆炸)(3)与氯气反应2Na+Cl 22NaCl (发出黄色火焰,产生白烟)2.与水反应钠与水反应的实验现象及现象解释如下:点燃 点燃注:钠与水反应在钠的周围有白雾生成,此白雾是氢气燃烧产生的水蒸气。