初三化学 第八单元 金属计算专题 三
- 格式:docx
- 大小:167.60 KB
- 文档页数:2


第八单元金属和金属材料测试卷(三)班姓名:成绩:相对原子质量:H—1 O—16 Mg—24 Zn—65 Cl—35.5 S—32 Cu—64 一、选择题(每小题3分,共45分)1.下列过程中发生了化学变化的是( )A.铁水铸锅B.石蜡熔化C.钢铁生锈D.水的蒸发2.下列有关合金的叙述不正确的是( )A.合金也属于金属材料 B.合金的所有性能一定优于组成它的纯金属C.合金一定是混合物 D.合金中可能有非金属3.下列反应中,不属于置换反应的是( )A.Cl2+2NaBr===2NaCl+Br2B.Fe2O3+3CO =====高温2Fe+3CO2C.Zn+CuSO4===ZnSO4+Cu D.CuO+H2 =====△Cu+H2O4.铝在一百多年里产量得到大幅度的提高,并被广泛地使用,原因之一就是铝的抗腐蚀性能好。
铝具有良好抗腐蚀性能的原因是( )A.铝的化学性质不活泼 B.铝不与酸、碱反应C.铝常温下不与氧气反应 D.铝表面生成一层致密的氧化铝保护膜5.铁钉在钉入木制品时,有经验的木匠习惯用口水将铁钉润湿,你认为这样做的主要目的是( )A.使铁钉更容易钉入木制品 B.使钉入的铁钉易生锈,防止脱落C.防止铁钉生锈而腐蚀 D.增大铁钉钉入时的摩擦力6.合金由于其优良的性能在生产生活中得到了广泛的使用。
下列关于合金及纯金属的各项比较中,不正确的是( )A.含碳量:生铁>钢 B.抗腐蚀能力:不锈钢>纯铁C.硬度:纯铜>黄铜 D.熔点:纯锡>武德合金7.下列铁制品的防锈方法不合理的是( )A.汽车外壳——烤漆 B.水龙头——镀防护金属C.公交车扶手——涂防锈油 D.脸盆——烧涂搪瓷8.保险丝的作用是当电路上电流过大时,使其中的金属线(或片)产生高温而熔断,以保护电路免于受到伤害。
所以家庭电路中的保险丝,除了要具有良好的导电性外,还一定要具有( )A.较小的密度 B.较小的硬度 C.较低的熔点 D.较高的熔点9.仅用下列各组试剂无法完成验证Zn、Cu、Ag三种金属活动性顺序的是( )A.Zn、Ag、CuSO4溶液 B.Cu、ZnSO4溶液、AgNO3溶液C.Zn、Ag、稀硫酸、ZnSO4溶液 D.Zn、Cu、稀硫酸、AgNO3溶液10.把X、Y、Z三种金属分别放入稀盐酸中,X、Y溶解并有气泡产生,Z不反应,取过量X放入Y(NO3)2和Z(NO3)2的混合溶液中充分反应后过滤,经检验,滤渣中只有X、Z。


例析初三化学金属类计算题的常见解法初三化学计算题在初三化学中,金属类计算题是非常常见的。
这类题目主要涉及到金属的质量、体积、密度、摩尔质量等之间的关系,需要运用化学知识和数学运算来解答。
下面以几个常见的金属类计算题为例,详细解析其解题思路和解法。
1. 金属的密度为5.8 g/cm³,质量为38 g,请计算该金属的体积。
解题思路:根据密度的定义,密度=质量/体积。
我们已知密度和质量,所以通过这个公式可以计算出体积。
解题步骤:密度=质量/体积,即5.8=38/体积通过移项变形,可以得到体积=质量/密度代入已知数值,体积= 38 / 5.8 ≈ 6.55 cm³ (保留两位小数)2. 铁锭的摩尔质量为55.85 g/mol,质量为125 g,请计算该铁锭的摩尔数。
解题思路:摩尔质量表示每一摩尔物质的质量,而摩尔数表示物质的量。
我们可以根据质量和摩尔质量的关系来计算摩尔数。
解题步骤:摩尔质量=质量/摩尔数,即55.85=125/摩尔数通过移项变形,可以得到摩尔数=质量/摩尔质量代入已知数值,摩尔数= 125 / 55.85 ≈ 2.238 mol (保留三位小数)3.一些金属在250mL的容器中,质量为90g,请计算该金属的密度。
解题思路:密度的定义是质量与体积的比值,我们已知质量和体积,可以通过这个比值来计算密度。
解题步骤:密度=质量/体积,即密度=90g/250mL注意,体积的单位应该和密度单位一致。
在本题中,将mL换算为cm³,即密度= 90 g / 250 cm³计算得,密度≈ 0.36 g/cm³ (保留两位小数)4. 其中一种金属的质量为8.96 g,摩尔质量为63.55 g/mol,请计算该金属的摩尔数。
解题思路:与题目2类似,我们可以通过质量和摩尔质量的关系来计算摩尔数。
解题步骤:摩尔质量=质量/摩尔数,即63.55=8.96/摩尔数通过移项变形,摩尔数=质量/摩尔质量代入已知数值,摩尔数= 8.96 / 63.55 ≈ 0.141 mol (保留三位小数)通过以上四个例子的解析,我们可以看出,金属类计算题的解答方法主要是根据已知条件和化学公式之间的关系进行计算。

化学九年级人教新课标第8单元金属和金属材料知识点的归纳总结(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(化学九年级人教新课标第8单元金属和金属材料知识点的归纳总结(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为化学九年级人教新课标第8单元金属和金属材料知识点的归纳总结(word版可编辑修改)的全部内容。
第8单元《金属和金属材料》知识点的归纳总结一、金属材料纯金属(90多种)合金(几千种)2、金属的物理性质:(1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)(3)有良好的导热性、导电性、延展性3、金属之最:(1)铝:地壳中含量最多的金属元素(2)钙:人体中含量最多的金属元素(3)铁:目前世界年产量最多的金属(铁〉铝〉铜)(4)银:导电、导热性最好的金属(银>铜〉金〉铝)(5)铬:硬度最高的金属(6)钨:熔点最高的金属(7)汞:熔点最低的金属(8)锇:密度最大的金属(9)锂:密度最小的金属4、金属分类:黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属。
5、合金:混合物,至少有一种金属二、金属的化学性质1、大多数金属可与氧气的反应2、金属+ 酸→盐+ H2↑3、金属+ 盐→另一金属+ 另一盐(条件:“前换后,盐可溶")Fe + CuSO4== Cu + FeSO4(“湿法冶金”原理) 三、常见金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au金属活动性由强逐渐减弱在金属活动性顺序里:(1)金属的位置越靠前,它的活动性就越强(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。
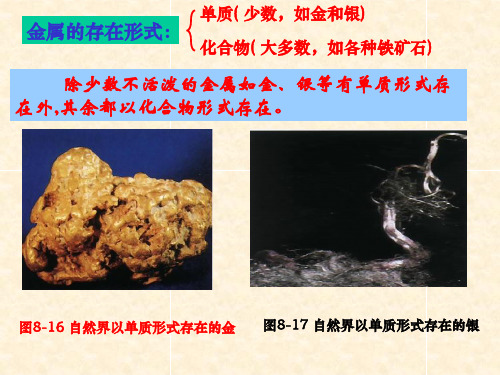
第八单元课题3 金属资源的利用和保护一、教材分析:本课题涉及面很广,包括地球上及我国的金属资源情况、铁的冶炼、有关化学方程式计算中的杂质问题计算、金属的腐蚀和防护,以及金属资源的保护等,既有知识、技能方面的内容,又有环境意识和资源意识等情感领域的内容。
是对前面两课题知识的应用,体现了金属材料某些化学性质,并针对这些性质提出炼铁的方法以及从我们日常生活中常有的现象来推出金属生锈的条件和防锈的方法。
把化学原理和生产生活实际紧密地结合在一起,使学习活动成为有机的整体,有利于学生主动参与学习。
课时分配:2课时。
二、教学目标:1. 知识与技能(1) 学会从铁矿石中将铁还原出来的方法。
(2) 学会有关化学方程式计算中的杂质问题计算。
(3) 理解金属锈蚀的条件以及生活中防止金属锈蚀的简单方法。
2. 过程与方法(1) 通过观察、实验、阅读资料、联系实际等方法获取信息。
(2) 通过对铁钉生锈条件的探究,学习运用对比实验方法。
3、情感态度和价值观目标(1) 增强对生活和自然界中化学现象的好奇心和探究欲。
(2) 逐步树立珍惜资源、爱护环境、合理使用化学物质的观念。
(3) 通过铁的冶炼原理和根据化学方程式有关杂质计算的学习,懂得化学原理、计算和生活实际是紧密结合的一个有机整体,培养学生主动参与学习的积极性。
三、教学重难点1、重点:炼铁的原理;铁锈蚀的条件及其防护。
2、难点:有关杂质问题的计算;对铁锈蚀条件的初步探究。
四、学情分析:本课题内容处在九年级整个教材的中间位置,学生已经具有一定的实验操作能力和原因分析能力,而铁是一种常见的金属,学生对于铁是如何得到的很有兴趣,并且学生对于铁制品容易生锈的事实较为熟悉,对防止金属生锈的措施也有所认识,但对其变化的实质尚不清楚,可通过阅读资料、探究性实验来合作学习本课题内容。
五、教学方法和学习方法1、教学方法:实验探究、讲练结合、分组讨论。
2、学习方法:合作学习、探究学习(注意优等生和后进生在学法上的区分)。
第八单元金属化学性质专项练习(三)
一、金属与氧气反应
二、金属与酸反应
三、金属和化合物(盐)的反应
写出下列方程式:
[1] 铝丝插入硝酸铜溶液________________________________ 现象:___________________
[2] 铜片插入硝酸银溶液_________________________________ 现象:___________________
[3] 湿法炼铜(硫酸铜溶液在铁板划线)________________________________ 现象:___________________
例1:如图所示,弹簧称下挂一重物,重物浸没在AgNO3溶液中,稳定时弹簧称读数F1.再向烧
杯中加入适量的铜粉,充分搅拌并配制足够的时间后,溶液体积未变,此时弹簧秤的读数为F2.已
知重物与前、后溶液均不发生任何反应,对于F1和F2的相对大小,下列说法正确的是()
A、无法判断
B、F2<F1
C、F2>F1
D、F2=F1
例2:锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,生成0.2g,将反应后
的溶液蒸发水分,则得固体硫酸、硫酸铝、硫酸镁的混合物的质量为()
A. 13.6g
B. 13.4g
C. 12g
D. 11g
例3:在AgNO3和Cu(NO3)2的混合溶液中,加入一定质量的铁粉,充分反应后,有少量金属析出,过滤后,像滤液,中滴加稀盐酸,有白色沉淀产生,则理论上析出的少量金属是()
A、Ag
B、Cu
C、Fe和Cu
D、Cu和Ag
例4:如图所示,在杠杆的两端分别挂质量相同的铜球和锌球;这时杠杆平衡,
然后两球分别浸没在稀硫酸和硫酸铜溶液中片刻;下列说法正确的是( )
A.取掉烧杯后,杠杆仍然平衡
B.两边烧杯中溶液的质量都增加
C.只有盛硫酸铜烧杯中溶液的质量增加
D.只有盛稀硫酸的烧杯中溶液的质量增加
综合
推断题混合金属分离
例5:化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属.流程如下:
请回答:
(1)四种金属的活动性顺序由强到弱的是______________________;
(2)固体丙中一定含有的金属是________________;
(3)写出③中反应的化学方程式__________________________________;
(4)为了检验滤液C中的溶质成分可向C中加入________。
实验题
例6:某化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案(1)试管乙中观察到的现象是_________________________,反应的化
学方程式为______________________________________
(2)同学们经讨论后认为该方案可以优化,试管的实验是多
余的。
同学经讨论得出三种金属的活动性由强到弱的顺序为
_______________
(3)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一
大烧杯中,一段时间后过滤,得到不溶物和滤液,并对不溶物的成分进
行如下探究:
【提出问题】烧杯中不溶物的成分是什么?
【实验探究】向过滤得到的不溶物中加稀硫酸
①若无气泡产生,则不溶物的成分是________
②若有气泡产生,则不溶物中一定含有______________ ,可能含有_____________
【实验结论】铁和水蒸气反应的化学方程式为___________________________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。