第16页,共20页。
练习(liànxí)2.某二元酸(H2A)在水中的电离方程
式是 H2A=H++HA-, HA-≒H++A2-
1.请判断H2A是强电解质还是弱电解质
理由是
2.已知0.1mol/LNaHA溶液的PH=2,则0.1mol/lH2A溶液中C(H+))应 0.11mol/L(填<,>或=)
元弱酸(HB)的比较:。4.一元强酸(HA)与一元弱酸(HB)的比较:。1)相同物质的量浓度 、相同体积时。2)相同pH、相同体积时
Image
第20页,共20页。
(guòchéng)
度 均升增高大,平衡向电离方向移动。K与
(2)浓度
弱电解质浓度越大,电离度
越小。K的大小与溶液的浓度无关.
第6页,共20页。
思考题1:
现有(xiàn yǒu)两瓶醋酸溶液,其物质的量浓
度分别为1 mol/L和0.1 mol/L,那么 这两瓶溶液的氢离子浓度的比值是大 于10、小于10、还是等于10 ?
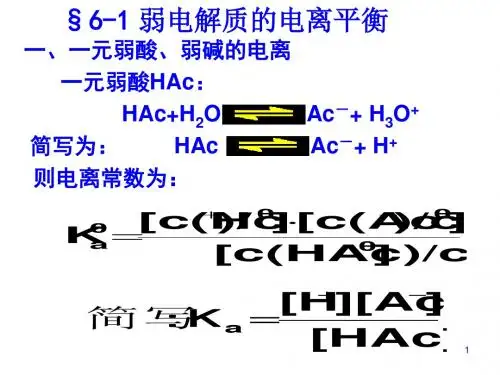
(1)电离平衡常数:
对于一元弱酸:HA
c ( H+) .c( A-)
Ka=
c(HA)
H++A-,平衡时
对于一元弱碱:MOH M++OH-,平衡时
c ( M+).c( OH- )
Kb=
c(MOH)
第3页,共20页。
(2)电离 度α (diànlí)
已电离的弱电解质浓度
α=
×100%
弱电解质的初始浓度
n(H+) C(H+) C (Ac- ) α
减小 减小 增大
Hale Waihona Puke 减小 减小 增大增大