无机化学实验第四版实验24铁钴镍
- 格式:docx
- 大小:83.78 KB
- 文档页数:4
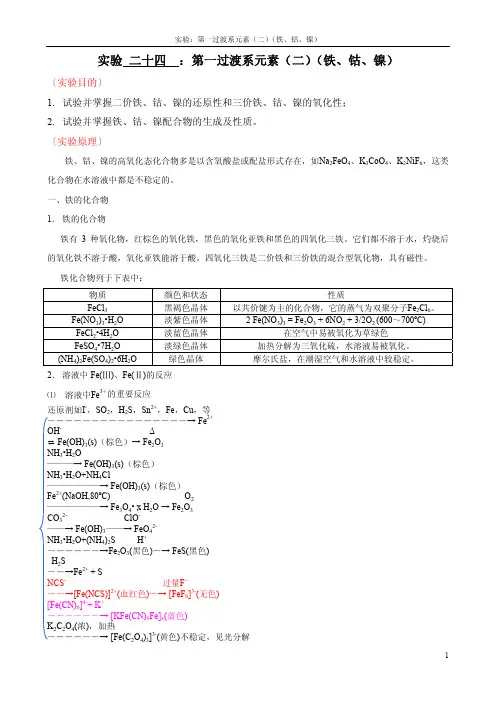
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。

实验25 第一过渡系元素(II)(铁,钴,镍)一、实验目的与要求:1.掌握二价铁,钴,镍的还原性和氧化性。
2.掌握铁,钴,镍配合物的生成及性质。
二、教学重点与难点:掌握二价铁,钴,镍的还原性和氧化性;掌握铁,钴,镍配合物的生成及性质。
三、教学方法与手段:讲授法;演示法四、教学课时: 4课时五、课的类型:实验课六、教学内容:[实验内容]:一、铁(II)、钴(II)、镍(II)的化合物的还原性1、铁(II)的还原性(1)酸性介质:往盛有0.5ml氯水的试管中加入3滴6 mol.L-1H2SO4溶液,然后滴加(NH4)2Fe(SO4)2溶液,观察现象,写出反应式:2Fe2+ + Cl2 === 2Fe3++ 2Cl-Fe3++nSCN-====[Fe(SCN)n]3-n(血红色)说明:Fe2+被氧化为Fe3+的现象不明显(淡绿色 黄棕色),可用KSCN检验Fe3+。
亚铁盐一般用硫酸亚铁铵,它稳定,不易分解,为防万一还需要加硫酸。
(2)碱性介质:在一试管中放入2ml蒸馏水和3滴6mol.L-1H2SO4溶液煮沸,以赶尽溶于其中的空气,然后溶于少量硫酸亚铁铵晶体。
在另一试管中加入3ml 6mol.L-1NaOH溶液煮沸。
冷却后,用一长滴管吸收NaOH溶液,插入(NH4)2Fe(SO4)2溶液到底部,慢慢挤出NaOH,观察产物颜色和状态。
Fe2++2OH- ====Fe(OH)2(为纯白色沉淀)4Fe(OH)2+O2+2H2O====4Fe(OH)3 (红褐色)说明:为了得到纯净的白色氢氧化亚铁沉淀,将溶液加热以赶净溶解在其中的氧气。
放置一段时间白色沉淀变为灰绿色,至实验结束也没有变为红褐色。
【现象:沉淀由白变成灰绿色再变成红棕色】2、钴(II)的还原性(1)、往盛有CoCl2溶液的试管中加入氯水,观察有何变化两者不反应.2Co2++Cl2+2H+ 不反应说明:在酸性溶液中,Co2+比较稳定,不易被氧化。
(2)、在盛有1ml CoCl2溶液的试管中滴入稀NaOH溶液(注:),观察沉淀的生成。

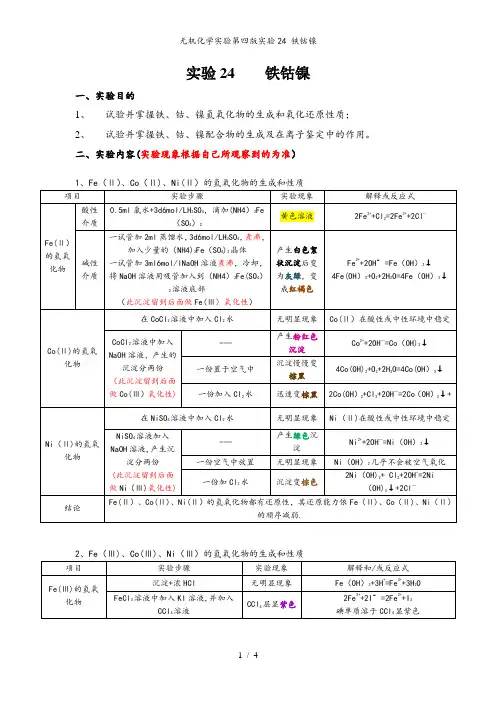
实验24 铁钴镍一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验内容(实验现象根据自己所观察到的为准)三、实验讨论(从自己实验操作展开)四、实验思考题和习题1。
实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?Fe(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色的转化过程。
2.根据实验现象总结+2价的铁、钴、镍化合物的还原性和+3价的铁钴镍化合物氧化性的变化规律。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的氢氧化物都有还原性,其还原能力依Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)在酸性介质中的氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)的顺序增加。
3。
比较钴镍氨配合物的氧化还原性相对大小及溶液稳定性。
钴盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co(Ⅲ)氨配合物。
即镍盐更稳定.4。
为什么制取+3价的钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co3+、Ni3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而Co(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
5。
如何分离混合液中的?Fe3+、Cr3+、Ni2+ ?6.总结Fe(Ⅱ、Ⅲ)、Co(Ⅱ、Ⅲ)、Ni(Ⅱ、Ⅲ)主要化合物性质。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)具有强的还原性,都易形成配合物,且Co的配合物极易被氧化,它们的氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强的氧化性,也易生成配合物。
7。
(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe (SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都是简单的,都可以轻易写出,在此我不一一写出了。
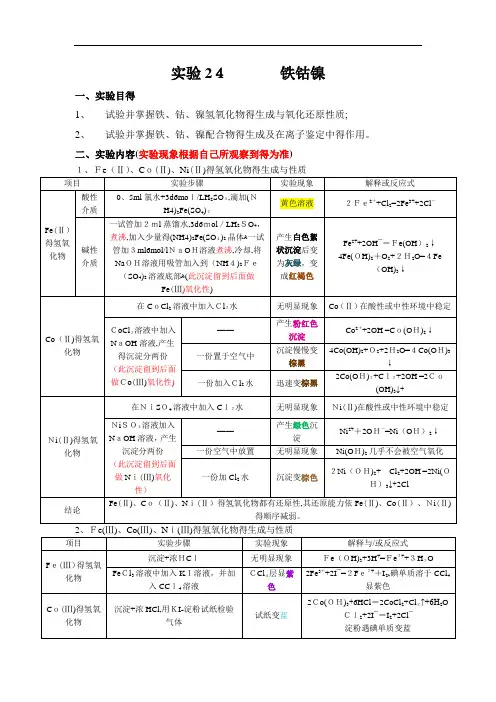
实验24铁钴镍一、实验目得1、试验并掌握铁、钴、镍氢氧化物得生成与氧化还原性质;2、试验并掌握铁、钴、镍配合物得生成及在离子鉴定中得作用。
二、实验内容(实验现象根据自己所观察到得为准)三、实验讨论(从自己实验操作展开) 四、实验思考题与习题1、实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?F e(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色得转化过程。
2.根据实验现象总结+2价得铁、钴、镍化合物得还原性与+3价得铁钴镍化合物氧化性得变化规律。
Fe (Ⅱ)、Co (Ⅱ)、Ni(Ⅱ)得氢氧化物都有还原性,其还原能力依Fe (Ⅱ)、Co (Ⅱ)、Ni (Ⅱ)得顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni (Ⅲ)在酸性介质中得氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)得顺序增加。
3、比较钴镍氨配合物得氧化还原性相对大小及溶液稳定性。
钴盐与镍盐生成碱式盐溶于过量得氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co (Ⅲ)氨配合物。
即镍盐更稳定。
4、为什么制取+3价得钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co 3+、Ni 3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而C o(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
53+3+2+ﻩ6.配合物极易被氧化,它们得氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强得氧化性,也易生成配合物。
7、(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe(SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都就是简单得,都可以轻易写出,在此我不一一写出了。

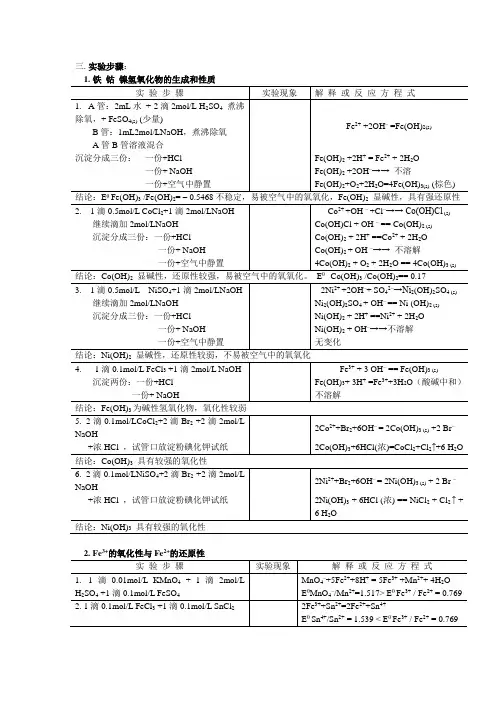
三.实验步骤:1.铁钴镍氢氧化物的生成和性质实验步骤实验现象解释或反应方程式1.A管:2mL水+ 2滴2mol/L H2SO4煮沸除氧,+ FeSO4(s) (少量)B管:1mL2mol/LNaOH,煮沸除氧A管B管溶液混合Fe2+ +2OH– =Fe(OH)2(s)沉淀分成三份:一份+HCl Fe(OH)2 +2H+ = Fe2+ + 2H2O一份+ NaOH Fe(OH)2 +2OH–→→不溶一份+空气中静置Fe(OH)2+O2+2H2O=4Fe(OH)3(s) (棕色) 结论:EθFe(OH)3 /Fe(OH)2= – 0.5468不稳定,易被空气中的氧氧化,Fe(OH)2显碱性,具有强还原性2. 1滴0.5mol/L CoCl2+1滴2mol/LNaOH Co2++OH –+Cl–→→ Co(OH)Cl (s)继续滴加2mol/LNaOH Co(OH)Cl + OH – == Co(OH)2 (s)沉淀分成三份:一份+HCl Co(OH)2 + 2H+ ==Co2+ + 2H2O一份+ NaOH Co(OH)2 + OH –→→不溶解一份+空气中静置4Co(OH)2 + O2 + 2H2O == 4Co(OH)3 (s)结论:Co(OH)2显碱性,还原性较强,易被空气中的氧氧化。
EθCo(OH)3 /Co(OH)2== 0.173. 1滴0.5mol/L NiSO4+1滴2mol/LNaOH 2Ni2+ +2OH–+ SO42–→Ni2(OH)2SO4 (s)继续滴加2mol/LNaOH Ni2(OH)2SO4 + OH–== Ni (OH)2 (s)沉淀分成三份:一份+HCl Ni(OH)2 + 2H+ ==Ni2+ + 2H2O一份+ NaOH Ni(OH)2 + OH–→→不溶解一份+空气中静置无变化结论:Ni(OH)2显碱性,还原性较弱,不易被空气中的氧氧化4. 1滴0.1mol/L FeCl3 +1滴2mol/L NaOH Fe3+ + 3 OH– == Fe(OH)3 (s)沉淀两份:一份+HCl Fe(OH)3+ 3H+ =Fe3++3H2O(酸碱中和)一份+ NaOH 不溶解结论:Fe(OH)3为碱性氢氧化物,氧化性较弱5. 2滴0.1mol/LCoCl2+2滴Br2 +2滴2mol/LNaOH2Co2++Br2+6OH–= 2Co(OH)3 (s) +2 Br–+浓HCl ,试管口放淀粉碘化钾试纸2Co(OH)3+6HCl(浓)=CoCl2+Cl2↑+6 H2O 结论:Co(OH)3具有较强的氧化性6. 2滴0.1mol/LNiSO4+2滴Br2 +2滴2mol/LNaOH2Ni2++Br2+6OH–= 2Ni(OH)3 (s) + 2 Br –+浓HCl ,试管口放淀粉碘化钾试纸2Ni(OH)3 + 6HCl (浓) == NiCl2 + Cl2 ↑ +6 H2O结论:Ni(OH)3具有较强的氧化性2.Fe3+的氧化性与Fe2+的还原性实验步骤实验现象解释或反应方程式1.1滴0.01mol/L KMnO4+ 1滴2mol/L H2SO4 +1滴0.1mol/L FeSO4MnO4–+5Fe2++8H+ = 5Fe3+ +Mn2++ 4H2OEθMnO4–/Mn2+=1.517> Eθ Fe3+ / Fe2+ = 0.7692. 1滴0.1mol/L FeCl3 +1滴0.1mol/L SnCl22Fe3++Sn2+=2Fe2++Sn4+Eθ Sn4+/Sn2+ = 1.539 < Eθ Fe3+ / Fe2+ = 0.769结论:在酸性条件下,Fe3+为中强氧化剂。

实验五:铁、钴、镍铁、钴、镍属于第八族元素,又称铁系元素。
氢氧化铁为红棕色固体,氢氧化亚铁为白色固体,但是氢氧化亚铁很容易被氧气氧化为氢氧化铁。
在Fe3+的溶液中滴加NH4SCN会得到Fe3+的血红色配合物,而在Fe2+的溶液中滴加NH4SCN不会有沉淀生成,也不会有颜色;在Co2+和Ni2+的溶液中滴加强碱,会生成粉红色氢氧化钴(II)和苹果绿色的氢氧化镍(II)沉淀,氢氧化钴(II)会被空气中的氧缓慢氧化为暗棕色的氧化物水合物Co2O3.xH2O。
氢氧化镍(II)需要在浓碱溶液中用较强的氧化剂(如次氯酸钠)才能氧化为黑色的NiO(OH)。
Co2O3和NiO(OH)会和水或酸根离子迅速发生氧化还原反应;在水溶液中Fe3+和Fe2+的水配合物的颜色分别为淡紫色和淡绿色的形式存在。
在Fe3+和Fe2+的溶液中分别滴加K4[Fe(CN)6]和K3[Fe(CN)6]溶液,都得到蓝色沉淀,它们是组成相同的普鲁士蓝和滕氏蓝,可以用来鉴定Fe3+和Fe2+的存在;由于Co3+在水溶液中不稳定,所以一般是将Co2+的盐溶在含有配合物的溶液中,用氧化剂将其氧化,从而得到Co3+的配合物;在含有Co2+的溶液中滴加NH4SCN溶液,会生成蓝色的[Co(NCS)4]2+,由此鉴定Co2+的存在;在含有Ni2+的溶液中逐滴滴加氨水,会得到蓝色Ni2+的配合物,在此基础上继续滴加丁二酮肟,得到鲜红色鳌合物沉淀,由此鉴定Ni2+的存在。
实验内容:1:Fe3+的氧化性、Fe2+的还原性及其离子鉴定(1)离子鉴定:分别用K4[Fe(CN)6]、K3[Fe(CN)6]、NH4SCN和0.25%邻菲罗啉来鉴定Fe3+和Fe2+。
(2)氧化还原特性;2:铁、钴、镍的氢氧化物,Co2+和Ni2+二价氢氧化物的制备与对比;3:钴、镍的配合物。
Co2+和Ni2+的鉴定反应。
注意事项:(1)此次实验是定性实验,颜色变化是实验的关键内容,颜色变化和离子的价态一一对应,仔细观察实验并在实验报告中反映、思考;药品:0.2M的FeCl3,2M的硫酸,铁粉,0.5M的NH4SCN,浓硝酸,0.1M的KMnO4,0.2M的Co(NO3)2,2M的NaOH,2M的HCl,0.2M的Ni(NO3)2,NH4Cl固体,6M的氨水,5%的H2O2,戊醇,饱和NH4SCN(溶解度:300C下,208克/100克水),0.2M的Ni(NO3)2,丁二酮肟(补加的药品)。


无机化学实验二十五铁、钴、镍(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--实验二十五铁、钴、镍[实验目的]1、试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2、试验并掌握铁、钴、镍配合物的生成和Fe2+、Fe3+、Co2+、Ni2+离子的鉴定方法;3、了解金属铁腐蚀的基本原理及其防止腐蚀的方法。
[实验用品]仪器:试管、离心试管固体药品:硫酸亚铁铵、硫氰酸钾液体药品:H2SO4(1mo1·L-1,6mo1·L-1)、HCl(浓)、NaOH(6mo1·L-1、2mo1·L-1)、氨水(6 mo1·L-1,浓)、(NH4)2Fe(SO4)2(固体,·L-1)、CoC12·L-1)、NiSO4·L-1)、KI·L-1)、K4[Fe(CN)6]·L-1)、FeCl3·L-1)、KSCN·L-1)、H2O2(3%)、氯水、碘水、四氯化碳、戌醇、乙醚材料:碘化钾淀粉试纸[实验内容]一、铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的化合物·的还原性1.铁(Ⅱ)的还原性(1)酸性介质:往盛有5d氯水的试管中加入2d 6mo1·L-1硫酸溶液,然后滴加硫酸亚铁铵溶液1-2d,观察现象,写出反应式。
(如现象不明显,可加1滴KSCN溶液,出现红色,证明有Fe3+生成)(2)碱性介质:在一试管中放入2mL蒸馏水和3d 6mo1·L-1硫酸溶液,煮沸,以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体(溶液表面若加3~4d油以隔绝空气,效果更好)。
在另一试管中加入1m1 6mo1·L-1氢氧化钠溶液,煮沸(为什么)。
冷却后,用一长d管吸取氢氧化钠溶液,插入硫酸亚铁铵溶液(直至试管底部)内,慢慢放出氢氧化钠(整个操作都要避免空气带进溶液中,为什么?)观察产物颜色和状态。
无机化学实验二十五铁、钴、镍实验二十五铁、钴、镍[实验目的]1、试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2、试验并掌握铁、钴、镍配合物的生成和Fe2+、Fe3+、Co2+、Ni2+离子的鉴定方法;3、了解金属铁腐蚀的基本原理及其防止腐蚀的方法。
[实验用品]仪器:试管、离心试管固体药品:硫酸亚铁铵、硫氰酸钾液体药品:H2SO4(1mo1·L-1,6mo1·L-1)、HCl(浓)、NaOH(6mo1·L-1、2mo1·L-1)、氨水(6 mo1·L-1,浓)、(NH4)2Fe(SO4)2(固体,·L-1)、CoC12·L-1)、NiSO4·L-1)、KI·L-1)、K4[Fe(CN)6]·L-1)、FeCl3·L-1)、KSCN·L-1)、H2O2(3%)、氯水、碘水、四氯化碳、戌醇、乙醚材料:碘化钾淀粉试纸[实验内容]一、铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的化合物·的还原性1.铁(Ⅱ)的还原性(1)酸性介质:往盛有5d氯水的试管中加入2d 6mo1·L-1硫酸溶液,然后滴加硫酸亚铁铵溶液1-2d,观察现象,写出反应式。
(如现象不明显,可加1滴KSCN溶液,出现红色,证明有Fe3+生成)(2)碱性介质:在一试管中放入2mL蒸馏水和3d 6mo1·L-1硫酸溶液,煮沸,以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体(溶液表面若加3~4d油以隔绝空气,效果更好)。
在另一试管中加入1m1 6mo1·L-1氢氧化钠溶液,煮沸(为什么)。
冷却后,用一长d 管吸取氢氧化钠溶液,插入硫酸亚铁铵溶液(直至试管底部)内,慢慢放出氢氧化钠(整个操作都要避免空气带进溶液中,为什么)观察产物颜色和状态。
振荡后放置一段时间,观察又有何变化。
写出反应方程式。
无机化学实验二十五铁、钴、镍实验二十五铁、钴、镍[实验目的]1、试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2、试验并掌握铁、钴、镍配合物的生成和Fe2+、Fe3+、Co2+、Ni2+离子的鉴定方法;3、了解金属铁腐蚀的基本原理及其防止腐蚀的方法。
[实验用品] 仪器:试管、离心试管固体药品:硫酸亚铁铵、硫氰酸钾液体药品:H2SO4(1mo1·L-1,6mo1·L-1)、HCl(浓)、NaOH(6mo1·L-1、2mo1·L-1)、氨水(6 mo1·L-1,浓)、(NH4)2Fe(SO4)2(固体,0.1mo1·L-1)、CoC12(0.1mo1·L-1)、NiSO4(0.1mo1·L-1)、KI(0.5mo1·L-1)、K4[Fe(CN)6](0.5mo1·L-1)、FeCl3(0.2mo1·L-1)、KSCN(0.5mo1·L-1)、H2O2(3%)、氯水、碘水、四氯化碳、戌醇、乙醚材料:碘化钾淀粉试纸 [实验内容]一、铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的化合物·的还原性1.铁(Ⅱ)的还原性(1)酸性介质:往盛有5d氯水的试管中加入2d 6mo1·L-1硫酸溶液,然后滴加硫酸亚铁铵溶液1-2d,观察现象,写出反应式。
(如现象不明显,可加1滴KSCN 溶液,出现红色,证明有Fe3+生成)(2)碱性介质:在一试管中放入2mL蒸馏水和3d 6mo1·L-1硫酸溶液,煮沸,以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体(溶液表面若加3~4d油以隔绝空气,效果更好)。
在另一试管中加入1m1 6mo1·L-1氢氧化钠溶液,煮沸(为什么?)。
冷却后,用一长d管吸取氢氧化钠溶液,插入硫酸亚铁铵溶液(直至试管底部)内,慢慢放出氢氧化钠(整个操作都要避免空气带进溶液中,为什么?)观察产物颜色和状态。
一、实验目的1. 了解铁、铬、镍的物理和化学性质。
2. 掌握铁铬镍合金的制备方法及其特性。
3. 通过实验操作,提高实验技能和数据分析能力。
二、实验原理铁、铬、镍均为过渡金属,具有独特的物理和化学性质。
铁具有优良的机械性能和耐腐蚀性,铬具有高硬度和良好的耐腐蚀性,镍具有良好的耐腐蚀性和低温性能。
铁铬镍合金结合了这三种金属的优点,具有高强度、高韧性、良好的耐腐蚀性和耐高温性。
三、实验材料与仪器实验材料:- 铁粉- 铬粉- 镍粉- 硼砂- 氢氧化钠- 盐酸- 氨水- 硫酸- 碘化钾- 氯化钡- 氢氧化钾- 氢氧化钠溶液- 盐酸溶液- 氨水溶液- 硫酸溶液- 碘化钾溶液- 氯化钡溶液- 氢氧化钾溶液实验仪器:- 坩埚- 烧杯- 烧瓶- 滴定管- 漏斗- 玻璃棒- 酒精灯- 铁架台- 研钵- 研杵四、实验步骤1. 制备铁铬镍合金:- 将铁粉、铬粉和镍粉按照一定比例混合。
- 将混合粉末放入坩埚中。
- 在酒精灯上加热,使粉末熔化。
- 熔化后,将合金倒入模具中,冷却固化。
2. 观察合金性质:- 观察合金的颜色、硬度、密度等物理性质。
- 使用酸碱滴定法、氧化还原滴定法等方法,测定合金的化学成分。
3. 制备铁铬镍合金溶液:- 将制备好的合金放入烧杯中。
- 加入适量的盐酸溶液,溶解合金。
- 将溶液过滤,得到铁铬镍合金溶液。
4. 测定溶液中金属离子浓度:- 使用碘量法测定溶液中铬离子的浓度。
- 使用氧化还原滴定法测定溶液中镍离子的浓度。
五、实验结果与分析1. 铁铬镍合金的性质:- 合金颜色为银白色,具有金属光泽。
- 合金硬度较高,不易划伤。
- 合金密度约为8.0g/cm³。
2. 溶液中金属离子浓度:- 铬离子浓度为0.2mol/L。
- 镍离子浓度为0.3mol/L。
六、结论与建议1. 结论:- 成功制备了铁铬镍合金,并对其性质进行了研究。
- 合金具有高强度、高韧性、良好的耐腐蚀性和耐高温性。
2. 建议:- 在实验过程中,注意安全操作,避免火灾和中毒。
凡事贵在坚持实验 24铁钴镍一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
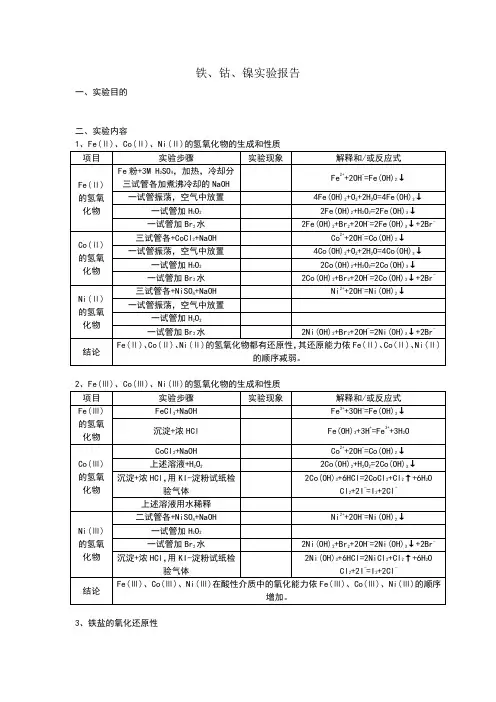
二、实验内容(实验现象根据自己所观察到的为准)1、Fe( Ⅱ )、 Co( Ⅱ )、 Ni( Ⅱ )的氢氧化物的生成和性质项目酸性介质Fe( Ⅱ )的氢氧碱性化物介质实验步骤0.5ml 氯水 +3d6mol/LH 2SO4,滴加(NH4) 2 Fe(SO4)2一试管加2ml 蒸馏水 ,3d6mol/LH 2SO4,煮沸,加入少量的 (NH4) 2Fe(SO4)2晶体一试管加3ml6mol/lNaOH溶液煮沸,冷却,将NaOH 溶液用吸管加入到 (NH4) 2Fe(SO4)2溶液底部(此沉淀留到后面做Fe( Ⅲ )氧化性)实验现象黄色溶液产生白色絮状沉淀后变为灰绿,变成红褐色解释或反应式2Fe2++Cl 2=2Fe3+ +2Cl -Fe2++2OH ˉ=Fe(OH) 2↓4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3↓在 CoCl 2溶液中加入 Cl 2水无明显现象Co( Ⅱ )在酸性或中性环境中稳定CoCl 2溶液中加入——产生粉红色Co2++2OH -=Co(OH) 2↓Co( Ⅱ )的氢氧沉淀NaOH 溶液,产生化物沉淀慢慢变的沉淀分两份一份置于空气中4Co(OH) 2+O 2+2H 2O=4Co(OH) 3↓棕黑(此沉淀留到后面做 Co( Ⅲ )氧化性 )一份加入 Cl 2水迅速变棕黑-2Co(OH) 2+Cl 2+2OH =2Co(OH) 3↓+在 NiSO 4溶液中加入 Cl 2水无明显现象Ni ( Ⅱ )在酸性或中性环境中稳定Ni ( Ⅱ )的氢氧NiSO 4溶液加入——产生绿色沉Ni 2++2OH -=Ni(OH) 2↓NaOH 溶液,产生淀化物沉淀分两份一份空气中放置无明显现象Ni(OH) 2几乎不会被空气氧化(此沉淀留到后面一份加 Cl 2水沉淀变棕色2Ni(OH) 2+做 Ni ( Ⅲ )氧化性 )Cl 2+2OH - =2Ni(OH) 3↓+2Cl -结论Fe( Ⅱ )、 Co( Ⅱ )、 Ni ( Ⅱ )的氢氧化物都有还原性,其还原能力依Fe( Ⅱ )、 Co( Ⅱ )、 Ni ( Ⅱ )的顺序减弱。
2、Fe(Ⅲ )、 Co(Ⅲ )、Ni( Ⅲ )的氢氧化物的生成和性质项目实验步骤实验现象解释和 /或反应式Fe( Ⅲ )的氢氧沉淀 +浓 HCl无明显现象Fe(OH) 3+3H +=Fe 3++3H 2OFeCl 3溶液中加入 KI 溶液,并加入2Fe3++2I ˉ=2Fe2++I 2化物CCl 4层显紫色CCl 4溶液碘单质溶于 CCl 4显紫色2Co(OH) 3 +6HCl =2CoCl2 +Cl 2 ↑ +6HCo( Ⅲ )的氢氧沉淀 + 浓 HCl ,用 KI- 淀粉试纸检验2 O化物试纸变 蓝Cl 2 +2I ˉ=I 2+2Cl ˉ气体淀粉遇碘单质变蓝Ni ( Ⅲ )的氢氧沉淀 + 浓 HCl ,用 KI- 淀粉试纸检验2Ni(OH) 3+6HCl =2NiCl 2 +Cl 2 ↑ +6H 2OCl 2+2I - =I 2+2Cl -化物试纸变 蓝气体淀粉遇碘单质变蓝结论Fe( Ⅲ )、 Co( Ⅲ )、 Ni ( Ⅲ)在酸性介质中的氧化能力依 Fe( Ⅲ )、 Co( Ⅲ )、 Ni ( Ⅲ )的顺序增加。
3、Fe 、Co 、Ni 的配合物项目 实验步骤向 1mlK 4 [Fe(CN) 6]溶液中加 0.5mlI 2 水,滴入 (NH4) 2Fe(SO 4)2 溶液实验现象产生 深红色晶体后变成 蓝色 沉淀解释和 /或反应式[Fe(CN) 6]4 —+I 2=2I — +2[Fe(CN) 6]3+↓Fe 2+ +[Fe(CN) 6 ]3++K +=KFe[Fe(CN) 6] ↓Fe 的配合物(NH4) 2Fe(SO 4)2溶液加入 I 2 水,加入 KSCN 溶液,分为两份在 FeCl 3 溶液中加入液加入 0.2ml 3%H 2O 2 溶液置于在空气中K 4[Fe(CN) 6] 溶 产生 血红色产生 血红色 ,且产生气泡产生 蓝色 沉淀2+3+—2Fe +I 2=2Fe +2I3+—Fe +3SCN =Fe(SCN) 3SCN — +3H 2 O 2=HCN ↑ +H ++SO 42 —+2H 2OK ++Fe 3++[Fe(CN) 6] 4— =KFe[Fe(CN) 6] ↓FeCl 3 溶液中滴加过量 NH 3 水在 1mlCoCl 2 溶液中加入 KSCN 溶液再各加入 0.5ml 乙醚及戊醇,振荡Co 的配合物CoCl 2+过量 NH 3 水2ml 0.1mol/l NiSO 4 溶液加入过量NH 3水产生 红褐色沉淀,氨水过量不溶解晶体周围 蓝色,后溶液分层,有机层 蓝色蓝色 →紫色→ 橙黄色产生的 绿色 的沉淀溶解Fe 3++3NH 3H 2O=Fe(OH) 3↓ +3NH 4 +Co 2+ +4SCN — =[Co(SCN)] 2 —(有机溶剂 中显蓝色 )--CoCl 2+OH =Co(OH)Cl ↓ +ClCo(OH)Cl+6NH 3=[Co(NH 3)6 ]2++OH -+Cl -2+3+ 4[Co(NH3 62 2O=4[Co(NH3 6] +4) ] +O +2H)OH -2Ni 2++2NH 3· H 2O+SO 4 2- 2(OH)24 ↓+2NH 4 +=NiSONi 2 (OH) 2SO 4+12NH 3 =2[Ni(NH 3)6]2++2OH -+SO 4 2↓Ni 的配合物——————加入 2mol/l上述溶液分四份绿色沉淀NaOH 溶液加入浅绿色 沉淀1mol/LH 2SO 4存在平衡 [Ni(NH 3 )6] 2+ ? Ni 2++6NH 3加入 OH — ,生成 Ni(OH) 22+—Ni +2OH =Ni(OH) 2↓加入 SO 4 2+,再次生成 Ni 2 (OH) 2 SO 42Ni 2++2NH 3· H 2O溶液+SO 42-=Ni 2(OH) 2SO4↓+2NH 4+加水稀释浅绿色溶液加入水,平衡右移,显Ni 2+颜色煮沸浅绿色沉淀煮沸,氨气溢出,生成Ni(OH) 2 Ni 2+ +2NH 3·H 2O=Ni(OH) 2↓ +2NH 4+铁盐生成氢氧化物不溶于过量的氨水,钴盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,结论Co ( Ⅱ )氨配合物易氧化转化成Co( Ⅲ )氨配合物。
三、实验讨论(从自己实验操作展开)四、实验思考题和习题1.实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?Fe(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色的转化过程。
2.根据实验现象总结 +2 价的铁、钴、镍化合物的还原性和+3 价的铁钴镍化合物氧化性的变化规律。
Fe(Ⅱ )、Co(Ⅱ)、Ni( Ⅱ)的氢氧化物都有还原性,其还原能力依 Fe(Ⅱ )、Co(Ⅱ)、Ni( Ⅱ )的顺序减弱。
Fe(Ⅲ )、Co(Ⅲ )、Ni( Ⅲ)在酸性介质中的氧化能力依Fe(Ⅲ)、Co(Ⅲ )、Ni( Ⅲ)的顺序增加。
3.比较钴镍氨配合物的氧化还原性相对大小及溶液稳定性。
钴盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成Co(Ⅲ)氨配合物。
即镍盐更稳定。
4.为什么制取 +3 价的钴镍氢氧化物要用 +2 价为原料在碱性条件下进行氧化,而不 +3 价直接制取?首先,作为最高价氧化值, Co3+、Ni 3+氧化性比较不稳定,易变成其它价态,故不用采用 +3 价直接氧化得到。
其次,而 Co(OH) 2、Ni(OH) 2两性,在碱性条件下易被氧化成 +3 价氢氧化物。
5.如何分离混合液中的? Fe3+、Cr3+、 Ni 2+?[Ni (NH 3)6] 2+加 Na OHNi (OH) 23+Cr3+、加入过量氨水Fe、Ni 2+Fe(OH) 3↓Fe(OH) 3加Na OHCr(OH) 3↓NaCrO26.总结 Fe(Ⅱ、Ⅲ )、 Co(Ⅱ、Ⅲ )、Ni( Ⅱ、Ⅲ )主要化合物性质。
Fe(Ⅱ )、Co(Ⅱ )、Ni( Ⅱ)具有强的还原性,都易形成配合物,且Co 的配合物极易被氧化,它们的氢氧化物也易被氧化;Fe(Ⅲ)、 Co(Ⅲ)、 Ni( Ⅲ)具有强的氧化性,也易生成配合物。
7.(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe (SO4)2溶液C: Fe(OH) 2D:NH 3E:I2F: Fe3+G: KFe[Fe(CN) 6]H : BaSO4这些方程式都是简单的,都可以轻易写出,在此我不一一写出了。