普通化学第九章 原子结构和元素周期律
- 格式:ppt
- 大小:2.32 MB
- 文档页数:55

原子结构元素周期律知识总结一、原子结构1.几个量的关系(X)质量数(A)=质子数(Z)+中子数(N)质子数=核电荷数=原子序数=原子的核外电子数阳离子:核外电子数=质子数—所带电荷数阴离子:核外电子数=质子数+所带电荷数2.同位素(1)要点:同——质子数相同,异——中子数不同,微粒——原子。
(2)特点:同位素的化学性质几乎完全相同;3.核外电子排布规律(1).核外电子是由里向外,分层排布的。
(2).各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个(第一层为最外层不超过2个),次外层电子数不得超过18个,。
(3).以上几点互相联系。
二、元素周期律和周期表1.几个量的关系周期数=电子层数主族序数=最外层电子数=最高正价数 |最高正价|+|负价|=8O、F无最高正价,金属无负价2.周期表中部分规律总结(1).最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He除外)。
(2).在周期表中,第ⅡA与ⅢA族元素的原子序数差分别有以下三种情况:①第2、3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期相差25。
(3).同主族相邻元素的原子序数差别有以下二种情况:①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅢA~ⅦA族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
4概念:元素的性质随着元素核电荷数的递增而呈周期性变化的规律叫做元素周期律。
本质:元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
(1)、半径(除稀有气体外)同周期元素原子从左到右逐渐减少,同主族元素原子从上到下逐渐增大。
(2)不同电子层数的粒子,电子层数多半径大。
(3)相同核外电子排布的粒子,核电荷数大半径小。
(4)同种元素的原子阴离子半径大于原子半径,原子半径大于阳离子半径。



原子结构一、认识原子结构发展历程惠施:物质是无限可分的。
墨子:物质分割是有一定条件的,当物质不存在被分割的条件,物质就不能被分割。
德谟克利特----古典原子论:物质有极小的原子构成,物质只能分割到原子为止。
道尔顿----道尔顿原子学说:①化学元素均有不可再分的微粒构成。
(×)②原子在一切化学变化中均保持其不可再分性。
(×)③同一元素的原子在质量和性质上都相同,不同元素原子质量和性质上都不同。
(×)④不同元素化合时,这些元素的原子都按简单整数比结合成化合物。
(×)汤姆生发现了电子,并提出了葡萄干面包模型:原子中的正电荷是均匀地分布在整个原子的球形体内,电子均匀地分布在这些正电荷之间。
伦琴发现了X射线,贝克勒尔发现了铀的放射性。
α粒子:氦核流He2+β粒子:电子流γ粒子:波长很短的电磁波卢瑟福的α粒子散射实验(用α粒子轰击金箔)现象:①绝大部分α粒子都直线穿了过去。
②极少数α粒子穿过金箔时发生了偏转,个别α粒子偏转了180°反弹。
结论:①原子是中空的。
②原子中存在一个体积很小、正电荷集中、质量很大的核。
继而提出了原子结构行星模型:原子是由带正电的质量很集中的、很小的原子核和它外面运动着的带负电荷的电子组成的一个体系,就像行星绕太阳旋转一样。
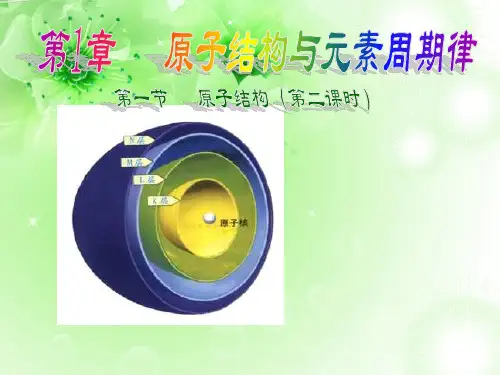
二、原子结构和相对原子质量原子是由位于原子中心的原子核和核外电子组成,原子核只占原子体积的几千亿分之一,原子核由质子和中子组成。
质子带正电,中子不带电,质子与中子的质量几乎相等,是电子质量的1836倍,所以原子的质量几乎全部集中在原子核上。
原子中的守恒关系:电性守恒:质子数=电子数=核电荷数=原子序数质量守恒:质量数=质子数+中子数原子的表示方法:质子(Z个)原子核(带一个单位正电荷,相对质量为1)中子(N个,N=A-Z)原子(A Z X)(不带电荷,相对质量为1)核外电子(Z个)(带一个单位负电荷,质量是质子质量的1/1836)相关定义:元素:具有相同核电荷数(即质子数)的同一类原子的总称。


第九章原子结构和元素周期律§本章摘要§1.微观粒子运动的特殊性微观粒子的波粒二象性测不准原理微观粒子运动的统计性规律2.核外电子运动状态的描述薛定谔方程用四个量子数描述电子的运动状态几率和几率密度径向分布和角度分布3.核外电子排布和元素周期律多电子原子的能级核外电子排布原则元素周期表科顿(F. A. Cotton) 轨道能级图斯蕾特(Slater) 规则4.元素基本性质的周期性原子半径电离能电子亲合能E电负性, , 射线粒子散射实验的质能联系公式 E = m, : , : , h = 6.626与相关速度方程:所以如果位置测不准量为x,量为p,原子半径为m,大测不准量为x 10m, 量v.9.11x Kg.2m =0.01Kg, x = m, v:第九章原子结构和元素周期律§本章摘要§1.微观粒子运动的特殊性微观粒子的波粒二象性测不准原理微观粒子运动的统计性规律2.核外电子运动状态的描述薛定谔方程用四个量子数描述电子的运动状态几率和几率密度径向分布和角度分布3.核外电子排布和元素周期律多电子原子的能级核外电子排布原则元素周期表科顿(F. A. Cotton) 轨道能级图斯蕾特(Slater) 规则4.元素基本性质的周期性原子半径电离能电子亲合能E电负性波函数是核外电子出现区域的函数。
为一个二阶偏微分方程:此方程= f(x, y, z):V = - (), 则可求解出和r,,,数的下标波函数的下标对于单电子体系, H 或,角动量,P = mv, (KJ.),单电子原子:多电子原子:为屏蔽系数,个值共1, 有三种空间取向Ms = ms (h/2)“”“”m(h/2)n,l,m通过本例得到结论在同一原子中两个电子同时存在在此= , 则有: w = X V 可用积. - r的形象化是是波函数,或波函数的线性组(r,,) or (x,y,z) , 无法用立体图形画出来与考察单位厚度球壳内电子出即在半径r: D(r) =:数:按如下方式进行计算得到对应Y(,) 的数据则(Pz)和轨道的与: 只有径向比无正负第九章原子结构和元素周期律§本章摘要§1.微观粒子运动的特殊性微观粒子的波粒二象性测不准原理微观粒子运动的统计性规律2.核外电子运动状态的描述薛定谔方程用四个量子数描述电子的运动状态几率和几率密度径向分布和角度分布3.核外电子排布和元素周期律多电子原子的能级核外电子排布原则元素周期表科顿(F. A. Cotton) 轨道能级图斯蕾特(Slater) 规则4.元素基本性质的周期性原子半径电离能电子亲合能E电负性:对于多电子体系:其中 = Z-, Z, 为屏= Z -可以看出l 大的, 相反: l l小的,电荷,主要是10只填一个电子成, 未达到,: ,区:,: ,: ,: ,除钍为外和.: 判断: 全充满: 中一个电子, ,关键在于如何确定屏蔽系数值=0 (: =0.35 [(1s)组的两个电子的相互屏蔽系数为=0.30]层上的每个电子的=0.85, (n-2)=1.00=1.00将各个值与相应电子数目乘积的和即为公式中的总,,求出,第九章原子结构和元素周期律§本章摘要§1.微观粒子运动的特殊性微观粒子的波粒二象性测不准原理微观粒子运动的统计性规律2.核外电子运动状态的描述薛定谔方程用四个量子数描述电子的运动状态几率和几率密度径向分布和角度分布3.核外电子排布和元素周期律多电子原子的能级核外电子排布原则元素周期表科顿(F. A. Cotton) 轨道能级图斯蕾特(Slater) 规则4.元素基本性质的周期性原子半径电离能电子亲合能E电负性只有当时,对称性较高的半充满和全充满时,所以比较大)长周期:为结短周期:电子填加到外层轨道少, Z*增加的幅度大填加到(n-1)度小, 所以超长周期:内过渡系核对电子的吸引增强I增大.短周期[He], 的一个电W = 1.602库仑= 1.602焦耳E = 1.602x13.6x6.02= 1312 (KJ/mol)4全充满的稳定结构, 所以[He], 为半充满结构突然增大电子结构为[He], 失去的一个电子到半[He], [Ar], 无法解释[Ar], 的电子达到的稳定结构,半充核对的Co 和 Ni : [Ar]和[Ar], [Ar],123[He], 2p能:再看电子亲合能:所以:: H < H(此分界为经验判断的电负性最小。


原子结构元素周期律原子结构和元素周期律是物质世界中最基本的概念之一、原子是构成物质的基本单位,在原子结构中包含了质子、中子和电子等多个组成要素。
元素周期律则是根据原子结构的特点和规律对元素进行分类和排列的一种方法。
下面将详细介绍原子结构和元素周期律的相关知识。
首先,我们来介绍一下原子的基本结构。
原子由原子核和围绕原子核运动的电子构成。
原子核是原子的中心部分,包含了质子和中子。
质子带有正电荷,中子没有电荷。
而电子则带有负电荷,围绕原子核中的质子和中子进行运动。
质子和中子的质量几乎相同,约为1.67x10^-27千克,而电子的质量则非常轻,约为9.11x10^-31千克。
原子的质量数等于质子数加中子数。
而原子的电荷数等于质子数减去电子数。
由于质子和电子的数目相等,所以正常情况下原子是电中性的。
但是,当原子失去或获得电子时,就会形成带电离子。
质子和中子分别位于原子核的核心部分,而电子则通过能级来描述它们在原子核周围的运动状态。
能级是指电子在原子内的一定区域内具有一定能量的状态。
能级从内到外按照顺序排列,依次称为K层、L层、M层等。
每个能级又分为不同的轨道,轨道是指电子在能级内运动的一条轨道,常用字母s、p、d、f来表示。
每个能级中的电子数是有限的,第一层K层最多容纳2个电子,第二层L层最多容纳8个电子,以此类推。
接下来我们来讨论元素周期律。
元素周期律是指把元素按照一定的规律排列的表格,以便更好地了解元素的性质和规律。
元素周期表是根据元素的原子序数(即原子核内质子的数目)将元素排列的表格。
这个表格通常显示元素的原子序数、符号和原子质量。
元素周期表中的元素按照周期和族进行排列。
周期是指元素按照原子结构的性质和规律重复出现的一行,一共有七个周期。
族是指元素按照化学性质的相似性分为的一列,一共有十八个族。
元素周期表的左边是金属元素,右边是非金属元素,左上方的位置是金属元素,右上方位置是半金属元素,左下方位置是非金属元素。

原子结构与元素周期律原子结构指的是原子的组成和结构。
根据量子力学理论,原子由电子、质子和中子组成。
质子和中子集中在原子核中,而电子则存在于原子的外层。
电子以特定的轨道围绕着原子核运动,这些轨道又被称为电子壳。
每个电子壳能够容纳不同数量的电子,其中第一电子壳最多容纳2个电子,第二电子壳最多容纳8个电子,而后续的电子壳分别容纳最多18个、32个和50个电子。
这是因为电子的分布满足一定的能级规则,即每个电子壳的能级比前一个电子壳的能级高。
元素周期律是研究和分类元素的规律性表达方式。
元素周期表是根据元素的原子序数和化学性质编排的表格。
元素周期表的主体是按照原子序数递增排列的,每个元素的原子序数代表了其原子核中的质子数。
现在的元素周期表是按照门捷列夫周期定律、贝尔定律和气体化学定律编撰的。
门捷列夫周期定律是指元素的性质会随着原子序数的增加而循环性地变化。
贝尔定律则是指元素的化学性质主要取决于其原子外层电子的数目。
基于这些定律和规律,元素周期表将元素分成了相应的周期和族。
元素周期表的周期是指元素周期表中的横行,也称为周期。
一共有7个周期,每个周期中的元素具有相似的化学性质。
元素周期表中的族则是指元素周期表中的竖列,也称为族。
元素周期表中的元素周期和族数共同描述了元素的化学性质,周期性地变化。
对于周期表上的每个元素,都有相应的元素符号、原子序数、相对原子质量和周期表中的位置。
元素周期表的开创者是俄国化学家门捷列夫,他在19世纪初首次提出了元素周期定律,并将元素按照这个定律排列在一张表上。
随着现代化学的发展,元素周期表逐渐完善,并逐渐扩展。
如今的元素周期表已经包含了118个元素,其中92个是自然界存在的元素,剩下的是由科学家们在实验室中合成的人工合成元素。
总结起来,原子结构和元素周期律是化学中两个重要的概念。
原子结构指的是原子的组成和结构,包括质子、中子和电子的分布。
元素周期律则是描述和分类元素的规律性表达方式,根据原子序数和周期规律将元素排列在一个表格里,以反映元素的周期性变化。

无机化学_09原子的电子层结构和周期律详解原子的电子层结构和周期律是无机化学的基础知识,对于理解元素的性质和反应过程非常重要。
本文将详细介绍原子的电子层结构和周期律,包括原子结构的基本概念、电子的排布规律、原子的周期性和电子云模型等方面。
1.原子的基本结构原子是物质的基本单位,由原子核和围绕原子核运动的电子组成。
原子核由质子和中子组成,质子带正电荷,中子不带电荷。
电子带负电荷,质量很小。
原子的电荷数等于质子数,因此原子是电中性的。
2.电子的排布规律电子在原子中的排布规律可以用电子的能级和轨道来描述。
能级是描述电子能量的概念,用数字或字母标记。
第一能级最低,能级越高,能量越大。
每个能级可以容纳一定数量的电子,根据对应的公式2n^2,n表示第几能级。
例如,第一能级最多容纳2个电子,第二能级最多容纳8个电子。
轨道是电子在原子中运动的区域。
轨道可以分为s、p、d、f等类型,每个轨道具有特定的形状和能量。
s轨道是球对称的,能量最低;p轨道是沿着坐标轴取平面的,能量较高;d轨道是复杂的形状,能量更高;f轨道更加复杂,能量最高。
根据电子排布规律,每个能级的s轨道最先填满,然后是p、d和f轨道。
同时,每个轨道最多容纳2个电子,并且电子要填满同一个轨道时,电子自旋方向相反。
3.原子的周期性根据电子排布规律,可以发现原子在元素周期表中具有周期性。
元素周期表是一种将元素安排成水平行和垂直列的表格,按照升序排列。
元素周期表中的水平行被称为周期,纵列被称为族。
周期数对应于原子的能级数,而族数则对应于最外层电子的轨道类型。
根据原子的电子配置,可以将元素划分为主族元素和过渡元素。
主族元素的最外层电子数和周期数相同,而过渡元素的最外层电子数小于周期数。
元素周期表的左侧为金属元素,右侧为非金属元素。
金属元素的电子云模型呈现电子向外的分布,非金属元素呈现电子向内的分布。
周期表的中心是过渡元素,具有中间性质。
4.电子云模型电子云模型是描述电子在原子周围运动的模型。
化学元素原子结构和周期性规律化学元素原子结构是指原子内部的组成和排列方式,以及原子之间的相互作用。
周期性规律是指元素周期表中元素的性质和原子结构的周期性变化规律。
1.原子结构–原子核:由质子和中子组成,质子带正电,中子不带电。
–电子:负电荷粒子,围绕原子核运动,分布在不同的能级上。
–能级:电子在原子核外部的不同区域,能级越高,电子距离原子核越远。
–轨道:电子在能级上的具体位置,有不同的形状和大小。
–电子云:描述电子在原子周围的分布情况,表示电子出现的概率。
2.元素周期表–元素周期表是按照原子序数递增排列的元素表格,分为横行(周期)和纵列(族)。
–周期:原子核外电子层数相同的元素排列在同一周期。
–族:具有相同最外层电子数的元素排列在同一族。
–主族元素:周期表中1A到8A族元素,包括碱金属、碱土金属、卤素等。
–过渡元素:周期表中3B到12B族元素,包括副族和第Ⅷ族元素。
–稀土元素:周期表中镧系元素,具有独特的化学性质。
3.周期性规律–原子半径:原子的大小随着原子序数的增加而变化,具有周期性规律。
–离子半径:离子的大小也随着原子序数的增加而变化,具有周期性规律。
–电负性:元素吸引电子的能力,具有周期性规律。
–金属性和非金属性:元素的金属性和非金属性随着原子序数的增加而变化,具有周期性规律。
–化合价:元素在化合物中的氧化态,具有周期性规律。
–电子亲和能和电子亲和能力:元素接受电子的能力,具有周期性规律。
以上是关于化学元素原子结构和周期性规律的基本知识点,希望对您有所帮助。
习题及方法:1.习题:请根据元素周期表,比较锂(Li)和钠(Na)的原子半径。
•查找元素周期表中锂(Li)和钠(Na)的位置。
•观察它们所在的周期,锂位于第二周期,钠位于第三周期。
•根据周期性规律,原子半径随着周期数的增加而增加。
•因此,钠的原子半径大于锂的原子半径。
答案:钠的原子半径大于锂的原子半径。
2.习题:请根据元素周期表,解释为什么氯(Cl)的电负性大于溴(Br)。
元素的原子结构及周期性元素是物质的基本构成单元,由相同类型的原子组成。
每个元素都具有其独特的原子结构和周期性特征。
本文将围绕元素的原子结构和周期性进行论述。
一、原子结构原子是构成物质的最小单位,由带正电荷的质子、中性的中子和带负电荷的电子组成。
原子结构包括原子核和电子云两个主要组成部分。
1.1 原子核原子核位于原子的中心,由质子和中子组成。
质子带正电荷,中子不带电荷。
原子核的质量主要由质子和中子的质量之和决定,而原子的化学性质主要由原子核的质子数量(即原子序数)决定。
1.2 电子云电子云环绕着原子核,呈现三维的空间分布。
电子具有负电荷,其数量与质子数量相等,使整个原子呈中性。
电子云由不同能级和轨道构成,每个能级最多容纳一定数量的电子。
能级从内到外依次增加,呈现分层排布的特点。
二、周期表周期表是元素的一种分类和排列方式,根据原子结构和周期性特征对元素进行归类。
元素周期表由化学家门捷列夫于1869年首次提出,现代的周期表则是根据元素的原子序数进行排列。
2.1 族/群周期表中,元素按照相似的化学性质分为不同的族或群。
主要的族包括有1A族到8A族,也称为1-18族;辅助的族包括3B族到2B族,1B族和2B族。
这些族的命名遵循IUPAC规范。
2.2 周期周期表中,元素按照原子序数从小到大排列,形成水平的周期。
一个周期包括7个能级,分别是1到7能级。
水平周期的元素具有相似的大小和电子结构。
2.3 主族和过渡族元素主族元素是周期表中IA到VIIA族的元素,这些元素的化学性质主要由最外层的电子数决定。
过渡族元素是周期表中IB到VIIIB族的元素,这些元素的化学性质主要由最外层和倒数第二层的电子数决定。
三、周期性规律周期表中元素的排列显示出一定的周期性规律,这些规律被称为周期性。
最早被发现和研究的周期性规律有以下三个:原子半径的周期性、电离能的周期性和电极电势的周期性。
3.1 原子半径的周期性原子半径是指原子核和最外层电子之间的距离。
纯纱州纳纲市驳纵学校高三化学原子结构、元素周期律一. 原子结构:1. 构成原子的粒子间相互关系质量数〔A〕= 质子数+中子数质子数 = 核电荷数 = 核外电子总数2. 电子云电子云密集〔密度大〕的地方表示电子出现的几率大电子云稀少〔密度小〕的地方表示电子出现的几率小3. 核外电子排布规律核外电子总是尽先排布在能量低〔离核近〕的电子层里,然后由里向外,依次排布在能量高〔离核远〕的电子层里。
各电子层最多容纳的电子数不超过2n2最外层电子数不超过8〔K层为最外层时不超过2〕次外层电子数不超过18倒数第三层电子数不超过32二. 元素周期律:1. 元素周期律内容2. 元素周期律实质3. 元素金属性强弱判断依据4. 元素非金属性强弱判断依据例1. 〔95-〕F2的沸点Br2的沸点。
A.大于B.小于C.于D.不能肯[解析]沸点上下的判断,一般步骤:同条件下的物理状态。
〔熔沸点:固体>液体>气体〕当同条件下的物理状态相同时,比拟晶体类型。
〔一般,熔沸点:原子晶体>液离子晶体>分子晶体〕当晶体类型也相同时,比拟结合力的大小。
氟单质和溴单质条件1、2都相同,所以比拟结合力。
分子晶体由分子间作用力结合在一起,而分子间作用力的大小主要由分子量决。
由于溴单质分子量大,所以它的沸点高。
答案:B例2.〔97-〕铍(Be)的原子序数为4。
以下对铍及其化合物的表达中,正确的选项是A. 铍的原子半径大于硼的原子半径B. 氯化铍分子中铍原子的最外层电子数是8C. 氢氧化铍的碱性比氢氧化钙的弱D. 单质铍跟冷水反产生氢气[解析]考察是元素周期律的相关知识。
注意:位置——结构——性质的三角关系,所以要熟悉重要元素在周期表中位置。
铍和硼属于同周期元素,同周期元素原子半径递减。
铍原子核外只有两层,失电子后,最外层只有2个电子。
同主族元素形成的单质或化合物化学性质相似,且有一的递变规律。
铍在钙上,金属性比钙弱,故氢氧化铍的碱性比氢氧化钙的弱;铍在镁上,和水反的剧烈程度比镁弱,镁和冷水不反,所以铍也不反。
原子结构和元素周期律原子结构和元素周期律是化学中非常重要的概念,对理解物质的性质和化学反应机理具有关键作用。
在现代原子理论中,原子被认为是由电子、质子和中子组成的。
元素周期表是将所有已知元素按照一定规律排列的表格,可以反映出元素之间的相似性和周期性规律。
首先,我们来了解原子结构。
原子是物质的最小单位,由电子、质子和中子组成。
电子是带负电荷的基本粒子,质子是带正电荷的基本粒子,中子是不带电荷的基本粒子。
在原子的中心核内,质子和中子集中存在,而电子则绕着核的轨道上运动。
原子的质量主要集中在核内,而体积主要由电子轨道决定,整体呈现出一种空心球的结构。
原子中的电子有不同的能级,能级越低,电子越稳定。
最靠近原子核的第一能级只能容纳2个电子,第二能级能够容纳8个电子,第三能级能够容纳18个电子,以此类推。
根据原子轨道的不同形状,可以有s轨道、p轨道、d轨道和f轨道等。
每个能级上都有不同数量和不同形状的轨道。
元素周期表是将元素按照一定规律排列的表格。
最早的元素周期表是由俄罗斯化学家门捷列夫在19世纪中叶提出的。
现在使用的国际标准元素周期表是根据元素的原子序数(元素中质子的数目)进行排列的。
元素周期表主要由若干周期和若干族组成。
周期表中的周期是指元素按照原子序数递增的顺序分成的若干行,每一行被称为一个周期。
一般来说,从左到右,周期中的元素的原子半径逐渐减小,原子电荷逐渐增加,而从上到下,周期中的元素的原子半径逐渐增大,原子电荷也逐渐增加。
元素周期表中的周期性规律是指周期表中的元素随着原子序数的增加,性质和反应规律呈现出周期性的变化。
周期表中的族是指元素按照元素化学性质相似原则划分的列。
周期表中共有18个族,其中,第1族至第2族为主族元素,第3族至第12族为d区过渡元素,第13族至第18族为p区过渡元素。
族内元素的化学性质相似,拥有相同的化学价态和类似的反应性质。
元素周期表的布局有很多重要的特征和规律。
在周期表的左侧,主要是金属元素,具有良好的导电性、热导性和延展性。
高二化学关于原子结构与元素周期律的总结在高二化学的学习中,原子结构与元素周期律是非常重要的知识板块。
它不仅是理解化学物质性质和化学反应的基础,还为我们探索物质世界的奥秘提供了有力的工具。
首先,让我们来了解一下原子结构。
原子是由位于中心的原子核和核外电子组成的。
原子核带正电荷,由质子和中子构成,其中质子带正电,中子不带电。
而核外电子则带负电,围绕着原子核做高速运动。
原子的质子数决定了它的元素种类,也就是元素的原子序数。
例如,氢原子的质子数为 1,氧原子的质子数为 8。
质子数相同但中子数不同的原子被称为同位素。
电子在原子核外的排布遵循一定的规律。
电子处于不同的能层和能级中,能层从内到外分别为 K、L、M、N 等,能级则有 s、p、d、f 等。
每个能层所能容纳的电子数是有一定限制的,比如第一层最多容纳 2个电子,第二层最多容纳 8 个电子。
在了解了原子结构的基础上,我们再来看看元素周期律。
元素周期表是元素周期律的直观体现,它按照原子序数递增的顺序排列。
元素周期律中,原子半径呈现出一定的变化规律。
同一周期,从左到右,原子半径逐渐减小;同一主族,从上到下,原子半径逐渐增大。
这是因为同一周期中,随着质子数的增加,原子核对外层电子的吸引力增强,导致原子半径减小;而同一主族中,电子层数增加,原子半径也就随之增大。
元素的化合价也是一个重要的规律。
主族元素的最高正化合价等于其最外层电子数,而最低负化合价则等于最外层电子数减去 8(氢元素除外)。
元素的金属性和非金属性也有周期性的变化。
同一周期,从左到右,金属性逐渐减弱,非金属性逐渐增强;同一主族,从上到下,金属性逐渐增强,非金属性逐渐减弱。
例如,在第三周期中,钠的金属性最强,氯的非金属性最强。
元素周期律的这些规律对于我们预测元素的性质、理解化合物的形成以及化学反应的发生都有着重要的意义。
比如说,我们知道了元素的金属性和非金属性的强弱,就能够推测出它们在化学反应中的表现。