总胆汁酸(TBA)试剂盒标准操作程序
- 格式:docx
- 大小:26.48 KB
- 文档页数:4

总胆红素(TBIL)测定试剂盒(重氮法)适用范围:该试剂盒用于体外定量测定人血清中总胆红素的浓度。
1.1 产品规格1.2 组成成分该试剂盒由试剂1(R1)、试剂2(R2)和校准品(选配)组成。
1.2.1试剂组成试剂1: 对氨基苯磺酸≥10.0mmol/L 十六烷基三甲基溴化铵≥5.0mmol/L试剂2: 亚硝酸钠≥1.0mmol/L 1.2.2 校准品组成牛血清总胆红素目标浓度:200μmol/L该校准品为牛血清基质冻干品2.1 外观a) R1应为无色溶液,无混浊,无未溶解物。
b) R2应为无色溶液,无混浊,无未溶解物。
c) 校准品应为白色至淡黄色固体。
2.2 净含量液体组分不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度应不大于0.050。
2.4 分析灵敏度TBIL试剂盒测定浓度100.0μmol/L的被测物时,吸光度差值(ΔA)应不小于0.050。
2.5 准确度用纯品测定回收率,应在85%-115%之间。
2.6 精密度2.6.1重复性变异系数应不大于5%。
2.6.2批间差批间相对极差(R)应不大于10%。
2.6.3校准品批内瓶间差测试校准品,所得结果的批内瓶间差应不大于5%。
2.7 线性在(0,427.0]μmol/L范围内,TBIL试剂盒的线性相关系数r应不低于0.9900;在(0,50.0]范围内绝对偏差应不超过5.0μmol/L,在(50.0,427.0]范围内相对偏差应不超过±10%。
2.8校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供总胆红素校准品的来源、赋值过程以及测量不确定度等内容。
校准品溯源至国家参考物质GBW(E)090002。
2.9稳定性2.9.1校准品复溶稳定性校准品复溶后,在2℃~8℃密封保存24小时,测试试剂盒准确度,应符合2.5的要求。
2.9.2 试剂盒稳定性原包装的TBIL试剂盒在2℃~8℃避光保存,有效期为18个月。
2性能指标
2.1外观和性状
2.1.1颜色性状
质控品复溶前为浅黄色或黄色冻干粉末,复溶后为浅黄色或黄色液体。
2.1.2包装
分装瓶为棕色硬质玻璃瓶,盖有橡胶瓶内塞;盒贴、瓶贴、标签标识应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;外盖应无明显划痕、崩缺。
2.2装量
质控品装量差异应在±7.0%以内。
2.3均一性
2.3.1瓶内均一性
质控品瓶内均一性应不大于表2的要求。
表 2 质控品瓶内均一性要求
2.3.2瓶间均一性
质控品瓶间均一性应不大于表3的要求。
表 3 质控品瓶间均一性要求
1
2.4参考值及参考范围
每批质控品均应提供本批产品的参考值表。
经迈瑞校准品校准的适用仪器及配套试剂对质控品进行测定,测定结果应在给定的参考范围内。
2.5生物安全性
质控品使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,乙型肝炎病毒表面抗原(HBsAg)、人类免疫缺陷病毒(HIV)抗体、丙型肝炎病毒(HCV)抗体、梅毒螺旋体(TP)抗体检测应为阴性。
2。

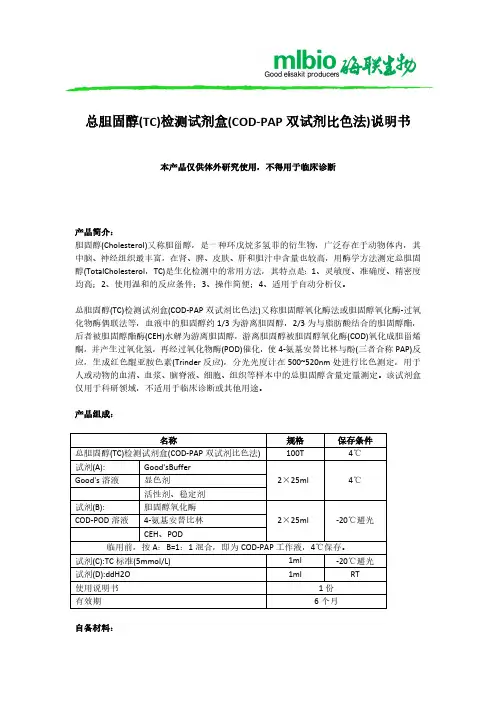
总胆固醇测定试剂盒标准操作程序1. 摘要本试剂盒供医疗机构用于体外定量测定人血清或血浆样本中总胆固醇的含量。
2. 适用范围程序适用于AU5811自动生化分析仪检测血清样本中总胆固醇的含量。
3. 职责使用AU5811自动生化分析仪进行测定总胆固醇浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP 的改动,可由任一使用本SOP 的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4. 检测方法上海科华生物工程股份有限公司生产的总胆固醇测定试剂盒采用的是氧化酶法。
5. 原理OH ESPAS O H O H O O H 222222244+−−−→−+-+-∆+−−−−→−++−−−→−+醌亚胺氨基安替比林胆甾烯酮游离胆固醇脂肪酸游离胆固醇总胆固醇过氧化物酶胆固醇氧化酶胆固醇酯酶ESPAS:N-乙基-N-(3-磺丙基)-间-茴香胺血清中的总胆固醇在胆固醇酯酶的作用下水解成游离胆固醇和脂肪酸,游离胆固醇在胆固醇氧化酶的催化下,氧化成Δ4-胆甾烯酮和双氧水,最后双氧水在过氧化物酶的催化下与色原底物4-氨基安替比林和ESPAS 反应生成红色化合物醌亚胺。
由于醌亚胺在波长550nm 处有吸收峰,所以在一定底物浓度范围内,550nm 处吸光度的变化值与样本中总胆固醇的含量成正比6. 仪器AU5811自动生化分析仪7. 试剂7.1 试剂来源:上海科华生物工程股份有限公司提供7.2 试剂瓶内主要成分:R1:胆固醇酯酶、抗坏血酸氧化酶、过氧化物酶、ESPAS (ADPS );R2:胆固醇氧化酶、 -氨基安替比林;校准品:胆固醇7.3试剂稳定性:未打开试剂于2℃-8℃避光保存可至失效期。
校准品应密闭保存,以免液体挥发。
8.标准品和质量控制8.1校准程序:使用科华公司的校准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品通过合适的数学模型绘制校准曲线。


沭阳县仁慈医院检验科生化室作业指导书文件编号:SYXRCYYLAB-SH –SOP第A版编制:路珊珊钱丽萍审核:李萍批准:侯波生效日期:2012年10月01日沭阳县仁慈医院检验科修订页血清总胆红素(T-BIL)测定一、目的保证总胆红素测定的结果准确、可靠。
二、修改程序本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:质量主管、授权人(科主任)。
三、适用范围钒酸盐氧化法测定总胆红素。
四、试剂来源本标准操作程序适用于上海执诚生物科技股份有限公司生产的总胆红素测定试剂盒。
五、溯源全国临床检验操作规程(第二版)。
六、原理此方法基于样品中的总胆红素在pH3.0 环境中,在有机复合物氧化剂的作用下,可以被氧化成胆绿素,而胆红素特有的黄色也随即消失,在450nm 处测定吸光度的变化,即可计算出样品中总胆红素的浓度。
七、试剂R1:硫磺酸缓冲液(pH2.9) 0.1mol/L表面活性剂R2:磷酸缓冲液(pH7.0) 10mmol/L有机钒酸盐 4mmol/L 不同批号试剂盒中各组份不能互换。
本试剂对光敏感,2~8℃密闭避光保存可以稳定18个月(勿冷冻);首次开启试剂后,避光保存于2~8℃防污染环境中,可继续稳定至效期。
校准液: Randox 公司提供的系列校准品。
八、标本采血清总胆红素(T-BIL)测定血清、血浆。
样本2~8℃保存可以存放约3天,-20℃保存可以存放3个月,但只能冻融一次。
九、操作步骤1、标本编号,分离血清,依顺序置样品架上。
2、按标本编号在全自动化生化仪器上输入标本的基本信息和测定要求,进行测定。
3、仪器校准:将校准液置试管架上,输入校准液浓度,然后进行测定(测定参数与下同),其吸光度贮存在电脑中,浓度值测定符合要求即可应用。
一般每3~6个月校准一次,若更换不同批号的试剂、质控超标或仪器维修处理后应进行校准。
4、测定参数:血清量 7μl试剂Ⅰ 200μl试剂Ⅱ 50μl主波长 444nm次波长 548nm反应类型终点法;负反应测定时间 10分钟温度 37℃报告单位μmol/L5、结果计算:ΔA 样品样本中总胆红素的含量 = ------- ×标准液浓度ΔA 标准单位换算:mg/dl×17.1=μmol/L十、正常参考值5.1-20μmol/L血清总胆红素(T-BIL)测定十一、室内质控质控方法:每天测定样品前做一组质控,在标本中间插一组质控,最后再做一组质控品,共三组。

凤庆县人民医院质量管理体系文件生化室SOP文件编号:FQYY-LAB-SH-CZ-01~47第二版编制:鲁伟审核:李树荣批准:李树荣生效日期:2012年10月1日凤庆县人民医院检验科目录目录目录修订页临床标本采集程序1.目的:规范临床标本的采集,减少实验前的影响因素。
2.范围:适用于为协助疾病诊断和治疗而进行的临床生化样品采集活动。
临床样本包括血液、尿液、胸腹水等各种体液。
3.职责:临床生化实验室:指导临床各科室正确采集标本,提高实验结果的准确性。
4.程序:4.1 静脉血的采集:4.1.1 静脉血标本采集前病人应注意的问题:4.1.1.1 避免剧烈运动,一般主张抽血前24小时不做剧烈运动,清晨取血,住院病人可在起床前抽血,匆忙赶到门诊的人应至少休息15分钟后取血。
4.1.1.2 注意合理饮食。
除了急诊或其它特殊原因外,一般主张在禁食12小时后空腹取血,延长空腹时间(饥饿)或餐后血液的化学成分都会变化.饮酒对实验亦有影响。
4.1.1.3 药物的影响。
很多的药物进入人体后可影响某些化验项目的结果,病人在化验前应尽可能停服对实验有干扰的药物。
4.1.2 静脉血标本采集前医生、护士应注意的问题:4.1.2.1.检验申请单填写要求:检验申请单用钢笔或黑笔填写,使用正楷字,字迹清楚,填写完整。
填写内容包括:受检者姓名、性别、年龄、临床诊断、送检标本、检验项目、标本采集年月日时、申请医生及采样者签名。
4.1.2.2 采用一次性真空采血管,多项化验时应首先将血注入血常规管,然后是抗凝管(注意要正确使用抗凝剂),最后是非抗凝管。
4.1.2.3 采血时的体位建议以坐位5分钟后取血为宜,止血带使用应少于1分钟,以免引起血液淤滞,造成血管内溶血或血液某些成分的改变。
4.1.2.4 当一侧手臂输液时应从对侧手臂取血,以降低对血糖、血钾等实验结果的影响。
4.1.2.5 血标本应防止溶血,影响溶血的因素有:使用止血带时间过长;抗凝管使用不当或抗凝混合时过度振荡;容器污染;血液中泡沫注入试管;标本放置时间过长;突然受冷或受热及离心力过大等。

总抗氧化能力(T-AOC)检测试剂盒使用说明微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1315规格:100管/96样产品内容:提取液:液体100mL×1瓶,使用前预冷。
试剂一:液体15mL×1瓶,避光保存。
试剂二:液体1.5mL×1瓶,4℃避光保存。
试剂三:液体1.5mL×1瓶,避光保存。
产品说明:测定对象中各种抗氧化物质和抗氧化酶等构成总抗氧化水平。
在生物学、医学和药学研究中常常检测血浆、血清、唾液、尿液等各种体液,细胞或组织等裂解液、植物或中草药抽提液及各种抗氧化物(antioxidant)溶液的总抗氧化能力。
在酸性环境下,物质还原Fe3+-三吡啶三吖嗪(Fe3+-TPTZ)产生蓝色的Fe2+-TPTZ的能力反映了其总抗氧化能力。
自备实验用品可见分光光度计/酶标仪、恒温水浴锅、低温离心机、微量石英比色皿/96孔板和蒸馏水。
操作步骤:一、样品的制备(1)血清、血浆、唾液或尿液样品血浆(制备时可以使用肝素或柠檬酸钠抗凝,不宜使用EDTA抗凝)4℃,5000rpm离心10min,取上清待测。
血清、唾液或尿液样品直接用于测定,也可以-80℃冻存(不宜超过30d)后再测定。
(2)组织样品按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液)进行冰浴匀浆,然后10000g,4℃离心10min,取上清,置冰上待测。
(3)细胞样品按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL提取液),冰浴超声波破碎(功率200W,超声3s,间隔10s,重复30次);10000g,4℃离心10min,取上清,置冰上待测。
二、测定操作混合液(现配现用):将试剂一、试剂二、试剂三按10:1:1的比例混合,使用前预温至37℃。
对照管测定管混合液(μL)180180样本(μL)/6双蒸水(μL)2418充分混匀,反应10min,双蒸水调零,于微量石英比色皿/96孔板,测定593nm处吸光值,△A=A测定-A空白注意:空白管只需测定一次。

页码:第1页共37页目录试剂文件名称页码ALB (4)TP (5)CHO (6)TG (7)GGT (8)GLU (9)ALT (10)AST (11)CK (12)CKMB (13)Ca (14)页码:第2页共37页Mg (15)UREA (17)UA (18)TBA (19)LDL (20)HDL (21)TBIL (22)DBIL (23)LDH (24)AMY (25)HBDH (26)PAB (27)页码:第3页共37页Fe (28)Ig (29)C (30)Cr (31)CO2 (32)CHE (33)ApoA1 ApoB (34)ALP (35)ADA (36)KNaCL (37)页码:第4页共37页白蛋白(ALB)1 方法:溴甲酚绿法。
2 原理:在pH4.2的缓冲液中,溴甲酚绿在有非离子去垢剂聚氧乙烯月桂醚(Brij-35)存在时,可与白蛋白形成蓝绿色复合物,此产物在636nm波长有一吸收峰,所产生颜色强度在一定范围内与白蛋白浓度成正比。
3 试剂厂家:。
4 临床意义4.1增高:严重失水。
4.2降低:(1)大量出血和严重烧伤(2)肾性蛋白尿、肝功能受损、腹水形成、急性肿瘤、甲亢、长期慢性发热等。
页码:第5页共37页总蛋白(TP)1 方法:双缩脲法。
2 原理:含有两个以上NH2-CO-或NH2-CH2-基因的蛋白质肽链,在碱性溶液中与铜离子结合,形成紫色化合物,在546nm波长处有吸收峰,可产生的颜色强度与蛋白质含量成正比。
3 试剂厂家:。
4 临床意义4.1增高:(1)高度脱水症。
(2)多发性骨髓瘤、原发性巨球蛋白血症。
(3)系统性红斑狼疮、多发性硬化和某些慢性感染。
4.2降低:(1) 各种原因引起的血清蛋白丢失或摄入不足。
(2)蛋白合成障碍。
页码:第6页共37页总胆固醇(CHO)1 方法:酶法2 原理:CE在胆固醇脂酶(CHE)作用下水解成FC和FFA,FC再经胆固醇氧化酶(COD)氧化成△4胆缁烯酮和H2O2,再分别定量O2的消耗或者H2O2的生成量,或者△4胆缁烯酮生成量,以作为FC的定量依据。

文件名称:AU5800全自动生化分析仪作业指导书文件编号:LAB—BL-SOP—INSTR 001 版本号: B 修订号: 0编制人:罗光成审核人:蒋兴亮页码:起始第1页共49页批准人:颁布日期:2014 年07月01日生效日期: 2014年07月01日仪器信息仪器名称:BECKMAN COULTER Chemistry Analyzer AU5800仪器型号: AU5800 (AU5821)生产商:贝克曼库尔特株式会社生产地:东京都江东区有明三丁目5 番7 号生产日期:2013年9月产品序号: 2013020683许可证号:国食药监械(进)字2011第24003311号(更)资产权属:川北医学院附属医院参考资料: AU5800中文操作手册AU5800 User’s Guide维修电话:400-667-1808(客户服务电话)相关记录: 检验科生化室 AU5800全自动生化分析仪使用记录检验科生化室 AU5800全自动生化分析仪校准记录检验科生化室 AU5800全自动生化分析仪试剂更换记录检验科生化室 AU5800全自动生化分析仪维护保养与故障记录目录目录 (2)BECKMAN COULTER AU5800全自动生化分析仪作业指导书 (3)1. 应用范围及仪器简介 (3)2. 测定范围及方法原理 (5)3。
开机前准备 (6)4。
开机 (6)5. 关机 (7)6. 参数设置 (7)7. 试剂装载程序 (9)8. 定标(校准) (11)9. 室内质控 (12)10。
标本测定程序 (13)11. 维护保养程序 (16)12。
错误标记(报警信息) (21)13。
AU5800术语 (22)BECKMAN COULTER AU5800全自动生化分析仪作业指导书1. 应用范围及仪器简介AU5800系列全自动生化分析仪是专为大型临床实验室和商业实验室设计的全自动生化分析系统,本实验所用的AU5821包括两个分析单元和带一个ISE单元,可进行比色分析、比浊分析、乳胶凝集分析、均项酶免疫分析和间接离子选择电极(ISE)分析,可同时测定111个项目,最高可达4900测试/小时(4000分光光度测试/小时+900离子选择电极测试/小时),可满足临床和科研检测的需要.1。

血清总胆汁酸循环酶法测定法1. 实验原理胆汁酸会被3α-羟甾醇脱氢(3α-HSD)以及β-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)特异性地氧化,生成3-酮类固醇以及β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)。
此外生成的3-酮类固醇在3α-羟甾醇脱氢(3α-HSD)及β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)存在下,生成胆汁酸及β-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD)。
如上所述,依据循环酶而放大微量的胆汁酸量,测定单位时间内生成的β-硫代烟酰胺脲嘌呤二核苷酸还原型(Thio-NADH)在405nm处的吸光度变化,以求得胆汁酸的浓度。
2. 标本:2.1 病人准备:标本以空腹血清为宜,餐后胆汁酸会升高,应注意采血时间。
2.2类型:血清、肝素或EDTA处理的血浆。
应使用新鲜标本。
标本必须避光保存。
3. 标本存放4℃保存可稳定7天,-20℃保存可稳定3个月。
4. 标本运输常温条件下避光保存运输。
5. 标本拒收标准细菌污染的标本。
6. 实验材料6.1 试剂南京波因特总胆汁酸测定试剂盒(试剂1:2×60ml 试剂2:2×20ml)6.1.1 试剂组成试剂1(R1):β-硫代烟酰胺脲嘌呤二核苷酸氧化型(Thio-NAD) 2mmol/LTris缓冲液30mmol/L试剂2(R2):脲嘌呤二核苷酸氧化型(NAD) 2mmol/L3a-羟甾醇脱氢酶(3a-HSD) 5U/L6.1.2 试剂准备:试剂为即用式。
6.1.3 试剂稳定性与贮存:试剂避光保存于2~8℃,若无污染,可稳定至失效期。
试剂不可冰冻,试剂2必须避光保存。
6.1.4 变质指示:当试剂有看得见的微生物生长,有浊度,或者未开盖的液体有沉淀时,表明试剂已变质,不能继续使用。
6.1.5 注意事项:不可入口!避免接触皮肤及粘膜。
应采取必要的预防措施使用试剂6.2 校准品:使用南京波因特公司提供的TBA校准品对自动分析仪进行校准,具体参见生化检验校准品和质控品.SOP文件。
胆汁酸液质检测报告检测对象:胆汁酸液样品
检测标准:国家药品标准
检测方法:高效液相色谱法
检测结果:
样品编号:BCSY20210802
检测项目检测结果检测单位检测标准
总胆汁酸(TBA)0.452 mg/mL ≤0.5 mg/mL 游离胆汁酸(FBA)0.022 mg/mL ≤0.1 mg/mL 结合胆汁酸(CBA)0.430 mg/mL ≥0.4 mg/mL
结论:
该样品中总胆汁酸含量为0.452 mg/mL,游离胆汁酸含量为
0.022 mg/mL,结合胆汁酸含量为0.430 mg/mL。
检测结果符合国
家药品标准。
附注:
1.本检测结果仅适用于该样品,不得用于其他样品。
2.本报告中的检测结果,仅反映了被检测样品本身的实际情况,不代表产品的质量水平或产品的推广和生产的合法性。
文件名称:AU5800全自动生化分析仪作业指导书文件编号:LAB-BL-SOP-INSTR 001 版本号: B 修订号: 0编制人:罗光成审核人:蒋兴亮页码:起始第1页共60页批准人:颁布日期:2014 年07月01日生效日期: 2014年07月01日仪器信息仪器名称:BECKMAN COULTER Chemistry Analyzer AU5800仪器型号:AU5800 (AU5821)生产商:贝克曼库尔特株式会社生产地:东京都江东区有明三丁目5 番7 号生产日期:2013年9月产品序号:2013020683许可证号:国食药监械(进)字2011第24003311号(更)资产权属:川北医学院附属医院参考资料:AU5800中文操作手册AU5800User’s Guide维修电话:400-667-1808(客户服务电话)相关记录:检验科生化室 AU5800全自动生化分析仪使用记录检验科生化室 AU5800全自动生化分析仪校准记录检验科生化室 AU5800全自动生化分析仪试剂更换记录检验科生化室 AU5800全自动生化分析仪维护保养与故障记录目录目录2BECKMAN COULTER AU5800全自动生化分析仪作业指导书31. 应用范围及仪器简介32. 测定范围及方法原理83. 开机前准备104. 开机115. 关机126. 参数设置127. 试剂装载程序148. 定标(校准)179. 室内质控1910. 标本测定程序2011. 维护保养程序2312. 错误标记(报警信息)2813. AU5800术语29BECKMAN COULTER AU5800全自动生化分析仪作业指导书1. 应用范围及仪器简介AU5800系列全自动生化分析仪是专为大型临床实验室和商业实验室设计的全自动生化分析系统,本实验所用的AU5821包括两个分析单元和带一个ISE单元,可进行比色分析、比浊分析、乳胶凝集分析、均项酶免疫分析和间接离子选择电极(ISE)分析,可同时测定111个项目,最高可达4900测试/小时(4000分光光度测试/小时+900离子选择电极测试/小时),可满足临床和科研检测的需要。
总胆汁酸TBA(Total Bile Acids)胆汁酸是肝细胞以胆固醇为原料合成的。
正常人肝脏合成的胆汁酸有胆酸(CA)、鹅脱氧胆酸(CDCA)和代中产生的脱氧胆酸(DCA)还有少量石胆酸(LCA)和微量熊脱氧胆酸(UDCA),合称总胆汁酸(TBA)。
总胆汁酸(TBA)是在肝脏合成,与甘氨酸或牛磺酸结合成为结合型胆汁酸,然后被肝细胞分泌入胆汁,随胆汁至肠道后,在肠道细菌作用下被水解成游离型胆汁酸,有97%被肠道重新吸收后回到肝脏。
如此循环不息。
这样能使总胆汁酸发挥最大生理效应。
更可防止总胆汁酸大量进入循环中对其它组织细胞的毒害。
健康人的周围血液中血清胆汁酸含量极微,当肝细胞损害或肝、外阻塞时,胆汁酸代就会出现异常,总胆汁酸就会升高。
因此,总胆汁酸测定是一项比较敏感和有效的肝功能试验之一。
血清总胆汁酸在医学上的测定:正常参考值:血清总胆汁酸(TBA)<10μmol/L血清氨胆酸(CG)<2.6mg/L鹅脱氧胆酸(CDCA)<1.61μmol/L临床意义1.正常人的血清总胆汁酸(TBA)是0 ~10 μmol/L的含量。
2.总胆汁酸(TBA)>10μmol/L提示肝细胞发生病变,血液中胆汁酸含量升高。
急性肝炎、慢性活动性肝炎、肝硬化、肝癌时胆汁酸明显升高。
特别是肝硬化、肝癌时总胆汁酸的升高率>(95%),也大于丙氨酸转氨基酶(ALT)20%。
3.当肝脏实质损害时,肝细胞对胆酸合成降低,鹅脱氧胆酸的合成绝对升高。
4.阻塞性黄疸时CA/CDCA比值大于1.0。
5.肝实质细胞损伤时,CA/CDCA比值小于1.0。
6..当幽门功能不全时,胆酸会反流到胃,同胃酸一起造成对胃粘膜的损伤,并引起胃痛等不适症状。
7.鹅脱氧胆酸(CDCA)增高见于急慢性病毒性肝炎、胆汁瘀滞、慢性乙醇中毒、肝硬化、原发性肝癌、胆道梗塞等。
8.采用进食后血清总胆汁酸测定可提高参考值。
在所有肝病中,餐后血清TBA水平及异常率均比空腹时高,故对肝病的诊断餐后TBA测定比空腹时测定更灵敏。
Total Bile Acids Assay Kit (Enzymatic Cycling)Catalog Number: BQ042A-EALDIntended UseThe assay kit is for determination of serum total bile acids (TBA). Total bile acids are metabolized in the liver and hence serve as a marker for normal liver function. Serum total bile acids are increased in patients with acute hepatitis, chronic hepatitis, liver sclerosis and liver cancer.Assay PrincipleThe reagents of the assay kit are stable liquid formulation that allows ease of use coupled with enhanced performance characteristics. In the presence of Thio-NAD, the enzyme 3-α.hydroxysteroid dehydrogenase (3-α-HSD) converts bile acids to 3-keto steroids and Thio-NADH. The reaction is reversible and 3-α-HSD can convert 3-keto steroids and Thio-NADH to bile acids and Thio-NAD. In the presence of excess NADH, the enzyme cycling occurs efficiently and the rate of formation of Thio-NADH is determined by measuring specific change of absorbance at 405nm.Specimen Collection and HandlingUse fresh patient serum or EDTA treated plasma samples. TBA concentration is increased after meals, hence sample should be collected under fasting condition. Serum or plasma samples are stable for a week at 4 °C, or for 3 month at –20 °C.If sample bile acids exceeds 180 μmole/L, dilute sample with 0.9% NaCl before assay.Catalog No. BQ042A-EALDR1 Thio-NAD 2 x 60 mLR2 3αHSD 2 x 20 mLCalibrator 1 x 2 mLWarnings1.For in vitro diagnostic use.2.Specimens and reagents containing human sourced materialsshould be handled as if potentially infectious, using safe laboratory procedures such as those outlined in Biosafety in Microbiological and Biomedical Laboratories (HHS Publication Number [CDC] 93-8395).3.As with any diagnostic test procedure, results should beinterpreted considering all other test results and the clinical status of the patient.4.Avoid swallowing and contact with skin or mucous membranes. Instructions For Reagent HandlingFor BQ042A-EALDReagents are ready-to-use. Reagents are light sensitive.Reagents are stable until the expiration indicated on the package label when unopened and stored at 2-8 °C.Reagents from different lots must not be interchanged.Assay ProcedureSee attached program parameters for COBAS and Hitachi systems. Test Scheme for Chemistry Analyzers(HITACHI 717/917)Wavelength: 405/600Std. Conc.: 50 μmol/LNormal rangeSerum or plasma containing 0-10 μmole/L bile acids is considered normal range. We suggest that each laboratory establish normal range first before doing patient sample set.Quality ControlWe recommend that each laboratory use bile acid controls to validate the performance of the assay. A set of normal and abnormal ranges of bile acid controls is available from Bio-Quant Laboratories.Instrument Parameter Settings。
总胆汁酸(TBA)试剂盒标准操作程序
1.摘要
本试剂盒供医疗机构用于体外定量测定人血清或血浆样本中总胆汁酸(TBA)的含量。
2.适用范围
程序适用于日立7600自动生化分析仪检测血清或血浆样本中总胆汁酸(TBA)的含量。
3.职责
使用日立7600自动生化分析仪进行测定直接胆红素浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法
上海科华生物工程股份有限公司生产的总胆汁酸(TBA)试剂盒采用的是循环酶法。
5.原理
血清中微量的胆汁酸(3α-羟甾醇)会被3α-羟甾醇脱氢酶(3α-HSD)及β-硫代烟酰胺腺嘌呤二核苷酸氧化型(Thio-NAD)特异性氧化生成3α-酮甾醇,同时Thio-NAD被还原成β-硫代烟酰胺腺嘌呤二核苷酸还原型(Thio-NADH)。
新生成的3α-酮甾醇在3α-HSD及β-烟酰胺腺嘌呤二核苷酸还化型(NADH)存在下,还原成胆汁酸,同时NADH氧化为β-烟酰胺腺嘌呤二核苷酸氧化型(NAD)。
这样,血清中微量的胆汁酸在多次酶循环的过程中被放大,同时可使生成的Thio-NADH扩增。
在405nm处测定Thio-NADH吸光度的变化值,可以求得血清中胆汁酸的含量。
胆汁酸THio−NAD3α−HSD
→THio−NADH
NAD←NADH
3α−铜羟甾醇
6.仪器
日立7600自动生化分析仪
7.试剂
7.1试剂来源:
上海科华生物工程股份有限公司提供
7.2注册号:
沪食药监械(准)字2011第2400009号
7.3试剂瓶内主要成分:
R1: -硫烟酰胺腺嘌呤二核苷酸氧化型(THio-NAD)、Good’s缓冲液;
R2 :β-硫烟酰胺腺嘌呤二核苷酸还原型(NADH)、3α-羟甾醇脱氢酶(3α-HSD)、Good’s 缓冲液、叠氮钠
7.4试剂稳定性:试剂于2℃-8℃避光保存,有效期为一年;开瓶后2-8℃避光保存,可
稳定一个月
8.标准品和质量控制
8.1校准程序:
使用某某公司的校准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品通过合适的数学模型绘制校准曲线。
8.2质控品:
某某公司提供的生化复合定值质控血清作为室内质控品。
每日在测定前做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:
按程序对检验后的质控后结果进行转换,及时质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
8.4质控判断规则:
按《Westgard多规则质控方法测定标准操作程序》
8.5室间质评:
分别参加某地区室间质评,对回报的室间质评结果按《室间质量评价程序》进行处理。
9.标本
9.1标本要求:
血清、肝素或EDTA抗凝的血浆。
尽量使用新鲜标本。
已知血清中总胆汁酸(TBA)的浓度在饭后上升,因此要注意采血时间。
不进行负荷试验时,应严守早晨空腹时采血。
血清中胆汁酸在4℃保存时一周内稳定,冷冻-20℃可保存三个月。
9.2标本拒收:
由实验室人员核收送来标本,如有溶血、已被污染、标识不清或与申请单不符状况,一律要求重新留取标本。
9.3标本处理:
收集编号后离心获取血清/血浆以备检测使用。
10.测定程序:
10.1分析参数:
详见参数表。
10.2操作步骤:
签收样本→离心→上机检测→审核报告→签发报告→标本保存。
10.3获取结果:
在日立7600仪器上或日立7600传送的中文系统电脑上查找相应结果。
10.4结果报告:
对检验后的结果进行审核,系统分析,判断结果的可报告性。
可报告的结果直接发报告,对不可报告结果进行复检后发报告。
11.计算
标准品校准项目后,测定室内质控,质控结果符合质控要求后方可测定样本。
无需手工计算,每个标本的结果自动打印。
12.废液处理
参阅检验科《安全手册》废液处理标准规程处理。
13.操作性能:
13.1可报告范围:
1-150 mol/L;样品中含量超出线性范围,则以0.1ml标本加0.5ml生理盐水稀释,再测定,结果乘以6。
13.2特异性/干扰:
样本中胆红素含量<50mg/dl,抗换血酸<100mg/dl,血红蛋白含量<500mg/dl时对试剂的测定没有影响。
13.3精密度:
批内变异系数CV≤10%;
批间相对极差≤10%
13.4准确度:
用质控品做样本,其测定结果应在该批质控品规定的范围内。
14.注意事项:
14.1试剂盒仅用于体外诊断。
14.2血清等标本有些含有感染性成分,因此应以具有感染危险性而充分注意操作。
14.3本试剂盒含有防腐剂叠氮钠,叠氮钠与铅、铜等反应,有时会形成一爆炸的叠氮化
金属盐,因此废液应用大量水冲洗。
14.4测定结果仅作为各种疾病的临床辅助诊断依据。
15.参考范围:
0-10 mol/L各实验室应建立自己的参考值范围。
16.临床意义:
总胆汁酸(TBA)是肝细胞合成并分泌,随胆汁排泄,是胆汁中存在的一大类胆烷酸的总称。
由于其是由肝脏分解代谢,能反映肝实质性损伤。
测定血清胆汁酸可提供肝胆系统是否正常的重要信息。
肝胆疾病时周围血液循环中的胆汁酸水平明显增高。
急性肝炎早期和肝外阻塞性黄疸时,有些病例可增至正常值的100倍以上。
血清中胆汁酸含量受肠道吸收的胆汁酸量与肝门静脉中的胆汁酸被肝脏摄取的摄取率所决定。
由于肝损伤的存在,经肝门静脉回肝的胆汁酸因肝细胞功能低下或侧枝循环的形成,导致肝不能充分摄取胆汁酸,则胆汁酸在血中浓度增高。
肝胆疾病时血清总胆汁酸浓度的升高与其他肝功能试验及肝组织学的变化极为吻合,在肝细胞仅有轻微坏死时,血清胆汁酸的升高常比其他检查更为灵敏。
有报告统计,急性肝炎、肝硬化、原发性肝癌、急性肝内胆汁淤滞、原发性胆汁性肝硬化以及肝外阻塞性黄疸,其血清总胆汁酸均100%出现异常,上述疾病时均有血清胆汁酸含量的增高。
17.支持性文件:
17.1日立7600自动生化分析仪使用说明书。
17.2日立7600自动生化分析仪分析参数。
17.3上海科华生物工程股份有限公司提供的试剂说明书。
用户可根据自身情况添加支持性文件。
18.参考文献
1.F.Mashige etc.,Clinical Chemistry, Vol 27,1352-1356(1981).。